
Щелочные металлы

Li, Na, K, Rb, Cs 1) (ns r, Э 0 r, Э+(КЧ=6) п Степени окисления 1, 57 0, 76 0, 97 0, +1 Na 1, 92 1, 01 0, +1 K 2, 36 1, 38 0, 91 0, +1 Rb 2, 53 1, 52 0, 89 0, +1 Cs 2, 74 1, 67 0, 86 0, +1 Li

Распространенность и минералы • Li – 29 место; Li 2[Al 2 Si 4 O 12] (сподумен) • Na – 6 место; Na. Cl (галит, кам. соль), • K – 8 место; KCl. Mg. Cl 2. 6 H 2 O (карналлит), KCl (сильвин) • Rb и Cs - 26 и 38 место; • Fr - радиоактивен

Открытие элементов • Li – 1817 г. , Берцелиус; греч. «литос» камень • Na – 1807 г. , анг. Дэви, « • K – 1807 г. , анг. Дэви, араб. «алкали» щелочное в-во • Rb - 1861 г. , нем. Бунзен и Кирхгоф; лат. «рубидос» - красный • Cs - 1861 г. , нем. Бунзен и Кирхгоф; лат. «цесиус» - небесно-голубой • Fr – 1939 г. , фр. Перей (ж), в честь Франции 227 Ac = 223 Fr + 4 He (t 89 87 2 1/2 = 22 мин)

Получение • Электролиз расплавов MCl или MOH (M = Li, Na, K) Катод: M+ + e = M Анод: 2 OH- -2 e = H 2 O +1/2 O 2 (или Cl 2) • 2 MCl + Ca = 2 M + Ca. Cl 2 (M = Rb, Cs) 700 o. C, вакуум

Особенности Li Li резко отличается от остальных М, похож на Mg (диагональное сходство). Ковалентный характер связей. 6 Li + N 2 = 2 Li 3 N – нитрид Остальные М реагируют с N 2 только в эл. Разряде и выход M 3 N низкий Н/р в воде: Li. F, Li 2 CO 3, Li 3 PO 4 (как и соли Mg 2+)

Основные свойства 1) Степень окисления ТОЛЬКО +1 2) Щелочные металлы. Очень реакционноспособные 3) Диагональное сродство: Li и Mg. 4) MOH – растворимы в воде, ЩЕЛОЧИ

Св-ва простых веществ 1) Реакции с водой (K, Rb, Cs – взрываются, иногда Nа) 2) M + H 2 = 2 M+H- (солеобразные гидриды) Na. H + H 2 O = Na. OH + 1/2 H 2 3) 2 M + X 2 = 2 MX (некоторые очень бурно) 4) M + S = M 2 S
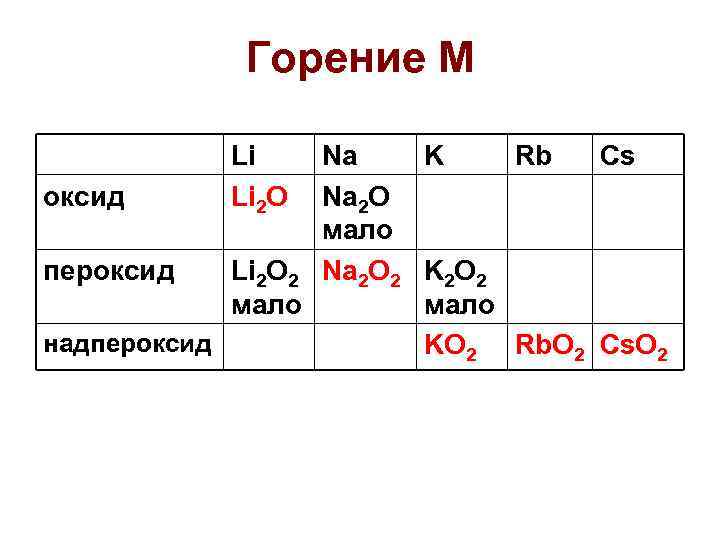
Горение М Li Li 2 O Na K Rb Cs оксид Na 2 O мало пероксид Li 2 O 2 Na 2 O 2 K 2 O 2 мало надпероксид KO 2 Rb. O 2 Cs. O 2

M-O соединения Na 2 O 2 + O 2 = 2 Na. O 2 (500 о. С, 300 атм) KO 2 + O 3 = KO 3 + O 2 MOH + M = M 2 O + H 2 (для всех М) Реакции с водой: M 2 O + H 2 O = 2 MOH M 2 O 2 + H 2 O = MOH + H 2 O 2 2 MO 2 + H 2 O = 2 MOH + H 2 O 2 + 1/2 O 2 2 MO 3 + H 2 O = 2 MOH + H 2 O 2 +3/2 O 2
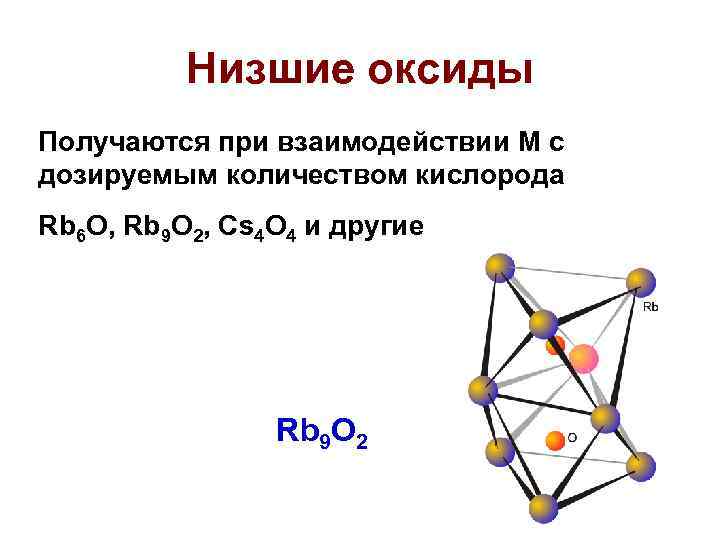
Низшие оксиды Получаются при взаимодействии М c дозируемым количеством кислорода Rb 6 O, Rb 9 O 2, Cs 4 O 4 и другие Rb 9 O 2