щелочноземельные металлы.ppt
- Количество слайдов: 10

Щелочноземельные металлы Выполнил студент группы ИБ-109 Старостин Даниил Проверила преподаватель химии Пряхина Олеся Петровна.

Положение в периодической таблице. В периодической системе находятся в главной подгруппе II группы. Являются сильными восстановителями, отдают 2 ē, во всех соединениях проявляют степень окисления +2. Общая конфигурация внешнего энергетического уровня n. S² Mg +12 2ē, 8ē, 2ē Ca +20 2ē, 8 ē, 2ē Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē Ba +56 2ē, 8ē, 18 ē, 8ē, 2ē
Положение в периодической таблице Be Mg Ca Sr Ba Ra Восстановительные свойства усиливаются

Строение атома. Ве Sr 2 2 Mg Ba 2 2 Ca 2

Физические свойства щелочноземельных металлов. Щелочноземельные металлы – серебристо-белые, твёрдые вещества. По сравнению со щелочными металлами обладают более высокими t°пл. и t°кип. , потенциалами ионизации, плотностями и твердостью. Бериллий (Ве) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу.
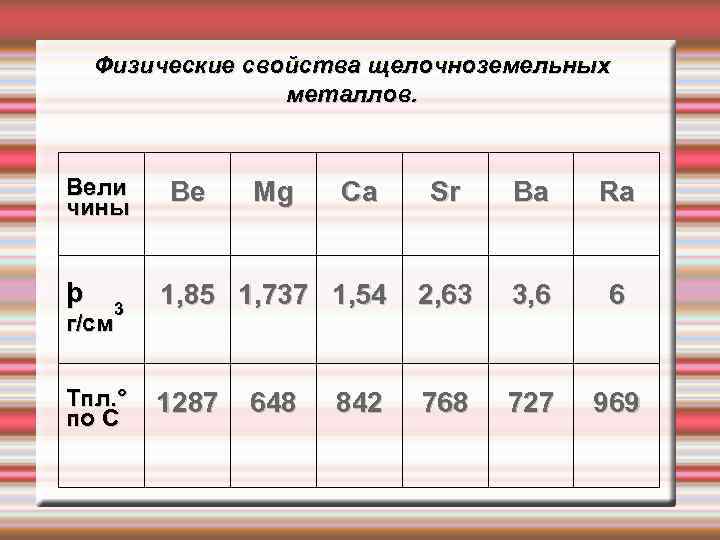
Физические свойства щелочноземельных металлов. Вели чины þ 3 г/см Tпл. ° по С Be Mg Sr Ba Ra 1, 85 1, 737 1, 54 2, 63 3, 6 6 1287 768 727 969 648 Ca 842

Физические свойства. цвет пламени Mg Ca Sr Ba þ 1, 74 г/см 3 t плавления 651 С 0 1, 54 г/см 3 851 С 0 2, 63 г/см 3 770 С 0 3, 76 г/см 3 710 С 0

Нахождение в природе. Бериллий: 3 Be. O • Al 2 O 3 • 6 Si. O 2 – берилл Магний: Mg. CO 3 – магнезит Кальций: Ca. CO 3 • Mg. CO 3 – доломит KCl • Mg. SO 4 • 3 H 2 O – каинит KCl • Mg. Cl 2 • 6 H 2 O – карналлит Ca. CO 3 – кальцит (известняк, мрамор, мел. ) Ca 3(PO 4)2 – апатит, фосфорит Ca. SO 4 • 2 H 2 O – гипс Ca. SO 4 – ангидрит Ca. F 2 – плавиковый шпат (флюорит) Стронций: Sr. SO 4 – целестин Sr. CO 3 – стронцианит Барий: Ba. SO 4 – барит Ba. CO 3 – витерит

Химические свойства. 1. С простыми веществами(неметаллами) 2 Me 0 +O 2 → 2 Me+2 O-2 - оксид Me 0 +H 2 → Me+2 H 2 Me 0 +Cl 02 → Me+2 Cl 2 Me 0 +S 0 → Me+2 S-2 - гидрид - хлорид - сульфид 2. Со сложными веществами Me 0 +2 HCl → Me+2 Cl 2 + H 2 Me 0 +2 HOH → Me+2(OH)2 +Н 2

Соединения щелочноземельных металлов. Оксиды щелочноземельных металлов –Ме. О, имеют основный характер, легко реагируют с оксидами неметаллов с образованием соответствующих солей.
щелочноземельные металлы.ppt