Щелочно-земельные металлы.ppt
- Количество слайдов: 18

ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ. БЕРИЛЛИЙ, МАГНИЙ, КАЛЬЦИЙ. Выполнили: Борисова Диана, Сабирова Неля Ученицы 9 В класса
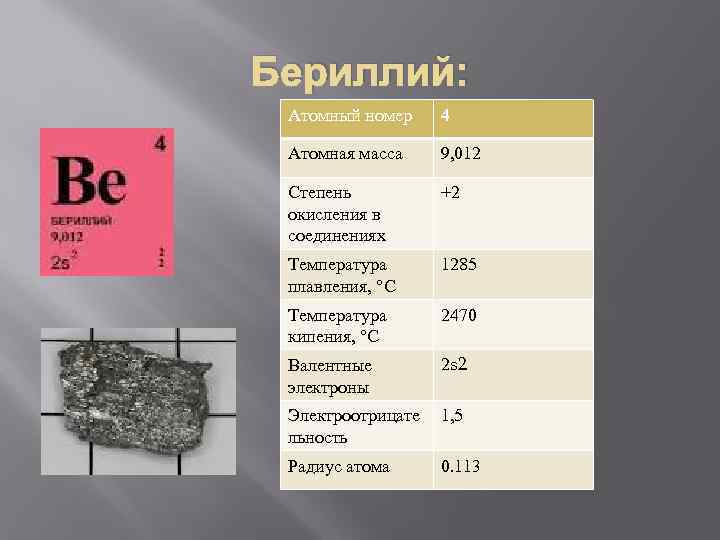
Бериллий: Атомный номер 4 Атомная масса 9, 012 Степень окисления в соединениях +2 Температура плавления, °С 1285 Температура кипения, °С 2470 Валентные электроны 2 s 2 Электроотрицате льность 1, 5 Радиус атома 0. 113

Физические свойства бериллия. кристаллическая решетка наиболее высокая теплоемкость высокой теплопроводность низким электросопротивлением температура перехода Бериллия из хрупкого состояния в пластическое 200 -400°С. светло-серого цвета с металлич. Блеском очень твердый

Химические свойства. (бериллий и оксид бериллия) При нагревании бериллий сгорает на воздухе с образованием оксида Be. O Реагирует с серой и азотом. С галогенами бериллий реагирует при обычной температуре или при слабом нагревании, например: Be + Cl 2 = Ве. Сl 2 Оксид бериллия не реагирует с водой Реагирует с кислотами: Be + 2 HCl = Be. Cl 2 + H 2 Реагирует с растворами щелочами: Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] + H 2

Гидроксид бериллия Be(OH)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: Be(OH)2 + 2 КOH = К 2[Be(OH)4], Be(OH)2 + 2 HСl = Be. Сl 2 + 2 H 2 O. В большинстве соединений бериллий проявляет координационное число 4. Например, в структуре твердого Be. Cl 2 имеются цепочки с мостиковыми атомами хлора.

Соединения бериллия в реакции с солями других металлов Be. F 2 + 2 KF = K 2[Be. F 4] Be. Cl 2 + 2 Li. H = Be. H 2 + 2 Li. Cl, проводимое в эфирном растворе

Получение бериллия В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия: В настоящее время бериллий получают, восстанавливая его фторид магнием: либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.

Применение бериллия Легирование сплавов Рентгенотехника Ядерная энергетика Лазерные материалы Аэрокосмическая техника Горное дело Ракетное топливо Огнеупорные материалы

Биологическая роль и физиологическое действие Бериллий ядовит: Летучие (и растворимые) соединения бериллия, в том числе и пыль, содержащая соединения бериллия, высокотоксичны. Для воздуха ПДК в пересчёте на бериллий составляет 0, 001 мг/м³. Бериллий обладает ярко выраженным аллергическим и канцерогенным действием. Вдыхание атмосферного воздуха, содержащего бериллий, приводит к тяжёлому заболеванию органов дыхания — бериллиозу.
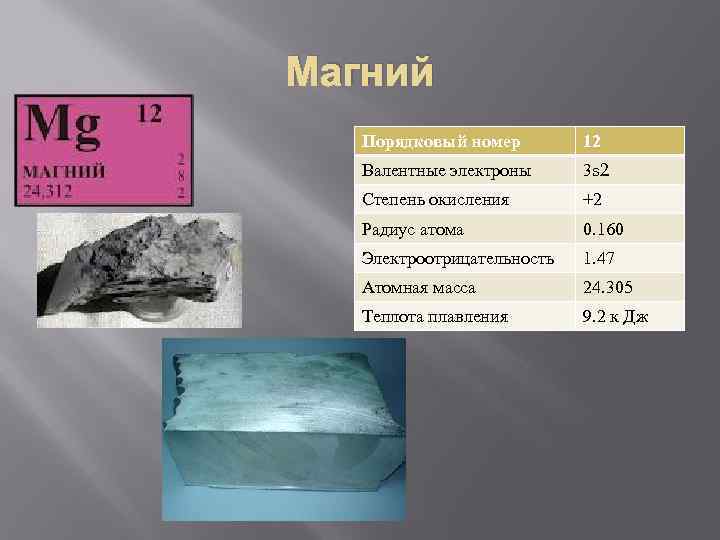
Магний Порядковый номер 12 Валентные электроны 3 s 2 Степень окисления +2 Радиус атома 0. 160 Электроотрицательность 1. 47 Атомная масса 24. 305 Теплота плавления 9. 2 к Дж

Физические свойства магния Серебристо- белый с гексагональной решёткой Легкий Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.

Химические свойства магния Раскаленный магний реагирует с водой: Mg (раск. ) + Н 2 О = Mg. O + H 2↑; Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода: Mg + 2 HCl = Mg. Cl 2 + H 2; При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида: 2 Mg + О 2 = 2 Mg. O; 3 Mg + N 2 = Mg 3 N 2 Mg+H 2=Mg. H 2 Смесь порошкового магния с перманганатом калия KMn. O 4 — взрывчатое вещество

Соединение магия и его применение Mg. CO 3=Mg. O+CO 2 (Mg. O-жженая магнезия, применяется для изготовления огнеупорных тиглей, труб, кирпечей, он входит в состав зубных порошков) 3 Mg. CO 3*Mg(OH)2*3 H 2 O – Магнезия белая Mg(Cl. O 4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния. Mg. SO 4*7 H 2 O – горькая соль Mg. F 2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы). Mg. Br 2 — в качестве электролита для химических резервных источников тока.

Соединения магния и их применение Mg. O=Mg. Cl 2+H 2 O=2 Mg. OHCl- магнезиальный цемент 3 Mg. O*4 Si. O 2*H 2 O – тальк Ca. O*3 Mg. O*Si. O 2 – асбест

Магний входит в состав около 200 минералов Магнезит – Mg. CO 3 Доломит – Mg. CO 3*Ca. CO 3 Карналлит – KCl*Mg. Cl 2*6 H 2 O

Применение магния в металлургии Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Магниевый порошок стали применять также в качестве высококалорийного горючего в современной ракетной технике Магний используется для рафинирования вторичного алюминия от примеси магния путем переплавки металла с жидкими хлоридными флюсами, содержащими криолит Важное значение в современной химической технологии получил синтез сложных веществ с помощью магнийорганических соединений Магний используют в качестве одного из компонентов при синтезе полупроводниковых соединений.

Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедномагниевый элемент, магний-ванадиевый элемент и др. ) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м. ДНБ элемент и др. ). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением.

Свойство металла гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб.
Щелочно-земельные металлы.ppt