СГТА Техническая термодинамика и



























































































1,2 закон термодинамики.ppt
- Количество слайдов: 100
 СГТА Техническая термодинамика и теплотехника ВВЕДЕНИЕ
СГТА Техническая термодинамика и теплотехника ВВЕДЕНИЕ
 СГТА 2 n Термодинамика – это наука об энергии, ее свойствах и закономерностях превращения различных видов энергии друг в друга. Термодинамику можно условно разделить на три части: - общая термодинамика; - химическая термодинамика; - техническая термодинамика.
СГТА 2 n Термодинамика – это наука об энергии, ее свойствах и закономерностях превращения различных видов энергии друг в друга. Термодинамику можно условно разделить на три части: - общая термодинамика; - химическая термодинамика; - техническая термодинамика.
 СГТА 3 n Общая термодинамика изучает процессы превращения энергии в твердых, жидких и газообразных телах, а также устанавливает зависимости между термодинамическими параметрами. n Химическая термодинамика на основе законов общей термодинамики изучает закономерности протекания химических и физико-химических процессов, а также возможности и направления протекания этих процессов. n Техническая термодинамика на основе законов общей термодинамики рассматривает закономерности взаимного превращения теплоты и работы.
СГТА 3 n Общая термодинамика изучает процессы превращения энергии в твердых, жидких и газообразных телах, а также устанавливает зависимости между термодинамическими параметрами. n Химическая термодинамика на основе законов общей термодинамики изучает закономерности протекания химических и физико-химических процессов, а также возможности и направления протекания этих процессов. n Техническая термодинамика на основе законов общей термодинамики рассматривает закономерности взаимного превращения теплоты и работы.
 СГТА 4 Термодинамика в широком смысле рассматривает : n закономерности перехода энергии из одной формы в другую; n энергетические эффекты, сопровождающие различные физические, физико-химические и химические процессы; n зависимость энергетических эффектов от условий протекания процессов; n возможность, направление и пределы самопроизвольного протекания процессов.
СГТА 4 Термодинамика в широком смысле рассматривает : n закономерности перехода энергии из одной формы в другую; n энергетические эффекты, сопровождающие различные физические, физико-химические и химические процессы; n зависимость энергетических эффектов от условий протекания процессов; n возможность, направление и пределы самопроизвольного протекания процессов.
 СГТА 5 Техническая термодинамика базируется на двух основных законах: n Первый закон термодинамики - является следствием всеобщего закона сохранения и превращения энергии, применительно к процессам превращения теплоты в работу и наоборот ( характеризует количественную сторону процесса) n Второй закон термодинамики устанавливает направление, возможность и пределы самопроизвольного протекания процесса.
СГТА 5 Техническая термодинамика базируется на двух основных законах: n Первый закон термодинамики - является следствием всеобщего закона сохранения и превращения энергии, применительно к процессам превращения теплоты в работу и наоборот ( характеризует количественную сторону процесса) n Второй закон термодинамики устанавливает направление, возможность и пределы самопроизвольного протекания процесса.
 СГТА Техническая термодинамика и теплотехника 1 ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
СГТА Техническая термодинамика и теплотехника 1 ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
 СГТА 7 Основные параметры состояния Основные процессы перехода тепла в работу и наоборот осущ-ся посредством рабочего тела. В любых установках раб. телом явл. газ, изменяющий свое физич. состояние при сообщении теплоты или при силовом воздействии.
СГТА 7 Основные параметры состояния Основные процессы перехода тепла в работу и наоборот осущ-ся посредством рабочего тела. В любых установках раб. телом явл. газ, изменяющий свое физич. состояние при сообщении теплоты или при силовом воздействии.
 СГТА 8 Величины, характеризующие физическое состояние тела называются термодинамическими параметрами состояния тела. За основные параметры принимаются: n удельный объем v, n температура T, n давление P, 1 Удельный объем – это объем единицы массы:
СГТА 8 Величины, характеризующие физическое состояние тела называются термодинамическими параметрами состояния тела. За основные параметры принимаются: n удельный объем v, n температура T, n давление P, 1 Удельный объем – это объем единицы массы:
 СГТА 9 2 Температурой называют физическую величину, являющуюся мерой отклонения одного тела от состояния теплового равновесия с другим телом, состояние которого принято, как нулевое. В зависимости от выбора нулевого состояния вводятся понятия эмпирической и абсолютной температур.
СГТА 9 2 Температурой называют физическую величину, являющуюся мерой отклонения одного тела от состояния теплового равновесия с другим телом, состояние которого принято, как нулевое. В зависимости от выбора нулевого состояния вводятся понятия эмпирической и абсолютной температур.
 СГТА 10 Эмпирическая температура - _ мера отклонения тела от состояния теплового равновесия с тающим льдом при давлении одна атмосфера (t, ºC). Температура таяния льда при давлении в одну атмосферу равно нулю градусов Цельсия (0 С). Абсолютной температурой тела называют температуру пропорциональную средней кинетической энергии движения молекулы (T, K).
СГТА 10 Эмпирическая температура - _ мера отклонения тела от состояния теплового равновесия с тающим льдом при давлении одна атмосфера (t, ºC). Температура таяния льда при давлении в одну атмосферу равно нулю градусов Цельсия (0 С). Абсолютной температурой тела называют температуру пропорциональную средней кинетической энергии движения молекулы (T, K).
 СГТА 11 Шкала Кельвина отсчитывается от абсолютного нуля и имеет только положительные значения, а шкала Цельсия - от температуры таяния льда и может быть как положительной, так и отрицательной. Для удобства пользователей цена деления шкал температур Цельсия и Кельвина принята одинаковой, поэтому .
СГТА 11 Шкала Кельвина отсчитывается от абсолютного нуля и имеет только положительные значения, а шкала Цельсия - от температуры таяния льда и может быть как положительной, так и отрицательной. Для удобства пользователей цена деления шкал температур Цельсия и Кельвина принята одинаковой, поэтому .
 СГТА 12 3 Абсолютным давлением называется полное давление, испытанное системой. Давление – это сила, действующая на единицу площади поверхности: или . С точки зрения молекулярно кинетической теории газа давление обусловлено силами взаимодействия молекул газа на заключающую газ оболочку.
СГТА 12 3 Абсолютным давлением называется полное давление, испытанное системой. Давление – это сила, действующая на единицу площади поверхности: или . С точки зрения молекулярно кинетической теории газа давление обусловлено силами взаимодействия молекул газа на заключающую газ оболочку.
 СГТА Термодинамическая система и т/д 13 процесс Все вокруг нас это материальный мир. Материя находится в движении. Мерой движения материи является энергия. Из всех видов энергии термодинамика рассматривает только внутреннюю энергию. Термодинамическая система - любое материальное тело или их совокупность, находящиеся в механическом или тепловом взаимодействии друг с другом и окружающей средой, полностью характеризующееся независимыми параметрами, ограниченная геометрическими размерами. Все тела, которые не входят в данную термодинамическую систему, называют внешними или окружающей средой.
СГТА Термодинамическая система и т/д 13 процесс Все вокруг нас это материальный мир. Материя находится в движении. Мерой движения материи является энергия. Из всех видов энергии термодинамика рассматривает только внутреннюю энергию. Термодинамическая система - любое материальное тело или их совокупность, находящиеся в механическом или тепловом взаимодействии друг с другом и окружающей средой, полностью характеризующееся независимыми параметрами, ограниченная геометрическими размерами. Все тела, которые не входят в данную термодинамическую систему, называют внешними или окружающей средой.
 СГТА 14 Количество параметров системы зависит от степени ее сложности. Для оценки степени сложности системы вводится понятие фазы. По числу фаз системы бывают однофазные и многофазные. Простейшей термодинамической системой является идеальный газ. Для ее характеристики достаточно трех параметров состояния: давления P, объема V и температуры Т. Функциональная зависимость, существующая между термодинамическими параметрами, называется уравнением состояния:
СГТА 14 Количество параметров системы зависит от степени ее сложности. Для оценки степени сложности системы вводится понятие фазы. По числу фаз системы бывают однофазные и многофазные. Простейшей термодинамической системой является идеальный газ. Для ее характеристики достаточно трех параметров состояния: давления P, объема V и температуры Т. Функциональная зависимость, существующая между термодинамическими параметрами, называется уравнением состояния:
 СГТА 15 Изолированная система – это система, не взаимодействующая с окружающей средой. Адиабатическая система – это система, отделенная от окружающей среды, так называемой адиабатической (теплоизолирующей) оболочкой. Если в любой точке состояние т/д системы не меняется во времени (параметры не изменяется), то такая термодинамическая система называется равновесной. ( Т/д состояние в любой системе координат обозначается точкой).
СГТА 15 Изолированная система – это система, не взаимодействующая с окружающей средой. Адиабатическая система – это система, отделенная от окружающей среды, так называемой адиабатической (теплоизолирующей) оболочкой. Если в любой точке состояние т/д системы не меняется во времени (параметры не изменяется), то такая термодинамическая система называется равновесной. ( Т/д состояние в любой системе координат обозначается точкой).
 СГТА 16 Т/Д процесс - последовательность изменений состояния т/д системы. Процесс – это результат взаимодействия термодинамической системы с окружающей средой, в результате которого изменяется внутренняя энергия системы.
СГТА 16 Т/Д процесс - последовательность изменений состояния т/д системы. Процесс – это результат взаимодействия термодинамической системы с окружающей средой, в результате которого изменяется внутренняя энергия системы.
 СГТА 17 n Обратимый процесс – процесс , который может происходить как в прямом так и в противоположном направлениях и при том так, что при обратном процессе система проходит через все те же состояния, что и в прямом процессе, причем в самой системе и в окружающей внешней среде не должны возникать какие-либо изменения. n Процесс не удовлетворяющий этому условию является необратимым.
СГТА 17 n Обратимый процесс – процесс , который может происходить как в прямом так и в противоположном направлениях и при том так, что при обратном процессе система проходит через все те же состояния, что и в прямом процессе, причем в самой системе и в окружающей внешней среде не должны возникать какие-либо изменения. n Процесс не удовлетворяющий этому условию является необратимым.
 СГТА 18 При переходе из одного состояния в другое система либо потребляет, либо отдает часть внутренней энергии. Если переход системы из одного состояния в другое таково, что начальное состояние совпадает с конечным, то такие процессы называются круговыми или циклами.
СГТА 18 При переходе из одного состояния в другое система либо потребляет, либо отдает часть внутренней энергии. Если переход системы из одного состояния в другое таково, что начальное состояние совпадает с конечным, то такие процессы называются круговыми или циклами.
 СГТА Уравнение состояния идеального 19 газа Преобразование тепловой энергии в механическую работу можно осуществить посредством рабочего тела , назначение которого принимать тепло и при этом расширяясь, совершать работу. Наиболее удобной формой рабочего тела является газообразное состояние вещества. В этом состоянии вещество обладает ярко выраженными упругими свойствами. В технической термодинамике в качестве рабочего тела рассматривают идеальные и реальные газы.
СГТА Уравнение состояния идеального 19 газа Преобразование тепловой энергии в механическую работу можно осуществить посредством рабочего тела , назначение которого принимать тепло и при этом расширяясь, совершать работу. Наиболее удобной формой рабочего тела является газообразное состояние вещества. В этом состоянии вещество обладает ярко выраженными упругими свойствами. В технической термодинамике в качестве рабочего тела рассматривают идеальные и реальные газы.
 СГТА 20 Идеальный газ – система материальных точек, находящихся в хаотическом движении, обладающих нулевым объемом и лишенных сил взаимодействия. Любой газ близок по свойствам к идеальному газу, чем выше температура и чем меньше давление. В термодинамике все газы с допускаемой точностью можно рассматривать как идеальные, за исключением водяного пара.
СГТА 20 Идеальный газ – система материальных точек, находящихся в хаотическом движении, обладающих нулевым объемом и лишенных сил взаимодействия. Любой газ близок по свойствам к идеальному газу, чем выше температура и чем меньше давление. В термодинамике все газы с допускаемой точностью можно рассматривать как идеальные, за исключением водяного пара.
 СГТА 21 Идеальный газ является простейшей термодинамической системой и для ее описания достаточно трех параметров: • абсолютная температура Т, • давление Р, • объем V. Функциональную зависимость между этими параметрами вывел Клапейрон: . R – газовая постоянная.
СГТА 21 Идеальный газ является простейшей термодинамической системой и для ее описания достаточно трех параметров: • абсолютная температура Т, • давление Р, • объем V. Функциональную зависимость между этими параметрами вывел Клапейрон: . R – газовая постоянная.
 СГТА 22 Д. И. Менделеев придал уравнению Клапейрона общую форму, воспользовавшись законом Авогадро. Пусть масса газа равна 1 кмоль, тогда: , - универсальная газовая постоянная. При постоянных значениях давления и температуры:
СГТА 22 Д. И. Менделеев придал уравнению Клапейрона общую форму, воспользовавшись законом Авогадро. Пусть масса газа равна 1 кмоль, тогда: , - универсальная газовая постоянная. При постоянных значениях давления и температуры:
 СГТА 23 Зная универсальную газовую постоянную, можно определить газовую постоянную для любого газа где μ - молекулярная масса газа; Из уравнения состояния идеального газа можно получить частные случаи, когда один из параметров не изменяется:
СГТА 23 Зная универсальную газовую постоянную, можно определить газовую постоянную для любого газа где μ - молекулярная масса газа; Из уравнения состояния идеального газа можно получить частные случаи, когда один из параметров не изменяется:
 СГТА 24 n в изотермическом процессе при T=const получаем закон Бойля – Мариотта: ; n в изобарном процессе при P=const получаем закон Гей-Люссака: ; n в изохорном процессе при V=const получаем закон Шарля: .
СГТА 24 n в изотермическом процессе при T=const получаем закон Бойля – Мариотта: ; n в изобарном процессе при P=const получаем закон Гей-Люссака: ; n в изохорном процессе при V=const получаем закон Шарля: .
 СГТА 25 Поведение реальных газов можно описать уравнением Ван-дер-Ваальса: , где - поправка на силу взаимодействия молекул газа; b - поправка на объем молекул.
СГТА 25 Поведение реальных газов можно описать уравнением Ван-дер-Ваальса: , где - поправка на силу взаимодействия молекул газа; b - поправка на объем молекул.
 СГТА 26 Смесь идеальных газов Во многих случаях рабочим телом являются смеси газов. Например, воздух, продукты сгорания топлива и т. д. Газовая смесь – смесь отдельных газов не вступающих между собой ни в какие химические реакции. Каждый газ в смеси ведет себя самостоятельно, независимо от других и занимает полный объем смеси.
СГТА 26 Смесь идеальных газов Во многих случаях рабочим телом являются смеси газов. Например, воздух, продукты сгорания топлива и т. д. Газовая смесь – смесь отдельных газов не вступающих между собой ни в какие химические реакции. Каждый газ в смеси ведет себя самостоятельно, независимо от других и занимает полный объем смеси.
 СГТА 27 Смесь идеальных газов подчиняется двум законам: n Закону дальтона: . Согласно закону Дальтона , полное давление газовой смеси равно сумме парциальных давлений ее компонентов n Уравнению состояния идеальных газов: Все параметры относятся к смеси. .
СГТА 27 Смесь идеальных газов подчиняется двум законам: n Закону дальтона: . Согласно закону Дальтона , полное давление газовой смеси равно сумме парциальных давлений ее компонентов n Уравнению состояния идеальных газов: Все параметры относятся к смеси. .
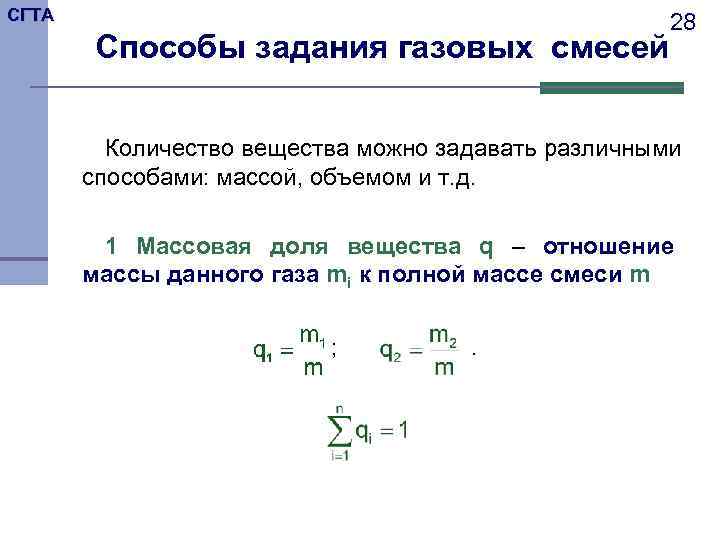
 СГТА 28 Способы задания газовых смесей Количество вещества можно задавать различными способами: массой, объемом и т. д. 1 Массовая доля вещества q – отношение массы данного газа mi к полной массе смеси m ; .
СГТА 28 Способы задания газовых смесей Количество вещества можно задавать различными способами: массой, объемом и т. д. 1 Массовая доля вещества q – отношение массы данного газа mi к полной массе смеси m ; .
 СГТА 29 2 Объемная доля вещества r – отношение приведенного объема газа к полному объему газовой смеси. Приведенный объем – объем газа вычисленный при давлении и температуре газовой смеси.
СГТА 29 2 Объемная доля вещества r – отношение приведенного объема газа к полному объему газовой смеси. Приведенный объем – объем газа вычисленный при давлении и температуре газовой смеси.
 СГТА 30 Для вычисления удельных объемов запишем уравнения состояния идеальных газов для двух случаев. Первое уравнение относится к состоянию, когда газ занимает весь объем сосуда и его давление равно парциальному. Второе уравнение относится к приведенному состоянию, когда давление будет равно полному давлению смеси , которому соответствует приведенный объем V 1
СГТА 30 Для вычисления удельных объемов запишем уравнения состояния идеальных газов для двух случаев. Первое уравнение относится к состоянию, когда газ занимает весь объем сосуда и его давление равно парциальному. Второе уравнение относится к приведенному состоянию, когда давление будет равно полному давлению смеси , которому соответствует приведенный объем V 1
 СГТА 31 Выразим из этих уравнений V 1: . Обозначим отношение , где r 1 – объемная доля газа. ; .
СГТА 31 Выразим из этих уравнений V 1: . Обозначим отношение , где r 1 – объемная доля газа. ; .
 СГТА 32 Покажем, что . ; .
СГТА 32 Покажем, что . ; .
 СГТА 33 Мольной долей называется отношение числа молей данного газа к общему числу молей. Из закона Авогадро следует, что один моль любого газа занимает одинаковый объем . Таким образом, мольные доли совпадают с объемными долями.
СГТА 33 Мольной долей называется отношение числа молей данного газа к общему числу молей. Из закона Авогадро следует, что один моль любого газа занимает одинаковый объем . Таким образом, мольные доли совпадают с объемными долями.
 СГТА 34 Расчет газовой смеси: n определение на основании заданного состава кажущейся молекулярной массы или газовой постоянной. n определение всех остальных параметров по уравнению состояния.
СГТА 34 Расчет газовой смеси: n определение на основании заданного состава кажущейся молекулярной массы или газовой постоянной. n определение всех остальных параметров по уравнению состояния.
 СГТА 35 1 Определение кажущейся молекулярной массы , где – молекулярная масса i – го компонента смеси. В качестве примера рассчитаем кажущуюся молекулярную массу атмосферного воздуха: mвозд = m. O × r. O + m. N × r. N = 32× 0. 21+ 28 × 0. 79 = 29. 2 2
СГТА 35 1 Определение кажущейся молекулярной массы , где – молекулярная масса i – го компонента смеси. В качестве примера рассчитаем кажущуюся молекулярную массу атмосферного воздуха: mвозд = m. O × r. O + m. N × r. N = 32× 0. 21+ 28 × 0. 79 = 29. 2 2
 СГТА 36 Массовую и объемную доли можно взаимно перевести ; .
СГТА 36 Массовую и объемную доли можно взаимно перевести ; .
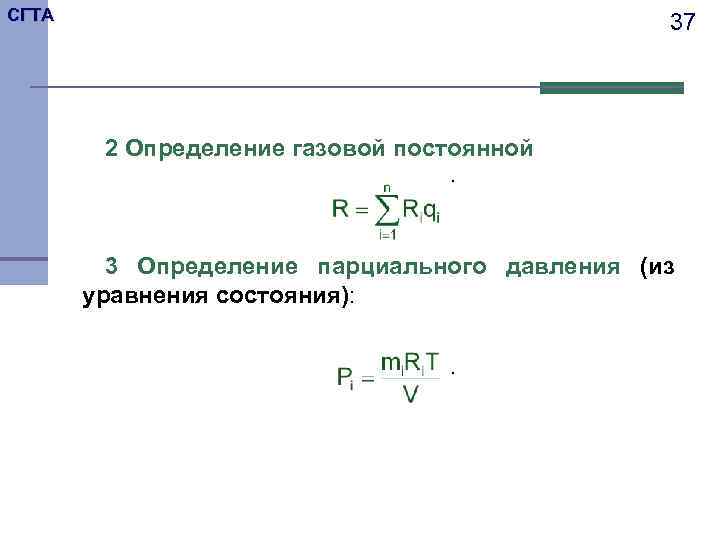
 СГТА 37 2 Определение газовой постоянной . 3 Определение парциального давления (из уравнения состояния): .
СГТА 37 2 Определение газовой постоянной . 3 Определение парциального давления (из уравнения состояния): .
 СГТА Теплоемкость газа. 38 Классификация теплоемкостей Удельная теплоемкость - количество теплоты, которая требуется для изменения температуры единицы количества вещества на один градус. 1 В зависимости от единицы количества вещества: nмассовая, Дж/(кг К); nмольная, Дж/(кмоль К); nобъемная, Дж/(м 3 К).
СГТА Теплоемкость газа. 38 Классификация теплоемкостей Удельная теплоемкость - количество теплоты, которая требуется для изменения температуры единицы количества вещества на один градус. 1 В зависимости от единицы количества вещества: nмассовая, Дж/(кг К); nмольная, Дж/(кмоль К); nобъемная, Дж/(м 3 К).
 СГТА 39 2 В зависимости от вида термодинамического процесса: n изобарная сp n изохорная сv. 3 В зависимости от интервала температур: n средняя, n истинная
СГТА 39 2 В зависимости от вида термодинамического процесса: n изобарная сp n изохорная сv. 3 В зависимости от интервала температур: n средняя, n истинная
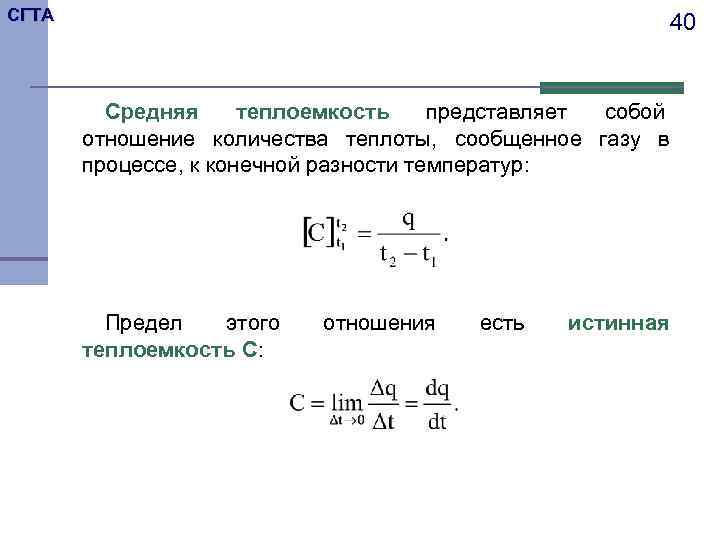
 СГТА 40 Средняя теплоемкость представляет собой отношение количества теплоты, сообщенное газу в процессе, к конечной разности температур: Предел этого отношения есть истинная теплоемкость C:
СГТА 40 Средняя теплоемкость представляет собой отношение количества теплоты, сообщенное газу в процессе, к конечной разности температур: Предел этого отношения есть истинная теплоемкость C:
 СГТА 41 Из этих выражений следует, что теплоту, сообщаемую газу в процессе можно определить по теплоемкости: Теплоемкость газов зависит от температуры и давления; от типа термодинамического процесса. Зависимость теплоемкости идеальных газов от давления несущественна и ею можно пренебречь. Для реальных газов при высоких давлениях эта зависимость проявляется весьма существенно.
СГТА 41 Из этих выражений следует, что теплоту, сообщаемую газу в процессе можно определить по теплоемкости: Теплоемкость газов зависит от температуры и давления; от типа термодинамического процесса. Зависимость теплоемкости идеальных газов от давления несущественна и ею можно пренебречь. Для реальных газов при высоких давлениях эта зависимость проявляется весьма существенно.
 СГТА 42 Зависимость теплоемкости вещества от температуры выражают уравнением: , где a 0 , b , c – постоянные коэффициенты для каждого вещества. Для идеальных газов можно считать, что их теплоемкость с увеличением температуры линейно возрастает .
СГТА 42 Зависимость теплоемкости вещества от температуры выражают уравнением: , где a 0 , b , c – постоянные коэффициенты для каждого вещества. Для идеальных газов можно считать, что их теплоемкость с увеличением температуры линейно возрастает .
 СГТА 43 Вычисление теплоемкости газов В настоящее время таблицы точных значений теплоемкостей для различных газов в зависимости от температуры составляются на основе расчетов по квантовой теории. При теплотехнических расчетах можно использовать значения теплоемкостей, полученные на основе молекулярно – кинетической теории газов, согласно которой мольная теплоемкость газов зависит только от их атомности и не зависит от температуры.
СГТА 43 Вычисление теплоемкости газов В настоящее время таблицы точных значений теплоемкостей для различных газов в зависимости от температуры составляются на основе расчетов по квантовой теории. При теплотехнических расчетах можно использовать значения теплоемкостей, полученные на основе молекулярно – кинетической теории газов, согласно которой мольная теплоемкость газов зависит только от их атомности и не зависит от температуры.
 СГТА 44 Для одноатомных газов: , - теплоемкость при постоянном объеме; - теплоемкость при постоянном давлении.
СГТА 44 Для одноатомных газов: , - теплоемкость при постоянном объеме; - теплоемкость при постоянном давлении.
 СГТА 45 Для двухатомных газов: , .
СГТА 45 Для двухатомных газов: , .
 СГТА 46 Для трех- и многоатомных газов: , .
СГТА 46 Для трех- и многоатомных газов: , .
 СГТА Обобщенное понятие работы, 47 теплоты и внутренней энергии В технической термодинамике двумя наиболее важными формами передачи энергии являются теплота и работа. Работа – это такая форма передачи энергии, которая осуществляется при перемещении всего тела или его части в пространстве. В этом случае тело должно передвигаться в пространстве или изменять свой объем, то есть должны быть силовые линии. L – полная работа, Дж; l – удельная работа, Дж/кг.
СГТА Обобщенное понятие работы, 47 теплоты и внутренней энергии В технической термодинамике двумя наиболее важными формами передачи энергии являются теплота и работа. Работа – это такая форма передачи энергии, которая осуществляется при перемещении всего тела или его части в пространстве. В этом случае тело должно передвигаться в пространстве или изменять свой объем, то есть должны быть силовые линии. L – полная работа, Дж; l – удельная работа, Дж/кг.
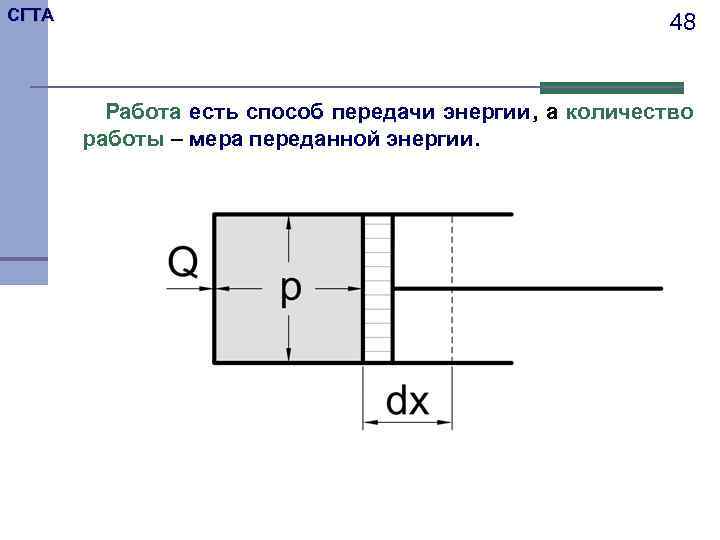
 СГТА 48 Работа есть способ передачи энергии, а количество работы – мера переданной энергии.
СГТА 48 Работа есть способ передачи энергии, а количество работы – мера переданной энергии.
 СГТА 49 Рассмотрим работу расширения - сжатия. Для этого рассмотрим цилиндр с поршнем площадью поверхности S, заполненный газом. К газу подведем некоторое количество теплоты Q. В результате этого объем газа увеличится на d. V. Это увеличение объема можно представить как перемещение поршня на расстояние dx. Поскольку в данном случае P - это давление действующее нормалью к поверхности поршня, то сила, действующая на поршень:
СГТА 49 Рассмотрим работу расширения - сжатия. Для этого рассмотрим цилиндр с поршнем площадью поверхности S, заполненный газом. К газу подведем некоторое количество теплоты Q. В результате этого объем газа увеличится на d. V. Это увеличение объема можно представить как перемещение поршня на расстояние dx. Поскольку в данном случае P - это давление действующее нормалью к поверхности поршня, то сила, действующая на поршень:
 СГТА 50 Следовательно работу, которая совершается в этом процессе можно записать так: Проинтегрировав последнее выражение, получим: где L - работа расширения – сжатия, Дж/кг.
СГТА 50 Следовательно работу, которая совершается в этом процессе можно записать так: Проинтегрировав последнее выражение, получим: где L - работа расширения – сжатия, Дж/кг.
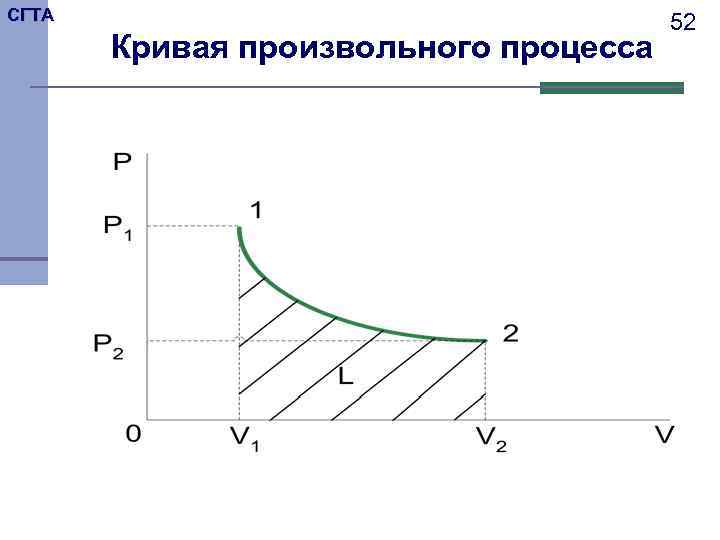
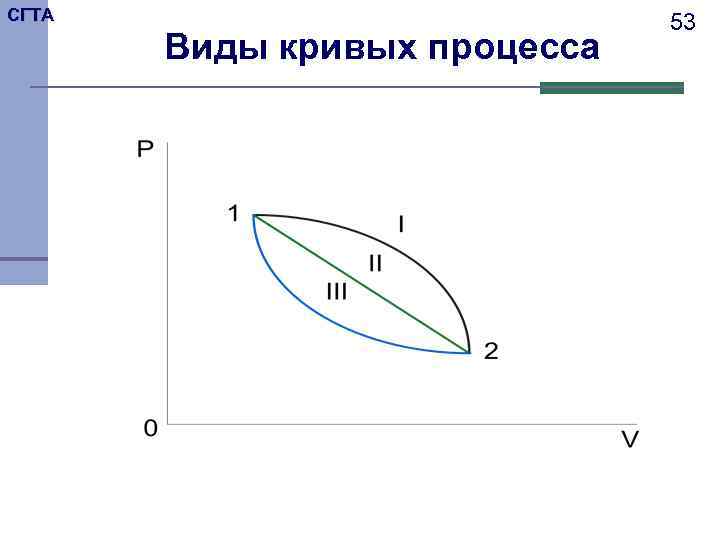
 СГТА 51 Работу расширения–сжатия можно графически представить в координатах давление – объем. В этих координатах работа равна площади под кривой процесса. Следовательно величина работы зависит от вида процесса.
СГТА 51 Работу расширения–сжатия можно графически представить в координатах давление – объем. В этих координатах работа равна площади под кривой процесса. Следовательно величина работы зависит от вида процесса.
 СГТА 52 Кривая произвольного процесса
СГТА 52 Кривая произвольного процесса
 СГТА 53 Виды кривых процесса
СГТА 53 Виды кривых процесса
 СГТА 54 Количество энергии, полученное телом в форме работы, называют совершенной над телом работой или отрицательной , а количество энергии, отданной телом в форме работы, называют затраченной или положительной.
СГТА 54 Количество энергии, полученное телом в форме работы, называют совершенной над телом работой или отрицательной , а количество энергии, отданной телом в форме работы, называют затраченной или положительной.
 СГТА 55 Теплота – это такая форма передачи энергии, которая реализуется при непосредственном контакте тел, имеющих различные температуры. Количество энергии, переданной в форме теплоты, называют количеством теплоты, а сам способ передачи энергии в форме теплоты - теплопередачей.
СГТА 55 Теплота – это такая форма передачи энергии, которая реализуется при непосредственном контакте тел, имеющих различные температуры. Количество энергии, переданной в форме теплоты, называют количеством теплоты, а сам способ передачи энергии в форме теплоты - теплопередачей.
 СГТА 56 Q – теплота, Дж; q – удельная теплота, Дж/кг. Количество энергии, полученное телом в форме теплоты, называют подведенной к телу теплотой или положительной. Количество энергии, отданное телом в форме теплоты - отведенной теплотой или отрицательной.
СГТА 56 Q – теплота, Дж; q – удельная теплота, Дж/кг. Количество энергии, полученное телом в форме теплоты, называют подведенной к телу теплотой или положительной. Количество энергии, отданное телом в форме теплоты - отведенной теплотой или отрицательной.
 СГТА 57 Внутренняя энергия - та часть энергии, которая связана с движением микрочастиц, составляющих систему. Внутренняя энергия U является экстенсивной функцией и имеет единицу измерения [к. Дж / кг]. Внутреннюю энергию можно представить как сумму составляющих:
СГТА 57 Внутренняя энергия - та часть энергии, которая связана с движением микрочастиц, составляющих систему. Внутренняя энергия U является экстенсивной функцией и имеет единицу измерения [к. Дж / кг]. Внутреннюю энергию можно представить как сумму составляющих:
 СГТА 58 n кинетической энергии молекул , включая энергию поступательного и вращательного движения молекул, а также колебательного движения атомов в молекуле; n потенциальной энергии или энергии положения в поле каких-либо сил; n энергии электронов; n внутриядерной энергии; n энергии электромагнитного излучения.
СГТА 58 n кинетической энергии молекул , включая энергию поступательного и вращательного движения молекул, а также колебательного движения атомов в молекуле; n потенциальной энергии или энергии положения в поле каких-либо сил; n энергии электронов; n внутриядерной энергии; n энергии электромагнитного излучения.
 СГТА 59 В термодинамике для идеального газа рассматривают только кинетическую энергию молекул , а для реальных газов – кинетическую и потенциальные энергии. Потенциальная энергия зависит от расстояния между молекулами газа. Внутренняя энергия системы отсчитывается от условно принятого нуля. В термодинамике принято, что внутренняя энергия газов условно равна нулю при температуре t=00 C.
СГТА 59 В термодинамике для идеального газа рассматривают только кинетическую энергию молекул , а для реальных газов – кинетическую и потенциальные энергии. Потенциальная энергия зависит от расстояния между молекулами газа. Внутренняя энергия системы отсчитывается от условно принятого нуля. В термодинамике принято, что внутренняя энергия газов условно равна нулю при температуре t=00 C.
 СГТА 60 Т. к состояние любой системы зависит от ее параметров, то и внутренняя энергия также должна полностью зависеть от совокупности этих параметров. Для реальных газов внутренняя энергия Для идеальных газов
СГТА 60 Т. к состояние любой системы зависит от ее параметров, то и внутренняя энергия также должна полностью зависеть от совокупности этих параметров. Для реальных газов внутренняя энергия Для идеальных газов
 СГТА 61 Изменение внутренней энергии в любом процессе можно определить по формуле: . Таким образом, изменение внутренней энергии не зависит от пути процесса, а определяется начальным и конечным состоянием системы.
СГТА 61 Изменение внутренней энергии в любом процессе можно определить по формуле: . Таким образом, изменение внутренней энергии не зависит от пути процесса, а определяется начальным и конечным состоянием системы.
 СГТА 62 Так как внутренняя энергия является функцией состояния, то в круговом процессе изменения внутренней энергии не происходит, то есть
СГТА 62 Так как внутренняя энергия является функцией состояния, то в круговом процессе изменения внутренней энергии не происходит, то есть
 СГТА 63 Внутреннюю энергию можно представить как функцию любой пары независимых переменных: n при независимых температуре и давлении; n при независимых температуре и удельном объеме; n при независимых давлении и удельном объеме. Взаимосвязь между работой, теплотой и внутренней энергией определяется первым законом термодинамики.
СГТА 63 Внутреннюю энергию можно представить как функцию любой пары независимых переменных: n при независимых температуре и давлении; n при независимых температуре и удельном объеме; n при независимых давлении и удельном объеме. Взаимосвязь между работой, теплотой и внутренней энергией определяется первым законом термодинамики.
 СГТА Техническая термодинамика и теплотехника 2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
СГТА Техническая термодинамика и теплотехника 2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
 СГТА Техническая термодинамика и теплотехника 2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
СГТА Техническая термодинамика и теплотехника 2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
 СГТА Основные формулировки первого 66 закона термодинамики Первый закон термодинамики является следствием всеобщего закона сохранения и превращения энергии , который гласит, что в изолированной системе сумма всех видов энергии постоянна. Первый закон термодинамики, являясь частным случаем закона сохранения и превращения энергии, устанавливает взаимосвязь между теплотой и работой.
СГТА Основные формулировки первого 66 закона термодинамики Первый закон термодинамики является следствием всеобщего закона сохранения и превращения энергии , который гласит, что в изолированной системе сумма всех видов энергии постоянна. Первый закон термодинамики, являясь частным случаем закона сохранения и превращения энергии, устанавливает взаимосвязь между теплотой и работой.
 СГТА 67 Первая формулировка первого закона термодинамики: теплота Q и работа L эквивалентны. Это значит, что теплота может превращаться в работу, а работа в теплоту , причем определенному количеству теплоты соответствует определенное количество работы и наоборот.
СГТА 67 Первая формулировка первого закона термодинамики: теплота Q и работа L эквивалентны. Это значит, что теплота может превращаться в работу, а работа в теплоту , причем определенному количеству теплоты соответствует определенное количество работы и наоборот.
 СГТА 68 Превращение работы в теплоту известно с древних времен, когда путем трения добывали огонь. Первое превращение теплоты в работу было совершено в 1766 г. в паровой машине И. И. Ползунова. В 1841 г. Роберт Майер на основе опытных данных установил эквивалентность между теплотой и работой: , где А – коэффициент пропорциональности.
СГТА 68 Превращение работы в теплоту известно с древних времен, когда путем трения добывали огонь. Первое превращение теплоты в работу было совершено в 1766 г. в паровой машине И. И. Ползунова. В 1841 г. Роберт Майер на основе опытных данных установил эквивалентность между теплотой и работой: , где А – коэффициент пропорциональности.
 СГТА 69 Вторая формулировка первого закона термодинамики : механическая работа, полученная из теплоты, не зависит от характера превращения теплоты в работу. Третья формулировка первого закона термодинамики : энергия системы является однозначной функцией ее состояния.
СГТА 69 Вторая формулировка первого закона термодинамики : механическая работа, полученная из теплоты, не зависит от характера превращения теплоты в работу. Третья формулировка первого закона термодинамики : энергия системы является однозначной функцией ее состояния.
 СГТА 70 Так как внутренняя энергия системы изменяется при взаимодействии с окружающей средой, а двумя формами передачи энергии являются теплота и работа, то между ними должна быть взаимосвязь, которая называется математическим выражением первого закона термодинамики.
СГТА 70 Так как внутренняя энергия системы изменяется при взаимодействии с окружающей средой, а двумя формами передачи энергии являются теплота и работа, то между ними должна быть взаимосвязь, которая называется математическим выражением первого закона термодинамики.
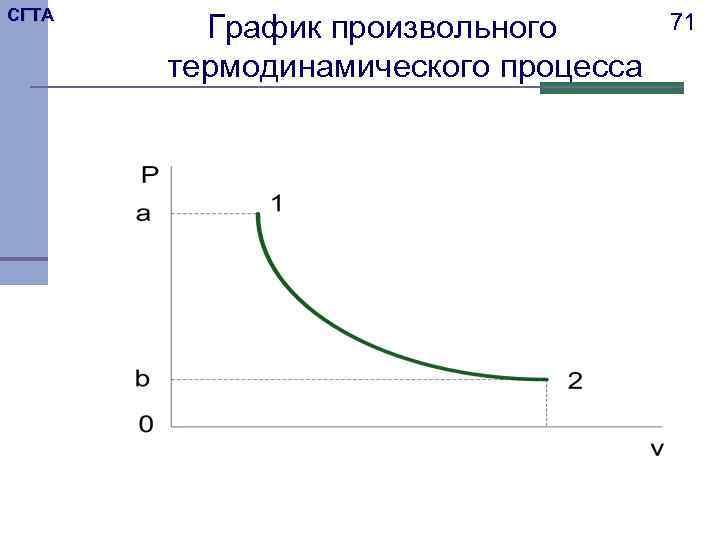
 СГТА График произвольного 71 термодинамического процесса
СГТА График произвольного 71 термодинамического процесса
 СГТА 72 Рассмотрим произвольный термодинамический процесс 1 -2, в котором при сообщении газу теплоты, происходит увеличение его внутренней энергии и совершается работа расширения против внешних сил. Отсюда вытекает: . Таким образом, теплота, сообщаемая газу , в каком – либо процессе расходуется на увеличение его внутренней энергии и на совершение работы.
СГТА 72 Рассмотрим произвольный термодинамический процесс 1 -2, в котором при сообщении газу теплоты, происходит увеличение его внутренней энергии и совершается работа расширения против внешних сил. Отсюда вытекает: . Таким образом, теплота, сообщаемая газу , в каком – либо процессе расходуется на увеличение его внутренней энергии и на совершение работы.
 СГТА Первый закон термодинамики для 73 идеальных газов в процессе расширения или сжатия Математически первый закон термодинамики выражается следующей формулой . Из всех видов работ будем рассматривать работу расширения и сжатия, где . Следовательно, математическое выражение закона для одного килограмма газа примет вид: .
СГТА Первый закон термодинамики для 73 идеальных газов в процессе расширения или сжатия Математически первый закон термодинамики выражается следующей формулой . Из всех видов работ будем рассматривать работу расширения и сжатия, где . Следовательно, математическое выражение закона для одного килограмма газа примет вид: .
 СГТА 74 Применив математическое выражение первого закона термодинамики, для случая изохорного процесса получаем: , Эта формула выведена для изохорного процесса, но применима к любому процессу изменения состояния идеального газа, т. к. для идеального газа изменение внутр. энергии зависит только от изменения температуры и не зависит от изменения давления.
СГТА 74 Применив математическое выражение первого закона термодинамики, для случая изохорного процесса получаем: , Эта формула выведена для изохорного процесса, но применима к любому процессу изменения состояния идеального газа, т. к. для идеального газа изменение внутр. энергии зависит только от изменения температуры и не зависит от изменения давления.
 СГТА 75 Таким образом, первое математическое выражение первого закона термодинамики примет вид:
СГТА 75 Таким образом, первое математическое выражение первого закона термодинамики примет вид:
 СГТА Второе математическое выражение 76 первого закона термодинамики. Энтальпия В термодинамике во многих случаях, особенно когда независимыми параметрами являются давление и температура, применяется не внутренняя энергия, а другая функция состояния называемая энтальпией . Физический смысл: энтальпия представляет собой сумму внутренней энергии системы и потенциальной энергии давления среды.
СГТА Второе математическое выражение 76 первого закона термодинамики. Энтальпия В термодинамике во многих случаях, особенно когда независимыми параметрами являются давление и температура, применяется не внутренняя энергия, а другая функция состояния называемая энтальпией . Физический смысл: энтальпия представляет собой сумму внутренней энергии системы и потенциальной энергии давления среды.
 СГТА 77 Поскольку внутренняя энергия, давление и объем, входящие в выражение для энтальпии, являются функциями состояния системы, то и энтальпия будет функцией состояния. Тогда ; .
СГТА 77 Поскольку внутренняя энергия, давление и объем, входящие в выражение для энтальпии, являются функциями состояния системы, то и энтальпия будет функцией состояния. Тогда ; .
 СГТА 78 Выразим первый закон термодинамики через энтальпию. Для этого запишем первое математическое выражение первого закона термодинамики: . Произведение P ∙ dv заменим из уравнения состояния. Получим: ; .
СГТА 78 Выразим первый закон термодинамики через энтальпию. Для этого запишем первое математическое выражение первого закона термодинамики: . Произведение P ∙ dv заменим из уравнения состояния. Получим: ; .
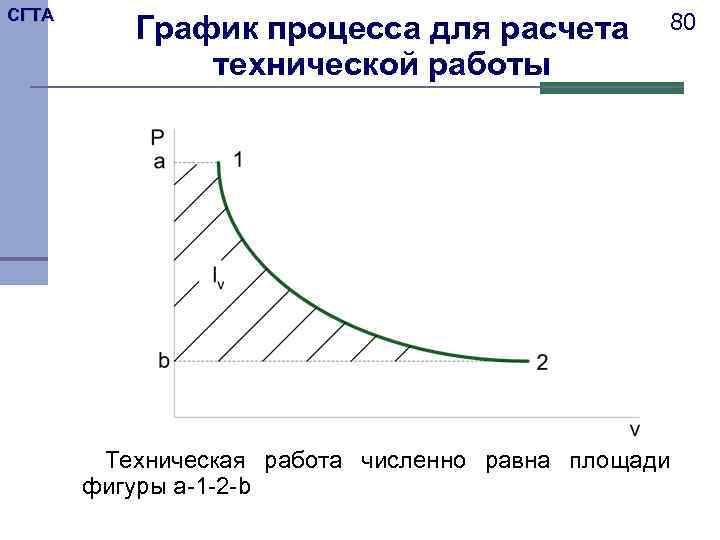
 СГТА 79 Проинтегрировав последнее выражение, получим: ; , где lv – техническая работа.
СГТА 79 Проинтегрировав последнее выражение, получим: ; , где lv – техническая работа.
 СГТА График процесса для расчета 80 технической работы Техническая работа численно равна площади фигуры а-1 -2 -b
СГТА График процесса для расчета 80 технической работы Техническая работа численно равна площади фигуры а-1 -2 -b
 СГТА 81 . В случае изобарного процесса из выражения для первого закона термодинамики получаем:
СГТА 81 . В случае изобарного процесса из выражения для первого закона термодинамики получаем:
 СГТА 82 Воспользовавшись законом Джоуля, который показывает зависимость энтальпии от давления, получаем второе математическое выражение первого закона термодинамики: . Примечание: в теплотехнике под энтальпией понимают количество теплоты необходимое для нагревания одного килограмма воды от 0 0 С до заданных условий.
СГТА 82 Воспользовавшись законом Джоуля, который показывает зависимость энтальпии от давления, получаем второе математическое выражение первого закона термодинамики: . Примечание: в теплотехнике под энтальпией понимают количество теплоты необходимое для нагревания одного килограмма воды от 0 0 С до заданных условий.
 СГТА Связь между изобарной и 83 изохорной теплоемкостью Первый закон термодинамики в случае работы расширения – сжатия имеет вид: . Для процессов протекающих при постоянном давлении установили, что , отсюда . Произведение P∙dv можем выразить из уравнения состояния: ; .
СГТА Связь между изобарной и 83 изохорной теплоемкостью Первый закон термодинамики в случае работы расширения – сжатия имеет вид: . Для процессов протекающих при постоянном давлении установили, что , отсюда . Произведение P∙dv можем выразить из уравнения состояния: ; .
 СГТА 84 Для изобарного процесса , поэтому . Получаем уравнение Майера: .
СГТА 84 Для изобарного процесса , поэтому . Получаем уравнение Майера: .
 СГТА 85 На практике важное значение имеет величина показателя адиабаты k, который равен: . Из молекулярно – кинетической теории газов вытекает: n для одноатомных газов k = 1. 67; n для двухатомных газов k = 1. 40; n для трех- и многоатомных газов k = 1. 29.
СГТА 85 На практике важное значение имеет величина показателя адиабаты k, который равен: . Из молекулярно – кинетической теории газов вытекает: n для одноатомных газов k = 1. 67; n для двухатомных газов k = 1. 40; n для трех- и многоатомных газов k = 1. 29.
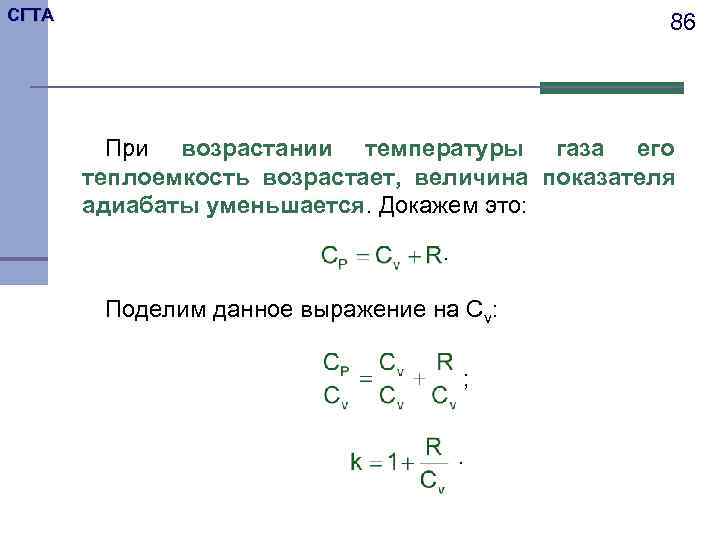
 СГТА 86 При возрастании температуры газа его теплоемкость возрастает, величина показателя адиабаты уменьшается. Докажем это: . Поделим данное выражение на Cv: ; .
СГТА 86 При возрастании температуры газа его теплоемкость возрастает, величина показателя адиабаты уменьшается. Докажем это: . Поделим данное выражение на Cv: ; .
 СГТА 87 Мы знаем, что . Отсюда получаем: , где α – постоянный коэффициент для каждого газа. Зная величину показателя адиабаты можно определить теплоемкости различных веществ: ; .
СГТА 87 Мы знаем, что . Отсюда получаем: , где α – постоянный коэффициент для каждого газа. Зная величину показателя адиабаты можно определить теплоемкости различных веществ: ; .
 СГТА Техническая термодинамика и теплотехника 3 ИССЛЕДОВАНИЕ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ
СГТА Техническая термодинамика и теплотехника 3 ИССЛЕДОВАНИЕ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ
 СГТА Метод исследования 89 термодинамических процессов Данный метод состоит из двух частей. В первой части устанавливаются закономерности изменения состояния идеального газа в том или ином процессе. Во второй части устанавливают особенности превращения газов в заданном процессе.
СГТА Метод исследования 89 термодинамических процессов Данный метод состоит из двух частей. В первой части устанавливаются закономерности изменения состояния идеального газа в том или ином процессе. Во второй части устанавливают особенности превращения газов в заданном процессе.
 СГТА 90 Рассмотрим порядок исследования термодинамических процессов , который не зависит от особенностей каждого процесса: выводят уравнение состояния общего вида; поясняют метод построения графика в P – v координатах; выводят формулы соотношения параметров; определяют изменение внутренней энергии; определяют количество совершенной работы; определяют количество сообщенной теплоты; выявляют особенности процесса и определяют коэффициент α.
СГТА 90 Рассмотрим порядок исследования термодинамических процессов , который не зависит от особенностей каждого процесса: выводят уравнение состояния общего вида; поясняют метод построения графика в P – v координатах; выводят формулы соотношения параметров; определяют изменение внутренней энергии; определяют количество совершенной работы; определяют количество сообщенной теплоты; выявляют особенности процесса и определяют коэффициент α.
 СГТА 91 На основании условий, при которых протекает процесс, выводят уравнение состояния общего вида: . Следует отметить, что уравнение состояния выражают в координатах давление – удельный объем, так как в данных координатах площадь под кривой процесса равна величине работы.
СГТА 91 На основании условий, при которых протекает процесс, выводят уравнение состояния общего вида: . Следует отметить, что уравнение состояния выражают в координатах давление – удельный объем, так как в данных координатах площадь под кривой процесса равна величине работы.
 СГТА 92 Для вывода уравнения процесса записывают первый закон термодинамики: ; . В данное уравнение подставляют значение dq , вычисленное для данного вида процесса, а значение d. T заменяют через давление P и объем v. Для простейшего случая - идеального газа эту замену делают из уравнения состояния идеального газа.
СГТА 92 Для вывода уравнения процесса записывают первый закон термодинамики: ; . В данное уравнение подставляют значение dq , вычисленное для данного вида процесса, а значение d. T заменяют через давление P и объем v. Для простейшего случая - идеального газа эту замену делают из уравнения состояния идеального газа.
 СГТА 93 Поясняют метод построения графика в P – v координатах; Выводят формулы соотношения параметров: ; ; . Эти формулы выводят из уравнений: и .
СГТА 93 Поясняют метод построения графика в P – v координатах; Выводят формулы соотношения параметров: ; ; . Эти формулы выводят из уравнений: и .
 СГТА 94 Определяют изменение внутренней энергии в данном процессе. Для всех термодинамических процессов: . Определяют количество совершенной работы: . В общем случае, с изменением удельного объема изменяется и давление , поэтому в последнюю формулу вместо Р необходимо подставить из формулы соотношения параметров.
СГТА 94 Определяют изменение внутренней энергии в данном процессе. Для всех термодинамических процессов: . Определяют количество совершенной работы: . В общем случае, с изменением удельного объема изменяется и давление , поэтому в последнюю формулу вместо Р необходимо подставить из формулы соотношения параметров.
 СГТА 95 Определяют количество сообщенной теплоты в процессе: ; , где CX – параметр постоянный в данном процессе. Выявляют особенности процесса и определяют коэффициент α , который показывает долю теплоты идущей на изменение внутренней энергии: .
СГТА 95 Определяют количество сообщенной теплоты в процессе: ; , где CX – параметр постоянный в данном процессе. Выявляют особенности процесса и определяют коэффициент α , который показывает долю теплоты идущей на изменение внутренней энергии: .
 СГТА Исследование основных 96 термодинамических процессов При протекании реальных процессов изменяются все термодинамические параметры. Однако на практике важны не произвольные термодинамические процессы, а процессы, протекающие в определенных условиях. Будем рассматривать только обратимые процессы. Реальные процессы могут несколько отличаться от указанных выше, но незначительно.
СГТА Исследование основных 96 термодинамических процессов При протекании реальных процессов изменяются все термодинамические параметры. Однако на практике важны не произвольные термодинамические процессы, а процессы, протекающие в определенных условиях. Будем рассматривать только обратимые процессы. Реальные процессы могут несколько отличаться от указанных выше, но незначительно.
 СГТА 97 К подобным процессам относятся: изохорный процесс изобарный процесс изотермический процесс адиабатный процесс dq = 0; политропный процесс
СГТА 97 К подобным процессам относятся: изохорный процесс изобарный процесс изотермический процесс адиабатный процесс dq = 0; политропный процесс
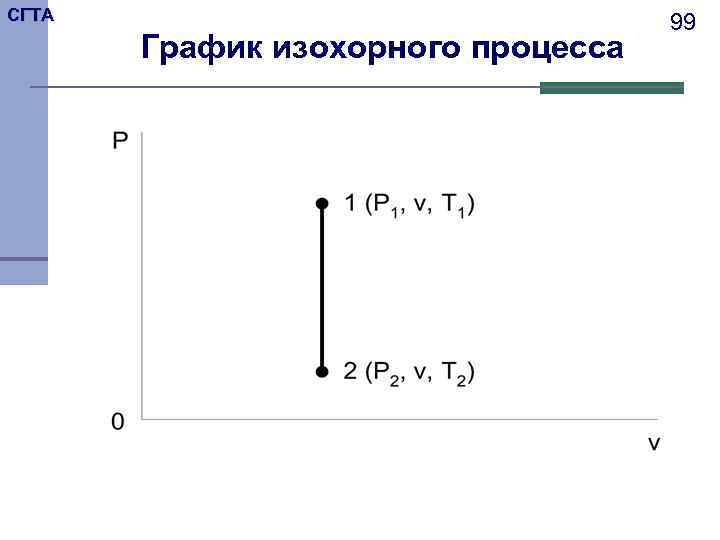
 СГТА 98 Изохорный процесс 1 Уравнение изохорного процесса v = const показывает условия протекания процесса. 2 Графиком такого процесса будет вертикальная прямая. 3 Выведем формулу соотношения параметров. Запишем уравнения состояния для двух крайних точек: ; . В изохорном процессе давление пропорционально абсолютным температурам.
СГТА 98 Изохорный процесс 1 Уравнение изохорного процесса v = const показывает условия протекания процесса. 2 Графиком такого процесса будет вертикальная прямая. 3 Выведем формулу соотношения параметров. Запишем уравнения состояния для двух крайних точек: ; . В изохорном процессе давление пропорционально абсолютным температурам.
 СГТА 99 График изохорного процесса
СГТА 99 График изохорного процесса
 СГТА 100 4 Изменение внутренней энергии определяется по общей формуле: . 5 Количество совершенной работы расширения-сжатия определяют по формуле ; 6 Кол-во, сообщенной теплоты .
СГТА 100 4 Изменение внутренней энергии определяется по общей формуле: . 5 Количество совершенной работы расширения-сжатия определяют по формуле ; 6 Кол-во, сообщенной теплоты .

