36827cff2e41d16c000c364b66addeaa.ppt
- Количество слайдов: 56

Северное окружное управление образования Государственное образовательное учреждение средняя общеобразовательная школа № 1125 Проектно- исследовательская работа Качество водопроводной воды в микрорайоне Бусиново и способы улучшения ее с целью содержания пресноводного аквариума с Роесiliа reticulata (гуппи). Выполнили: Учащиеся 9 класса: Базарнова Ольга Давлетгареев Ринат Дорошин Дмитрий Учитель: Москва 2009 Прохорова М. Н.

Цель работы 1. Определить химические характеристики водопроводной воды в микрорайоне Бусиново и оценить ее пригодность к использованию для аквариумного разведения рыб. 2. Разработать способы улучшения характеристик воды для с целью создания оптимальных условий содержания гуппи.

Социологический опрос • Нашей группой был проведен социологический опрос учащихся нашей школы. • Все респонденты постоянно проживают в нашем микрорайоне Перечень вопросов, заданных во время социологического опроса. 1. Имеется ли у Вас дома аквариум? 2. Содержатся ли в Вашем аквариуме гуппи? 3. Хотели бы Вы иметь аквариум, если у Вас его пока нет? 4. Нравится ли Вам наблюдать за жизнью обитателей аквариума?
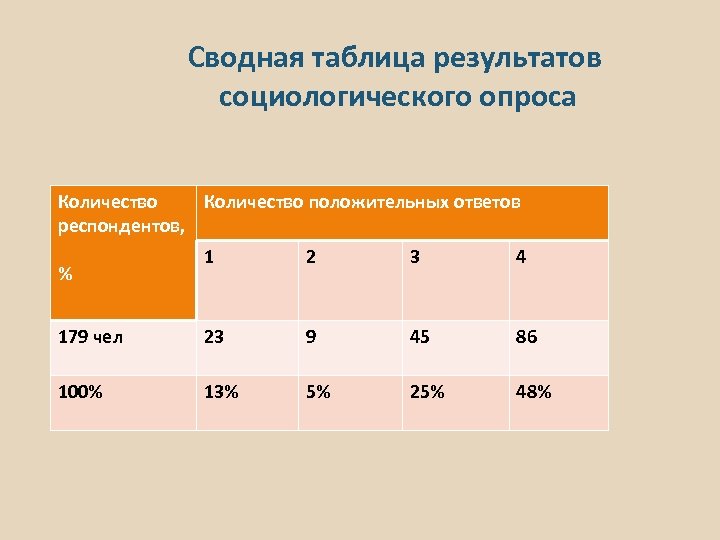
Сводная таблица результатов социологического опроса Количество положительных ответов респондентов, 1 2 3 4 179 чел 23 9 45 86 100% 13% 5% 25% 48% %

Анализ результатов социологического опроса 1. 13% респондентов содержат в домашних условиях аквариумных рыб. 2. 5 % респондентов содержат именно гуппи, что составляет 40% респондентов, имеющих аквариум. 3. 25 % респондентов, не имеющих аквариум, хотели бы его иметь. 4. 48 % респондентов испытывают положительные эмоции наблюдая за рыбами. Таким образом, данная работа может оказаться полезной для по крайней мере 5% жителей нашего микрорайона, тем более, если ее результатом будут конкретные рекомендации, учитывающие качество водопроводной воды в Бусиново и особенности биологии гуппи.

Биология рыб Строение рыбы Внешний вид рыб довольно разнообразен, и некоторые из них вообще не похожи на рыб. Все же все они — вариации простой "базовой модели", которую наилучшим образом представляет типичная костная рыба.
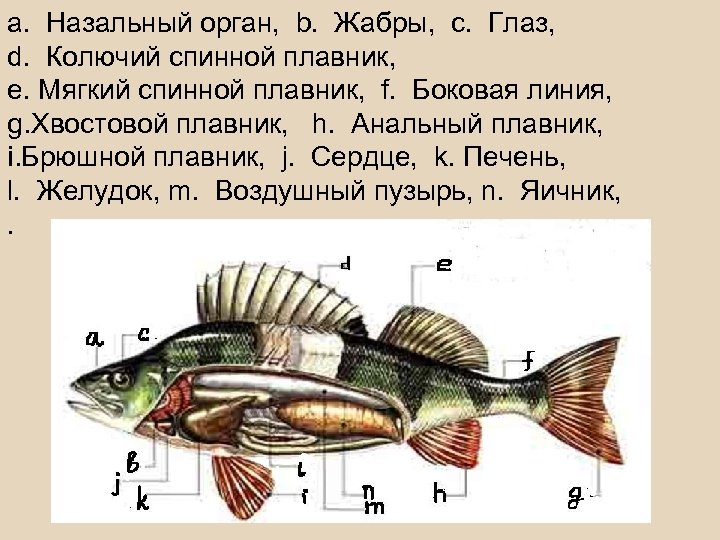
а. Назальный орган, b. Жабры, с. Глаз, d. Колючий спинной плавник, е. Мягкий спинной плавник, f. Боковая линия, g. Хвостовой плавник, h. Анальный плавник, i. Брюшной плавник, j. Сердце, k. Печень, l. Желудок, m. Воздушный пузырь, n. Яичник, .

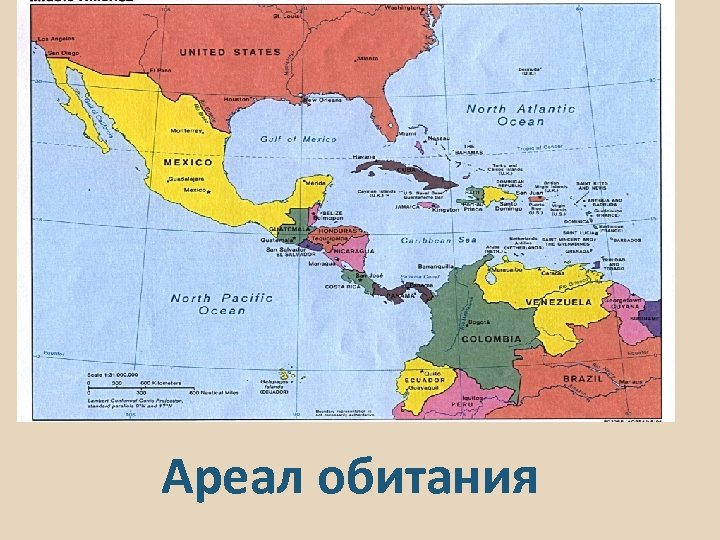
БИОЛОГИЯ ГУППИ Гуппи Роесiliа reticulata Отряд Карпозубые Семейство Пецилиевые Ареал обитания Венесуэла, Барбадос, Тринидад, Гайана и север Бразилии. Населяет как пресные, так и солоноватые водоемы p. H 7. 00 - 8. 00, d. GH 10. 00 - 15. 00 Температура 18. 00 - 28. 00 Способ размножения: Живородящие
Ареал обитания

Длина самцов от 3, 75 см, самки крупнее - до 6, 25 см. Но хотя самки крупнее самцов, зато самцы намного ярче и обладают не только красивым рисунком, но и роскошными хвостами и плавниками, в то время как плавники у особей женского пола короткие, окраска слабая. У самцов анальный плавник превратился в орган оплодотворения – гоноподиум.

Не следует содержать гуппи с рыбами, склонными повреждать их вуалевые плавники (крупные хищники, бойцовые рыбки, барбусы суматранусы и т. п. ). Хорошо сказывается на самочувствии рыб, особенно вуалевых самцов, добавление в воду поваренной или морской соли (1 -2 чайные ложки на 10 л). Если вода мягкая, то можно повысить ее жесткость с помощью хлористого кальция.

Характерные болезни гуппи • Часто при содержании гуппи аквариумисты сталкиваются с проблемой “ломки” и расщепления хвостов у самцов. Причин этому может быть множество и они неоднозначны, так как этот дефект возникает по многим причинам: инбридинг, ведущий к вырождению, плохое кормление, редкая подмена воды, слишком плотная посадка, слабая аэрация, способствующая росту тщедушных самцов с плохими хвостами. Еще одна типичная болезнь самцов гуппи - сжатие плавников. Причина этого – однообразное кормление в возрасте после 4 – 5 месяцев, нестабильные условия содержания, помещение самцов в свежую воду. Для лечения рыб в воду вносят морскую или поверенную соль из расчета 1 – 1, 5 г/л (предварительно ее не растворяют). Очень распространена среди гуппи "красная парша": на конце хвоста появляется ярко-красный налет, постепенно съедающий весь хвост. Самцов с такими признаками вылавливают и острой бритвой отсекают у них пораженные участки, а в воду вносят соль (2, 5 г/л). При лечении обязательно ставят дополнительную аэрацию.

Влияние качества воды на состояние Гуппи Недостаточная жесткость воды является одной из причин следующих заболеваний: -так называемое «сжатие хвостов» у самцов, часто возникает из- за помещения самцов в слишком мягкую воду. -расщепление хвостов у самцов вуалевых форм, возникает нередко изза нерегулярной подмены воды. Задачей данной работы является определение общей жесткости водопроводной воды в нашем микрорайоне, сравнение ее с необходимым показателем для Гуппи, выработка рекомендаций для доведения параметров воды до требуемых для содержания данного вида аквариумных раб.

Количественные методы анализа состава аквариумной воды

Титрование с использованием индикаторов Титриметрический анализ (титрование) — методы количественного анализа в аналитической и фармацевтической химии, основанные на измерении объема раствора реактива известной концентрации, расходуемого для реакции с определяемым веществом. Титриметрический — от слова титр. Титр раствора (от французского. titre — качество, характеристика) — количество растворенного вещества в граммах, содержащееся в 1 мл раствора. Например, Т (титр) = 0, 001 означает, что в 1 мл раствора содержится 0, 001 растворенного вещества.

Индикаторы Химические индикаторы -вещества, введение которых в анализируемый раствор позволяет установить конец химической реакции или концентрацию водородных ионов по легко заметному признаку.
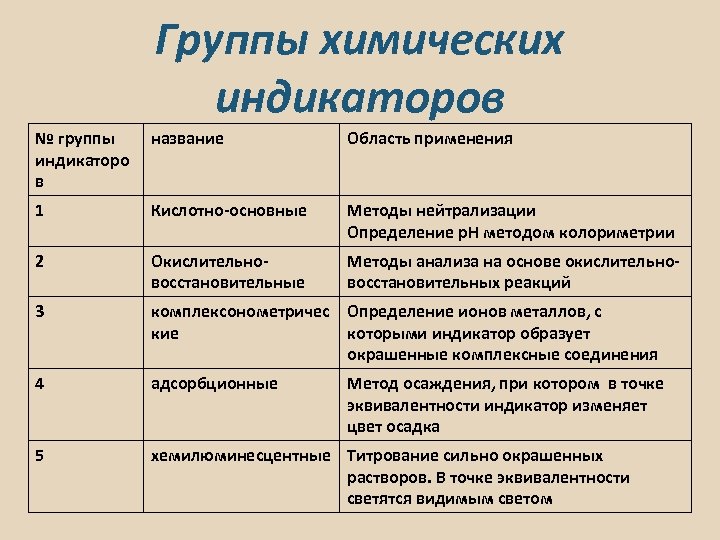
Группы химических индикаторов № группы индикаторо в название Область применения 1 Кислотно-основные Методы нейтрализации Определение р. Н методом колориметрии 2 Окислительновосстановительные Методы анализа на основе окислительно- восстановительных реакций 3 комплексонометричес Определение ионов металлов, с кие которыми индикатор образует окрашенные комплексные соединения 4 адсорбционные 5 хемилюминесцентные Титрование сильно окрашенных растворов. В точке эквивалентности светятся видимым светом Метод осаждения, при котором в точке эквивалентности индикатор изменяет цвет осадка

Химические методы анализа, использованные в работе В данной проектно-исследовательской работе нами было использован метод комплексонометрии. Комплексонометрия- для определения общей жесткости воды. В качестве титранта мы использовали трилон Б, а в качестве индикатора – эриохром черный. Кислотность воды определялась с помощью универсальной индикаторной бумаги.

ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ Вывод значения ионного произведения

Вода – слабый электролит H 2 O + H 2 O ↔ H 3 O+ + OH− или H 2 O ↔ H+ + OH− Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: где: [H+] — концентрация ионов гидроксония(протонов); [OH−] — концентрация гидроксид-ионов; [H 2 O] — концентрация воды (в молекулярной форме) в воде;

Расчет ионного произведения воды Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55, 56 моль/л. При 22 °C константа диссоциации воды равна 1, 8· 10− 16 моль/л. Уравнение (1) можно переписать как: Обозначим произведение K·[H 2 O] = Kв = 1, 8· 10− 16 моль/л· 55, 56 моль/л = 10− 14 моль²/л² = [H+]·[OH−] (при 22 °C). Константа Kв, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ.
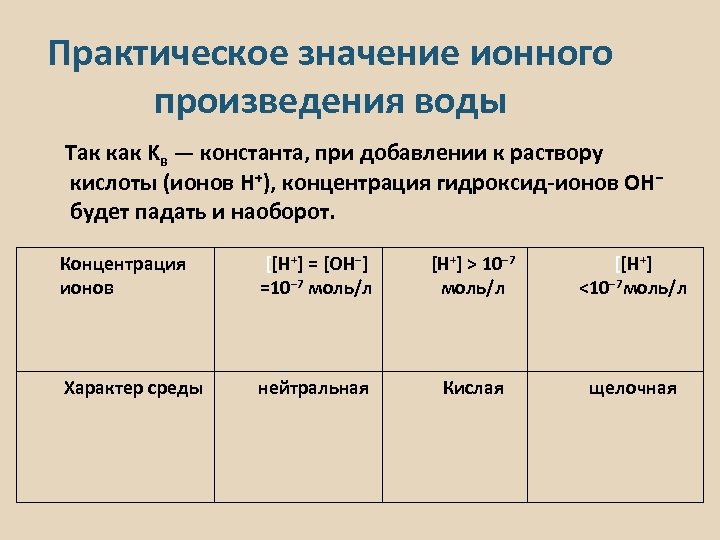
Практическое значение ионного произведения воды Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. Концентрация ионов [[H+] = [OH−] =10− 7 моль/л [H+] > 10− 7 моль/л [[H+] <10− 7 моль/л Характер среды нейтральная Кислая щелочная

Водородный показатель, p. H — это мера активности ионов водорода в растворе, количественно выражающая его кислотность. Вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр В случае разбавленных растворов p. H совпадает с концентрацией.

Кислотно-основные индикаторы используют в методах нейтрализации, а также при определении p. H методом колориметрии. Интервал значений p. H (интервал перехода), в котором наблюдается изменение окраски, связан с константой диссоциации индикатора (p. K) соотношением p. H = p. K ± 1. При проведении анализа индикатор выбирают таким образом, чтобы интервал перехода окраски включал то значение p. H, которое раствор должен иметь в точке эквивалентности. индикатор Интервал перехода окраски (р. Н) Метиловый оранжевый 3, 1 -4, 4 Метиловый красный 4, 2 -6, 3 фенолфталеин 8, 0 -9, 8

Природные кислотно-основные индикаторы Кислотно-основные индикаторы весьма разнообразны; многие из них легко доступны и потому известны не одно столетие. Это отвары или экстракты окрашенных цветов, ягод и плодов. Так, отвар ириса, анютиных глазок, тюльпанов, черники, ежевики, малины, черной смородины, красной капусты, свеклы и других растений становится красным в кислой среде и зелено-голубым – в щелочной. Это легко заметить, если помыть кастрюлю с остатками борща мыльной (т. е. щелочной) водой. С помощью кислого раствора (уксус) и щелочного (питьевая, а лучше – стиральная сода) можно также сделать надписи на лепестках различных цветов красного или синего цвета. Обычный чай – тоже индикатор. Если в стакан с крепким чаем капнуть лимонный сок или растворить несколько кристалликов лимонной кислоты, то чай сразу станет светлее. Если же растворить в чае питьевую соду, раствор потемнеет (пить такой чай, конечно, не следует). Чай же из цветков «каркаде» дает намного более яркие цвета.

Окислительновосстановительные индикаторы • Известны два типа индикаторов для окислительно- восстановительного титрования: специфические индикаторы - вещества, вступающие в химическую реакцию с одним из участников титрования, и истинные окислительно-восстановительные индикаторы, реагирующие на изменение потенциала системы, а не на появление или исчезновение отдельных веществ в процессе титрования. Специфические индикаторы Наиболее известным специфическим индикатором является крахмал, образующий с йодом комплекс темно-синего цвета. Образование этого комплекса указывает на достижение конечной точки титрования, когда йод либо выделяется в результате реакции, либо расходуется.

Адсорбционные индикаторы — вещества, в присутствии которых в точке эквивалентности, устанавливаемой методом осаждения (например, при титровании ионов хлора стандартным раствором нитрата серебра), изменяется цвет осадка. В качестве таких индикаторов применяют главным образом красители (например, эозин, флуоресцеин), а также хромат калия.

Комплексонометрические индикаторы Комплексонометрия- метод титриметрического анализа, основанный на образовании хорошо растворимых в воде и слабо диссоциированных комплексных соединений при реагировании большинства катионов с т. н. комплексонами аминополикарбоновыми кислотами.

Хемилюминесцентные индикаторы Применяются в методах, основанных на измерении интенсивности излучения в видимой области спектра, сопровождающего некоторые химические реакции. Метод, однако, не универсален. Известно всего несколько «хемилюминесцентных индикаторов» – веществ, при окислении которых перекисью водорода или кислородом выделяется световая энергия.

Понятие «жесткости воды» Параметры, характеризующие качество воды. Жесткость воды – параметр, определяемый наличием растворенных в ней минералов и во многом определяет остальные свойства воды. Жесткость воды обуславливают карбонаты — соли кальция и магния: Ca. CO 3 и Mg. CO 3 гидрокарбонаты Ca(HCO 3)2 и Mg(HCO 3)2, сульфаты Ca. SO 4 и Mg. SO 4, хлориды Ca. Cl 2 и Mg. Cl 2. В присутствии CO 2 протекают реакции: Ca. CO 3 + СO 2 + H 2 O = Ca(HCO 3) 2 Mg. СO 3 + СO 2 + H 2 O = Mg(HCO 3) 2 В результате образуются хорошо растворимые в воде гидрокарбонаты кальция и магния.

Постоянная и переменная жесткость Жесткость воды делится на две части: постоянную (GH, general hardness) - обусловлена присутствием в воде сульфатов, хлоридов и некоторых других солей кальция и магния, которые не удаляются при кипячении; переменную (карбонатную, KH, carbonate hardness) обусловлена присутствием в воде Ca(HCO 3) 2, Mg(HCO 3) 2. Сумма временной и постоянной жесткости дает общую жесткость воды. После кипячения воды соли, определяющие карбонатную жесткость - выпадают в осадок: Ca(HCO 3)2 ―t→ Ca. CO 3↓ + CO 2 + H 2 O Mg{HCO 3) 2―t→ Ca. CO 3↓ + CO 2+ H 2 O

Единицы измерения жесткости воды Измеряется постоянная жесткость в мг-экв/литр, в аквариумистике принято измерение жесткости в градусах (d. GH, d. KH) 1 d. GH = 2, 804 *мг-экв/литр Условная классификация типов воды по ее свойствам 0 -4 d. GH очень мягкая вода 4 -8 d. GH мягкая вода 8 -12 d. GH средняя жесткость 12 -18 d. GH умеренная жесткость 18 -30 d. GH жесткая вода

Способы изменения жесткости воды Жесткость воды увеличивается и за счет испарения воды. При этом растворенные соли остаются в аквариуме и их концентрация увеличивается). Жесткость воды несколько уменьшается вследствие выпадения в осадок карбонатов кальция и магния при подкисления воды, а также в результате поглощения ионов кальция и магния рыбами и некоторыми аквариумными растениями. Для увеличения карбонатной жесткости воды, в аквариум следует поместить известняк и создать в воде достаточную концентрацию CO 2 (например, установить продувку воды воздухом). Для увеличения не карбонатной жесткости обычно добавляют раствор хлорида кальция Ca. Cl 2 и сульфата магния Mg. SO 4. Уменьшить жесткость воды несколько сложнее. Здесь наиболее простой путь — добавление дистиллированной, смягченной (иногда — дождевой) воды.

Жесткость воды и ее роль в жизни человека Повышенная жесткость воды : -способствует усиленному образованию накипи в паровых котлах, отопит. приборах и бытовой технике. . -увеличивает расход мыла при стирке, поскольку часть его образует с катионами Са 2+ и Mg 2+ нерастворимый осадок. -качество тканей, стираемых в жесткой воде , и тканей, при отделке которых она применяется, ухудшается. - в воде с высокой жесткостью плохо развариваются овощи и мясо. Общая жесткость питьевой воды во избежание ухудшения ее органолептических. свойств должна быть не более 7 мг-экв/л

Экспериментальная часть

Этапы проведения исследований 1. Определение с помощью универсального индикатора р. Н: - водопроводной воды; - образцов воды из 3 школьных аквариумов. 2. Определение общей жесткости воды с помощью комплексонометрии для: - водопроводной воды; - образцов воды из 3 аквариумов в школе № 1125. 3 Дополнительное исследование: - определение общей жесткости пробы воды из рифового аквариума «Морского аквариумаокеанариума» ООО «Фрегат» на Чистых прудах. - определение р. Н воды из рифового аквариума.

Оборудование для выполнения экспериментальной части работы • • для выполнения экспериментальной части: мерный цилиндр на 50 мл, 25 мл, мерная пипетка на 5 мл, воронка, бюретка на 25 мл, мерные колбы на 1000, 500, 100, 50 мл. резиновая груша, стаканы химические.

Реактивы Трилон Б 25% водный раствор аммиака Хлорид аммония Вода дистиллированная Индикаторная бумага универсальная Индикатор эриохром черный Исследуемые образцы воды

Определение жесткости аквариумной и водопроводной воды методом комплексонометрии Реактивы: Эриохром черный Т, концентрированный раствор аммиака, 0. 025 М раствор трилона Б, Хлорид аммония. До титрования приготавливают буферный раствор с р. Н 10. Исследуемый раствор до титрования Исследуемый раствор после титрования

Приготовление реактивов для титрования трилоном Б в присутствии эриохрома черного Буферный раствор- раствор, поддерживающий постоянное значение р. Н среды 10, необходимое для «работы» индикатора. Приготовление буферного раствора: 10 г химически чистой NH 4 Cl растворили в дистиллированной воде, добавили 50 мл 25%-ного раствора NH 4 OH и довели объем дистиллированной водой до 0, 5 л. Проверили р. Н с помощью индикаторной бумаги универсальной: р. Н =10

Приготовление раствора трилона Б и определение его титра. Этапы выполнения работы: -определили массу трилона Б, необходимую для приготовления 500 мл 0, 025 М раствора: Молярная масса Трилона Б – 372 гмоль -определили количество молей трилона Б, необходимого для получения 500 мл 0, 025 М раствора – γ =0, 0125 моль.

Расчет реальной концентрации трилона Б -рассчитали массу трилона Б, необходимого для получения раствора: m=γ*M=4. 65 г. - Взвесили навеску трилона Б: - m = 4, 86 г - Рассчитали точное значение молярной концентрации трилона Б: С=m /M*2, (моль/л)= 4, 86/372*2=0, 026 моль/л С = 0, 026 моль/л

Расчетная формула для определения общей жесткости воды Формула для расчета общей жесткости (Са 2+/Мg 2+)(мг-экв/л)= (2000×Vтрилона (мл)× Cтрилона): Vводы (мл) Для того, чтобы пересчитать жесткость на немецкие градусы (d. GH), надо умножить результат на 2. 804.

Процесс титрования Исследуемый раствор до и после титрования
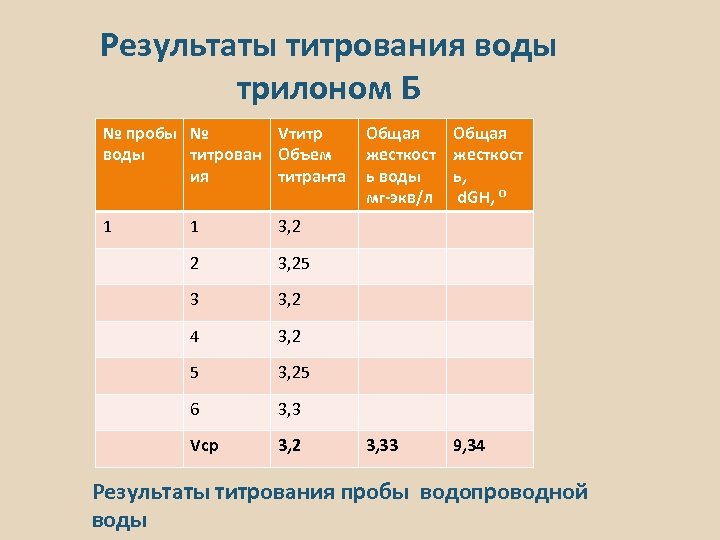
Результаты титрования воды трилоном Б № пробы № Vтитр воды титрован Объем ия титранта 1 1 3, 2 5 3, 25 6 3, 3 Vср 3, 2 9, 34 3, 2 4 3, 33 3, 25 3 Общая жесткост ь, d. GH, ⁰ 3, 2 2 Общая жесткост ь воды мг-экв/л Результаты титрования пробы водопроводной воды
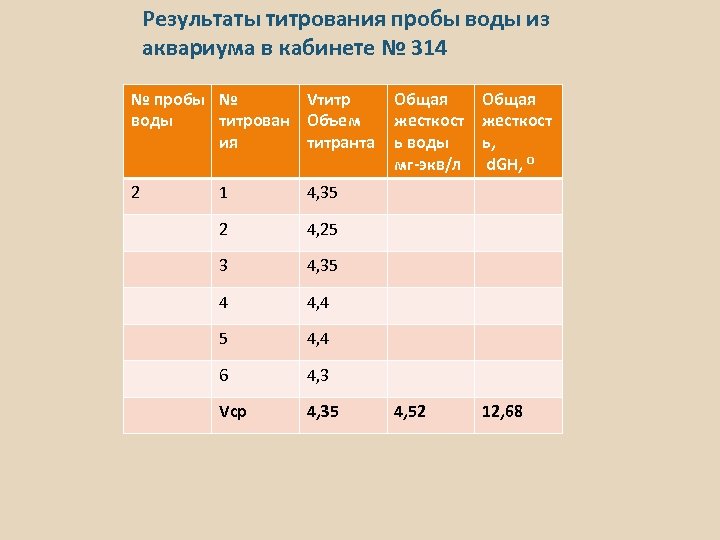
Результаты титрования пробы воды из аквариума в кабинете № 314 № пробы № Vтитр воды титрован Объем ия титранта 2 1 4, 4 5 4, 4 6 4, 3 Vср 4, 35 12, 68 4, 35 4 4, 52 4, 25 3 Общая жесткост ь, d. GH, ⁰ 4, 35 2 Общая жесткост ь воды мг-экв/л
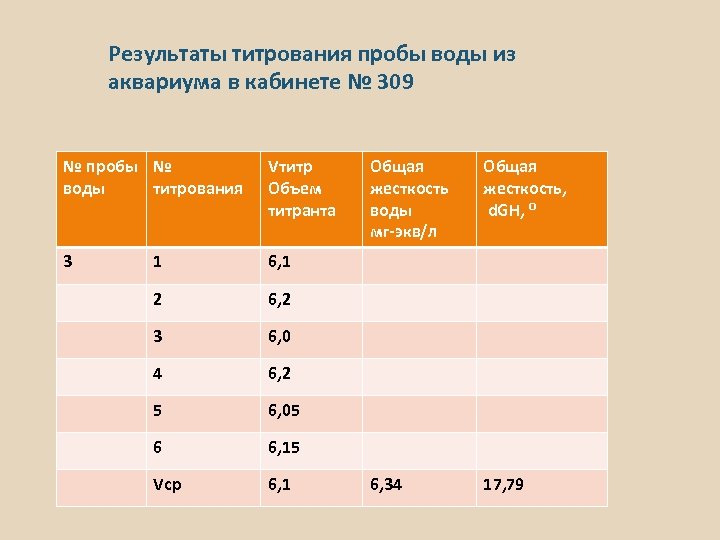
Результаты титрования пробы воды из аквариума в кабинете № 309 № пробы № воды титрования Vтитр Объем титранта 3 1 6, 1 2 6, 2 3 6, 0 4 6, 2 5 6, 05 6 6, 15 Vср 6, 1 Общая жесткость воды мг-экв/л Общая жесткость, d. GH, ⁰ 6, 34 17, 79
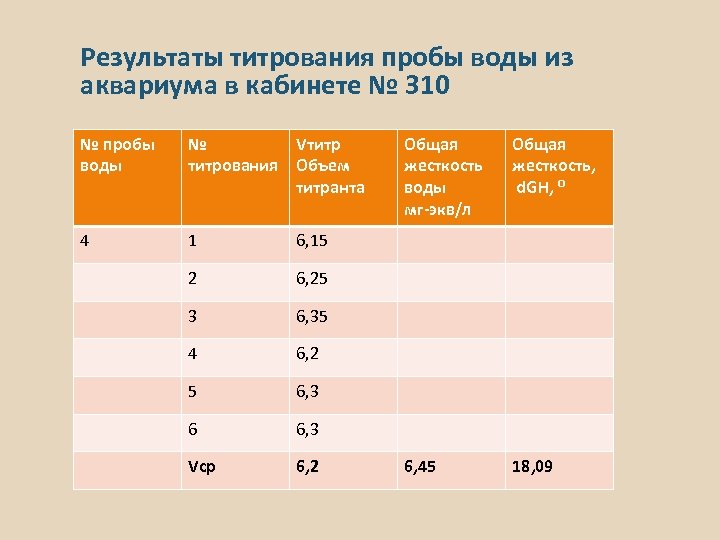
Результаты титрования пробы воды из аквариума в кабинете № 310 № пробы воды № титрования Vтитр Объем титранта 4 1 6, 15 2 6, 25 3 6, 35 4 6, 2 5 6, 3 6 6, 3 Vср 6, 2 Общая жесткость воды мг-экв/л Общая жесткость, d. GH, ⁰ 6, 45 18, 09
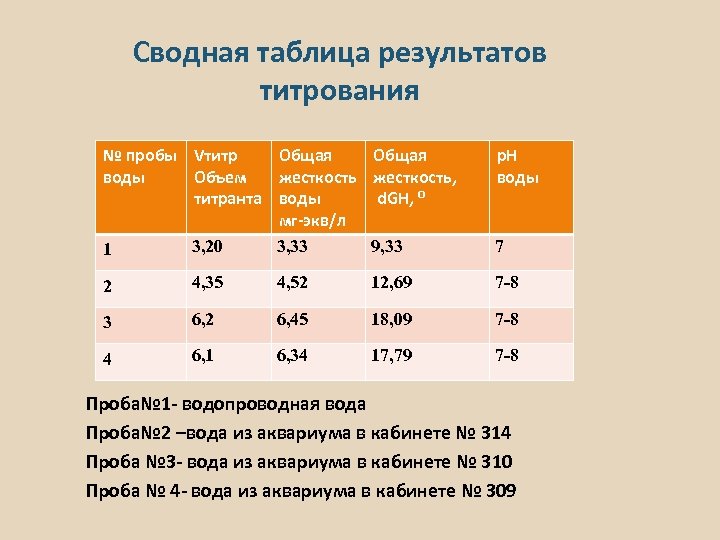
Сводная таблица результатов титрования № пробы Vтитр Общая воды Объем жесткость титранта воды мг-экв/л 3, 20 3, 33 1 Общая жесткость, d. GH, ⁰ p. H воды 9, 33 7 2 4, 35 4, 52 12, 69 7 -8 3 6, 2 6, 45 18, 09 7 -8 4 6, 1 6, 34 17, 79 7 -8 Проба№ 1 - водопроводная вода Проба№ 2 –вода из аквариума в кабинете № 314 Проба № 3 - вода из аквариума в кабинете № 310 Проба № 4 - вода из аквариума в кабинете № 309
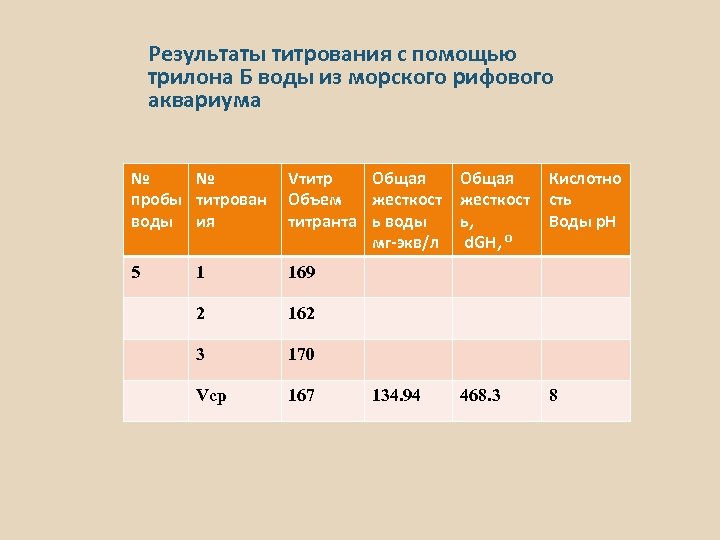
Результаты титрования с помощью трилона Б воды из морского рифового аквариума № № пробы титрован воды ия Vтитр Общая Объем жесткост титранта ь воды мг-экв/л 5 1 169 2 162 3 170 Vср 167 134. 94 Общая жесткост ь, d. GH, ⁰ Кислотно сть Воды р. Н 468. 3 8

Сравнительная характеристика Параметров качества воды Пресноводный аквариум Кислотность воды р. Н=7. 5 Общая жесткость воды 17 -18 d. GH Морской аквариум Кислотность воды р. Н=8, 5 Общая жесткость воды 468. 3 d. GH
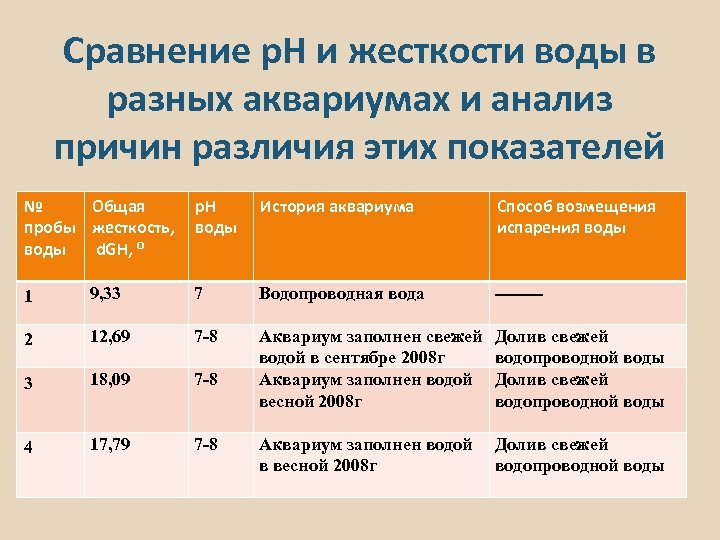
Сравнение р. Н и жесткости воды в разных аквариумах и анализ причин различия этих показателей № Общая p. H пробы жесткость, воды d. GH, ⁰ История аквариума Способ возмещения испарения воды 1 9, 33 7 Водопроводная вода ---- 2 12, 69 7 -8 3 18, 09 7 -8 Аквариум заполнен свежей водой в сентябре 2008 г Аквариум заполнен водой весной 2008 г Долив свежей водопроводной воды 4 17, 79 7 -8 Аквариум заполнен водой в весной 2008 г Долив свежей водопроводной воды

Выводы из результатов титрования 1. 2. 3. 4. 5. Исходная жесткость водопроводной воды в микрорайоне Бусиново имеет значение ниже требуемой для комфортных условий содержания гуппи. При возмещении испарившейся воды водопроводной, жесткость воды увеличивается примерно на 0, 8 -1, 0 d. GH в месяц. В результате уже через 6 месяцев такого режима содержания жесткость воды начинает превышать допустимое предельное значение 15 d. GH. При первичном заселении аквариума желательно повысить жесткость воды до 11 -13 d. GH (средние допустимые значения). Жесткость воды из аквариумов № 3, 4 необходимо понизить до допустимых значений.

Рекомендации по первоначальному заполнению аквариума водой 1. Увеличение значения жесткости водопроводной воды растворением в воде хлорида кальция. Расчет: d. GH=10 -15, среднее значение 13 Жесткость в мг-экв/л=13/2, 804=4, 64 Количество молей Са 2+, Мg 2+ в 1 литре воды γ= 4, 64/2/1000=0, 0023 моль/л Количество молей Са 2+, Мg 2+ в 1 литре водопроводной воды: γ= 3, 33/2/1000=0, 0023 моль/л=0, 0017 моль/л Δγ=0, 0023 -0, 0017= 0, 0006 моль Добавляемый реактив- хлорид кальция В расчете на 10 литров воды: m. Ca. Cl 2=0, 0006*МCa. Cl 2*10= 111*10*0, 0006=0, 67 г Итак, На каждые 10 л воды нужно добавить 0, 67 г хлорида кальция 2. Для понижения жесткости воды желательно при доливе использовать дистиллированную воду
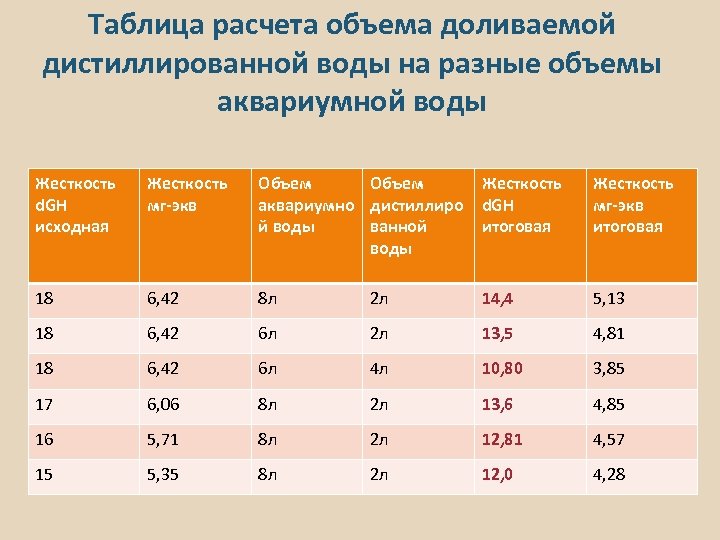
Таблица расчета объема доливаемой дистиллированной воды на разные объемы аквариумной воды Жесткость d. GH исходная Жесткость мг-экв Объем аквариумно дистиллиро й воды ванной воды Жесткость d. GH итоговая Жесткость мг-экв итоговая 18 6, 42 8 л 2 л 14, 4 5, 13 18 6, 42 6 л 2 л 13, 5 4, 81 18 6, 42 6 л 4 л 10, 80 3, 85 17 6, 06 8 л 2 л 13, 6 4, 85 16 5, 71 8 л 2 л 12, 81 4, 57 15 5, 35 8 л 2 л 12, 0 4, 28

Заключение. Мы исследовали Качество водопроводной воды из нескольких аквариумов, в которых содержатся гуппи. Мы выяснили, что: Водопроводная вода не имеет достаточной общей жесткости для содержания гуппи, и хотя нехватка жесткости незначительна, желательно ее предварительно повысить при помощи добавления хлорида кальция согласно выработанным нами рекомендациям. Доливая в аквариум взамен испарившейся водопроводную воду, аквариумист повышает ее жесткость. Если на начальном этапе содержания это даже полезно, то со временем уровень жесткости принимает слишком большие значения, что тоже может плохо повлиять на здоровье гуппи, их внешний вид, особенно самцов. Для долива желательно использовать дистиллированную воду, что поможет избежать накопления в воде ионов кальция и магния. Мы считаем, что следование нашим рекомендациям поможет аквариумистам, проживающим в нашем микрорайоне, содержать этот интересный и такой многообразный вид аквариумных рыб.
36827cff2e41d16c000c364b66addeaa.ppt