0a5e02be729719cd92e45759ef31dbd2.ppt
- Количество слайдов: 16

Sertifikasi, Registrasi & Evaluasi Obat

Syarat Pendirian Industri Farmasi n n n Dasar Hukum : SK Menkes No. 245/Men. Kes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin Usaha Industri Farmasi WAJIB memiliki Izin Usaha Industri Farmasi dikeluarkan oleh Menteri Kesehatan 360

Tata cara Pendirian Industri Farmasi Mengajukan permohonan melalui Kepala Din. Kes. MENKES Izin Prinsip Calon Industri Farmasi Syarat : • Badan Hukum • Rencana Investasi • Izin Lokasi (dari Pemda) • Kesediaan 2 orang Apoteker sebagai penanggung jawab produksi dan QC • RIP • Dokumen AMDAL 361
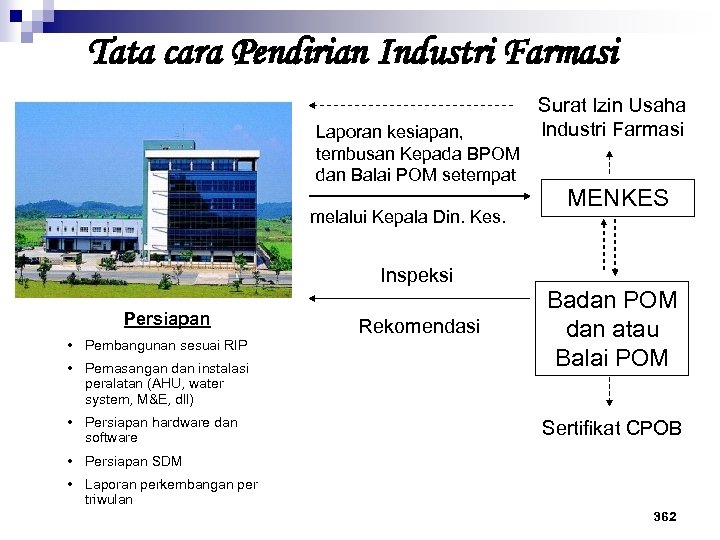
Tata cara Pendirian Industri Farmasi Laporan kesiapan, tembusan Kepada BPOM dan Balai POM setempat melalui Kepala Din. Kes. Surat Izin Usaha Industri Farmasi MENKES Inspeksi Persiapan • Pembangunan sesuai RIP • Pemasangan dan instalasi peralatan (AHU, water system, M&E, dll) • Persiapan hardware dan software Rekomendasi Badan POM dan atau Balai POM Sertifikat CPOB • Persiapan SDM • Laporan perkembangan per triwulan 362

Kewajiban Industri Farmasi n n n Melaksanakan produksi obat jadi dengan jenis produksi sesuai dengan Sertifikat CPOB yang ditetapkan Memproduksi obat jadi yang telah memperoleh persetujuan pendaftaran sesuai dengan ketentuan yang ditetapkan oleh Kepala Badan POM Menyalurkan dan memasarkan produknya sesuai dengan ketentuan perundang-undangan yang berlaku Menyampaikan laporan secara berkala setiap 6 bulan sekali kepada Badan POM dengan tembusan Kepala Kantor Wilayah Depkes setempat, meliputi jumlah dan nilai produksi Melaksanakan upaya keseimbangan dan kelestarian sumber daya alam serta pencegahan timbulnya kerusakan dan pencemaran terhadap lingkunan hidup Melaksanakan upaya yang menyangkut keamanan dan keselamatan alat, bahan baku, bahan penolong, proses serta hasil produksinya termasuk pengangkutannya dan keselamatan kerja 363

Pencabutan Izin Usaha Industri Farmasi n n Memindah-tangankan hak milik izin usaha dan melakukan perluasan tanpa izin Tidak menyampaikan laporan 3 kali berturut-turut atau dengan sengaja menyampaikan laporan palsu Memindahkan lokasi industri tanpa persetujuan tertulis Menteri Kesehatan Sengaja memproduksi Obat/bahan baku obat jadi yang tidak memenuhi persyaratan/obat palsu 364

Registrasi & Pendaftaran obat Jadi Registrasi Prosedur pendaftaran dan evaluasi obat untuk mendapat izin edar Tujuan : Memberikan perlindungan yang optimal kepada masyarakat dari peredaran obat yang tidak memenuhi persyaratan efikasi, keamanan, mutu dan kemanfaatannya Syarat obat yg dapat memiliki izin edar : o Efikasi (khasiat) yg meyakinkan dan keamanan yg memadai (dibuktikan melalui uji preklinik dan uji klinik atau bukti-bukti lain yg sesuai dgn status perkembangan ilmu pengetahuan yg bersangkutan) o Proses produksi memenuhi syarat CPOB, spesifikasi & metode analisa thd semua bahan yg digunakan serta produk jadi dgn bukti yang sahih o Penandaan berisi informasi yg lengkap & obyektif yg dapat menjamin penggunaan obat secara tepat, rasional dan aman o Syarat tambahan: Sesuai dgn kebutuhan nyata masyarakat dan terjangkau Proses Registrasi Obat o Registrasi Obat diajukan oleh pendaftar (industri farmasi/PBF) kepada Kepala Badan POM o Dibagi menjadi 2 kategori: Registrasi obat baru & Registrasi Variasi o Dilakukan dalam 2 tahap : Pra-registrasi dan Penyerahan berkas registrasi 365

Tata Cara Registrasi Obat Jadi I. Tahap Pra-Registrasi Tujuan : - Untuk mempertimbangkan jalur dan biaya evaluasi serta kelengkapan dokumen yang diperlukan pada tahap registrasi obat - Khusus untuk proses registrasi obat kategori 1, 2, 3, 4, 5, 6, dan 7 - Pengajuan Nama (merek) obat (generik maupun nama dagang) Pembagian Kategori : Registrasi Baru, terdiri dari : a. Kategori 1 : Obat baru dgn zat aktif baru atau derivat baru atau kombinasi baru atau produk biologi dgn zat aktif baru atau kombinasi baru atau dlm bentuk sediaan baru b. Kategori 2 : Obat baru dgn komposisi lama dalam bentuk sediaan baru atau kekuatan baru atau produk biologi sejenis c. Kategori 3 : Obat atau produk biologi dengan komposisi lama dgn indikasi baru atau posologi baru d. Kategori 4 : Obat copy dengan nama dagang atau nama generik e. Kategori 5 : Sediaan lain yang mengandung obat 366

Registrasi Variasi, terdiri dari : a. Kategori 6 : Obat copy yg sudah mendapat izin edar dgn perubahan yg sudah pernah disetujui di Indonesia - Perubahan atau penambahan bentuk sediaan dgn posologi atau cara pemberian yang berbeda - Perubahan atau penambahan bentuk sediaan - Perubahan atau penambahan kekuatan sediaan - Perubahan komposisi - Perubahan obat copy nama generik menjadi nama dagang atau sebaliknya b. Kategori 7 : Obat sudah mendapat izin edar dgn perubahan klim penandaan yg mempengaruhi keamanan c. Kategori 8 : Obat yg sudah mendapat izin edar dgn perubahan : - zat tambahan - Spesifikasi dan/atau metode analisa - Stabilitas - teknologi produksi dan/atau tempat produksi d. Kategori 9 : Obat yg sudah mendapat izin edar dgn perubahan atau penambahan jenis kemasan e. Kategori 10 : Obat yg sudah mendapat izin edar dgn perubahan : - Klim penandaan yg tidak mempengaruhi efikasi, keamanan dan mutu - Design kemasan - Nama pabrik atau nama pemberi lisensi - Importir - Besar kemasan - Nama dagang tanpa perubahan formula dan jenis kemasan 367
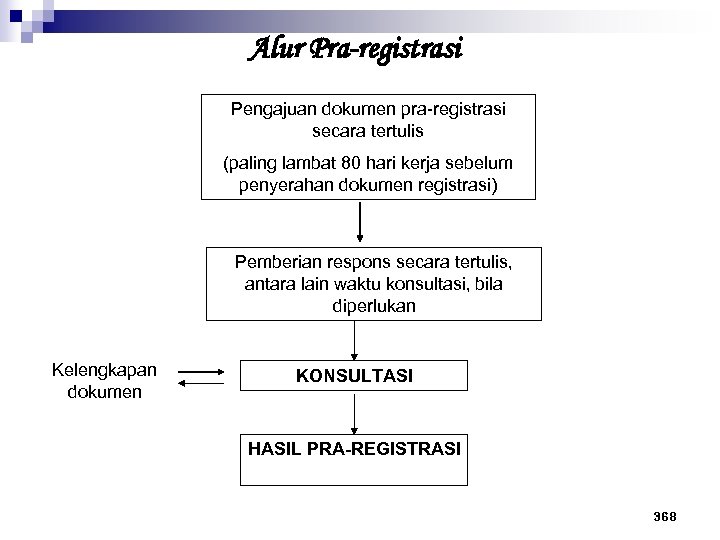
Alur Pra-registrasi Pengajuan dokumen pra-registrasi secara tertulis (paling lambat 80 hari kerja sebelum penyerahan dokumen registrasi) Pemberian respons secara tertulis, antara lain waktu konsultasi, bila diperlukan Kelengkapan dokumen KONSULTASI HASIL PRA-REGISTRASI 368

Tahap Registrasi I. Umum n Pengajuan permohonan registrasi dilakukan dgn menyerahkan berkas registrasi (formulir & disket, disertai dgn bukti pembayaran biaya evaluasi dan pendaftaran) n Disertai dgn hasil Pra-registrasi n Menyerahkan contoh obat jadi untuk 3 (tiga) kali pengujian dan bahan baku pembanding sesuai spesifikasi & metode pengujian zat aktif dan obat jadi II. Berkas Registrasi, terdiri dari : n Dokumen administratif n Dokumen penunjang ¨ Dokumen mutu & teknologi untuk menjamin mutu obat jadi ¨ Dokumen uji pre klinik (profil farmakodinamik, farmakokinetik, maupun toksisitas) ¨ Dokumen uji klinik n Formulir registrasi ¨ Formulir A : Nama & Alamat Industri farmasi ¨ Formulir B : Efikasi, keamanan & mutu obat (termasuk informasi harga) ¨ Formulir C : Dokumen mutu & teknologi (C 1), Dokumen uji pre klinis (C 2) dan dokumen uji klinik (C 3) ¨ Formulir D : Contoh obat jadi & baku pembanding 369
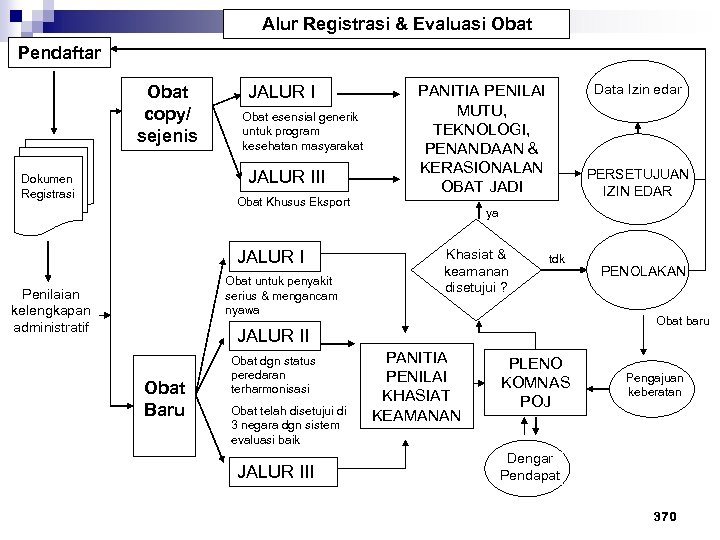
Alur Registrasi & Evaluasi Obat Pendaftar Obat copy/ sejenis JALUR I Obat esensial generik untuk program kesehatan masyarakat JALUR III Dokumen Registrasi Obat Khusus Eksport JALUR I Obat untuk penyakit serius & mengancam nyawa Penilaian kelengkapan administratif Data Izin edar PANITIA PENILAI MUTU, TEKNOLOGI, PENANDAAN & KERASIONALAN OBAT JADI PERSETUJUAN IZIN EDAR ya Khasiat & keamanan disetujui ? tdk Obat baru JALUR II Obat Baru Obat dgn status peredaran terharmonisasi Obat telah disetujui di 3 negara dgn sistem evaluasi baik JALUR III PENOLAKAN PANITIA PENILAI KHASIAT KEAMANAN PLENO KOMNAS POJ Pengajuan keberatan Dengar Pendapat 370

Prosedur Registrasi Obat Tradisional, Food Supplement & Kosmetik Industri Farmasi, Industri Makanan/Minuman, OT Berkas Registrasi • mengisi formulir & disket registrasi • bukti pembayaran • Contoh product • Rancangan penandaan Direktorat Penilaian Tradisional, suplemen makanan dan kosmetik Badan POM Evaluasi Data Teknis • Formulasi (komposisi & cara pemakaian) • Mutu & teknologi (cara pembuatan; spesifikasi bhn penyusun, wadah & tutup; penilaian mutu produk jadi; metode & hasil pengujian stabilitas) • Penandaan (etiket&brosur) No. Registrasi 371

Nomor Registrasi Obat Jadi Terdiri dari 15 digit ( 3 huruf dan 12 angka) A B C 1 2 3 4 5 6 7 8 9 10 11 12 Contoh : D B L 0 1 1 0 8 0 3 7 1 6 A 1 Digit 1 (A) : Kode huruf menunjukan nama Dagang (D) atau Generik (G) Digit 2 (B) : Kode huruf golongan obat K : Golongan obat keras T : Golongan obat bebas terbatas B : Golongan obat bebas N : Golongan obat narkotika P : Golongan obat psikotropika Digit 3 (C) : Kode huruf menunjukkan asal obat; I (obat jadi impor), L (lokal) Digit 4 – 5 (1, 2) : Menunjukan Tahun daftar; 01 = 2001 Digit 6 – 8 (3, 4, 5) : Menunjukan nomor urut pabrik; 108 = PT. Berlico M. F. Digit 9 – 11 (6, 7, 8) : Menunjukan nomor urut obat jadi yg disetujui; 037 = obat ke 37 yg disetujui dari pabrik tersebut Digit 12 – 13 (9, 10): Menunjukan macam bentuk sediaan yg ada 16 = sediaan tablet salut non antibiotik Digit 14 (11) : Kekuatan sediaan obat; A = pertama Digit 15 (12) : Kemasan; 1 = kemasan utama, 2 = beda kemasan yg pertama, dst 372

Nomor Registrasi Obat Tradisional Terdiri dari 12 digit ( 3 huruf dan 9 angka) A B 1 2 3 4 5 6 7 8 9 Contoh : T R 0 0 1 7 0 0 0 3 2 Arti kode huruf: TR : Obat tradisional lokal TI : Obat tradisional impor TL : Obat tradisional lisensi Kode angka : Ke-1, 2 : tahun didaftarkan; 00 = tahun 2000 Ke-3 : status produsen; 1 = pabrik farmasi, 2 = pabrik jamu, 3 = perush. jamu Ke-4 : menunjukan sediaan; 1 = rajangan, 2 = serbuk, 3 = kapsul, 4 = pil, granul, boli, pastiles, tablet/kaplet, 5 = dodol, majun, 6 = cairan, 7 = salep/krim, 8 = plester/koyok, 9 = bentuk lain : dupa, ratus, mangir Ke-5, 6, 7, 8 : menunjukan nomor urut jenis produk yg terdaftar Ke-9 : menunjukan jenis atau macam yang ke berapa; 1 = 15 ml, 2 = 30 ml, dst 373

Pelaksanaan Izin Edar n n Izin Edar berlaku : 5 (lima) tahun Obat jadi yang telah mendapat No. Registrasi WAJIB memproduksi atau mengimport dan mengedarkan obat selambat-lambatnya 12 (dua belas) bulan setelah izin dikeluarkan Evaluasi Kembali n Obat dgn resiko efek samping lebih besar vs efektifitasnya n Obat dgn efektifitas tidak lebih baik dari plasebo n Obat tidak memenuhi persyaratan bio avaibility/bio equivalency Pembatalan Izin Edar n Berdasarkan pemantauan atau pemantauan tdk memenuhi persyaratan n Penandaan atau promosi menyimpang dari persetujuan izin edar n Izin industri farmasi/PBF yg mendaftarkan, memproduksi atau mengedarkan dicabut n Pemilik izin edar melakukan pelanggaran di bidang produksi dan/atau peredaran obat 374
0a5e02be729719cd92e45759ef31dbd2.ppt