 Серная кислота как электролит. Сульфаты и гидросульфаты.
Серная кислота как электролит. Сульфаты и гидросульфаты.
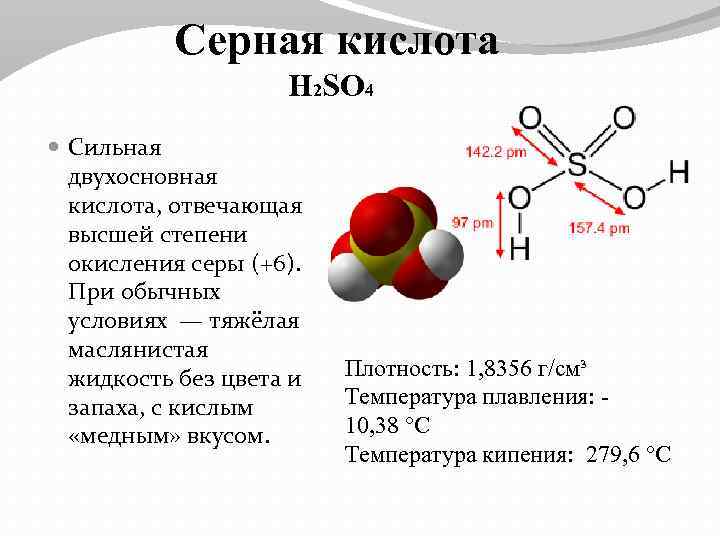 Серная кислота H 2 SO 4 Сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. Плотность: 1, 8356 г/см³ Температура плавления: 10, 38 °C Температура кипения: 279, 6 °C
Серная кислота H 2 SO 4 Сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. Плотность: 1, 8356 г/см³ Температура плавления: 10, 38 °C Температура кипения: 279, 6 °C
 Химические свойства Серная кислота реагирует с металлами, образуя сульфаты и водород H 2 SO 4 + Zh = Zh. SO 4 + H 2 Серная кислота реагирует с основными оксидами, образуя сульфат и воду: Серная кислота реагирует с солями: H 2 SO 4 + Na 2 CO 3 = Na 2 SO 4 + CO 2 + H 2 O
Химические свойства Серная кислота реагирует с металлами, образуя сульфаты и водород H 2 SO 4 + Zh = Zh. SO 4 + H 2 Серная кислота реагирует с основными оксидами, образуя сульфат и воду: Серная кислота реагирует с солями: H 2 SO 4 + Na 2 CO 3 = Na 2 SO 4 + CO 2 + H 2 O
 Электролит — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.
Электролит — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.
 Электролиты Сильные (HCl, HBr, HI, HNO 3) Слабые (HF, H 2 CO 3, H 2 SO 3, H 2 O)
Электролиты Сильные (HCl, HBr, HI, HNO 3) Слабые (HF, H 2 CO 3, H 2 SO 3, H 2 O)
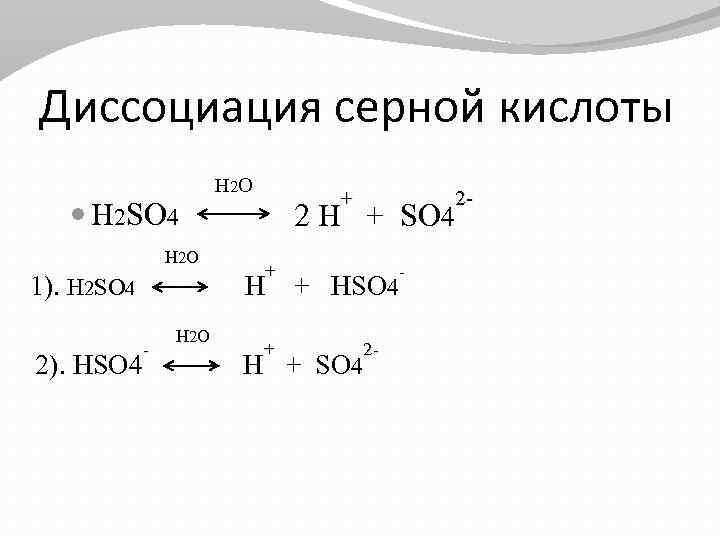 Диссоциация серной кислоты H 2 SO 4 H 2 O 1). H 2 SO 4 - 2). HSO 4 H 2 O + 2 + SO 4 2 H + + HSO 4 H + 2 + SO 4 H
Диссоциация серной кислоты H 2 SO 4 H 2 O 1). H 2 SO 4 - 2). HSO 4 H 2 O + 2 + SO 4 2 H + + HSO 4 H + 2 + SO 4 H
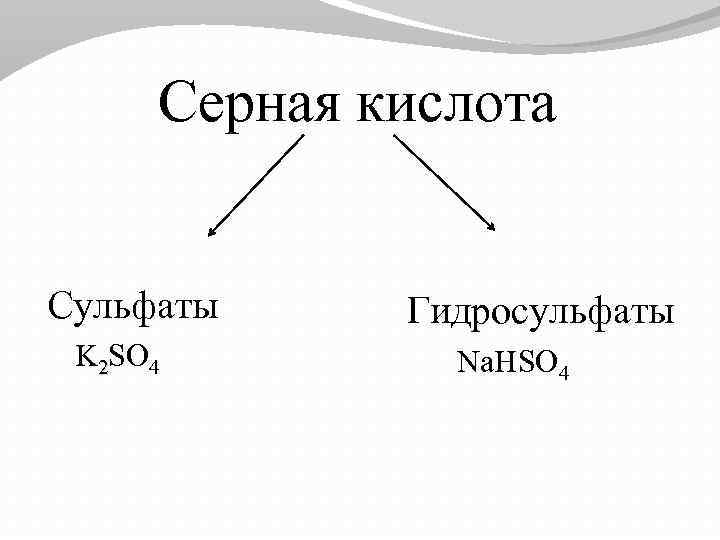 Серная кислота Сульфаты K 2 SO 4 Гидросульфаты Na. HSO 4
Серная кислота Сульфаты K 2 SO 4 Гидросульфаты Na. HSO 4
 Получение сульфатов 2 Na. Cl + H 2 SO 4 Na 2 SO 4 + 2 HCl Получение гидросульфатов K 2 SO 4+H 2 SO 4 2 KHSO 4
Получение сульфатов 2 Na. Cl + H 2 SO 4 Na 2 SO 4 + 2 HCl Получение гидросульфатов K 2 SO 4+H 2 SO 4 2 KHSO 4