Серебряно-цинковые аккумуляторные батареи.pptx
- Количество слайдов: 7

Серебряно цинковые аккумуляторные батареи

Серебряно цинковые аккумуляторы применяются тогда, когда малый вес и малый объем являются важнейшими требованиями. Отличаются очень малым внутренним сопротивлением и большой удельной энергоёмкостью.
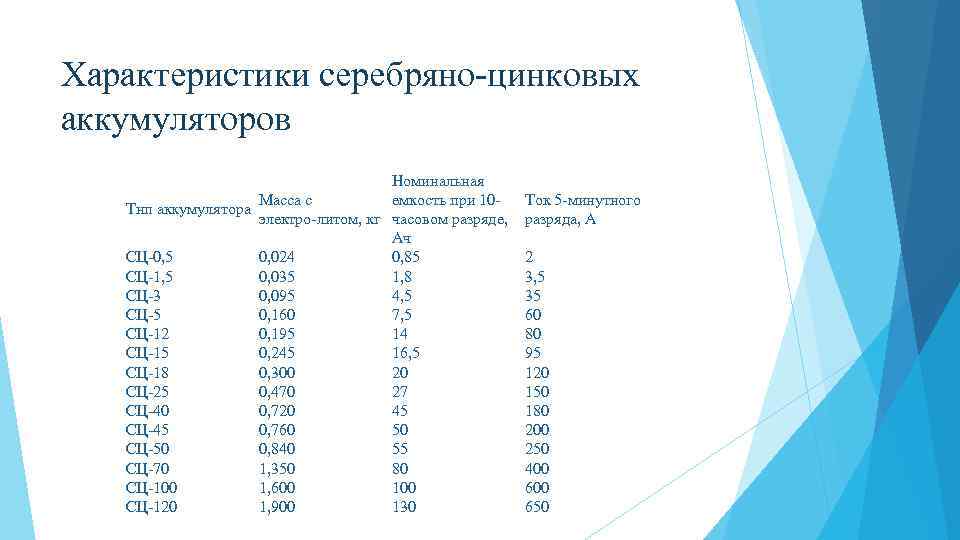
Характеристики серебряно цинковых аккумуляторов Номинальная Масса с емкость при 10 Тнп аккумулятора электро литом, кг часовом разряде, Ач СЦ 0, 5 0, 024 0, 85 СЦ 1, 5 0, 035 1, 8 СЦ 3 0, 095 4, 5 СЦ 5 0, 160 7, 5 СЦ 12 0, 195 14 СЦ 15 0, 245 16, 5 СЦ 18 0, 300 20 СЦ 25 0, 470 27 СЦ 40 0, 720 45 СЦ 45 0, 760 50 СЦ 50 0, 840 55 СЦ 70 1, 350 80 СЦ 100 1, 600 100 СЦ 120 1, 900 130 Ток 5 минутного разряда, А 2 3, 5 35 60 80 95 120 150 180 200 250 400 650

Параметры Теоретическая удельная электроёмкость : до 425 Вт·ч/кг Практическая удельная электроёмкость: до 150 Вт·ч/кг Удельная энергоплотность: до 650 Вт·ч/дм³ ЭДС : 1, 85 В (рабочее напряжение 1, 55 В) Рабочая температура: − 40…+50 °C

Конструкция В серебряно цинковых аккумуляторах положительные пластины изготавливаются из серебра, а отрицательные – из окиси цинка в смеси с порошком металлического цинка. Положительные пластины отделены от отрицательных слоями гидратцелюлозной пленки. Собранный пакет электродов помещается в пластмассовый сосуд и заливается химически чистой калиевой щелочью.

Зарядка аккумулятора (восстановление на электроде активных веществ) На аноде происходит окисление серебра до одновалентного иона: 2 Ag + 2 OH– =Ag 2 O + H 2 O + 2 e– с последующим окислением до иона двухвалентного серебра: Ag + 2 OH– = 2 Ag. O + H 2 O + 2 e– На катоде происходит процесс восстановления: +2 Zn(OH)2 + 4 e– = 2 Zn + 4 OH– После того, как потенциал серебряного электрода достигнет величины потенциала выделения кислорода, главной реакцией становится реакция образования кислорода: 4 OH– ( 2 H 2 O + O 2 + 4 e–

При отборе электрического тока, т. е. при режиме разряда, протекают следующие электрохимические процессы: На аноде внутренней цепи происходит реакция окисления металлического цинка: 2 Zn + 4 OH– = Zn. O + HOH + Zn(OH)2 + 4 e– На катоде внутренней цепи протекает реакция: 2 Ag. O + 2 e– + HOH = Ag 2 O + 2 OH– т. е. происходит реакция восстановления иона двухвалентного серебра до одновалентного иона и далее до чистого серебра по схеме: Ag 2 O + 2 e– + HOH = 2 Ag + 2 OH– Суммарное уравнение записывается в виде: 2 Ag. O + HOH + 2 Zn = 2 Ag + Zn. O + Zn(OH)2 При заряде эта реакция идет в прямом направлении, а при разряде – в обратном.
Серебряно-цинковые аккумуляторные батареи.pptx