серд.нед.ppt
- Количество слайдов: 90
 Сердечная недостаточность типовая форма патологии, возникающая вследствие различных причин, при которой ослабляется сократительная функция миокарда и сердце не обеспечивает потребности органов и тканей в адекватном кровоснабжении
Сердечная недостаточность типовая форма патологии, возникающая вследствие различных причин, при которой ослабляется сократительная функция миокарда и сердце не обеспечивает потребности органов и тканей в адекватном кровоснабжении
 Виды сердечной недостаточности • - По происхождению: миокардиальная перегрузочная смешанная - По скорости развития - острая - хроническая По поражению отдела сердца: - левожелудочковая - правожелудочковая - тотальная
Виды сердечной недостаточности • - По происхождению: миокардиальная перегрузочная смешанная - По скорости развития - острая - хроническая По поражению отдела сердца: - левожелудочковая - правожелудочковая - тотальная
 Этиология сердечной недостаточности: 1. Интракардиальные причины 2. Перегрузка сердца сопротивлением 3. Перегрузка сердца объемом
Этиология сердечной недостаточности: 1. Интракардиальные причины 2. Перегрузка сердца сопротивлением 3. Перегрузка сердца объемом
 1. Интракардиальные: - поражение миокарда (инфекционный миокардит, токсическая кардиомиопатия, инфаркт миокарда, ИБС, кардиосклероз) - нарушения ритма работы сердца (аритмии) при поражениях миокарда и/или проводящей системы сердца
1. Интракардиальные: - поражение миокарда (инфекционный миокардит, токсическая кардиомиопатия, инфаркт миокарда, ИБС, кардиосклероз) - нарушения ритма работы сердца (аритмии) при поражениях миокарда и/или проводящей системы сердца
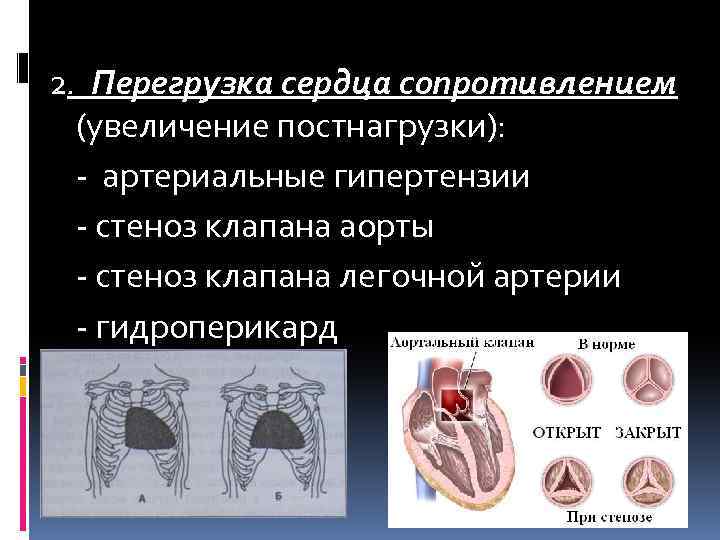 2. Перегрузка сердца сопротивлением (увеличение постнагрузки): - артериальные гипертензии - стеноз клапана аорты - стеноз клапана легочной артерии - гидроперикард
2. Перегрузка сердца сопротивлением (увеличение постнагрузки): - артериальные гипертензии - стеноз клапана аорты - стеноз клапана легочной артерии - гидроперикард
 3. Перегрузка сердца объемом - увеличение преднагрузки: гиперволемия гемоконцентрация недостаточность аортального клапана недостаточность клапана легочной артерии врожденные пороки сердца синего типа (со сбросом крови справа налево): триада, тетрада, пентада Фалло
3. Перегрузка сердца объемом - увеличение преднагрузки: гиперволемия гемоконцентрация недостаточность аортального клапана недостаточность клапана легочной артерии врожденные пороки сердца синего типа (со сбросом крови справа налево): триада, тетрада, пентада Фалло
 ФАКТОРЫ РИСКА Корригируемые • Дислипидемия • Артериальная гипертензия • Курение • Сахарный диабет • Ожирение • Недостаточная физическая активность (гиподинамия) Некорригируемые • Наследственное предрасположенность к сердечно-сосудистым заболеваниям • Принадлежность к мужскому полу • Возраст (мужчины старше 45 лет, женщины старше 55 лет)
ФАКТОРЫ РИСКА Корригируемые • Дислипидемия • Артериальная гипертензия • Курение • Сахарный диабет • Ожирение • Недостаточная физическая активность (гиподинамия) Некорригируемые • Наследственное предрасположенность к сердечно-сосудистым заболеваниям • Принадлежность к мужскому полу • Возраст (мужчины старше 45 лет, женщины старше 55 лет)
 Прогноз У человека, имеющего хотя бы один (любой) фактор риска, вероятность инфаркта, стенокардии, инсульта, и смерти от них увеличивалась в 2 -3 раза по сравнению с его ровесником, но без факторов риска. При сочетании двух, трех, четырех факторов риска прогноз прогрессивно ухудшается, вероятность всяческих несчастий от сердечно-сосудистых заболеваний увеличивается до 15 раз!
Прогноз У человека, имеющего хотя бы один (любой) фактор риска, вероятность инфаркта, стенокардии, инсульта, и смерти от них увеличивалась в 2 -3 раза по сравнению с его ровесником, но без факторов риска. При сочетании двух, трех, четырех факторов риска прогноз прогрессивно ухудшается, вероятность всяческих несчастий от сердечно-сосудистых заболеваний увеличивается до 15 раз!
 Классификация сердечной недостаточности (по Меерсону) Меерсону 1. Аварийная стадия, неустойчивая стадия компенсации 2. Стадия устойчивой компенсации (стадия патологической гипертрофии) 3. Стадия истощения и прогрессирующего кардиосклероза
Классификация сердечной недостаточности (по Меерсону) Меерсону 1. Аварийная стадия, неустойчивая стадия компенсации 2. Стадия устойчивой компенсации (стадия патологической гипертрофии) 3. Стадия истощения и прогрессирующего кардиосклероза
 Аварийная стадия Кратковременное напряжение сократительной функции сердца для поддержания системного кровообращения за счет мобилизации всех резервов миокарда. Характеризуется гиперфункцией сердца.
Аварийная стадия Кратковременное напряжение сократительной функции сердца для поддержания системного кровообращения за счет мобилизации всех резервов миокарда. Характеризуется гиперфункцией сердца.
 Повышенная работа (A) приходится на прежнюю площадь миокарда (S), что приводит к повышению соотношения работа/площадь миокарда и A удельная работа становится > 1. (в физиологических условиях А уд. работа ~1)
Повышенная работа (A) приходится на прежнюю площадь миокарда (S), что приводит к повышению соотношения работа/площадь миокарда и A удельная работа становится > 1. (в физиологических условиях А уд. работа ~1)
 Особенностью этой стадии является: - интенсивный расход энергетических запасов - преобладание процессов потребления АТФ над синтезом
Особенностью этой стадии является: - интенсивный расход энергетических запасов - преобладание процессов потребления АТФ над синтезом
 Сердце не имеет запасов субстратов, основными источниками энергообеспечения миокарда в физиологических условиях являются: : 1. свободные жирные кислоты (60 -70%), • поступающие из печени, жировых депо • 2. недоокисленные продукты обмена, выделяемые клетками других органов: молочная кислота и кетоновые тела.
Сердце не имеет запасов субстратов, основными источниками энергообеспечения миокарда в физиологических условиях являются: : 1. свободные жирные кислоты (60 -70%), • поступающие из печени, жировых депо • 2. недоокисленные продукты обмена, выделяемые клетками других органов: молочная кислота и кетоновые тела.
 • Такая нетребовательность к “еде” повышает надежность работы сердца. При этом образуется 80 -90% всего АТФ, потребляемого сердечной мышцей.
• Такая нетребовательность к “еде” повышает надежность работы сердца. При этом образуется 80 -90% всего АТФ, потребляемого сердечной мышцей.
 • Запас макроэргических соединений в миокарде практически отсутствует (его достаточно лишь на 5— 10 сокращений сердца)
• Запас макроэргических соединений в миокарде практически отсутствует (его достаточно лишь на 5— 10 сокращений сердца)
 • Сердце выполняет функцию насоса круглосуточно, при постоянно меняющихся нагрузках и особенностях коронарного кровотока.
• Сердце выполняет функцию насоса круглосуточно, при постоянно меняющихся нагрузках и особенностях коронарного кровотока.
 Максимально высокий кровоток в коронарных сосудах представлен во время диастолы, в систолу кровоток практически отсутствует, только в эпикардиальных сосудах.
Максимально высокий кровоток в коронарных сосудах представлен во время диастолы, в систолу кровоток практически отсутствует, только в эпикардиальных сосудах.
 • Общее количество циркулирующей через сердечную мышцу крови невелико по отношению к объему совершаемой работы. Но извлечение кислорода из оксигемоглобина оказывается максимально высоким по сравнению с другими тканями.
• Общее количество циркулирующей через сердечную мышцу крови невелико по отношению к объему совершаемой работы. Но извлечение кислорода из оксигемоглобина оказывается максимально высоким по сравнению с другими тканями.
 • Сердце имеет массу всего 0, 5% массы тела (300 -400 г) и получает 5% всего кровотока, при этом потребляя 10% всего кислорода, используемого организмом.
• Сердце имеет массу всего 0, 5% массы тела (300 -400 г) и получает 5% всего кровотока, при этом потребляя 10% всего кислорода, используемого организмом.
 • Такое высокое потребление кислорода происходит потому, что сердце даже в покое использует 60 -75% кислорода, поступающего с кровью, и, следовательно, этот показатель (КУК коэффициент утилизации кислорода) не может увеличиваться при нагрузке.
• Такое высокое потребление кислорода происходит потому, что сердце даже в покое использует 60 -75% кислорода, поступающего с кровью, и, следовательно, этот показатель (КУК коэффициент утилизации кислорода) не может увеличиваться при нагрузке.
 • Сердце потребляет большие кислорода “выжимает” артериальной максимум. объемы и из крови
• Сердце потребляет большие кислорода “выжимает” артериальной максимум. объемы и из крови
 • Этому способствует необычайно высокое содержание митохондрий в кардиомиоцитах, которые занимают цитоплазмы. до 35% от объема
• Этому способствует необычайно высокое содержание митохондрий в кардиомиоцитах, которые занимают цитоплазмы. до 35% от объема
 • Коэффициент безопасности для миокарда всего 1 – «степень уменьшения кровотока, которая может быть компенсирована увеличением экстракции кислорода» .
• Коэффициент безопасности для миокарда всего 1 – «степень уменьшения кровотока, которая может быть компенсирована увеличением экстракции кислорода» .
 Самое “слабое звено” миокарда – высокая зависимость от доставки кислорода.
Самое “слабое звено” миокарда – высокая зависимость от доставки кислорода.
 • При нагрузке увеличивается концентрация ионов калия, водородных ионов, молочной кислоты, двуокиси углерода, появляются вазоактивные вещества (гистамин, кинины, простагландины группы Е), что ведет к расширению сосудов и увеличению кровотока в миокарде.
• При нагрузке увеличивается концентрация ионов калия, водородных ионов, молочной кислоты, двуокиси углерода, появляются вазоактивные вещества (гистамин, кинины, простагландины группы Е), что ведет к расширению сосудов и увеличению кровотока в миокарде.
 • Ацетилхолин через М-холинорецепторы, адреналин и норадреналин через βадренорецепторы расширяют коронарные артерии.
• Ацетилхолин через М-холинорецепторы, адреналин и норадреналин через βадренорецепторы расширяют коронарные артерии.
 • Тироксин, кортизол и другие гормоны усиливают кровоснабжение миокарда через метаболические посредники.
• Тироксин, кортизол и другие гормоны усиливают кровоснабжение миокарда через метаболические посредники.
 • Отрицательное действие на коронарный кровоток оказывают ангиотензины и вазопрессин, которые в больших дозах приводят к сужению коронарных артерий.
• Отрицательное действие на коронарный кровоток оказывают ангиотензины и вазопрессин, которые в больших дозах приводят к сужению коронарных артерий.
 • Адреналин и норадреналин через активацию α-адренорецепторов вызывают выраженную вазоконстрикцию.
• Адреналин и норадреналин через активацию α-адренорецепторов вызывают выраженную вазоконстрикцию.
 • В аварийную стадию включается ряд компенсаторных механизмов — интракардиальных и экстракардиальных, которые могут поддерживать сократительную функцию миокарда и обеспечивать минутный объем кровообращения (МОК) на уровне, соответствующем потребностям организма.
• В аварийную стадию включается ряд компенсаторных механизмов — интракардиальных и экстракардиальных, которые могут поддерживать сократительную функцию миокарда и обеспечивать минутный объем кровообращения (МОК) на уровне, соответствующем потребностям организма.
 Интракардиальные механизмы
Интракардиальные механизмы
 Гемодинамические миогенные механизмы обеспечивают постоянство систолического объема крови (гетерогенные).
Гемодинамические миогенные механизмы обеспечивают постоянство систолического объема крови (гетерогенные).
 Механизм Франка-Старлинга функционирует при перегрузке сердца объемом. Сила сокращений сердца зависит от исходной длины мышечных волокон и степени их растяжения во время диастолы. Чем больше приток крови к сердцу, тем больше растянуты волокна, что приводит к увеличению ЧСС и силы во время систолы.
Механизм Франка-Старлинга функционирует при перегрузке сердца объемом. Сила сокращений сердца зависит от исходной длины мышечных волокон и степени их растяжения во время диастолы. Чем больше приток крови к сердцу, тем больше растянуты волокна, что приводит к увеличению ЧСС и силы во время систолы.
 • Другой тип миогенной саморегуляции работы сердца - гомеометрический, который не зависит от исходной длины кардиомиоцитов. К нему относятся «лестница» Боудича и • феномен Анрепа.
• Другой тип миогенной саморегуляции работы сердца - гомеометрический, который не зависит от исходной длины кардиомиоцитов. К нему относятся «лестница» Боудича и • феномен Анрепа.
 • Сила сердечных сокращений может возрастать при увеличении частоты сокращений сердца. Чем чаще оно сокращается, тем выше амплитуда его сокращений - «лестница» Боудича
• Сила сердечных сокращений может возрастать при увеличении частоты сокращений сердца. Чем чаще оно сокращается, тем выше амплитуда его сокращений - «лестница» Боудича
 Феномен Анрепа • функционирует при повышении сопротивления оттоку. При повышении давления в аорте или легочном стволе сила сердечных сокращений автоматически возрастает, обеспечивая возможность выброса того же объема крови, что и в норме.
Феномен Анрепа • функционирует при повышении сопротивления оттоку. При повышении давления в аорте или легочном стволе сила сердечных сокращений автоматически возрастает, обеспечивая возможность выброса того же объема крови, что и в норме.
 Внутрисердечные периферические рефлексы • в сердце независимо от нервных элементов экстракардиального происхождения функционирует внутриорганная нервная система, образующая миниатюрные рефлекторные дуги
Внутрисердечные периферические рефлексы • в сердце независимо от нервных элементов экстракардиального происхождения функционирует внутриорганная нервная система, образующая миниатюрные рефлекторные дуги
 ЭКСТРАКАРДИАЛЬНЫЕ МЕХАНИЗМЫ • Поскольку сердечно-сосудистая и дыхательная системы выполняют общую функцию (доставляют кислород к тканям и клеткам), то они во многом работают согласованно. В норме на 1 дыхательное движение (вдох-выдох-пауза) приходится около 4 сокращений сердца.
ЭКСТРАКАРДИАЛЬНЫЕ МЕХАНИЗМЫ • Поскольку сердечно-сосудистая и дыхательная системы выполняют общую функцию (доставляют кислород к тканям и клеткам), то они во многом работают согласованно. В норме на 1 дыхательное движение (вдох-выдох-пауза) приходится около 4 сокращений сердца.
 • Экстракардиальными механизмами компенсации являются активация симпатоадреналовой, ренинангиотензиновой систем функции надпочечников. и минералокортикоидной
• Экстракардиальными механизмами компенсации являются активация симпатоадреналовой, ренинангиотензиновой систем функции надпочечников. и минералокортикоидной
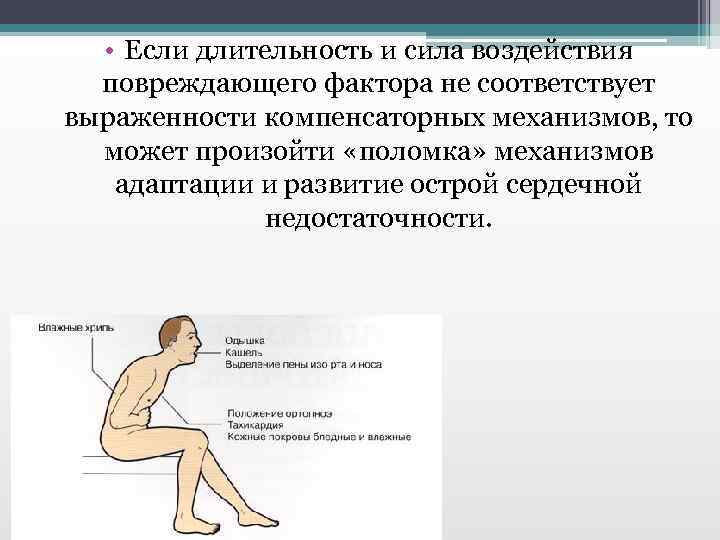 • Если длительность и сила воздействия повреждающего фактора не соответствует выраженности компенсаторных механизмов, то может произойти «поломка» механизмов адаптации и развитие острой сердечной недостаточности.
• Если длительность и сила воздействия повреждающего фактора не соответствует выраженности компенсаторных механизмов, то может произойти «поломка» механизмов адаптации и развитие острой сердечной недостаточности.
 Если компенсаторные механизмы сработали адекватно, то происходит переход в следующую стадию сердечной недостаточности – стадию УСТОЙЧИВОЙ КОМПЕНСАЦИИ
Если компенсаторные механизмы сработали адекватно, то происходит переход в следующую стадию сердечной недостаточности – стадию УСТОЙЧИВОЙ КОМПЕНСАЦИИ
 Стадия устойчивой компенсации (стадия патологической гипертрофии) Мышечная нагрузка приводит к усилению синтеза сократительных белков миокарда и появлению гипертрофии — утолщению стенок сердца и увеличению его размеров (внутриклеточные механизмы)
Стадия устойчивой компенсации (стадия патологической гипертрофии) Мышечная нагрузка приводит к усилению синтеза сократительных белков миокарда и появлению гипертрофии — утолщению стенок сердца и увеличению его размеров (внутриклеточные механизмы)
 Повышение функции сердца в условиях перегрузки миокарда давлением или объемом связаны с активацией миокардиальных (локальных) нейрогормональных систем.
Повышение функции сердца в условиях перегрузки миокарда давлением или объемом связаны с активацией миокардиальных (локальных) нейрогормональных систем.
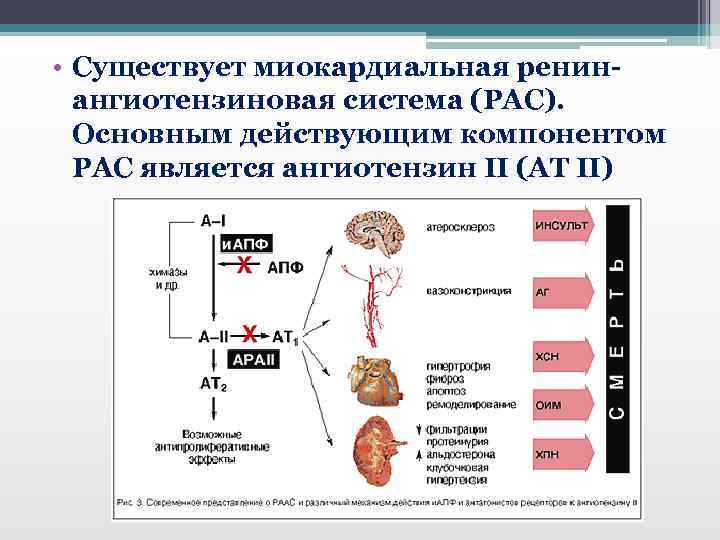 • Существует миокардиальная ренинангиотензиновая система (РАС). Основным действующим компонентом РАС является ангиотензин II (АТ II)
• Существует миокардиальная ренинангиотензиновая система (РАС). Основным действующим компонентом РАС является ангиотензин II (АТ II)
 АТ II миокардиальной РАС • оказывает как прямое пролиферативное действие на кардиомиоциты и гладкомышечные клетки сосудов, вызывая их гипертрофию, так и опосредованное действие - путем стимуляции или потенцирования действия факторов роста
АТ II миокардиальной РАС • оказывает как прямое пролиферативное действие на кардиомиоциты и гладкомышечные клетки сосудов, вызывая их гипертрофию, так и опосредованное действие - путем стимуляции или потенцирования действия факторов роста
 • Эндотелин - вазоконстрикторный пептид, синтезируется разными сосудов, в сосудах клетками: миоциты и миокарде эндотелиоциты желудочков сердца, фибробласты. • Увеличение эндотелина ремоделированию способствует миокарда, вызывает гипертрофию миоцитов и изменения в экстрацеллюлярном увеличения фиброза. матриксе в виде
• Эндотелин - вазоконстрикторный пептид, синтезируется разными сосудов, в сосудах клетками: миоциты и миокарде эндотелиоциты желудочков сердца, фибробласты. • Увеличение эндотелина ремоделированию способствует миокарда, вызывает гипертрофию миоцитов и изменения в экстрацеллюлярном увеличения фиброза. матриксе в виде
 • В ответ на эти факторы активизируется генетический аппарат мышечных и соединительно-тканных клеток (c-myc, c-fos), увеличивается синтез ДНК и РНК, числа рибосом, усиливается синтез белков, что ведет к быстрому увеличению объема мышечного волокна, его внутриклеточной гиперплазии и гипертрофии.
• В ответ на эти факторы активизируется генетический аппарат мышечных и соединительно-тканных клеток (c-myc, c-fos), увеличивается синтез ДНК и РНК, числа рибосом, усиливается синтез белков, что ведет к быстрому увеличению объема мышечного волокна, его внутриклеточной гиперплазии и гипертрофии.
 • Развитие гипертрофии миокарда приводит к увеличению площади поперечного сечения миокарда, при этом показатель А удельная работа вновь возвращается к нормальным величинам (в пределах ~1)
• Развитие гипертрофии миокарда приводит к увеличению площади поперечного сечения миокарда, при этом показатель А удельная работа вновь возвращается к нормальным величинам (в пределах ~1)
 Гипертрофия - компенсаторноприспособительное увеличение массы органа за счет возрастание массы каждой его структурной единицы, сопровождающееся усилением функции
Гипертрофия - компенсаторноприспособительное увеличение массы органа за счет возрастание массы каждой его структурной единицы, сопровождающееся усилением функции
 Гипертрофия имеет приобретенный характер и является обратимым процессом. В этой стадии масса увеличивается на 100 – 120 % и больше не прибавляется, что позволяет сердцу адекватно выполнять свою функцию
Гипертрофия имеет приобретенный характер и является обратимым процессом. В этой стадии масса увеличивается на 100 – 120 % и больше не прибавляется, что позволяет сердцу адекватно выполнять свою функцию
 • В миокарде новообразования клеток не происходит и в основе гипертрофии лежит усиление анаболических процессов и гиперплазия клеточных органелл (митохондрий, мышечных белков, рибосом…) Нормальные клетки (А), гипертрофия (B), гиперплазия (C) и комбинация (D)
• В миокарде новообразования клеток не происходит и в основе гипертрофии лежит усиление анаболических процессов и гиперплазия клеточных органелл (митохондрий, мышечных белков, рибосом…) Нормальные клетки (А), гипертрофия (B), гиперплазия (C) и комбинация (D)
 • В эту стадию патологические изменения в обмене и структуре миокарда не выявляются, потребление кислорода, образование энергетических соединений не отличаются от нормы.
• В эту стадию патологические изменения в обмене и структуре миокарда не выявляются, потребление кислорода, образование энергетических соединений не отличаются от нормы.
 • Нормализуются гемодинамические нарушения. Гипертрофированное сердце приспособилось к новым условиям нагрузки и в течение длительного времени компенсирует их
• Нормализуются гемодинамические нарушения. Гипертрофированное сердце приспособилось к новым условиям нагрузки и в течение длительного времени компенсирует их
 Сроки устойчивости миокарда зависят: - от этиологического фактора, - лечения - образа жизни
Сроки устойчивости миокарда зависят: - от этиологического фактора, - лечения - образа жизни
 • Гипертрофия миокарда может быть реализована по концентрическому или эксцентрическому типу. Увеличение напряжения миокарда во время систолы при перегрузке сопротивлением является основным фактором, стимулирующим развитие концентрической гипертрофии миокарда (параллельное добавление миофибрилл) - утолщению мышечной стенки без расширения полости желудочка.
• Гипертрофия миокарда может быть реализована по концентрическому или эксцентрическому типу. Увеличение напряжения миокарда во время систолы при перегрузке сопротивлением является основным фактором, стимулирующим развитие концентрической гипертрофии миокарда (параллельное добавление миофибрилл) - утолщению мышечной стенки без расширения полости желудочка.

 • При перегрузке объемом во время диастолы развивается эксцентрическая гипертрофия (последовательное добавление миофибрилл), при которой утолщение стенки сопровождается расширением полости органа и сохранением его функции. Это явление носит название тоногенная дилятация, подразумевая в данном случае под этим термином как степень растяжения мускулатуры сердца, так и степень сокращения к концу диастолы.
• При перегрузке объемом во время диастолы развивается эксцентрическая гипертрофия (последовательное добавление миофибрилл), при которой утолщение стенки сопровождается расширением полости органа и сохранением его функции. Это явление носит название тоногенная дилятация, подразумевая в данном случае под этим термином как степень растяжения мускулатуры сердца, так и степень сокращения к концу диастолы.
 • В условиях достигнутого предела функциональных нагрузок, гиперплазия и гиперфункция компенсирующих структур относительно стабилизируются по степени, что соответствует стадии устойчивой компенсации.
• В условиях достигнутого предела функциональных нагрузок, гиперплазия и гиперфункция компенсирующих структур относительно стабилизируются по степени, что соответствует стадии устойчивой компенсации.
 Ремоделирование миокарда Термин "ремоделирование сердца" был предложен N. Sharp в конце 70 -х годов прошлого века. В клинике структурные изменения желудочков, характеризующиеся гипертрофией, дилатацией, увеличением массы миокарда, изменением геометрии и формы левого желудочка называют ремоделированием миокарда
Ремоделирование миокарда Термин "ремоделирование сердца" был предложен N. Sharp в конце 70 -х годов прошлого века. В клинике структурные изменения желудочков, характеризующиеся гипертрофией, дилатацией, увеличением массы миокарда, изменением геометрии и формы левого желудочка называют ремоделированием миокарда
 Ремоделирование миокарда Структурно–геометрические изменения в сердце: - гипертрофия, гиперплазия, нарушение взаимного расположения миофибрилл - дистрофия, фиброз, замена коллагена типа I на тип III - снижение относительной плотности капилляров - увеличение капилляро–мышечного пространства
Ремоделирование миокарда Структурно–геометрические изменения в сердце: - гипертрофия, гиперплазия, нарушение взаимного расположения миофибрилл - дистрофия, фиброз, замена коллагена типа I на тип III - снижение относительной плотности капилляров - увеличение капилляро–мышечного пространства

 Ремоделирование миокарда Последствия: - изменение геометрии полостей сердца и его контуров - дилатация полостей его желудочков и предсердий - снижение сократительной функции миокарда
Ремоделирование миокарда Последствия: - изменение геометрии полостей сердца и его контуров - дилатация полостей его желудочков и предсердий - снижение сократительной функции миокарда
 Стадия истощения и прогрессирующего кардиосклероза • Стадия истощения характеризуется глубокими нарушениями обмена веществ, что проявляется в нарушении энергообразования и, как следствие, сократительной функции миокарда.
Стадия истощения и прогрессирующего кардиосклероза • Стадия истощения характеризуется глубокими нарушениями обмена веществ, что проявляется в нарушении энергообразования и, как следствие, сократительной функции миокарда.
 • В результате дефицита кислорода в кардиомиоцитах происходит накопление промежуточных продуктов обмена СЖК – ацилкарнитина, ацил. Ко. А, НАД·Н, угнетается пируватдегидрогеназа, соответственно устраняется возможность утилизации пирувата, в результате чего он практически полностью превращается в лактат.
• В результате дефицита кислорода в кардиомиоцитах происходит накопление промежуточных продуктов обмена СЖК – ацилкарнитина, ацил. Ко. А, НАД·Н, угнетается пируватдегидрогеназа, соответственно устраняется возможность утилизации пирувата, в результате чего он практически полностью превращается в лактат.
 • Лактат накапливается в клетке вместе с ионами Н+, что приводит к снижению внутриклеточного р. Н и развитию внутриклеточного ацидоза.
• Лактат накапливается в клетке вместе с ионами Н+, что приводит к снижению внутриклеточного р. Н и развитию внутриклеточного ацидоза.
 Промежуточные продукты обмена СЖК угнетают адениннуклеотидтранслоказу митохондрий и затрудняют перенос макроэргических фосфатов через их мембрану, что нарушается процесс образования энергии в миокарде.
Промежуточные продукты обмена СЖК угнетают адениннуклеотидтранслоказу митохондрий и затрудняют перенос макроэргических фосфатов через их мембрану, что нарушается процесс образования энергии в миокарде.
 • Формирующийся лактатацидоз тканевый вызывает окислительного разобщение фосфорилирования, вызывая перегрузку кардиомиоцитов ионами кальция, который активирует фосфолипазу А 2 с последующим инициированием процессов ПОЛ и повреждением мембранных структур.
• Формирующийся лактатацидоз тканевый вызывает окислительного разобщение фосфорилирования, вызывая перегрузку кардиомиоцитов ионами кальция, который активирует фосфолипазу А 2 с последующим инициированием процессов ПОЛ и повреждением мембранных структур.
 • Нарушается работа гипоксантиновой системы. При дефиците кислорода ксантиндегидрогеназа функционирует как оксидаза, которая приводит к образованию активных форм кислорода и активации СРО
• Нарушается работа гипоксантиновой системы. При дефиците кислорода ксантиндегидрогеназа функционирует как оксидаза, которая приводит к образованию активных форм кислорода и активации СРО
 • Начинают преобладать отрицательные биологические эффекты механизмов, которые ранее компенсации, способствовали формируются называемые «порочные круги» . так
• Начинают преобладать отрицательные биологические эффекты механизмов, которые ранее компенсации, способствовали формируются называемые «порочные круги» . так
 • - Под влиянием стимулируется повышается способствует ангиотензина рост содержание II фибробластов, коллагена. снижению Это плотности капилляров, нарушению диффузии кислорода и ишемии миокарда.
• - Под влиянием стимулируется повышается способствует ангиотензина рост содержание II фибробластов, коллагена. снижению Это плотности капилляров, нарушению диффузии кислорода и ишемии миокарда.
 • - Повышенное содержание коллагена приводит к снижению эластичности миокарда и повышению его ригидности
• - Повышенное содержание коллагена приводит к снижению эластичности миокарда и повышению его ригидности
 • Чрезмерная гипертрофия миокарда и воздействие на него повышенного количества катехоламинов сопровождается увеличением потребности миокарда в кислороде.
• Чрезмерная гипертрофия миокарда и воздействие на него повышенного количества катехоламинов сопровождается увеличением потребности миокарда в кислороде.
 • В результате гипертрофии миокарда возникает также относительная недостаточность его кровоснабжения.
• В результате гипертрофии миокарда возникает также относительная недостаточность его кровоснабжения.
 Гипертрофия сердца в конечном итоге приводит к декомпенсации: • На уровне органа: увеличение массы сердца опережает рост иннервирующих его аксонов симпатических нейронов. В результате концентрация норадреналина в миокарде падает, что приводит к снижению инотропного и расслабляющего эффекта.
Гипертрофия сердца в конечном итоге приводит к декомпенсации: • На уровне органа: увеличение массы сердца опережает рост иннервирующих его аксонов симпатических нейронов. В результате концентрация норадреналина в миокарде падает, что приводит к снижению инотропного и расслабляющего эффекта.
 На уровне тканей: рост артериол и капилляров отстает от увеличения размеров мышечных клеток, что приводит к локальной гипоксии и ишемии, снижению коронарного резерва
На уровне тканей: рост артериол и капилляров отстает от увеличения размеров мышечных клеток, что приводит к локальной гипоксии и ишемии, снижению коронарного резерва
 • На уровне клетки: масса клетки увеличивается в большей степени, чем ее поверхность, покрытая мембраной. Снижается локализованных в мембране сарколемной мощность K-Na, Na-Ca насосов, что нарушает ионный транспорт, сопряжение сокращения и расслабления сердечной мышцы.
• На уровне клетки: масса клетки увеличивается в большей степени, чем ее поверхность, покрытая мембраной. Снижается локализованных в мембране сарколемной мощность K-Na, Na-Ca насосов, что нарушает ионный транспорт, сопряжение сокращения и расслабления сердечной мышцы.
 • На уровне органелл: • при значительном увеличении массы миофибрилл, становится мало митохондрий, что приводит к снижению энергообеспечения гипертрофированного сердца
• На уровне органелл: • при значительном увеличении массы миофибрилл, становится мало митохондрий, что приводит к снижению энергообеспечения гипертрофированного сердца
 • На уровне молекул: увеличения соотношения между легкими и тяжелыми цепями (тяжелые в головках цепи активности), что - молекул носители приводит к миозина АТФ-азной снижению скорости сокращения сердечной мышцы
• На уровне молекул: увеличения соотношения между легкими и тяжелыми цепями (тяжелые в головках цепи активности), что - молекул носители приводит к миозина АТФ-азной снижению скорости сокращения сердечной мышцы
 Повышенная нагрузка неравномерно распределяется между различными группами мышечных волокон: более интенсивно функционирующие волокна быстрее выходят из строя, гибнут и замещаются соединительной тканью (кардиосклероз), а оставшиеся принимают олее повышенную нагрузку
Повышенная нагрузка неравномерно распределяется между различными группами мышечных волокон: более интенсивно функционирующие волокна быстрее выходят из строя, гибнут и замещаются соединительной тканью (кардиосклероз), а оставшиеся принимают олее повышенную нагрузку
 Соединительная ткань сдавливает кардиомиоциты, что приводит к изменению механических свойств сердца, еще большему ухудшению диффузии, углублению обменных нарушений. Считается, что при замене соединительной тканью 20— 30% массы сердца его нормальная работа невозможна.
Соединительная ткань сдавливает кардиомиоциты, что приводит к изменению механических свойств сердца, еще большему ухудшению диффузии, углублению обменных нарушений. Считается, что при замене соединительной тканью 20— 30% массы сердца его нормальная работа невозможна.
 Распространенность хронической сердечной недостаточности • в 2002 году в РФ насчитывалось 8, 1 млн человек с четкими признаками ХСН, из которых 3, 4 миллиона имели терминальный, III–IV ФК заболевания • У 4/5 всех больных с СН в России это заболевание ассоциируется с АГ и у ⅔ больных – с ИБС • Однолетняя смертность больных с клинически выраженной СН достигает 26– 29 %, то есть за один год в РФ умирает от 880 до 986 тысяч больных СН
Распространенность хронической сердечной недостаточности • в 2002 году в РФ насчитывалось 8, 1 млн человек с четкими признаками ХСН, из которых 3, 4 миллиона имели терминальный, III–IV ФК заболевания • У 4/5 всех больных с СН в России это заболевание ассоциируется с АГ и у ⅔ больных – с ИБС • Однолетняя смертность больных с клинически выраженной СН достигает 26– 29 %, то есть за один год в РФ умирает от 880 до 986 тысяч больных СН
 Хроническая сердечная недостаточность заболевание с комплексом характерных симптомов (одышка, утомляемость и cнижение физической активности, отеки и др. ), которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме.
Хроническая сердечная недостаточность заболевание с комплексом характерных симптомов (одышка, утомляемость и cнижение физической активности, отеки и др. ), которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме.
 Патогенез отеков при застойной сердечной недостаточности • Центральным патогенетическим звеном хронической сердечной недостаточности является снижение сердечного выброса, а также дисбаланс вазоконстрикторных и вазодилатирующих нейрогуморальных систем
Патогенез отеков при застойной сердечной недостаточности • Центральным патогенетическим звеном хронической сердечной недостаточности является снижение сердечного выброса, а также дисбаланс вазоконстрикторных и вазодилатирующих нейрогуморальных систем
 • Для поддержания на должном уровне артериального давления активизируется симпатоадреналовая система. Выброс катехоламинов приводит к вазоконстрикции сосудов и усугублению снижения кровоснабжения органов и тканей
• Для поддержания на должном уровне артериального давления активизируется симпатоадреналовая система. Выброс катехоламинов приводит к вазоконстрикции сосудов и усугублению снижения кровоснабжения органов и тканей
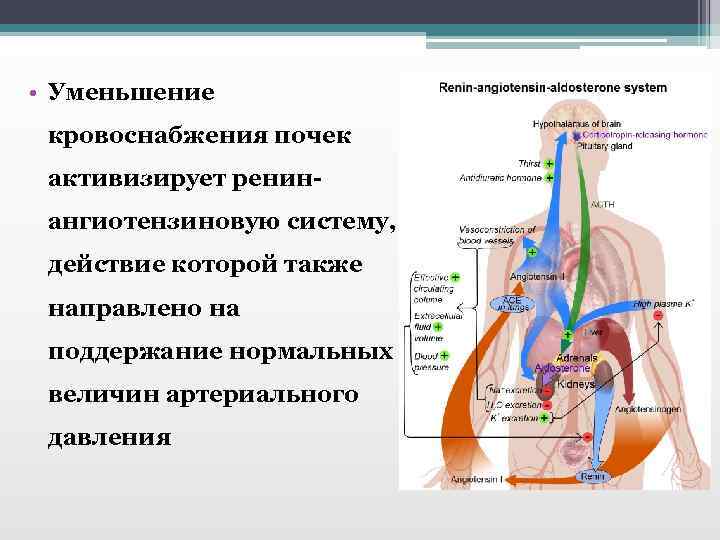 • Уменьшение кровоснабжения почек активизирует ренинангиотензиновую систему, действие которой также направлено на поддержание нормальных величин артериального давления
• Уменьшение кровоснабжения почек активизирует ренинангиотензиновую систему, действие которой также направлено на поддержание нормальных величин артериального давления
 • Ангиотензин II, синтезируемый ренинангиотензиновой системой, стимулирует синтез альдостерона, который повышает реабсорбцию в почках натрия и способствует активации антидиуретического гормона. Это приводит задержке в организме воды, увеличению объема циркулирующей крови и формированию застойной сердечной недостаточности.
• Ангиотензин II, синтезируемый ренинангиотензиновой системой, стимулирует синтез альдостерона, который повышает реабсорбцию в почках натрия и способствует активации антидиуретического гормона. Это приводит задержке в организме воды, увеличению объема циркулирующей крови и формированию застойной сердечной недостаточности.

 Клинические признаки ХСН • Слабость, утомляемость и ограничение активности. • Одышка • Сердцебиение • Застой в легких • Застойная гепатомегалия
Клинические признаки ХСН • Слабость, утомляемость и ограничение активности. • Одышка • Сердцебиение • Застой в легких • Застойная гепатомегалия
 • Отеки (прежде всего, в области голеней, стоп, с дальнейшим распространением кверху) • Асцит • Цирроз печени • Акроцианоз (синюшные губы, ушные раковины, холодные цианотичные кисти, стопы) • Набухшие вены шеи • Гидроторакс
• Отеки (прежде всего, в области голеней, стоп, с дальнейшим распространением кверху) • Асцит • Цирроз печени • Акроцианоз (синюшные губы, ушные раковины, холодные цианотичные кисти, стопы) • Набухшие вены шеи • Гидроторакс
 .
.


