
Сера. Сероводород. Лабец Анастасия 10 «З» класс

Определение • Сера —элемент 16 -й группы , третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulphur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
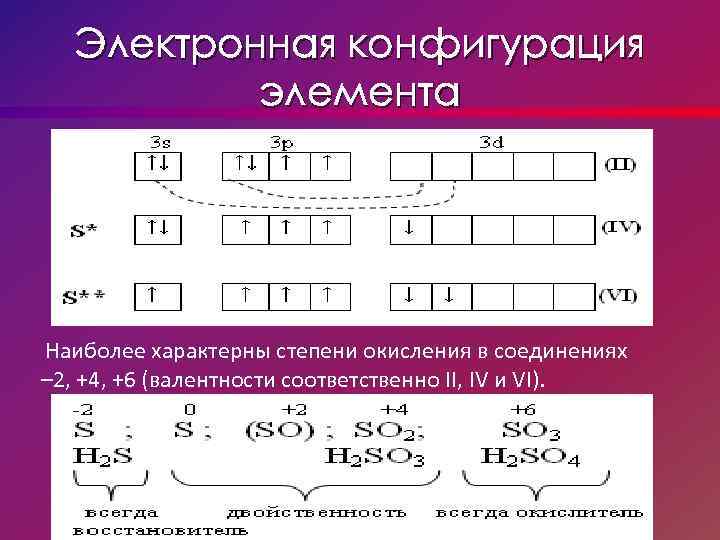
Электронная конфигурация элемента Наиболее характерны степени окисления в соединениях – 2, +4, +6 (валентности соответственно II, IV и VI).

Физические свойства • В обычных условиях сера S - желтые хрупкие кристаллы без вкуса и запаха, легко растворимые в сероуглероде CS 2. • Не растворяется в воде и при обычных условиях не реагирует с ней. • Характерна аллотропия

Аллотропные модификации Ромбическая Состоит из S 8 молекул, лимонно-жёлтые, полупрозрачные кристаллы Моноклинная Получается при кристаллизации ромбической Пластическая Можно получить при нагревании моноклинной и дальнейшем её выливании в холодную воду.

Получение пластической серы

Получение серы в промышленности • Серу получают, в основном, выплавляя ее из горных пород, содержащих самородную (элементарную) серу. Так называемый геотехнологический способ позволяет получать серу без подъема руды на поверхность. • По другому (термическому) методу, получившему особое распространение в начале 20 века на Сицилии, серу выплавляют, или возгоняют, из дробленной горной породы в специальных глиняных печах. • Существуют и другие методы выделения самородной серы из породы, например, экстракцией сероуглеродом или флотационными методами. • В связи с тем, что потребность промышленности в сере очень велика, разработаны методы ее получения из сероводорода H 2 S и сульфатов.

Метод Леблана • Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получения соды Na 2 CO 3 по методу французского химика Н. Леблана сульфида кальция Ca. S. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка Ca. CO 3. • Na 2 SO 4 + 2 C = Na 2 S + 2 CO 2; • Na 2 S + Ca. CO 3 = Na 2 CO 3 + Ca. S. • Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода: • Ca. S + CO 2 + H 2 O = Ca. CO 3 + H 2 S • Образующийся сероводород H 2 S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера: • 2 H 2 S + O 2 = 2 H 2 O +2 S

Применение • Издавна использовалась сера в медицине — ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. • Широкое использование серы для военных целей. • Издавна было известно и важнейшее соединение серы — серная кислота. • Получение SO 2, H 2 SO 4, H 2 S, CS

Биологическая роль • Сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом. • Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина и цистеина и, следовательно, в состав пептидов и белков. • В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере — около 4.

Реакции взаимодействия • При нагревании сера реагирует почти со всеми элементами, кроме инертных газов, йода, азота, платины и золота. • При нагревании растворяется в щелочах (реакции самоокисления-самовосстановления): • 3 S + 6 KOH = K 2 SO 3 + 2 K 2 S + 3 H 2 O • С металлами: • 2 Na + 2 S = Na 2 S 2 • Ca + S = Ca. S • Fe + S = Fe. S • Zn + S = Zn. S

Взаимодействие с натрием

Взаимодействие с цинком

Реакции взаимодействия. Восстановительные свойства • При комнатной температуре сера взаимодействует со фтором, хлором и концентрированными кислотами-окислителями (HNO 3, H 2 SO 4): • S + 3 F 2 = SF 6 • S + Cl 2 = SCl 2 • S + 6 HNO 3 (конц) = H 2 SO 4 | + 6 NO 2| + 2 H 2 O • S + 2 H 2 SO 4 (конц) = 3 SO 2 | + 2 H 2 O • При горении в O 2 образуется SO 2: • S + O 2 = SO 2 • Во всех указанных реакциях S - восстановитель

Горение серы в кислороде

Реакции взаимодействия. Окислительные свойства • При нагревании сера реагирует с углеродом и кремнием, фосфором, водородом и большинством металлов, проявляя окислительные свойства: • 4 С + S 8 = 4 CS 2 • 4 Si + S 8 = 4 Si. S 2 • 2 P + 3 S = P 2 S 3 • H 2 + S = H 2 S + 20, 6 к. Дж • Fe + S = Fe. S • Реакция со ртутью происходит уже при комнатной температуре: • Hg + S = Hg. S

Взаимодействие с кислотами • Концентрированная серная кислота при нагревании окисляет серу до SO 2: • S + 2 H 2 SO 4 = 2 H 2 O + 3 SO 2. • Разбавленная азотная кислота, соляная кислота без окислителей и серная кислота на холоде с серой во взаимодействие не вступают.

Взаимодействие с солями. Получение тиосульфата. • S + Na 2 SO 3 = (t) Na 2 S 2 O 3 • 4 S (изб. )+ 6 Na. OH → 2 Na 2 S + Na 2 S 2 O 3 + 3 H 2 O • В данной реакции степень окисления +2. Однако, она складывается из двух степеней окисления -2 и +4. • Na 2 S 2 O 3 - тиосульфат натрия. Растворим в воде. Сильный восстановитель. Применяется в медицине.
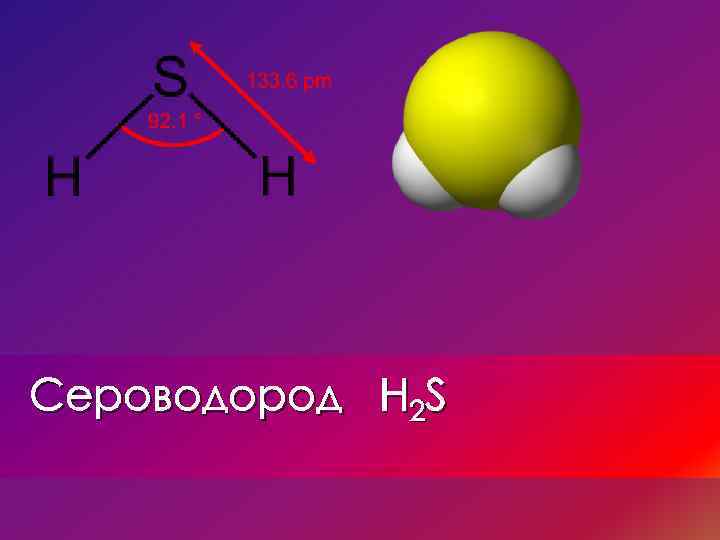
Сероводород H 2 S

Сероводород H 2 S. Получение сероводорода • Бесцветный и очень токсичный газ с запахом тухлых яиц. • Обычно в лабораторных условиях его получают действием разбавленных кислот на сульфиды: • Fe. S + 2 HCl = Fe. Cl 2 + H 2 S • Другой способ получения сероводорода заключается в добавлении холодной воды к сульфиду алюминия: • Al 2 S 3 (тв) + 6 H 2 O(ж) = 2 Al(OH)3 | + 3 H 2 S • Сероводород используют для получения серы, неорганических и органических серосодержащих соединений.

Получение H 2 S

Реакции взаимодействия • H 2 S – ковалентное соединение. Его молекулы имеют изогнутую структуру, подобную структуре воды. Однако, в отличие от воды, молекулы H 2 S не образуют водородных связей. Отсутствие водородных связей в H 2 S объясняет также его плохую растворимость в воде. • H 2 S – типичный восстановитель. В кислороде он сгорает до: • 2 H 2 S + O 2 = 2 S + 2 H 2 O серы или • 2 H 2 S + 3 O 2=2 SO 2+2 H 20 оксида серы (l. V)

Реакции взаимодействия • H 2 S + Na. OH = Na. HS + H 2 O (кислая соль, при соотношении 1: 1) • H 2 S +2 Na. OH = Na 2 S +2 H 2 O (обычная соль при избытке Na. OH) • Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO 42−, например: • 3 H 2 S + 4 HCl. O 3 = 3 H 2 SO 4 + 4 HCl • 2 H 2 S + SO 2 = 2 H 2 O + 3 S

Реакции взаимодействия. Диссоциация • Легко окисляется галогенами: • H 2 S + Br 2 = S | + 2 HBr • Раствор сероводорода в воде – это очень слабая кислота, которая диссоциирует ступенчато: • H 2 S = H+ +HS- (K 1= 6*10 -8) • HS-=H+ + S 2 - (K 2=1*10 -14)

Сероводородная кислота • Сероводородная кислота так же, как и сероводород – типичный восстановитель и окисляется не только сильными окислителями, например хлором: • H 2 S + 4 Cl 2 + 4 H 2 O = H 2 SO 4 + 8 HCl • но и более слабыми, например сернистой кислотой H 2 SO 3 и SO 2: • 2 H 2 S + H 2 SO 3 = 3 S | + 3 H 2 O • или ионами трёхвалентного железа: • 2 Fe. Cl 3 + H 2 S = 2 Fe. Cl 2 + S | + 2 HCl

Сульфиды • Соли сероводорода - сульфиды - малорастворимы в воде для большинства металлов, кроме щелочных и щелочноземельных (последние сильно гидролизуются). Сульфиды обладают характерной окраской: • черные Hg. S, Ag 2 S, Pb. S, Cu. S, Fe. S • оранжевые Sb 2 S 3, Sb 2 S 5 • розовый (телесный) Mn. S • белые Zn. S, Al 2 S 3, Ba. S, Ca. S, K 2 S, Na 2 S Для олимпиады • коричневые Sn. S, Bi 2 S 3 • желтые Sn. S 2, Cd. S, Ti. S 2

Сульфиды. Реакции. • Сероводород и сульфиды - типичные восстановители: 2 H 2 S + 3 O 2 = 2 SO 2 + 2 H 2 O 2 H 2 S + O 2 = 2 S + 2 H 2 O сгорание до SO 2 считается "полным", до S - неполным; последнее используется в процессе десульфурации): 2 Zn. S + O 2 = 2 Zn. O + S • Реакции в водном растворе: а) H 2 S + 2 HNO 3(конц. ) = S↓ + 2 NO 2↑ + 2 H 2 O Mn. S(т) + 8 HNO 3(конц. ) = Mn. SO 4 + 8 NO 2↑ + 4 H 2 O • б) H 2 S + I 2 = S↓ + 2 HI H 2 S + 4 H 2 O + 4 Cl 2 = H 2 SO 4 + 8 HCl • в) 3 H 2 S + 2 KMn. O 4 = 3 S↓ + 2 Mn. O 2↓ + 2 KOH + 2 H 2 O 3 H 2 S + 4 H 2 SO 4 + K 2 Cr 2 O 7 = 3 S↓ + Cr 2(SO 4)3 + 7 H 2 O + K 2 SO 4

Сульфиды. Реакции. • Ag 2 S + O 2 = 2 Ag + SO 2 • Cu. S + O 2 = Cu. O + SO 2

СПАСИБО ЗА ВНИМАНИЕ!

Использованная литература • 1) Видео взяты с сайта You. Tube • 2) Учебник «Начала химии» Н. Е. Кузьменко, В. В. Ерёмин , В. А. Попков. 2010 год. • 3) «Общая и неорганическая химия» Высшая Школа , Н. С. Ахметов. 1998 год (схематические рисунки)