Сера, селен, теллур.pptx
- Количество слайдов: 23
 Сера, селен, теллур.
Сера, селен, теллур.
 Сера, селен и теллур – это элементы главной подгруппы VI группы, члены семейства халькогенов.
Сера, селен и теллур – это элементы главной подгруппы VI группы, члены семейства халькогенов.
 СЕРА Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. Куски самородной серы использовались для совершения обряда изгнания злых духов.
СЕРА Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. Куски самородной серы использовались для совершения обряда изгнания злых духов.
 ТЕЛЛУР В одной из областей Австрии, которая называлась Семигорьем, в XVIII веке была открыта странная руда голубовато- белого цвета.
ТЕЛЛУР В одной из областей Австрии, которая называлась Семигорьем, в XVIII веке была открыта странная руда голубовато- белого цвета.
 СЕЛЕН Селен является одним из элементов, который человек знал еще до его официального открытия. Этот химический элемент очень хорошо маскировался другими химическими элементами, которые по своим характеристикам были похожи на селен. Основными элементами маскирующими его были сера и теллур.
СЕЛЕН Селен является одним из элементов, который человек знал еще до его официального открытия. Этот химический элемент очень хорошо маскировался другими химическими элементами, которые по своим характеристикам были похожи на селен. Основными элементами маскирующими его были сера и теллур.
 ПОЛУЧЕНИЕ Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получении соды Na 2 CO 3 по методу французского химика Н. Леблана сульфида кальция Ca. S. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка Ca. CO 3. Na 2 SO 4 + 2 C = Na 2 S + 2 CO 2; Na 2 S + Ca. CO 3 = Na 2 CO 3 + Ca. S
ПОЛУЧЕНИЕ Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получении соды Na 2 CO 3 по методу французского химика Н. Леблана сульфида кальция Ca. S. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка Ca. CO 3. Na 2 SO 4 + 2 C = Na 2 S + 2 CO 2; Na 2 S + Ca. CO 3 = Na 2 CO 3 + Ca. S
 Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода Ca. S + CO 2 + H 2 O = Ca. CO 3 + H 2 S Образующийся сероводород H 2 S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера 2 H 2 S + O 2 = 2 H 2 O +2 S
Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода Ca. S + CO 2 + H 2 O = Ca. CO 3 + H 2 S Образующийся сероводород H 2 S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера 2 H 2 S + O 2 = 2 H 2 O +2 S
 Селеновая кислота при нагревании с соляной кислотой восстанавливается до селенистой кислоты. Затем через полученный раствор селенистой кислоты пропускают сернистый газ SO 2 H 2 Se. O 3 + 2 SO 2 + H 2 O = Se + 2 H 2 SO 4 Для очистки селен далее сжигают в кислороде, насыщенном парами дымящей азотной кислоты HNO 3. При этом сублимируется чистый диоксид селена Se. O 2. Из раствора Se. O 2 в воде после добавления соляной кислоты селен опять осаждают, пропуская через раствор сернистый газ.
Селеновая кислота при нагревании с соляной кислотой восстанавливается до селенистой кислоты. Затем через полученный раствор селенистой кислоты пропускают сернистый газ SO 2 H 2 Se. O 3 + 2 SO 2 + H 2 O = Se + 2 H 2 SO 4 Для очистки селен далее сжигают в кислороде, насыщенном парами дымящей азотной кислоты HNO 3. При этом сублимируется чистый диоксид селена Se. O 2. Из раствора Se. O 2 в воде после добавления соляной кислоты селен опять осаждают, пропуская через раствор сернистый газ.
 Для выделения Te из шламов используют их спекание с содой с последующим выщелачиванием. Те переходит в щелочной раствор, из которого при нейтрализации он осаждается в виде Te. O 2 Na 2 Te. O 3+2 HC=Te. O 2+2 Na. Cl. Для очистки теллура от S и Se используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2 6 Te+2 Al+8 Na. OH=3 Na 2 Te 2+2 Na[Al(OH)4].
Для выделения Te из шламов используют их спекание с содой с последующим выщелачиванием. Те переходит в щелочной раствор, из которого при нейтрализации он осаждается в виде Te. O 2 Na 2 Te. O 3+2 HC=Te. O 2+2 Na. Cl. Для очистки теллура от S и Se используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2 6 Te+2 Al+8 Na. OH=3 Na 2 Te 2+2 Na[Al(OH)4].
 Для осаждения теллура через раствор пропускают воздух или кислород: 2 Na 2 Te 2+2 H 2 O+O 2=4 Te+4 Na. OH. Для получения теллура особой чистоты его хлорируют: Te+2 Cl 2=Te. Cl 4. Образующийся тетрахлорид очищают дистилляцей или ректификацией. Затем тетрахлорид гидролизуют водой: Te. Cl 4+2 H 2 O=Te. O 2Ї+4 HCl, а образовавшийся Те. О 2 восстанавливают водородом: Te. O 2+4 H 2=Te+2 H 2 O.
Для осаждения теллура через раствор пропускают воздух или кислород: 2 Na 2 Te 2+2 H 2 O+O 2=4 Te+4 Na. OH. Для получения теллура особой чистоты его хлорируют: Te+2 Cl 2=Te. Cl 4. Образующийся тетрахлорид очищают дистилляцей или ректификацией. Затем тетрахлорид гидролизуют водой: Te. Cl 4+2 H 2 O=Te. O 2Ї+4 HCl, а образовавшийся Те. О 2 восстанавливают водородом: Te. O 2+4 H 2=Te+2 H 2 O.
 ФИЗИЧЕСКИЕ СВОЙСТВА
ФИЗИЧЕСКИЕ СВОЙСТВА
 ХИМИЧЕСКИЕ СВОЙСТВА На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом: S + O 2 → SO 2 Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором: S + 3 F 2 → SF 6
ХИМИЧЕСКИЕ СВОЙСТВА На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом: S + O 2 → SO 2 Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором: S + 3 F 2 → SF 6
 Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов 2 S + Cl 2 → S 2 Cl 2 S + Cl 2 → SCl 2 При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P 2 S 5: 5 S + 2 P → P 2 S 2 Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием: S + H 2 → H 2 S (сероводород) C + 2 S → CS 2 (сероуглерод)
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов 2 S + Cl 2 → S 2 Cl 2 S + Cl 2 → SCl 2 При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P 2 S 5: 5 S + 2 P → P 2 S 2 Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием: S + H 2 → H 2 S (сероводород) C + 2 S → CS 2 (сероуглерод)
 Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щелочью , в которой сера диспропорционирует аналогично хлору: 3 S + 6 KOH → K 2 SO 3 + 2 K 2 S + 3 H 2 O С концентрированными кислотами окислителями сера реагирует только при длительном нагревании: S+ 6 HNO 3 (конц) → H 2 SO 4 + 6 NO 2↑ + 2 H 2 O S+ 2 H 2 SO 4 (конц) → 3 SO 2↑ + 2 H 2 O
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щелочью , в которой сера диспропорционирует аналогично хлору: 3 S + 6 KOH → K 2 SO 3 + 2 K 2 S + 3 H 2 O С концентрированными кислотами окислителями сера реагирует только при длительном нагревании: S+ 6 HNO 3 (конц) → H 2 SO 4 + 6 NO 2↑ + 2 H 2 O S+ 2 H 2 SO 4 (конц) → 3 SO 2↑ + 2 H 2 O
 При 100– 160°C окисляется водой: Te+2 H 2 O= Te. O 2+2 H 2 При кипячении в щелочных растворах теллур диспропорционирует с образованием теллурида и теллурита: 8 Te+6 KOH=2 K 2 Te+ K 2 Te. O 3+3 H 2 O.
При 100– 160°C окисляется водой: Te+2 H 2 O= Te. O 2+2 H 2 При кипячении в щелочных растворах теллур диспропорционирует с образованием теллурида и теллурита: 8 Te+6 KOH=2 K 2 Te+ K 2 Te. O 3+3 H 2 O.
 Разбавленная HNO 3 окисляет Te до теллуристой кислоты H 2 Te. O 3: 3 Te+4 HNO 3+H 2 O=3 H 2 Te. O 3+4 NO. Сильные окислители (HCl. O 3, KMn. O 4) окисляют Te до слабой теллуровой кислоты H 6 Te. O 6: Te+HCl. O 3+3 H 2 O=HCl+H 6 Te. O 6. Соединения теллура (+2) неустойчивы и склонны к диспропорционированию: 2 Te. Cl 2=Te. Cl 4+Te.
Разбавленная HNO 3 окисляет Te до теллуристой кислоты H 2 Te. O 3: 3 Te+4 HNO 3+H 2 O=3 H 2 Te. O 3+4 NO. Сильные окислители (HCl. O 3, KMn. O 4) окисляют Te до слабой теллуровой кислоты H 6 Te. O 6: Te+HCl. O 3+3 H 2 O=HCl+H 6 Te. O 6. Соединения теллура (+2) неустойчивы и склонны к диспропорционированию: 2 Te. Cl 2=Te. Cl 4+Te.
 При нагревании на воздухе сгорает с образованием бесцветного кристаллического Se. O 2: Se +O 2 = Se. O 2. С водой взаимодействует при нагревании: 3 Se + 3 H 2 O = 2 H 2 Se + H 2 Se. O 3. Селен реагирует при нагревании с азотной кислотой, с образованием селенистой кислоты H 2 Se. O 3: 3 Se + 4 HNO 3 + H 2 O = 3 H 2 Se. O 3 + 4 NO.
При нагревании на воздухе сгорает с образованием бесцветного кристаллического Se. O 2: Se +O 2 = Se. O 2. С водой взаимодействует при нагревании: 3 Se + 3 H 2 O = 2 H 2 Se + H 2 Se. O 3. Селен реагирует при нагревании с азотной кислотой, с образованием селенистой кислоты H 2 Se. O 3: 3 Se + 4 HNO 3 + H 2 O = 3 H 2 Se. O 3 + 4 NO.
 При кипячении в щелочных растворах селен диспропорционирует: 3 Se + 6 KOH = K 2 Se. O 3 + 2 K 2 Se + 3 H 2 O. Если селен кипятят в щелочном растворе, через который пропускают воздух или кислород, то образуются красно коричневые растворы, содержащие полиселениды: K 2 Se + 3 Se = K 2 Se 4
При кипячении в щелочных растворах селен диспропорционирует: 3 Se + 6 KOH = K 2 Se. O 3 + 2 K 2 Se + 3 H 2 O. Если селен кипятят в щелочном растворе, через который пропускают воздух или кислород, то образуются красно коричневые растворы, содержащие полиселениды: K 2 Se + 3 Se = K 2 Se 4
 Если селен кипятят в щелочном растворе, через который пропускают воздух или кислород, то образуются красно коричневые растворы, содержащие полиселениды: K 2 Se + 3 Se = K 2 Se 4 Селен взамодействует с сульфидами и полисульфидами с образованием тиоселенидов. При нагревании селена с растворами Na 2 SO 3 и KCN протекают реакции: Na 2 SO 3 + Se = Na 2 SSe. O 3; KCN + Se = KSe. CN. Сильные окислители (озон О 3, фтор F 2) окисляют селен до Se+6: Se + O 3 = Se. O 3, Se + 3 F 2 = Se. F 6.
Если селен кипятят в щелочном растворе, через который пропускают воздух или кислород, то образуются красно коричневые растворы, содержащие полиселениды: K 2 Se + 3 Se = K 2 Se 4 Селен взамодействует с сульфидами и полисульфидами с образованием тиоселенидов. При нагревании селена с растворами Na 2 SO 3 и KCN протекают реакции: Na 2 SO 3 + Se = Na 2 SSe. O 3; KCN + Se = KSe. CN. Сильные окислители (озон О 3, фтор F 2) окисляют селен до Se+6: Se + O 3 = Se. O 3, Se + 3 F 2 = Se. F 6.
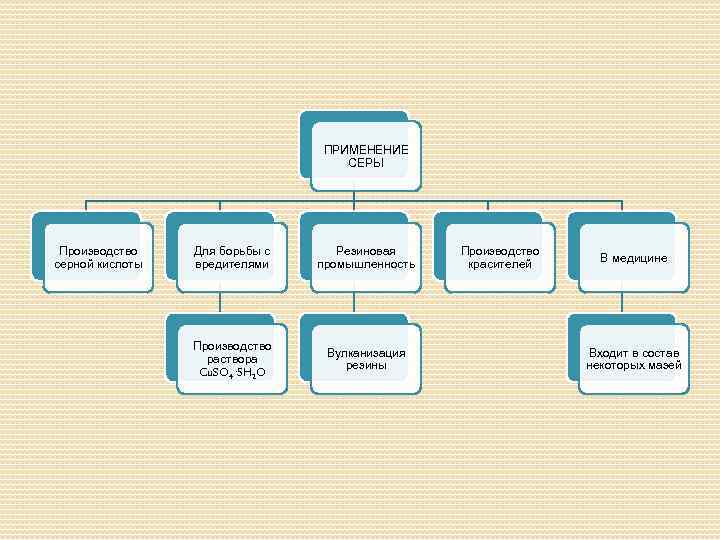 ПРИМЕНЕНИЕ СЕРЫ Производство серной кислоты Для борьбы с вредителями Резиновая промышленность Производство раствора Cu. SO 4· 5 H 2 O Вулканизация резины Производство красителей В медицине Входит в состав некоторых мазей
ПРИМЕНЕНИЕ СЕРЫ Производство серной кислоты Для борьбы с вредителями Резиновая промышленность Производство раствора Cu. SO 4· 5 H 2 O Вулканизация резины Производство красителей В медицине Входит в состав некоторых мазей
 Основное применение Te и его соединений — полупроводниковая техника. Добавки Te в чугун и сталь , свинец или медь повышают их механическую и химическую стойкость. Те и его соединения применяют в производстве катализаторов, специальных стекол, инсектицидов, гербицидов.
Основное применение Te и его соединений — полупроводниковая техника. Добавки Te в чугун и сталь , свинец или медь повышают их механическую и химическую стойкость. Те и его соединения применяют в производстве катализаторов, специальных стекол, инсектицидов, гербицидов.
 Аморфный Se входит в состав светочувствительных слоев в ксерографии и лазерных принтерах. Серый Se применяется в изготовлении диодов, фоторезисторов и др. Селен — пигмент для стекол, присадка к стали, добавка к сере при вулканизации, для получения катализаторов, гербицидов, инсектицидов, лекарственных средств.
Аморфный Se входит в состав светочувствительных слоев в ксерографии и лазерных принтерах. Серый Se применяется в изготовлении диодов, фоторезисторов и др. Селен — пигмент для стекол, присадка к стали, добавка к сере при вулканизации, для получения катализаторов, гербицидов, инсектицидов, лекарственных средств.
 СПАСИБО ЗА ВНИМАНИЕ
СПАСИБО ЗА ВНИМАНИЕ


