Сера, селен и теллур История открытия Сера в














10406-s,se,te.ppt
- Количество слайдов: 17
 Сера, селен и теллур
Сера, селен и теллур
 История открытия Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Точно происхождение серы не установлено, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён. Впервые в литературе он описан у Агриколы. Элементарную природу серы установил А.Л. Лавуазье (1789) в своих опытах по сжиганию и включил ее в список неметаллических простых тел. В 1822 г. Э. Мичерлих обнаружил аллотропию серы. Селен открыт Й. Я. Берцелиусом в 1817. рассказ самого Берцелиуса о том, как произошло это открытие: Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты Теллур впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
История открытия Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Точно происхождение серы не установлено, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён. Впервые в литературе он описан у Агриколы. Элементарную природу серы установил А.Л. Лавуазье (1789) в своих опытах по сжиганию и включил ее в список неметаллических простых тел. В 1822 г. Э. Мичерлих обнаружил аллотропию серы. Селен открыт Й. Я. Берцелиусом в 1817. рассказ самого Берцелиуса о том, как произошло это открытие: Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты Теллур впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.

 Область применения Сера применяется в первую очередь для получения серной кислоты: в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения чёрного (охотничьего) пороха; в производстве спичек. В медицинской практике применение Сера основано на её способности при взаимодействии с органическими веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. kéras — рог и lytikós — растворяющий), противомикробные и противопаразитарные эффекты. Селен потребляется главным образом при изготовлении выпрямителей переменного тока. Теллур применяется в производстве свинцовых кабелей. Добавка его (до 0,1%) к свинцу сильно повышает твердость и эластичность последнего Такой свинец оказывается также более стойким по отношению, к различным химическим воздействиям.
Область применения Сера применяется в первую очередь для получения серной кислоты: в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения чёрного (охотничьего) пороха; в производстве спичек. В медицинской практике применение Сера основано на её способности при взаимодействии с органическими веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. kéras — рог и lytikós — растворяющий), противомикробные и противопаразитарные эффекты. Селен потребляется главным образом при изготовлении выпрямителей переменного тока. Теллур применяется в производстве свинцовых кабелей. Добавка его (до 0,1%) к свинцу сильно повышает твердость и эластичность последнего Такой свинец оказывается также более стойким по отношению, к различным химическим воздействиям.
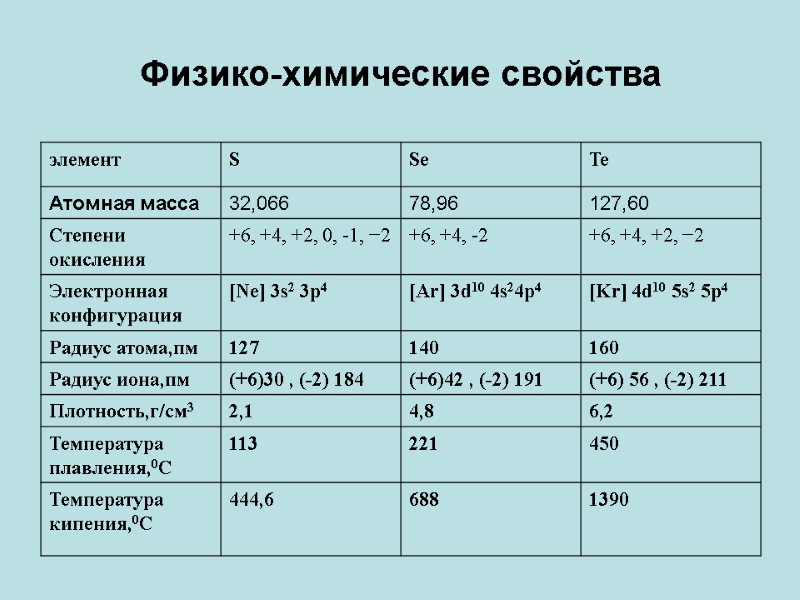
 Физико-химические свойства
Физико-химические свойства
 В обычных условиях сера c кислородом не взаимодействует. Лишь во влажной атмосфере она медленно окисляется кислородом с образованием следовых количеств SO2. Температура воспламенения чистой серы в воздухе находится в пределах 280-360°C. Примеси в сере значительно повышают температуру ее воспламенения. Пары серы, а также серная пыль в смеси с достаточным количеством воздуха, взрывоопасны. Сера горит голубоватым пламенем с образованием диоксида серы. Горение развивается по свободной поверхности при достижении температуры воспламенения. С водородом сера заметно взаимодействует уже при 150-200°C с образованием H2S: S + H2 = H2S. Сера взаимодействует почти со всеми металлами, образуя сульфиды. При комнатной температуре сера соединяется со щелочными и щелочноземельными (Mg, Ca, Sr, Ba) металлами, а также с Cu, Ag, Hg; при нагревании – с Fe, Pb, Sn, Ni, Co, Zn, Mn, Cr, Al. Тугоплавкие металлы и некоторые металлы платиновой группы взаимодействуют с серой при высокой температуре в мелкораздробленном состоянии; некоторые – с парами серы под давлением. Следует отметить, что с ростом температуры активность серы резко возрастает. И дело не только в том, что с ростом температуры возрастает количество молекул, способных преодолеть энергетический барьер реакции – энергию активации.
В обычных условиях сера c кислородом не взаимодействует. Лишь во влажной атмосфере она медленно окисляется кислородом с образованием следовых количеств SO2. Температура воспламенения чистой серы в воздухе находится в пределах 280-360°C. Примеси в сере значительно повышают температуру ее воспламенения. Пары серы, а также серная пыль в смеси с достаточным количеством воздуха, взрывоопасны. Сера горит голубоватым пламенем с образованием диоксида серы. Горение развивается по свободной поверхности при достижении температуры воспламенения. С водородом сера заметно взаимодействует уже при 150-200°C с образованием H2S: S + H2 = H2S. Сера взаимодействует почти со всеми металлами, образуя сульфиды. При комнатной температуре сера соединяется со щелочными и щелочноземельными (Mg, Ca, Sr, Ba) металлами, а также с Cu, Ag, Hg; при нагревании – с Fe, Pb, Sn, Ni, Co, Zn, Mn, Cr, Al. Тугоплавкие металлы и некоторые металлы платиновой группы взаимодействуют с серой при высокой температуре в мелкораздробленном состоянии; некоторые – с парами серы под давлением. Следует отметить, что с ростом температуры активность серы резко возрастает. И дело не только в том, что с ростом температуры возрастает количество молекул, способных преодолеть энергетический барьер реакции – энергию активации.
 Сульфаты и сульфиды являются обычными продуктами высокотемпературных эндогенных процессов, тогда как сульфиты в геологических обстановках, связанных с высокотемпературными эндогенными процессами, практически не встречаются. Скорее всего, это обусловлено тем, что сульфиты являются сильными восстановителями, при первой возможности окисляясь в сульфаты. Кроме того, в высокотемпературных условиях протекает реакция разложения сульфитов с одновременным образованием сульфидов и сульфатов. В состав природных сульфатов входят щелочные (Na, K) и щелочноземельные (Mg, Ca, Sr, Ba) металлы, а также Pb, Cu, Fe, Al. Значительная часть сульфатов – основные и водные соли. В тетраэдрическом анионе [SO4]2– сера находится в высшей степени окисления. Для сульфатов характерен ионный тип связи. В основных и водных сульфатах велика роль водородных связей. Изовалентные и гетеровалентные замещения носят ограниченный характер. Совершенный изоморфизм установлен только между баритом BaSO4 и целестином SrSO4. В барите, кроме того, Ba2+ нередко замещается ионами Pb2+ и Ra2+. Широкие замещения между катионами развиты в водных сульфатах Fe, Cu, Zn. Сера относится к халькофильным и биофильным элементам
Сульфаты и сульфиды являются обычными продуктами высокотемпературных эндогенных процессов, тогда как сульфиты в геологических обстановках, связанных с высокотемпературными эндогенными процессами, практически не встречаются. Скорее всего, это обусловлено тем, что сульфиты являются сильными восстановителями, при первой возможности окисляясь в сульфаты. Кроме того, в высокотемпературных условиях протекает реакция разложения сульфитов с одновременным образованием сульфидов и сульфатов. В состав природных сульфатов входят щелочные (Na, K) и щелочноземельные (Mg, Ca, Sr, Ba) металлы, а также Pb, Cu, Fe, Al. Значительная часть сульфатов – основные и водные соли. В тетраэдрическом анионе [SO4]2– сера находится в высшей степени окисления. Для сульфатов характерен ионный тип связи. В основных и водных сульфатах велика роль водородных связей. Изовалентные и гетеровалентные замещения носят ограниченный характер. Совершенный изоморфизм установлен только между баритом BaSO4 и целестином SrSO4. В барите, кроме того, Ba2+ нередко замещается ионами Pb2+ и Ra2+. Широкие замещения между катионами развиты в водных сульфатах Fe, Cu, Zn. Сера относится к халькофильным и биофильным элементам
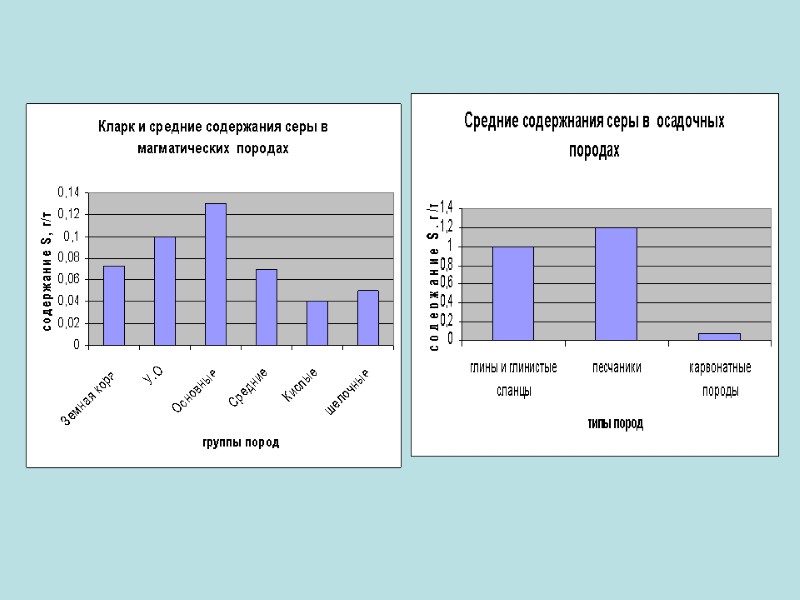
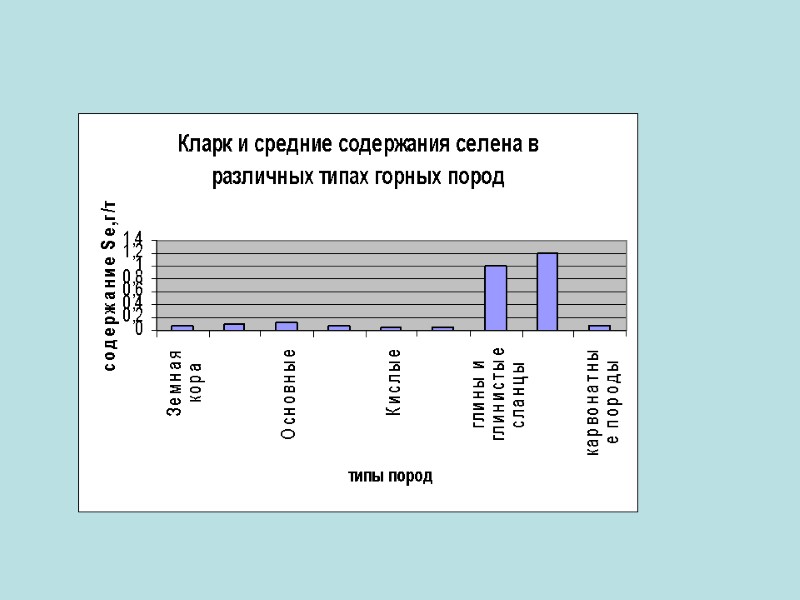
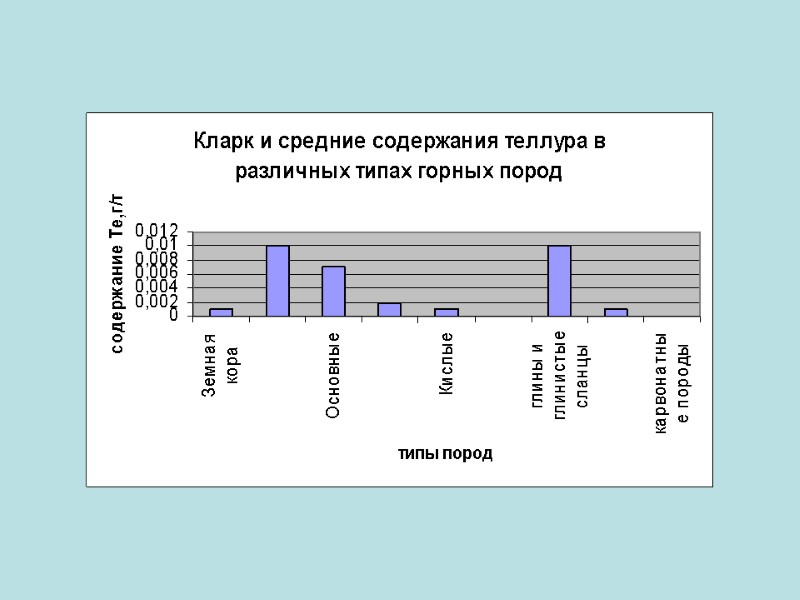
 Распространенность в земной коре Сера является шестнадцатым по химической распространённости элементом в земной коре. В свободном (самородном) состоянии встречается чаще всего сера а селен и теллур изредка. В виде соединении их встречаются на много больше чем в самородном виде.
Распространенность в земной коре Сера является шестнадцатым по химической распространённости элементом в земной коре. В свободном (самородном) состоянии встречается чаще всего сера а селен и теллур изредка. В виде соединении их встречаются на много больше чем в самородном виде.



 Основные минералы-носители элемента Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в минералах (сульфиды - 40 минералов и сульфаты): FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит(стибнит), CaSO4 – ангидрит, BaSO4 - барит, SrSO4 -целестин, PbSO4 –англезит и т.д. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом.
Основные минералы-носители элемента Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в минералах (сульфиды - 40 минералов и сульфаты): FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит(стибнит), CaSO4 – ангидрит, BaSO4 - барит, SrSO4 -целестин, PbSO4 –англезит и т.д. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом.
 Известно около 100 минералов теллура. Наиболее часты теллуриды меди, свинца, цинка, серебра и золота. Изоморфная примесь теллура наблюдается во многих сульфидах, однако изоморфизм Te — S выражен хуже, чем в ряду Se — S, и в сульфиды входит ограниченная примесь теллура. Среди минералов теллура особое значение имеют алтаит PbTe, сильванит AgAuTe4, калаверит AuTe2, гессит Ag2Te, креннерит (Au, Ag)Te, петцит Ag2AuTe2, мутманнит (Ag, Au)Te, монбрейит Au2Te3, нагиагит [Pb5Au(Te, Sb)]4S5, тетрадимит Bi2Te2S. Встречаются кислородные соединения теллура, например ТеО2 — теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
Известно около 100 минералов теллура. Наиболее часты теллуриды меди, свинца, цинка, серебра и золота. Изоморфная примесь теллура наблюдается во многих сульфидах, однако изоморфизм Te — S выражен хуже, чем в ряду Se — S, и в сульфиды входит ограниченная примесь теллура. Среди минералов теллура особое значение имеют алтаит PbTe, сильванит AgAuTe4, калаверит AuTe2, гессит Ag2Te, креннерит (Au, Ag)Te, петцит Ag2AuTe2, мутманнит (Ag, Au)Te, монбрейит Au2Te3, нагиагит [Pb5Au(Te, Sb)]4S5, тетрадимит Bi2Te2S. Встречаются кислородные соединения теллура, например ТеО2 — теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
 Формы нахождения и поведение в водной и воздушной средах,участие в биологическом круговороте Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе. Человек содержит примерно 2 г серы на 1 кг своего веса. Концентрация селена в морской воде 4×10-4 мг/л. Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина.Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях. Микроколичества теллура всегда содержатся в живых организмах, его биологическая роль не выяснена. Теллур и его летучие соединения токсичны
Формы нахождения и поведение в водной и воздушной средах,участие в биологическом круговороте Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе. Человек содержит примерно 2 г серы на 1 кг своего веса. Концентрация селена в морской воде 4×10-4 мг/л. Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина.Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях. Микроколичества теллура всегда содержатся в живых организмах, его биологическая роль не выяснена. Теллур и его летучие соединения токсичны
 месторождение Самородная сера встречается в верхней земной коры и на её поверхности при разложении сернистых соединении металлов и гипсоносных осадочных толщ. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Большая часть упомянутых минералов теллура развита в низкотемпературных золото-серебряных месторождениях, где они обычно выделяются после основной массы сульфидов совместно с самородным золотом, сульфосолями серебра, свинца, а также с минералами висмута. Несмотря на развитие большого числа теллуровых минералов, главная масса теллура, извлекаемого промышленностью, входит в состав сульфидов других металлов. В частности, теллур в несколько меньшей степени, чем селен, входит в состав халькопирита медно-никелевых месторождений магматического происхождения, а также халькопирита, развитого в медноколчеданных гидротермальных месторождениях. Теллур находится также в составе пирита, халькопирита, молибденита и галенита месторождений порфировых медных руд, полиметаллических месторождений алтайского типа, галенита свинцово-цинковых месторождений, связанных со скарнами, сульфидно-кобальтовых, сурьмяно-ртутных и некоторых других. Содержание теллура в молибдените колеблется в пределах 8 — 53 г/т, в халькопирите 9 — 31 г/т, в пирите до 70 г/т.
месторождение Самородная сера встречается в верхней земной коры и на её поверхности при разложении сернистых соединении металлов и гипсоносных осадочных толщ. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Большая часть упомянутых минералов теллура развита в низкотемпературных золото-серебряных месторождениях, где они обычно выделяются после основной массы сульфидов совместно с самородным золотом, сульфосолями серебра, свинца, а также с минералами висмута. Несмотря на развитие большого числа теллуровых минералов, главная масса теллура, извлекаемого промышленностью, входит в состав сульфидов других металлов. В частности, теллур в несколько меньшей степени, чем селен, входит в состав халькопирита медно-никелевых месторождений магматического происхождения, а также халькопирита, развитого в медноколчеданных гидротермальных месторождениях. Теллур находится также в составе пирита, халькопирита, молибденита и галенита месторождений порфировых медных руд, полиметаллических месторождений алтайского типа, галенита свинцово-цинковых месторождений, связанных со скарнами, сульфидно-кобальтовых, сурьмяно-ртутных и некоторых других. Содержание теллура в молибдените колеблется в пределах 8 — 53 г/т, в халькопирите 9 — 31 г/т, в пирите до 70 г/т.

 Спасибо за внимание
Спасибо за внимание

