Сера и ее соединения мини.pptx
- Количество слайдов: 17
 Сера–S или S 8 и ее соединения
Сера–S или S 8 и ее соединения
 Сера –S 3 s 3 p 3 d Сера расположена в VIA группе, в 3 -м периоде Сера состоит из четырех стабильных изотопов: 32 S , 33 S , 34 S , 36 S 3 s 23 p 4 Возможные степени окисления: -2, 0, +2, +4, +6 Электронная конфигурация Характерная валентность: II, IV, VI
Сера –S 3 s 3 p 3 d Сера расположена в VIA группе, в 3 -м периоде Сера состоит из четырех стабильных изотопов: 32 S , 33 S , 34 S , 36 S 3 s 23 p 4 Возможные степени окисления: -2, 0, +2, +4, +6 Электронная конфигурация Характерная валентность: II, IV, VI
 Физические свойства Твердое кристаллическое вещество желтого цвета, хрупкое, нерастворима в воде и не смачивается водой (плавает на поверхности), плохо проводит тепло и ток. Аллотропные модификации: моноклинная, ромбическая, пластическая
Физические свойства Твердое кристаллическое вещество желтого цвета, хрупкое, нерастворима в воде и не смачивается водой (плавает на поверхности), плохо проводит тепло и ток. Аллотропные модификации: моноклинная, ромбическая, пластическая
 Химические свойства: Сера химически активна за исключением N 2, I 2, Au, Pt и инертных газов. Сера реагирует с Na + S = Na 2 S металлами (кроме Au, Pt): Al + S = Al S (t°) 2 3 С неметаллами H 2 + S = H 2 S обратимая реакция P + S = P 2 S 3 S + O 2 = SO 2 сернистый газ (t°) S + Cl 2 = SCl 2 S + F 2 = SF 6 S + C = CS 2 c кислотами S + H 2 SO 4 (конц) = SO 2 + H 2 O S + HNO 3 (конц) = H 2 SO 4 + NO 2 + H 2 O S + HNO 3 (разб) = H 2 SO 4 + NO + H 2 O со щелочами S + KOH = K 2 SO 3 + K 2 S + H 2 O с водой при о. у. не взаимодействует Сера – окислитель Сера – восстановитель
Химические свойства: Сера химически активна за исключением N 2, I 2, Au, Pt и инертных газов. Сера реагирует с Na + S = Na 2 S металлами (кроме Au, Pt): Al + S = Al S (t°) 2 3 С неметаллами H 2 + S = H 2 S обратимая реакция P + S = P 2 S 3 S + O 2 = SO 2 сернистый газ (t°) S + Cl 2 = SCl 2 S + F 2 = SF 6 S + C = CS 2 c кислотами S + H 2 SO 4 (конц) = SO 2 + H 2 O S + HNO 3 (конц) = H 2 SO 4 + NO 2 + H 2 O S + HNO 3 (разб) = H 2 SO 4 + NO + H 2 O со щелочами S + KOH = K 2 SO 3 + K 2 S + H 2 O с водой при о. у. не взаимодействует Сера – окислитель Сера – восстановитель
 Сероводород и сульфиды
Сероводород и сульфиды
 Строение молекулы H S H Ковалентная полярная связь ФИЗИЧЕСКИЕ СВОЙСТВА ПОЛУЧЕНИЕ H 2+S→H 2 S
Строение молекулы H S H Ковалентная полярная связь ФИЗИЧЕСКИЕ СВОЙСТВА ПОЛУЧЕНИЕ H 2+S→H 2 S
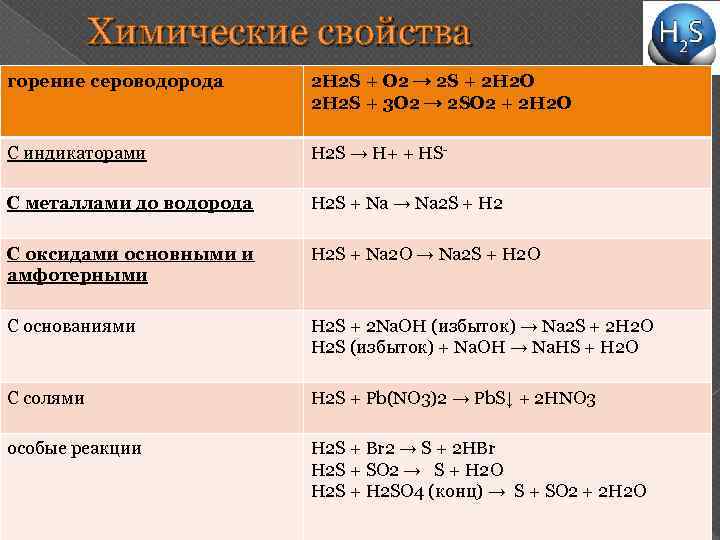 Химические свойства горение сероводорода 2 H 2 S + O 2 → 2 S + 2 H 2 O 2 H 2 S + 3 O 2 → 2 SO 2 + 2 H 2 O С индикаторами H 2 S → H+ + HS- С металлами до водорода H 2 S + Na → Na 2 S + H 2 С оксидами основными и амфотерными H 2 S + Na 2 O → Na 2 S + H 2 O С основаниями H 2 S + 2 Na. OH (избыток) → Na 2 S + 2 H 2 O H 2 S (избыток) + Na. OH → Na. НS + H 2 O С солями H 2 S + Pb(NO 3)2 → Pb. S↓ + 2 HNO 3 особые реакции H 2 S + Br 2 → S + 2 HBr H 2 S + SO 2 → S + H 2 O H 2 S + H 2 SO 4 (конц) → S + SO 2 + 2 H 2 O
Химические свойства горение сероводорода 2 H 2 S + O 2 → 2 S + 2 H 2 O 2 H 2 S + 3 O 2 → 2 SO 2 + 2 H 2 O С индикаторами H 2 S → H+ + HS- С металлами до водорода H 2 S + Na → Na 2 S + H 2 С оксидами основными и амфотерными H 2 S + Na 2 O → Na 2 S + H 2 O С основаниями H 2 S + 2 Na. OH (избыток) → Na 2 S + 2 H 2 O H 2 S (избыток) + Na. OH → Na. НS + H 2 O С солями H 2 S + Pb(NO 3)2 → Pb. S↓ + 2 HNO 3 особые реакции H 2 S + Br 2 → S + 2 HBr H 2 S + SO 2 → S + H 2 O H 2 S + H 2 SO 4 (конц) → S + SO 2 + 2 H 2 O
 Кислородсодержащие соединения серы
Кислородсодержащие соединения серы
 Оксиды серы Оксид серы (IV) диоксид серы, сернистый газ, Оксид серы (VI) триоксид серы, серный газ, серный ангидрид сернистый ангидрид Строение молекулы Ковалентная полярная связь, молекулярная кр. решётка бесцветный газ с характерным резким удушливым запахом хорошо растворяется в воде с образованием нестойкой сернистой кислоты; ядовит; Zn. S + O 2 = Zn. O + SO 2 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + 8 SO 2 пирит легколетучая бесцветная жидкость с удушающим запахом; гигроскопичен, Ядовит, Мало растворим в воде, проявляет свойствами сильного окислителя. 2 SO 2 + O 2 2 SO 3
Оксиды серы Оксид серы (IV) диоксид серы, сернистый газ, Оксид серы (VI) триоксид серы, серный газ, серный ангидрид сернистый ангидрид Строение молекулы Ковалентная полярная связь, молекулярная кр. решётка бесцветный газ с характерным резким удушливым запахом хорошо растворяется в воде с образованием нестойкой сернистой кислоты; ядовит; Zn. S + O 2 = Zn. O + SO 2 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + 8 SO 2 пирит легколетучая бесцветная жидкость с удушающим запахом; гигроскопичен, Ядовит, Мало растворим в воде, проявляет свойствами сильного окислителя. 2 SO 2 + O 2 2 SO 3
 Оксид серы (IV) Оксид серы (VI) Химические свойства. Проявляют свойства типичного кислотного оксида: + вода → + основный оксид, амфотерный оксид + щелочь = (две соли) + своя соль Проявляет как свойства окислителя, так и восстановителя: 1) Проявляет только свойства окислителя: 3 SO 3 + H 2 S → 4 SO 2 + H 2 O SO 2 + 2 H 2 S = 3 S + 2 H 2 O 2) Растворяется в 100%-й серной кислоте, образуя олеум: H 2 SO 4 (100 %) + SO 3 → H 2 S 2 O 7 олеум
Оксид серы (IV) Оксид серы (VI) Химические свойства. Проявляют свойства типичного кислотного оксида: + вода → + основный оксид, амфотерный оксид + щелочь = (две соли) + своя соль Проявляет как свойства окислителя, так и восстановителя: 1) Проявляет только свойства окислителя: 3 SO 3 + H 2 S → 4 SO 2 + H 2 O SO 2 + 2 H 2 S = 3 S + 2 H 2 O 2) Растворяется в 100%-й серной кислоте, образуя олеум: H 2 SO 4 (100 %) + SO 3 → H 2 S 2 O 7 олеум
 SO 2 химические свойства Водой SO 2+H 2 O=H 2 SO 3 Основными оксидами SO 2+Na 2 O=Na 2 SO 3 Амфотерными оксидами SO 2 + Fe 2 O 3=Fe 2(SO 3) 3 Co щелочами SO 2+Na. OH=Na 2 SO 3+H 2 O SO 2+Na. OH=Na. HSO 3+H 2 O с сульфитами образуя кислые соли Na 2 SO 3 +SO 2+H 2 O → 2 Na. HSO 3 окисление 2 SO 2 + O 2→ 2 SO 3 t 450
SO 2 химические свойства Водой SO 2+H 2 O=H 2 SO 3 Основными оксидами SO 2+Na 2 O=Na 2 SO 3 Амфотерными оксидами SO 2 + Fe 2 O 3=Fe 2(SO 3) 3 Co щелочами SO 2+Na. OH=Na 2 SO 3+H 2 O SO 2+Na. OH=Na. HSO 3+H 2 O с сульфитами образуя кислые соли Na 2 SO 3 +SO 2+H 2 O → 2 Na. HSO 3 окисление 2 SO 2 + O 2→ 2 SO 3 t 450
 SO 3 химические свойства С Основными оксидами SO 3 + Na 2 O = Na 2 SO 4 С Амфотерными оксидами Zn. O + SO 3 = Zn. SO 4 С Водой SO 3 + H 2 O = H 2 SO 4 С Основаниями 2 KOH + SO 3 → K 2 SO 4 + H 2 O KOH + SO 3 (изб) → KHSO 4 Взаимодействует с сульфатами образуя Na 2 SO 4 + SO 3 + H 2 O → 2 Na. HSO 4 кислые соли
SO 3 химические свойства С Основными оксидами SO 3 + Na 2 O = Na 2 SO 4 С Амфотерными оксидами Zn. O + SO 3 = Zn. SO 4 С Водой SO 3 + H 2 O = H 2 SO 4 С Основаниями 2 KOH + SO 3 → K 2 SO 4 + H 2 O KOH + SO 3 (изб) → KHSO 4 Взаимодействует с сульфатами образуя Na 2 SO 4 + SO 3 + H 2 O → 2 Na. HSO 4 кислые соли
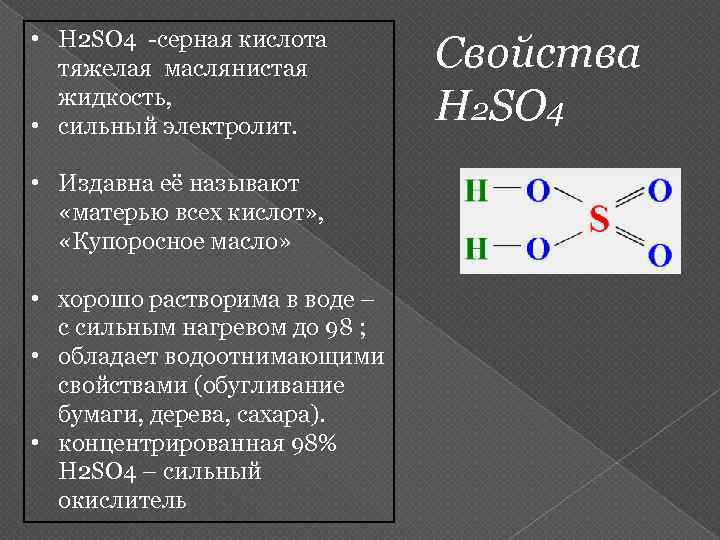 • H 2 SO 4 -серная кислота тяжелая маслянистая жидкость, • сильный электролит. • Издавна её называют «матерью всех кислот» , «Купоросное масло» • хорошо растворима в воде – с сильным нагревом до 98 ; • обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара). • концентрированная 98% H 2 SO 4 – сильный окислитель Свойства H 2 SO 4
• H 2 SO 4 -серная кислота тяжелая маслянистая жидкость, • сильный электролит. • Издавна её называют «матерью всех кислот» , «Купоросное масло» • хорошо растворима в воде – с сильным нагревом до 98 ; • обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара). • концентрированная 98% H 2 SO 4 – сильный окислитель Свойства H 2 SO 4
 Разбавление серной кислоты водой С давних пор существует строгое правило: «Сначала вода, потом кислота, иначе случится большая беда!» Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду. Никогда не добавляйте воду в кислоту
Разбавление серной кислоты водой С давних пор существует строгое правило: «Сначала вода, потом кислота, иначе случится большая беда!» Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду. Никогда не добавляйте воду в кислоту
 Получение 1 -я стадия. Обжиг пирита (серного колчедана) 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 + Q Процесс гетерогенный: 800 о. С 1) измельчение железного колчедана (пирита) 2) метод "кипящего слоя « 2 -я стадия. Окисление сернистого газа. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V 2 O 5): 2 SO 2 + O 2 ⇄ 2 SO 3 + Q 3 -я стадия. Поглощение серного ангидрида. Поглотительная башня: n. SO 3 + H 2 SO 4(конц) = (H 2 SO 4 • n. SO 3)(олеум) Воду использовать нельзя из-за образования тумана.
Получение 1 -я стадия. Обжиг пирита (серного колчедана) 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 + Q Процесс гетерогенный: 800 о. С 1) измельчение железного колчедана (пирита) 2) метод "кипящего слоя « 2 -я стадия. Окисление сернистого газа. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V 2 O 5): 2 SO 2 + O 2 ⇄ 2 SO 3 + Q 3 -я стадия. Поглощение серного ангидрида. Поглотительная башня: n. SO 3 + H 2 SO 4(конц) = (H 2 SO 4 • n. SO 3)(олеум) Воду использовать нельзя из-за образования тумана.
 Химические свойства 1. Индикатор -лакмус(красный), Диссоциация ступенчатая H 2 SO 4 → H+ + HSO 4 - (α =1) HSO 4 - ⇄ H+ + SO 42 - (α<1) метилоранж(красный) , фенолфтал. (б/ц) 2. С основными и амфотерными оксидами Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Al 2 O 3 +3 H 2 SO 4 = Al 2(SO 4)3 +3 Н 2 О 3. С основаниями H 2 SO 4 + 2 Na. OH = Na 2 SO 4 + 2 H 2 O H 2 SO 4 изб. + КОН = KHSO 4 + H 2 O 4. С солями, если образуется осадок, газ или вода. СО 3 + H 2 SO 4 = Са. SO 4 + CO 2 + H 2 O Ba. Cl 2 + H 2 SO 4 = Ba. SO 4 + 2 HCl качественная реакция на серную кислоту. Образуется белый осадок Ba. SO 4
Химические свойства 1. Индикатор -лакмус(красный), Диссоциация ступенчатая H 2 SO 4 → H+ + HSO 4 - (α =1) HSO 4 - ⇄ H+ + SO 42 - (α<1) метилоранж(красный) , фенолфтал. (б/ц) 2. С основными и амфотерными оксидами Cu. O + H 2 SO 4 = Cu. SO 4 + H 2 O Al 2 O 3 +3 H 2 SO 4 = Al 2(SO 4)3 +3 Н 2 О 3. С основаниями H 2 SO 4 + 2 Na. OH = Na 2 SO 4 + 2 H 2 O H 2 SO 4 изб. + КОН = KHSO 4 + H 2 O 4. С солями, если образуется осадок, газ или вода. СО 3 + H 2 SO 4 = Са. SO 4 + CO 2 + H 2 O Ba. Cl 2 + H 2 SO 4 = Ba. SO 4 + 2 HCl качественная реакция на серную кислоту. Образуется белый осадок Ba. SO 4
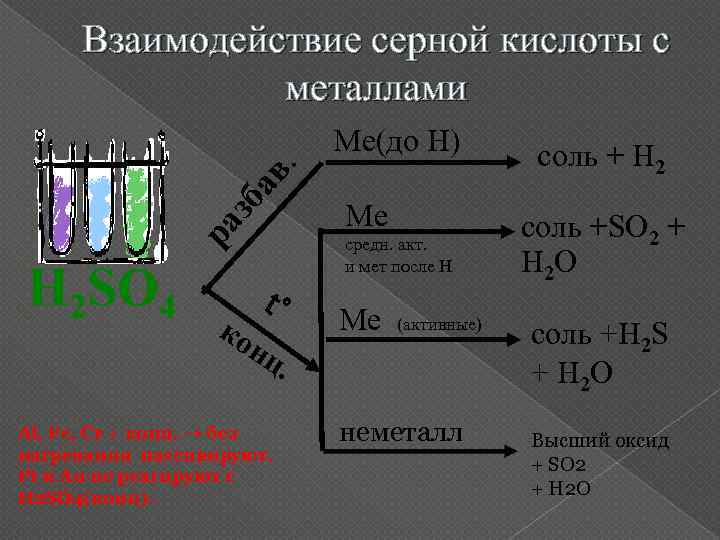 Взаимодействие серной кислоты с металлами ра зб ав . Ме(до Н) H 2 SO 4 Ме t° Ме ко нц средн. акт. и мет после Н (активные) . Al, Fe, Cr + конц. → без нагревания пассивируют. Pt и Au не реагируют с H 2 SO 4(конц). неметалл соль + Н 2 соль +SO 2 + H 2 O соль +H 2 S + H 2 O Высший оксид + SO 2 + H 2 O
Взаимодействие серной кислоты с металлами ра зб ав . Ме(до Н) H 2 SO 4 Ме t° Ме ко нц средн. акт. и мет после Н (активные) . Al, Fe, Cr + конц. → без нагревания пассивируют. Pt и Au не реагируют с H 2 SO 4(конц). неметалл соль + Н 2 соль +SO 2 + H 2 O соль +H 2 S + H 2 O Высший оксид + SO 2 + H 2 O


