sera.pptx
- Количество слайдов: 15
 Сера S элемент главной подгруппы шестой группы третьего периода периодической системы химических элементов Д. И. Менделеева с порядковым номером 16
Сера S элемент главной подгруппы шестой группы третьего периода периодической системы химических элементов Д. И. Менделеева с порядковым номером 16
 Во внешнем электронной оболочке содержатся шесть электронов 2 на s-орибитали 4 на p-орибитали 1 s 22 p 63 s 23 p 4 Заряд ядра +16 Число неспаренных электронов может быть увеличено путем перевода s- и pэлектронов на d-подуровень внешнего слоя.
Во внешнем электронной оболочке содержатся шесть электронов 2 на s-орибитали 4 на p-орибитали 1 s 22 p 63 s 23 p 4 Заряд ядра +16 Число неспаренных электронов может быть увеличено путем перевода s- и pэлектронов на d-подуровень внешнего слоя.
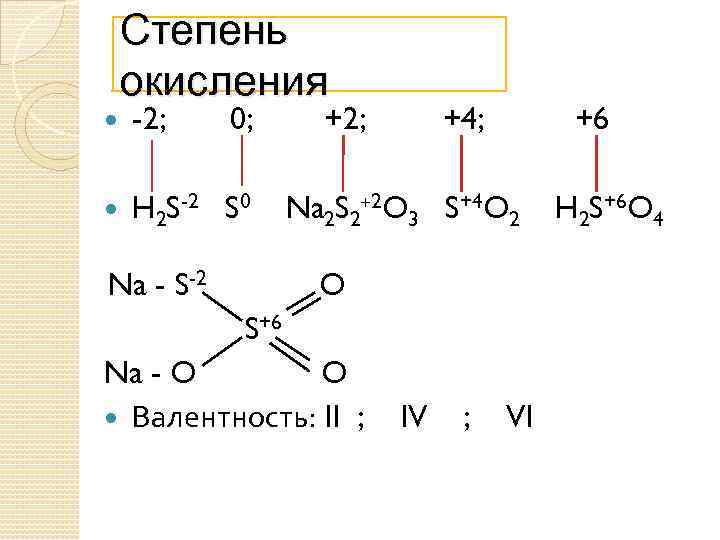 Степень окисления -2; 0; H 2 S-2 S 0 Na - S-2 +2; +4; +6 Na 2 S 2+2 O 3 S+4 O 2 O S+6 Na - O O Валентность: II ; IV ; VI H 2 S+6 O 4
Степень окисления -2; 0; H 2 S-2 S 0 Na - S-2 +2; +4; +6 Na 2 S 2+2 O 3 S+4 O 2 O S+6 Na - O O Валентность: II ; IV ; VI H 2 S+6 O 4
 Нахождение серы в природе v. Cамородная сера v. Сульфидная сера : Халькоцирит(Cu. Fe. S 2); Сфалерит(Zn. S) v. Сульфатная сера : Гипс ( Ca. SO 4 * 2 H 2 O)
Нахождение серы в природе v. Cамородная сера v. Сульфидная сера : Халькоцирит(Cu. Fe. S 2); Сфалерит(Zn. S) v. Сульфатная сера : Гипс ( Ca. SO 4 * 2 H 2 O)
 Химические свойства Ø Взаимодействие с металлами. Образует сульфиды и выступает в роли окислителя q Со Щелочными металлами (без нагревания) S + 2 Na = Na 2 S Но при условии: В расплав серы медленно прибавить натрий и перемешать: S + Na = Na 2 S 2 S + 2 K = K 2 S q С остальными металлами (повышенная t) Fe + S t Fe. S Zn + S t Zn. S 2 Al + 3 S t Al 2 S 3 НЕ реагирует с Au , Pt q
Химические свойства Ø Взаимодействие с металлами. Образует сульфиды и выступает в роли окислителя q Со Щелочными металлами (без нагревания) S + 2 Na = Na 2 S Но при условии: В расплав серы медленно прибавить натрий и перемешать: S + Na = Na 2 S 2 S + 2 K = K 2 S q С остальными металлами (повышенная t) Fe + S t Fe. S Zn + S t Zn. S 2 Al + 3 S t Al 2 S 3 НЕ реагирует с Au , Pt q
 Взаимодействие с неметаллами q Образует бинарные соединения ( проявляет окислительные свойства) H 2 + S = H 2 S 2 P + 3 S = P 2 S 3 C + 2 S =CS 2 q С кислородом (S- восстановитель) S + O 2 t SO 2 S + O 3 = SO 3 С галогенами S + Cl 2 t S 2 Cl 2 S + 3 F 2 = SF 6 ( комнатная t ) q НЕ реагирует с I 2
Взаимодействие с неметаллами q Образует бинарные соединения ( проявляет окислительные свойства) H 2 + S = H 2 S 2 P + 3 S = P 2 S 3 C + 2 S =CS 2 q С кислородом (S- восстановитель) S + O 2 t SO 2 S + O 3 = SO 3 С галогенами S + Cl 2 t S 2 Cl 2 S + 3 F 2 = SF 6 ( комнатная t ) q НЕ реагирует с I 2
 q Взаимодействие серы с концентрированной кислотами- окислителями S + 6 HNO 3 = H 2 SO 4 + 6 NO 2 + 2 H 2 O S + 2 H 2 SO 4 = 3 SO 2 + 2 H 2 O q Взаимодействие с бертолетовой солью(выше 130 o ) 3 S+ 2 KCl. O 3 = 2 KCl + 3 SO 2 Реакция диспропорционирования: 3 S + 6 KOH = K 2 SO 3 + 2 K 2 S + 3 H 2 O q q Сера растворяется в концентрированном растворе сульфита натрия S + Na 2 SO 3 = Na 2 S 2 O 3 (тиосульфат натрия)
q Взаимодействие серы с концентрированной кислотами- окислителями S + 6 HNO 3 = H 2 SO 4 + 6 NO 2 + 2 H 2 O S + 2 H 2 SO 4 = 3 SO 2 + 2 H 2 O q Взаимодействие с бертолетовой солью(выше 130 o ) 3 S+ 2 KCl. O 3 = 2 KCl + 3 SO 2 Реакция диспропорционирования: 3 S + 6 KOH = K 2 SO 3 + 2 K 2 S + 3 H 2 O q q Сера растворяется в концентрированном растворе сульфита натрия S + Na 2 SO 3 = Na 2 S 2 O 3 (тиосульфат натрия)
 Ø Некоторые свойства v Взаимодействие с кислотами v Na 2 SO 3 + 2 HCl = 2 Na. Cl + SO 2 + H 2 O ОВР 3 Na 2 SO 3 + 2 KMn. O 4 + H 2 O = 3 Na 2 SO 4 + 2 Mn. O 2 + 2 KOH 3 Na 2 SO 3+K 2 Cr 2 O 7+4 H 2 SO 4=3 Na 2 SO 4+Cr 2(SO 4)3+ K 2 SO 4+4 H 2 O
Ø Некоторые свойства v Взаимодействие с кислотами v Na 2 SO 3 + 2 HCl = 2 Na. Cl + SO 2 + H 2 O ОВР 3 Na 2 SO 3 + 2 KMn. O 4 + H 2 O = 3 Na 2 SO 4 + 2 Mn. O 2 + 2 KOH 3 Na 2 SO 3+K 2 Cr 2 O 7+4 H 2 SO 4=3 Na 2 SO 4+Cr 2(SO 4)3+ K 2 SO 4+4 H 2 O
 H 2 S cероводород Сероводород - бесцветный газ с характерным запахом гниющего белка(запах тухлых яиц). Он немного тяжелее воздуха, сжижается при -60, 30 С. Легко воспламеняется: смесь с воздухом взрывается. Сероводород очень ядовит.
H 2 S cероводород Сероводород - бесцветный газ с характерным запахом гниющего белка(запах тухлых яиц). Он немного тяжелее воздуха, сжижается при -60, 30 С. Легко воспламеняется: смесь с воздухом взрывается. Сероводород очень ядовит.
 Получение При высокой температуре сера взаимодействует с водородом, образуя газ сероводород S + H 2 = H 2 S Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы , например на сульфид железа: Fe. S + 2 HCl = Fe. Cl 2 + H 2 S
Получение При высокой температуре сера взаимодействует с водородом, образуя газ сероводород S + H 2 = H 2 S Практически сероводород обычно получают действием разбавленных кислот на сернистые металлы , например на сульфид железа: Fe. S + 2 HCl = Fe. Cl 2 + H 2 S
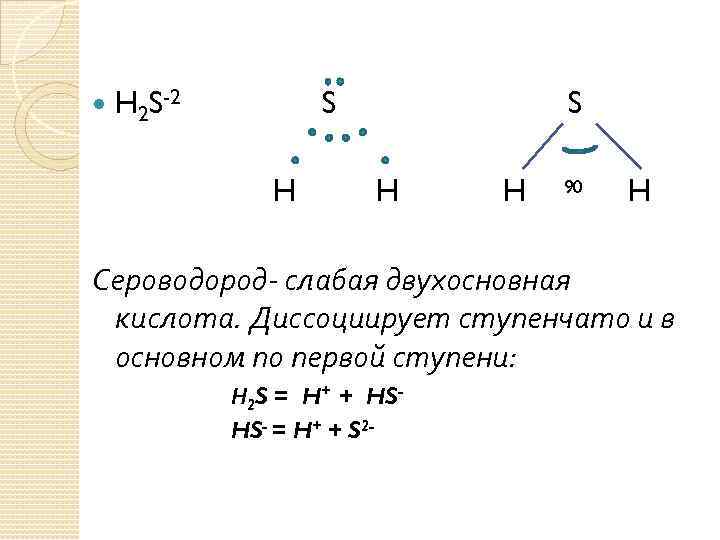 H 2 S-2 S H H 90 H Сероводород- слабая двухосновная кислота. Диссоциирует ступенчато и в основном по первой ступени: Н 2 S = H+ + HSHS- = H+ + S 2 -
H 2 S-2 S H H 90 H Сероводород- слабая двухосновная кислота. Диссоциирует ступенчато и в основном по первой ступени: Н 2 S = H+ + HSHS- = H+ + S 2 -
 Химические свойства ü Взаимодействие с металлами Реагируют все металлы до H 2 H 2 S + 2 Na = 2 Na. HS+ H 2 НО Реагирует с Ag 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S + 2 H 2 O (серебро чернеет) Взаимодействие с O 2 2 Н 2 S + 3 O 2(изб) t 2 H 2 O + 2 SO 2 2 Н 2 S + O 2(нед) t 2 H 2 O + 2 S ü Взаимодействие с галогенами H 2 S + 4 Cl 2 + 4 H 2 O = H 2 SO 4 + 8 HCl H 2 S + Br 2 t S + 2 HBr H 2 S + Cl 2 t S + 2 HCl
Химические свойства ü Взаимодействие с металлами Реагируют все металлы до H 2 H 2 S + 2 Na = 2 Na. HS+ H 2 НО Реагирует с Ag 4 Ag + 2 H 2 S + O 2 = 2 Ag 2 S + 2 H 2 O (серебро чернеет) Взаимодействие с O 2 2 Н 2 S + 3 O 2(изб) t 2 H 2 O + 2 SO 2 2 Н 2 S + O 2(нед) t 2 H 2 O + 2 S ü Взаимодействие с галогенами H 2 S + 4 Cl 2 + 4 H 2 O = H 2 SO 4 + 8 HCl H 2 S + Br 2 t S + 2 HBr H 2 S + Cl 2 t S + 2 HCl
 ü Взаимодействие с солями H 2 S + 2 Fe. Cl 3 = 2 Fe. Cl 2 + S +2 HCl ( ОВР) Cu. SO 4 + H 2 S = Cu. S + H 2 SO 4 (не ОВР, искл. Ag , Pb) ü Разрушает Cu, Ag, Pb комплексы 2[Ag(NH 3)2]OH + 5 H 2 S = Ag 2 S + 4 NH 4 HS + 2 H 2 O [Cu(NH 3)4](OH)2 + 5 H 2 S = Cu. S + 2 NH 4 HS + 2 H 2 O ü Взаимодействие с кислотами H 2 S(изб) + H 2 SO 4(конц) = S(тверд. ) + SO 2 +2 H 2 O H 2 S + H 2 SO 4(конц) t 4 SO 2 + 2 H 2 O также с HNO 3 c образованием NO(при t) и NO 2 (комнатная t) 5 H 2 S + 2 KMn. O 4 + 3 H 2 SO 4 = 5 S + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O
ü Взаимодействие с солями H 2 S + 2 Fe. Cl 3 = 2 Fe. Cl 2 + S +2 HCl ( ОВР) Cu. SO 4 + H 2 S = Cu. S + H 2 SO 4 (не ОВР, искл. Ag , Pb) ü Разрушает Cu, Ag, Pb комплексы 2[Ag(NH 3)2]OH + 5 H 2 S = Ag 2 S + 4 NH 4 HS + 2 H 2 O [Cu(NH 3)4](OH)2 + 5 H 2 S = Cu. S + 2 NH 4 HS + 2 H 2 O ü Взаимодействие с кислотами H 2 S(изб) + H 2 SO 4(конц) = S(тверд. ) + SO 2 +2 H 2 O H 2 S + H 2 SO 4(конц) t 4 SO 2 + 2 H 2 O также с HNO 3 c образованием NO(при t) и NO 2 (комнатная t) 5 H 2 S + 2 KMn. O 4 + 3 H 2 SO 4 = 5 S + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O
 Разложение сульфатов v Соли щелочных металлов плавятся без разложения 2 Cu. SO 4 650 2 Cu. O + 2 SO 2 + O 2 2 Fe 2(SO 4)3 1000 2 Fe 2 O 3 +6 SO 2 + 3 O 2 Ca. SO 4 = Ca 0 + SO 3
Разложение сульфатов v Соли щелочных металлов плавятся без разложения 2 Cu. SO 4 650 2 Cu. O + 2 SO 2 + O 2 2 Fe 2(SO 4)3 1000 2 Fe 2 O 3 +6 SO 2 + 3 O 2 Ca. SO 4 = Ca 0 + SO 3


