Хорошилов.ppt
- Количество слайдов: 104
 Сепсис-ассоциированное острое почечное повреждение : понятие, патофизиология и принципы лечения Хорошилов Сергей Евгеньевич Научно-исследовательский институт ОБЩЕЙ РЕАНИМАТОЛОГИИ РАМН доктор медицинских наук заведующий отделением гемодиализа ГВКГ им. Бурденко ведущий научный сотрудник НИИ Общей реаниматологии им. В. А Неговского РАМН
Сепсис-ассоциированное острое почечное повреждение : понятие, патофизиология и принципы лечения Хорошилов Сергей Евгеньевич Научно-исследовательский институт ОБЩЕЙ РЕАНИМАТОЛОГИИ РАМН доктор медицинских наук заведующий отделением гемодиализа ГВКГ им. Бурденко ведущий научный сотрудник НИИ Общей реаниматологии им. В. А Неговского РАМН
 Всемирный день почки 14 марта 2013 года
Всемирный день почки 14 марта 2013 года
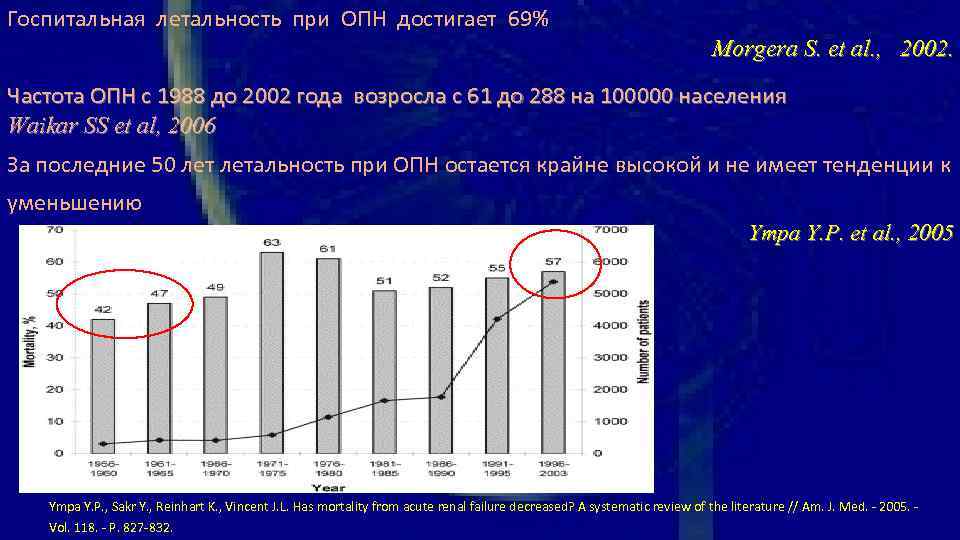 Госпитальная летальность при ОПН достигает 69% Morgera S. et al. , 2002. Частота ОПН с 1988 до 2002 года возросла с 61 до 288 на 100000 населения Waikar SS et al, 2006 За последние 50 летальность при ОПН остается крайне высокой и не имеет тенденции к уменьшению Ympa Y. P. еt al. , 2005 Ympa Y. P. , Sakr Y. , Reinhart K. , Vincent J. L. Has mortality from acute renal failure decreased? A systematic review of the literature // Am. J. Med. - 2005. - Vol. 118. - P. 827 -832.
Госпитальная летальность при ОПН достигает 69% Morgera S. et al. , 2002. Частота ОПН с 1988 до 2002 года возросла с 61 до 288 на 100000 населения Waikar SS et al, 2006 За последние 50 летальность при ОПН остается крайне высокой и не имеет тенденции к уменьшению Ympa Y. P. еt al. , 2005 Ympa Y. P. , Sakr Y. , Reinhart K. , Vincent J. L. Has mortality from acute renal failure decreased? A systematic review of the literature // Am. J. Med. - 2005. - Vol. 118. - P. 827 -832.
 Эпидемиология Сепсис и ОПН Сепсис 19 % Тяжелый сепсис 23 % Септический шок 51 % Сочетание сепсиса и ОПН – приговор (Ронко, Белломо, Келлум 2007)
Эпидемиология Сепсис и ОПН Сепсис 19 % Тяжелый сепсис 23 % Септический шок 51 % Сочетание сепсиса и ОПН – приговор (Ронко, Белломо, Келлум 2007)
 Дефиниция ? ? ? ?
Дефиниция ? ? ? ?
 Определение острых поражений почки • 1802 г. W. Heberden – ishuria renalis – первое описание острого поражения почек • 1909 г. W. Osler – acute Bright’s disease – описание поражений почек при воздействии токсических веществ, беременности, ожогов, травмы или операций • 1917 г. F. Davis – war nephritis – поражение почек в результате шока, рабдомиолиза и сепсиса • 1941 г. E. G. Bywaters, D. Beall – описание классических патофизиологических нарушений при синдроме раздавливания
Определение острых поражений почки • 1802 г. W. Heberden – ishuria renalis – первое описание острого поражения почек • 1909 г. W. Osler – acute Bright’s disease – описание поражений почек при воздействии токсических веществ, беременности, ожогов, травмы или операций • 1917 г. F. Davis – war nephritis – поражение почек в результате шока, рабдомиолиза и сепсиса • 1941 г. E. G. Bywaters, D. Beall – описание классических патофизиологических нарушений при синдроме раздавливания
 Определение острых поражений почки • 1951 г. H. W. Smith – введение термина «acute renal failure» (ОПН) • 1986 г. P. F. Shanley с соавт. – обоснование термина «acute tubular necrosis» (ОКН) • 2004 -2007 гг. ADQI – предложены классификация RIFLE и единое определение острых поражений почки «acute kidney injury» (острое поражение почек – ОПП)
Определение острых поражений почки • 1951 г. H. W. Smith – введение термина «acute renal failure» (ОПН) • 1986 г. P. F. Shanley с соавт. – обоснование термина «acute tubular necrosis» (ОКН) • 2004 -2007 гг. ADQI – предложены классификация RIFLE и единое определение острых поражений почки «acute kidney injury» (острое поражение почек – ОПП)
 • Острая почечная недостаточность (ОПН, Acute Renal Failure, ARF) • Острый канальцевый некроз (ОКН, Acute Tubular Necrosis, ATN) • Острое почечное повреждение (Acute kidney injury, AKI)
• Острая почечная недостаточность (ОПН, Acute Renal Failure, ARF) • Острый канальцевый некроз (ОКН, Acute Tubular Necrosis, ATN) • Острое почечное повреждение (Acute kidney injury, AKI)
 Острая почечная недостаточность Недостаточная функция интактных почек в условиях гиперкатаболизма ПРЕРАНАЛЬНАЯ АЗОТЕМИЯ ПОВРЕЖДЕНИЕ ПОЧЕК
Острая почечная недостаточность Недостаточная функция интактных почек в условиях гиперкатаболизма ПРЕРАНАЛЬНАЯ АЗОТЕМИЯ ПОВРЕЖДЕНИЕ ПОЧЕК
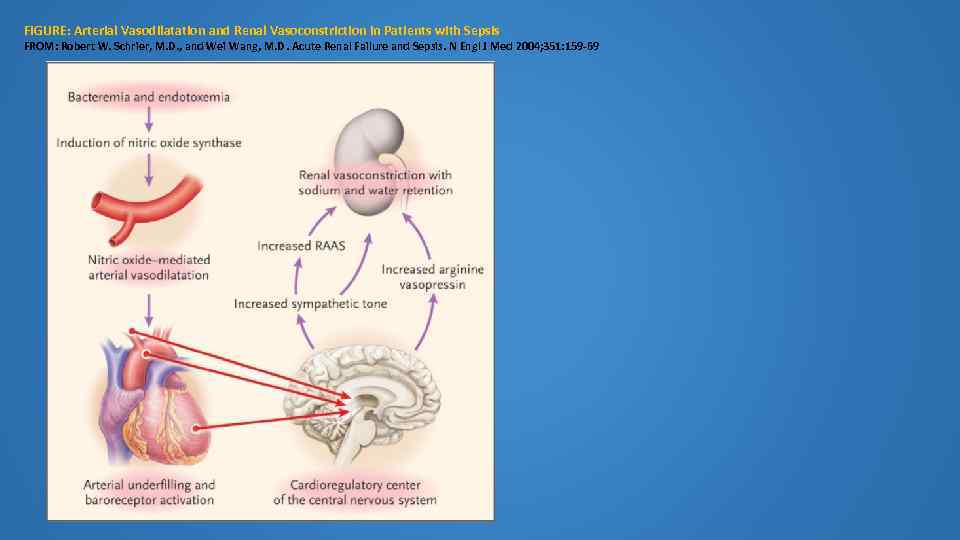 FIGURE: Arterial Vasodilatation and Renal Vasoconstriction in Patients with Sepsis FROM: Robert W. Schrier, M. D. , and Wei Wang, M. D. Acute Renal Failure and Sepsis. N Engl J Med 2004; 351: 159 -69
FIGURE: Arterial Vasodilatation and Renal Vasoconstriction in Patients with Sepsis FROM: Robert W. Schrier, M. D. , and Wei Wang, M. D. Acute Renal Failure and Sepsis. N Engl J Med 2004; 351: 159 -69
 FIGURE: Pathogenic mechanisms of sepsis-related acute kidney injury FROM: Arghya Majumdar. Sepsis-induced acute kidney injury. Indian J Crit Care Med. 2010 Jan-Mar; 14(1): 14– 21 Острая ишемия Расстройства кровообращения Системное воспаление липополисахарид / эндотоксин прямое – непрямое (цитокины) • Гипоперфузия общая / локальная • Микротромбообразование Сепсис Интоксикация • • • • гипоксия оксидативный стресс токсины интоксикация эндотелиальная дисфункция оксид азота Экзогенные отравления Гемоглобин. Миоглобин Антибиотики, РФП Вазопрессоры • • Повреждение нефротелия Пороговая «травма» Репарация и регенерация Апоптоз и некроз Утрата функции
FIGURE: Pathogenic mechanisms of sepsis-related acute kidney injury FROM: Arghya Majumdar. Sepsis-induced acute kidney injury. Indian J Crit Care Med. 2010 Jan-Mar; 14(1): 14– 21 Острая ишемия Расстройства кровообращения Системное воспаление липополисахарид / эндотоксин прямое – непрямое (цитокины) • Гипоперфузия общая / локальная • Микротромбообразование Сепсис Интоксикация • • • • гипоксия оксидативный стресс токсины интоксикация эндотелиальная дисфункция оксид азота Экзогенные отравления Гемоглобин. Миоглобин Антибиотики, РФП Вазопрессоры • • Повреждение нефротелия Пороговая «травма» Репарация и регенерация Апоптоз и некроз Утрата функции
 Острая почечная недостаточность – внезапное прекращение функции почек, приводящее к нарушению водноэлектролитного обмена и накоплению продуктов белкового метаболизма
Острая почечная недостаточность – внезапное прекращение функции почек, приводящее к нарушению водноэлектролитного обмена и накоплению продуктов белкового метаболизма
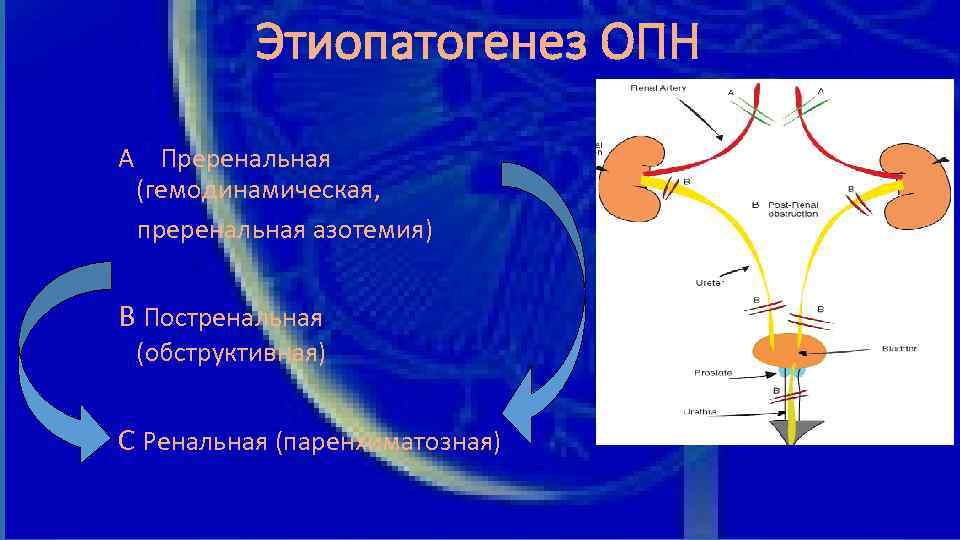 Этиопатогенез ОПН А Преренальная (гемодинамическая, преренальная азотемия) В Постренальная (обструктивная) С Ренальная (паренхиматозная)
Этиопатогенез ОПН А Преренальная (гемодинамическая, преренальная азотемия) В Постренальная (обструктивная) С Ренальная (паренхиматозная)
 ОПН преренальные, факторы Системная гипотония • снижение сосудистого тонуса (инфекционно - токсический или эндотоксический шок, анафилаксия ); • дегидратация и гиповолемия • снижение сердечного выброса (сердечная недостаточность, тромбэмболия легочной артерии); Гипотония в почечных артериях адреномиметическая терапия, применение йод-содержащих рентгенконтрастных веществ, блокада почечного кровотока
ОПН преренальные, факторы Системная гипотония • снижение сосудистого тонуса (инфекционно - токсический или эндотоксический шок, анафилаксия ); • дегидратация и гиповолемия • снижение сердечного выброса (сердечная недостаточность, тромбэмболия легочной артерии); Гипотония в почечных артериях адреномиметическая терапия, применение йод-содержащих рентгенконтрастных веществ, блокада почечного кровотока


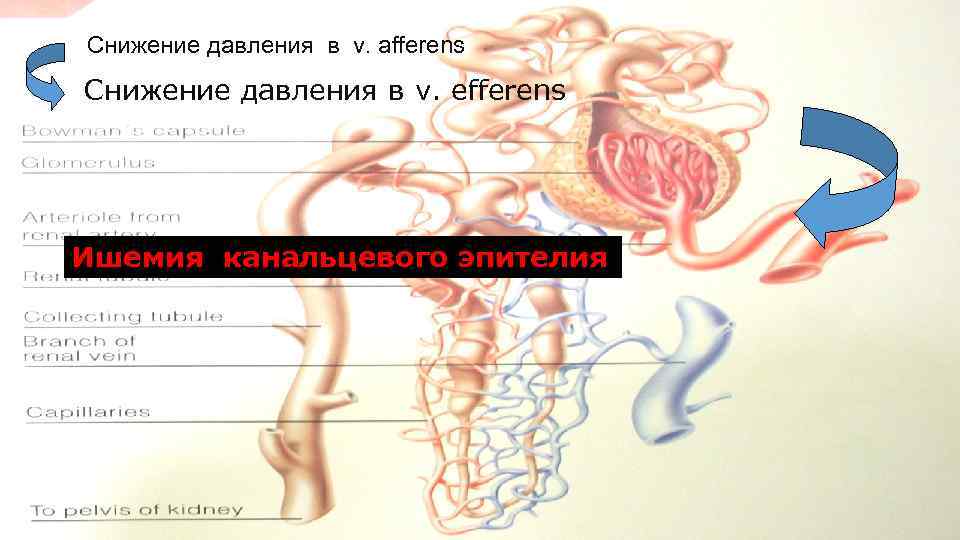 Снижение давления в v. afferens Снижение давления в v. efferens Ишемия канальцевого эпителия
Снижение давления в v. afferens Снижение давления в v. efferens Ишемия канальцевого эпителия
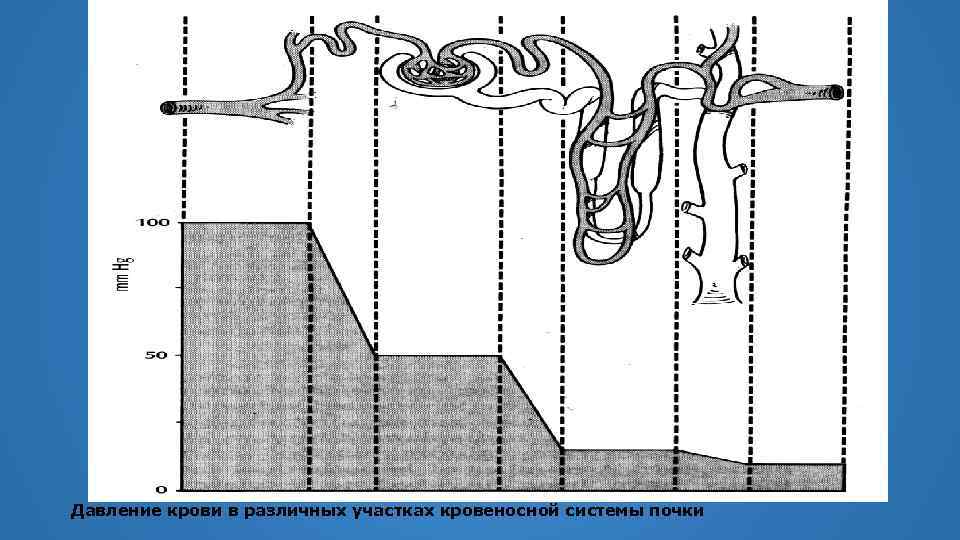 Давление крови в различных участках кровеносной системы почки
Давление крови в различных участках кровеносной системы почки
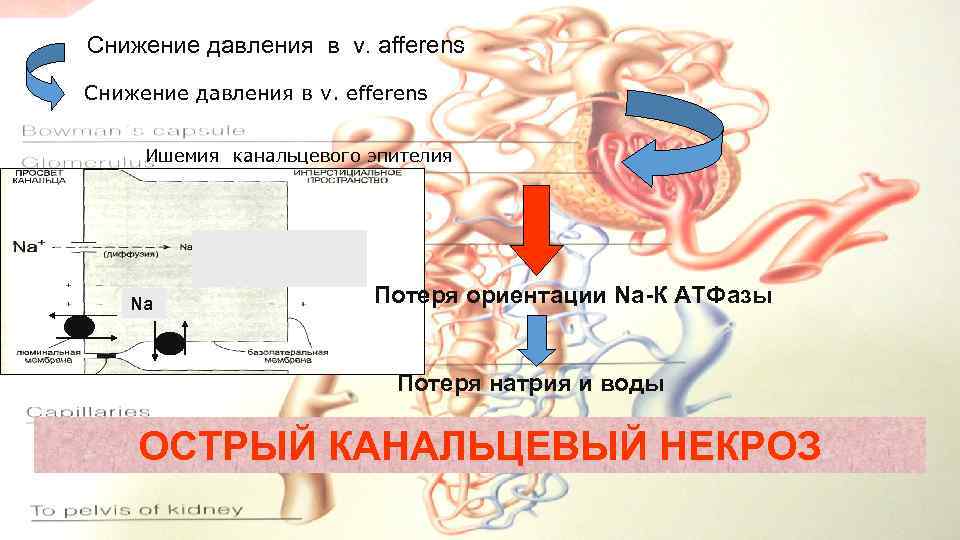 Снижение давления в v. afferens Снижение давления в v. efferens Ишемия канальцевого эпителия Na Потеря ориентации Na-К АТФазы Потеря натрия и воды ОСТРЫЙ КАНАЛЬЦЕВЫЙ НЕКРОЗ КАНАЛЬЦЕВАЯ ДИСТРОФИЯ
Снижение давления в v. afferens Снижение давления в v. efferens Ишемия канальцевого эпителия Na Потеря ориентации Na-К АТФазы Потеря натрия и воды ОСТРЫЙ КАНАЛЬЦЕВЫЙ НЕКРОЗ КАНАЛЬЦЕВАЯ ДИСТРОФИЯ
 ДИАГНОСТИКА ОПН Должна быть своевременной, функционально и патофизиологически обоснованной ОПН чаще всего развивается на глазах реаниматолога Азотемия и олигурия как правило признак уже состоявшегося повреждения почек, поэтому суточный диурез, азотемия – поздно и неадекватно В сутки первичной мочи – 150 – 200 л; 1% МДН без реабсорбции – суточный диурез 1. 5 – 2 л
ДИАГНОСТИКА ОПН Должна быть своевременной, функционально и патофизиологически обоснованной ОПН чаще всего развивается на глазах реаниматолога Азотемия и олигурия как правило признак уже состоявшегося повреждения почек, поэтому суточный диурез, азотемия – поздно и неадекватно В сутки первичной мочи – 150 – 200 л; 1% МДН без реабсорбции – суточный диурез 1. 5 – 2 л
 Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз 1960 гг ЛДГ 1970 гг КФК - МБ 1990 гг Тропонин Т 2000 гг Острая почечная недостаточность Тропонин И Слайд С. Ronco
Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз 1960 гг ЛДГ 1970 гг КФК - МБ 1990 гг Тропонин Т 2000 гг Острая почечная недостаточность Тропонин И Слайд С. Ronco
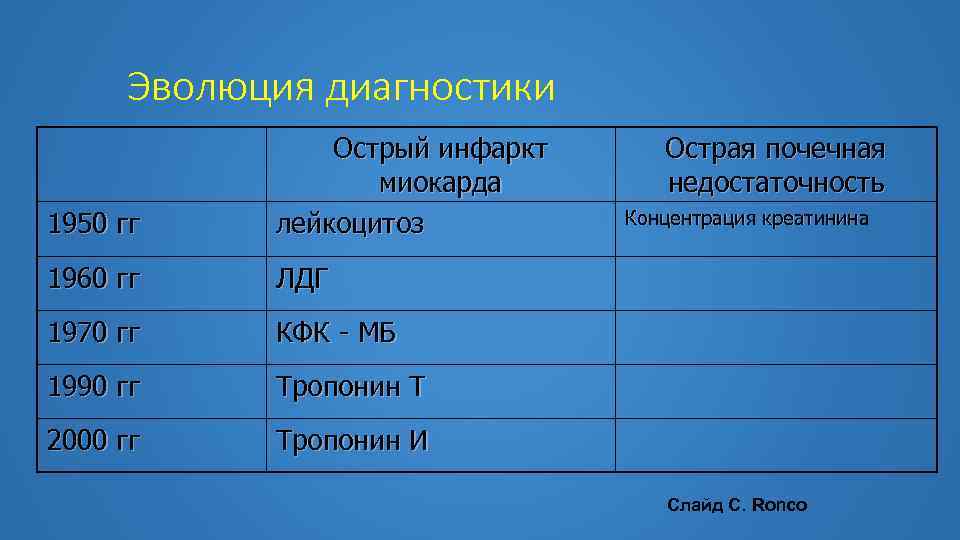 Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз 1960 гг ЛДГ 1970 гг КФК - МБ 1990 гг Тропонин Т 2000 гг Острая почечная недостаточность Тропонин И Концентрация креатинина Слайд С. Ronco
Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз 1960 гг ЛДГ 1970 гг КФК - МБ 1990 гг Тропонин Т 2000 гг Острая почечная недостаточность Тропонин И Концентрация креатинина Слайд С. Ronco
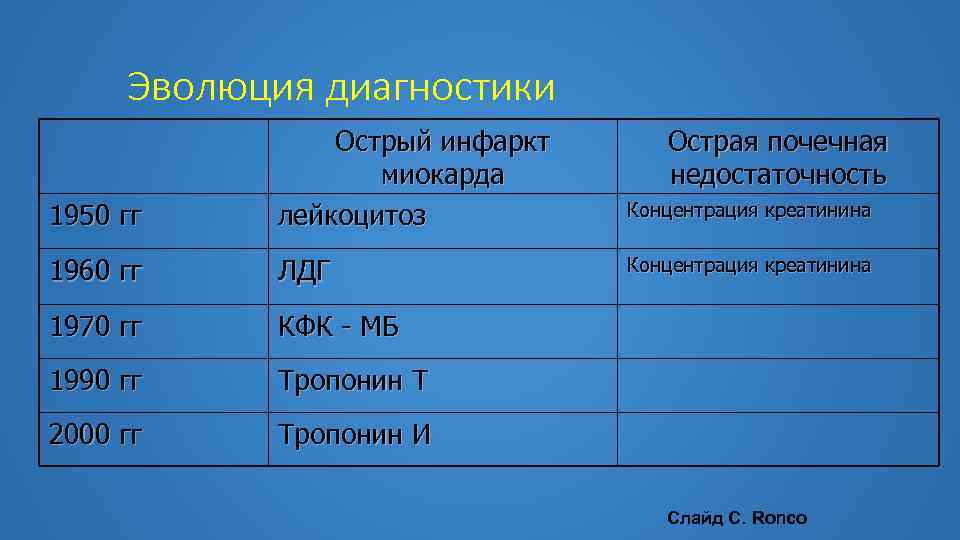 Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ 1990 гг Тропонин Т 2000 гг Тропонин И Слайд С. Ronco
Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ 1990 гг Тропонин Т 2000 гг Тропонин И Слайд С. Ronco
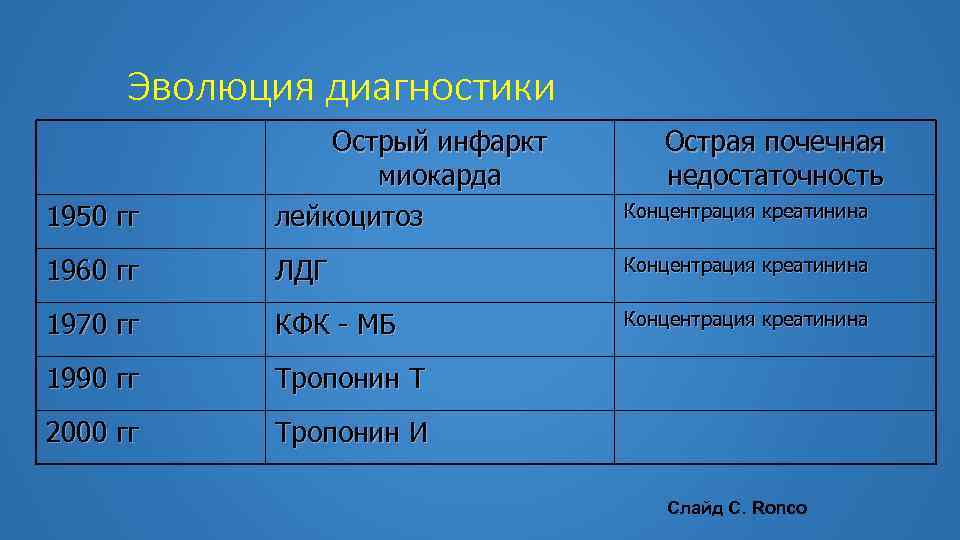 Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ Концентрация креатинина 1990 гг Тропонин Т 2000 гг Тропонин И Слайд С. Ronco
Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ Концентрация креатинина 1990 гг Тропонин Т 2000 гг Тропонин И Слайд С. Ronco
 Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ Концентрация креатинина 1990 гг Тропонин Т Концентрация креатинина 2000 гг Тропонин И Слайд С. Ronco
Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ Концентрация креатинина 1990 гг Тропонин Т Концентрация креатинина 2000 гг Тропонин И Слайд С. Ronco
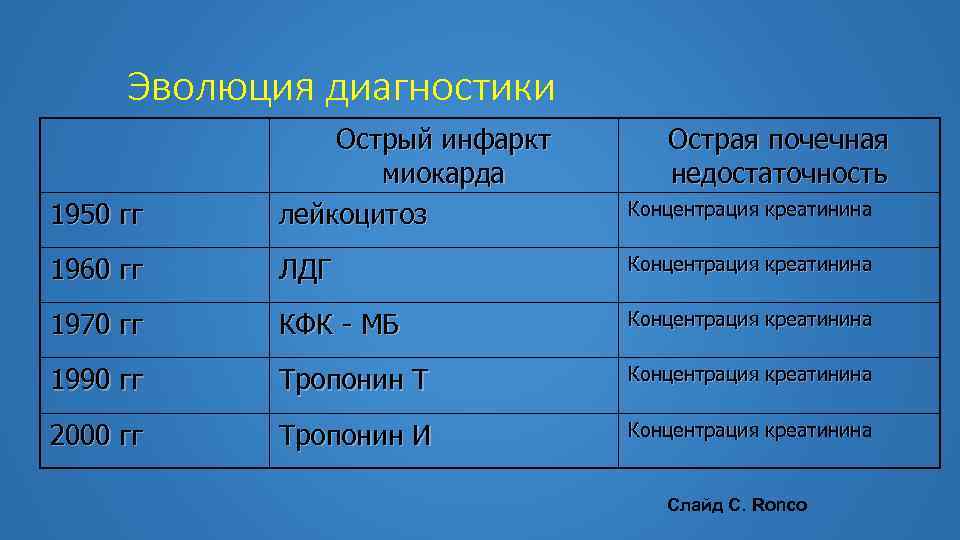 Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ Концентрация креатинина 1990 гг Тропонин Т Концентрация креатинина 2000 гг Тропонин И Концентрация креатинина Слайд С. Ronco
Эволюция диагностики 1950 гг Острый инфаркт миокарда лейкоцитоз Острая почечная недостаточность Концентрация креатинина 1960 гг ЛДГ Концентрация креатинина 1970 гг КФК - МБ Концентрация креатинина 1990 гг Тропонин Т Концентрация креатинина 2000 гг Тропонин И Концентрация креатинина Слайд С. Ronco
 ДИАГНОСТИКА ОПН (продолжение) И тем не менее диурез и азотемия – самые доступные критерии оценки почечной функции Оптимизация контроля этих параметров позволила предложить новую классификацию RIFLE
ДИАГНОСТИКА ОПН (продолжение) И тем не менее диурез и азотемия – самые доступные критерии оценки почечной функции Оптимизация контроля этих параметров позволила предложить новую классификацию RIFLE
 RIFLE Criteria for Acute Renal Dysfunction Acute Dialysis Quality Initiative (the first consensus criteria, 2003 г) Рост креатинина в 1, 5 раза или уменьшение СКФ > 25% Risk Диурез < 0, 5 мл/кг/ч за 6 часов Рост креатинина в 2 раза или Диурез < 0, 5 мл/кг/ч уменьшение СКФ > 50% за 12 часов Injury Рост креатинина в 3 раза или уменьшение Failure СКФ > 75% Loss ESRD High sensitivity Диурез < 0, 5 мл/кг/ч в сутки или анурия за 12 часов Persistent (стойкая) ОПН = полная утрата почечной функции более чем на 4 недели Терминальная почечная недостаточность High specificity
RIFLE Criteria for Acute Renal Dysfunction Acute Dialysis Quality Initiative (the first consensus criteria, 2003 г) Рост креатинина в 1, 5 раза или уменьшение СКФ > 25% Risk Диурез < 0, 5 мл/кг/ч за 6 часов Рост креатинина в 2 раза или Диурез < 0, 5 мл/кг/ч уменьшение СКФ > 50% за 12 часов Injury Рост креатинина в 3 раза или уменьшение Failure СКФ > 75% Loss ESRD High sensitivity Диурез < 0, 5 мл/кг/ч в сутки или анурия за 12 часов Persistent (стойкая) ОПН = полная утрата почечной функции более чем на 4 недели Терминальная почечная недостаточность High specificity
 RIFLE в кардиохирургии • 813 последовательно поступивших для кардиохирургических операций больных. • 19. 3% имели поражение почек после операции, классифицированных по RIFLE. • 90 -дневная летальность F - 32. 5%; I – 21. 4%; R – 8. 0%. Kuitunen A et al. Ann Thorac Surg 2006; 81: 542 -546
RIFLE в кардиохирургии • 813 последовательно поступивших для кардиохирургических операций больных. • 19. 3% имели поражение почек после операции, классифицированных по RIFLE. • 90 -дневная летальность F - 32. 5%; I – 21. 4%; R – 8. 0%. Kuitunen A et al. Ann Thorac Surg 2006; 81: 542 -546
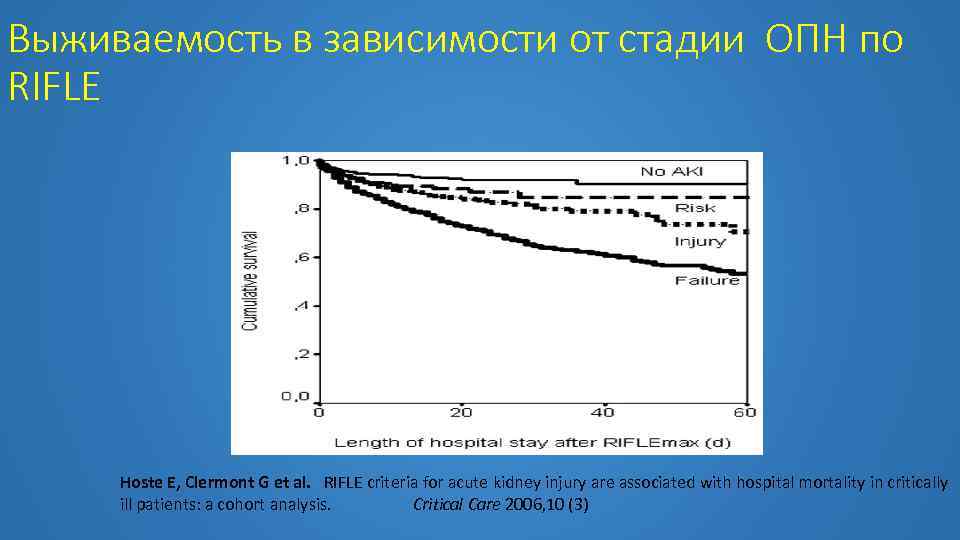 Выживаемость в зависимости от стадии ОПН по RIFLE Hoste E, Clermont G et al. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis. Critical Care 2006, 10 (3)
Выживаемость в зависимости от стадии ОПН по RIFLE Hoste E, Clermont G et al. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis. Critical Care 2006, 10 (3)
 Стадии ОПН по критериям Acute Kidney Injury Network Mehta et al. Critical Care 2007 11: R 31 Стадии Критерий креатинина Критерий диуреза I Увеличение сывороточного креатинина более чем на 0. 3 мг% (26 мкмоль/л) или от 150 до 200 % исходного < 0. 5 мл/кг/час более 6 часов II Увеличение сывороточного креатинина от 200 до 300 % исходного < 0. 5 мл/кг/час более 12 часов III Увеличение сывороточного креатинина более чем на 300 % или концентрация креатинина более 4 мг% (354 мкмоль/л) с острым повышением более чем на 0. 5 мг% (44 мкмоль/л) < 0. 3 мл/кг/час за 24 часа либо анурия 12 часов
Стадии ОПН по критериям Acute Kidney Injury Network Mehta et al. Critical Care 2007 11: R 31 Стадии Критерий креатинина Критерий диуреза I Увеличение сывороточного креатинина более чем на 0. 3 мг% (26 мкмоль/л) или от 150 до 200 % исходного < 0. 5 мл/кг/час более 6 часов II Увеличение сывороточного креатинина от 200 до 300 % исходного < 0. 5 мл/кг/час более 12 часов III Увеличение сывороточного креатинина более чем на 300 % или концентрация креатинина более 4 мг% (354 мкмоль/л) с острым повышением более чем на 0. 5 мг% (44 мкмоль/л) < 0. 3 мл/кг/час за 24 часа либо анурия 12 часов
 Ранняя диагностика (на этапе функционального повреждения - острого почечного повреждения) требует оценки ФУНКЦИИ !
Ранняя диагностика (на этапе функционального повреждения - острого почечного повреждения) требует оценки ФУНКЦИИ !
 Функциональная диагностика ОПН Концентрационные индексы (urea/plasma) Норма ОПН По креатинину По мочевине По осмоляльности По молекулам средней массы 40 20 2. 0 1. 5 < 20 < 1. 2 По натрию 0. 12 > 0/3 Костюченко А. Л. с соавт. , 1999 Экскретируемая фракция натрия Норма < 1%, ОПН > 3 % Espaniel & Gregory, 1980
Функциональная диагностика ОПН Концентрационные индексы (urea/plasma) Норма ОПН По креатинину По мочевине По осмоляльности По молекулам средней массы 40 20 2. 0 1. 5 < 20 < 1. 2 По натрию 0. 12 > 0/3 Костюченко А. Л. с соавт. , 1999 Экскретируемая фракция натрия Норма < 1%, ОПН > 3 % Espaniel & Gregory, 1980
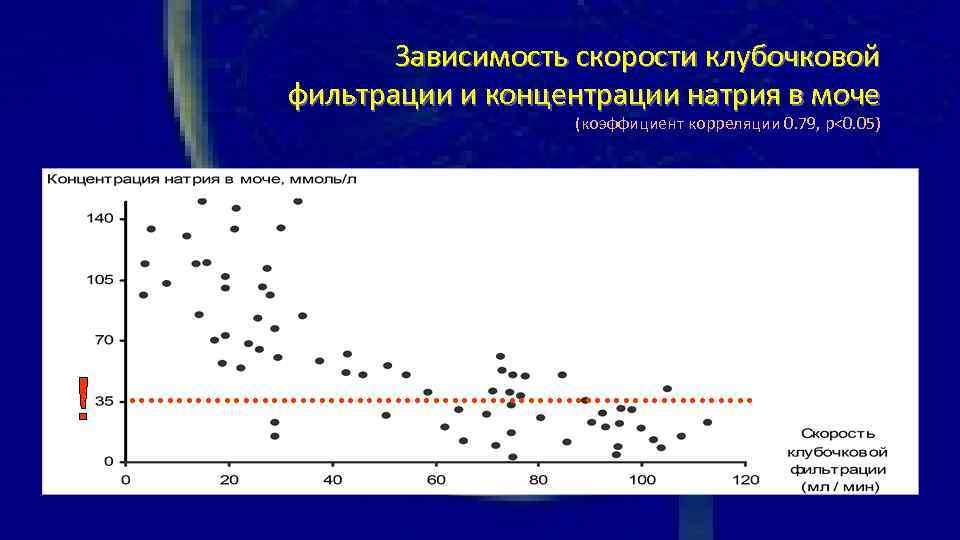 Зависимость скорости клубочковой Показания для начала заместительной почечной фильтрации и концентрации натрия в моче терапии (коэффициент корреляции 0. 79, р<0. 05)
Зависимость скорости клубочковой Показания для начала заместительной почечной фильтрации и концентрации натрия в моче терапии (коэффициент корреляции 0. 79, р<0. 05)
 Дифференциальный диагностика преренальной азотемии и ОКН (из книги С. Ronco et al. Acute Kidney Injury, 2007) Преренальная азотемия Острый канальцевый некроз (ATN) < 15 > 20 Экскретируемая фракция натрия (FENa, %) <1 >1 Соотношение натрия/калия мочи (UNa/K) < 1/4 > 1/4 Соотношение креатинина мочи / плазмы (U/P Cr) > 20 < 15 Экскретируемая фракция мочевины (FE un, %) < 35 > 35 Натрий мочи (UN, ммоль/л)
Дифференциальный диагностика преренальной азотемии и ОКН (из книги С. Ronco et al. Acute Kidney Injury, 2007) Преренальная азотемия Острый канальцевый некроз (ATN) < 15 > 20 Экскретируемая фракция натрия (FENa, %) <1 >1 Соотношение натрия/калия мочи (UNa/K) < 1/4 > 1/4 Соотношение креатинина мочи / плазмы (U/P Cr) > 20 < 15 Экскретируемая фракция мочевины (FE un, %) < 35 > 35 Натрий мочи (UN, ммоль/л)
 Ранняя диагностика острой почечной недостаточности Оценка темпа диуреза Концентрация натрия в моче, ммоль/л Экскретируемая фракция натрия Скорость клубочковой фильтрации (по клиренсу эндогенного креатинина, b 2 – микроглобулина) • Суточная экскреция креатинина и мочевины с мочой • Изменение концентрации креатинина, мочевины, молекул средней массы в плазме крови • •
Ранняя диагностика острой почечной недостаточности Оценка темпа диуреза Концентрация натрия в моче, ммоль/л Экскретируемая фракция натрия Скорость клубочковой фильтрации (по клиренсу эндогенного креатинина, b 2 – микроглобулина) • Суточная экскреция креатинина и мочевины с мочой • Изменение концентрации креатинина, мочевины, молекул средней массы в плазме крови • •
 Перспективные биохимические маркеры ранней стадии ОПН • Липокалин (NGAL) • IL – 18 • Cystatin C • KIM-1
Перспективные биохимические маркеры ранней стадии ОПН • Липокалин (NGAL) • IL – 18 • Cystatin C • KIM-1
 NGAL Нейтрофильный желатиназо- ассоциированный липокалин α-2 микроглобулин с ММ 22 -25 к. Да Увеличивается в моче в 10 -100 раз в течение нескольких часов после ишемии, не изменяется при ХПН и преренальной азотемии
NGAL Нейтрофильный желатиназо- ассоциированный липокалин α-2 микроглобулин с ММ 22 -25 к. Да Увеличивается в моче в 10 -100 раз в течение нескольких часов после ишемии, не изменяется при ХПН и преренальной азотемии
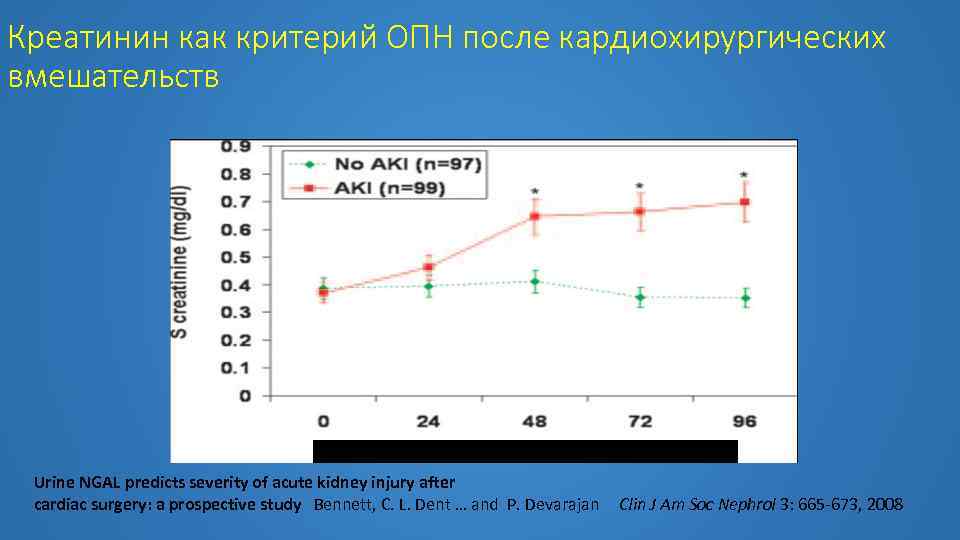 Креатинин как критерий ОПН после кардиохирургических вмешательств Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
Креатинин как критерий ОПН после кардиохирургических вмешательств Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
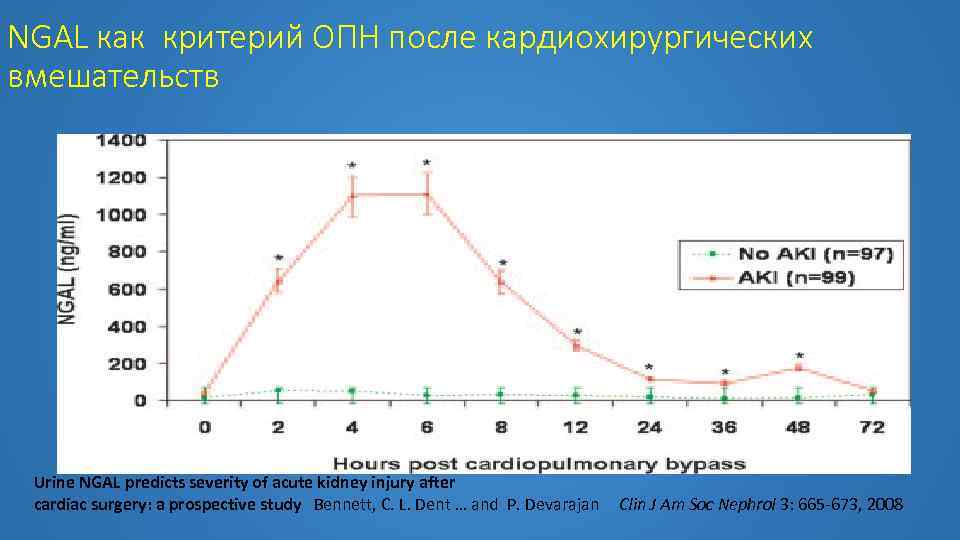 NGAL как критерий ОПН после кардиохирургических вмешательств Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
NGAL как критерий ОПН после кардиохирургических вмешательств Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
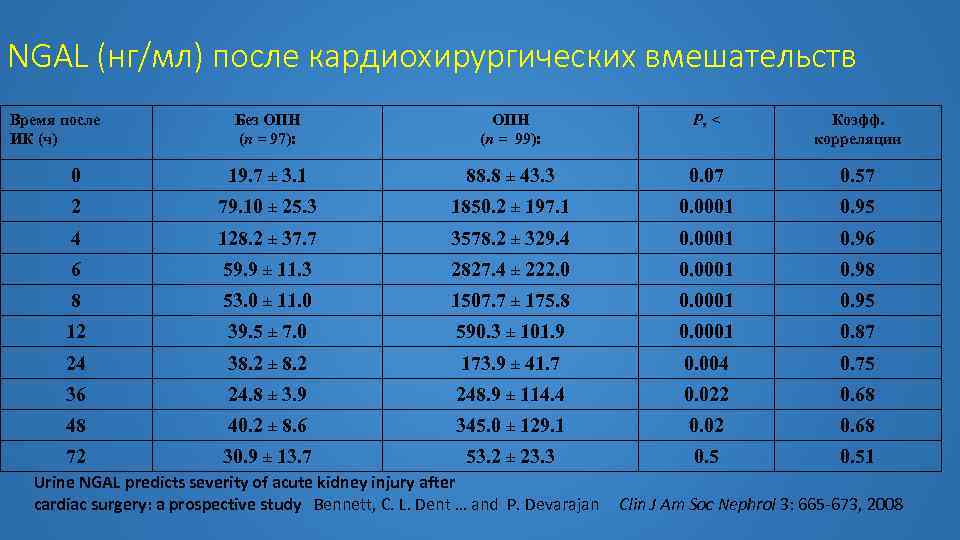 NGAL (нг/мл) после кардиохирургических вмешательств Время после ИК (ч) Без ОПН (n = 97): ОПН (n = 99): P, < Коэфф. корреляции 0 19. 7 ± 3. 1 88. 8 ± 43. 3 0. 07 0. 57 2 79. 10 ± 25. 3 1850. 2 ± 197. 1 0. 0001 0. 95 4 128. 2 ± 37. 7 3578. 2 ± 329. 4 0. 0001 0. 96 6 59. 9 ± 11. 3 2827. 4 ± 222. 0 0. 0001 0. 98 8 53. 0 ± 11. 0 1507. 7 ± 175. 8 0. 0001 0. 95 12 39. 5 ± 7. 0 590. 3 ± 101. 9 0. 0001 0. 87 24 38. 2 ± 8. 2 173. 9 ± 41. 7 0. 004 0. 75 36 24. 8 ± 3. 9 248. 9 ± 114. 4 0. 022 0. 68 48 40. 2 ± 8. 6 345. 0 ± 129. 1 0. 02 0. 68 72 30. 9 ± 13. 7 53. 2 ± 23. 3 0. 51 Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
NGAL (нг/мл) после кардиохирургических вмешательств Время после ИК (ч) Без ОПН (n = 97): ОПН (n = 99): P, < Коэфф. корреляции 0 19. 7 ± 3. 1 88. 8 ± 43. 3 0. 07 0. 57 2 79. 10 ± 25. 3 1850. 2 ± 197. 1 0. 0001 0. 95 4 128. 2 ± 37. 7 3578. 2 ± 329. 4 0. 0001 0. 96 6 59. 9 ± 11. 3 2827. 4 ± 222. 0 0. 0001 0. 98 8 53. 0 ± 11. 0 1507. 7 ± 175. 8 0. 0001 0. 95 12 39. 5 ± 7. 0 590. 3 ± 101. 9 0. 0001 0. 87 24 38. 2 ± 8. 2 173. 9 ± 41. 7 0. 004 0. 75 36 24. 8 ± 3. 9 248. 9 ± 114. 4 0. 022 0. 68 48 40. 2 ± 8. 6 345. 0 ± 129. 1 0. 02 0. 68 72 30. 9 ± 13. 7 53. 2 ± 23. 3 0. 51 Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
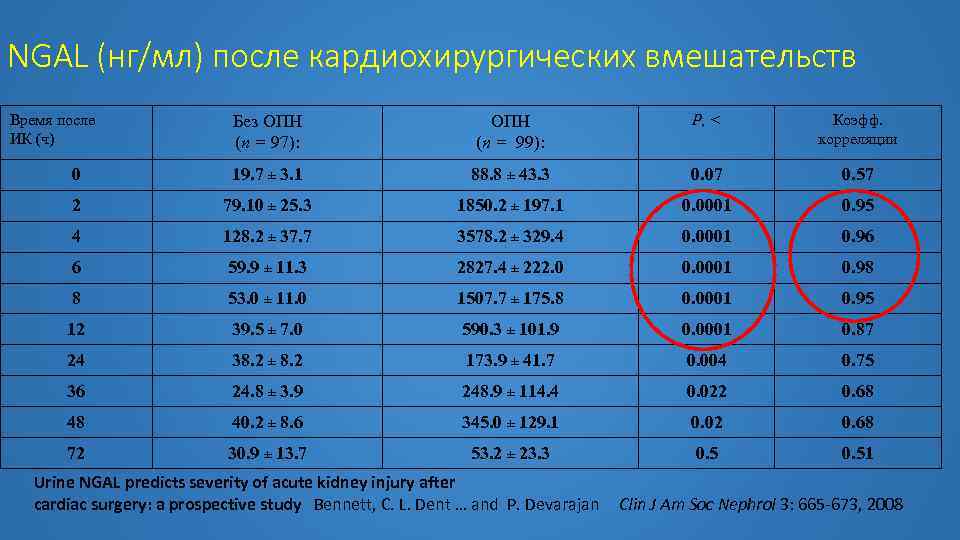 NGAL (нг/мл) после кардиохирургических вмешательств Время после ИК (ч) Без ОПН (n = 97): ОПН (n = 99): P, < Коэфф. корреляции 0 19. 7 ± 3. 1 88. 8 ± 43. 3 0. 07 0. 57 2 79. 10 ± 25. 3 1850. 2 ± 197. 1 0. 0001 0. 95 4 128. 2 ± 37. 7 3578. 2 ± 329. 4 0. 0001 0. 96 6 59. 9 ± 11. 3 2827. 4 ± 222. 0 0. 0001 0. 98 8 53. 0 ± 11. 0 1507. 7 ± 175. 8 0. 0001 0. 95 12 39. 5 ± 7. 0 590. 3 ± 101. 9 0. 0001 0. 87 24 38. 2 ± 8. 2 173. 9 ± 41. 7 0. 004 0. 75 36 24. 8 ± 3. 9 248. 9 ± 114. 4 0. 022 0. 68 48 40. 2 ± 8. 6 345. 0 ± 129. 1 0. 02 0. 68 72 30. 9 ± 13. 7 53. 2 ± 23. 3 0. 51 Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
NGAL (нг/мл) после кардиохирургических вмешательств Время после ИК (ч) Без ОПН (n = 97): ОПН (n = 99): P, < Коэфф. корреляции 0 19. 7 ± 3. 1 88. 8 ± 43. 3 0. 07 0. 57 2 79. 10 ± 25. 3 1850. 2 ± 197. 1 0. 0001 0. 95 4 128. 2 ± 37. 7 3578. 2 ± 329. 4 0. 0001 0. 96 6 59. 9 ± 11. 3 2827. 4 ± 222. 0 0. 0001 0. 98 8 53. 0 ± 11. 0 1507. 7 ± 175. 8 0. 0001 0. 95 12 39. 5 ± 7. 0 590. 3 ± 101. 9 0. 0001 0. 87 24 38. 2 ± 8. 2 173. 9 ± 41. 7 0. 004 0. 75 36 24. 8 ± 3. 9 248. 9 ± 114. 4 0. 022 0. 68 48 40. 2 ± 8. 6 345. 0 ± 129. 1 0. 02 0. 68 72 30. 9 ± 13. 7 53. 2 ± 23. 3 0. 51 Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study Bennett, C. L. Dent … and P. Devarajan Clin J Am Soc Nephrol 3: 665 -673, 2008
 Модификация RIFLE – 2010 Функциональные критерии Критерии повреждения Рост креатинина в 1, 5 раза или рост > 0, 3 мг% менее чем за 48 часов или диурез < 0, 5 мл/кг/ч за 6 часов Risk NGAL > 100 нг/мл или KIM > 2 или IL-18 > 2 Рост креатинина в 2 раза или диурез < 0, 5 мл/кг/ч за 12 часов Injury NGAL > 200 нг/мл или KIM > 2 или IL-18 > 2 Рост креатинина в 3 раза или Cr > 4 мг% или диурез < 0, 3 мл/кг/ч за 24 ч или анурия > 12 ч Failure Loss ESRD ? ? ? Persistent (стойкая) ОПН = полная утрата почечной функции более чем на 4 недели Терминальная почечная недостаточность
Модификация RIFLE – 2010 Функциональные критерии Критерии повреждения Рост креатинина в 1, 5 раза или рост > 0, 3 мг% менее чем за 48 часов или диурез < 0, 5 мл/кг/ч за 6 часов Risk NGAL > 100 нг/мл или KIM > 2 или IL-18 > 2 Рост креатинина в 2 раза или диурез < 0, 5 мл/кг/ч за 12 часов Injury NGAL > 200 нг/мл или KIM > 2 или IL-18 > 2 Рост креатинина в 3 раза или Cr > 4 мг% или диурез < 0, 3 мл/кг/ч за 24 ч или анурия > 12 ч Failure Loss ESRD ? ? ? Persistent (стойкая) ОПН = полная утрата почечной функции более чем на 4 недели Терминальная почечная недостаточность
 Острое почечное повреждение определяется, если: 1) Сывороточный креатинин увеличивается на 0. 3 mg/dl ( 26. 5 mmol/l) в течение 48 часов; или 2) Сывороточный креатинин увеличивается в 1, 5 раза от исходного, если исходный определялся в течение хотя бы 7 предшествующих дней , или 3) Диурез < 0. 5 ml/kg/h в течение 6 часов.
Острое почечное повреждение определяется, если: 1) Сывороточный креатинин увеличивается на 0. 3 mg/dl ( 26. 5 mmol/l) в течение 48 часов; или 2) Сывороточный креатинин увеличивается в 1, 5 раза от исходного, если исходный определялся в течение хотя бы 7 предшествующих дней , или 3) Диурез < 0. 5 ml/kg/h в течение 6 часов.
 Принципы интенсивной терапии ОПН 1. Ранняя диагностика 2. Устранение причины – восстановление перфузии почек 3. Недопущение перехода канальцевой дистрофии в канальцевый некроз Неолигурическая ОПН
Принципы интенсивной терапии ОПН 1. Ранняя диагностика 2. Устранение причины – восстановление перфузии почек 3. Недопущение перехода канальцевой дистрофии в канальцевый некроз Неолигурическая ОПН
 Факторы, определяющие летальность при ОПН 1. 2. 3. 4. 5. 6. 7. Острый инфаркт миокарда (RR 3. 14) Инсульт (RR 3. 08) Мужской пол (RR 3. 08) Хроническая иммуносупрессия (RR 2. 37) Олигурия (RR 2. 25) ИВЛ (RR 1. 86) Предшествующие нарушения питания, гипоальбумиемия, гипохолестеринемия Chertow G. et al. , 1998; Fiaccadori E et al. , 1999; Obialo C. et al. , 1999
Факторы, определяющие летальность при ОПН 1. 2. 3. 4. 5. 6. 7. Острый инфаркт миокарда (RR 3. 14) Инсульт (RR 3. 08) Мужской пол (RR 3. 08) Хроническая иммуносупрессия (RR 2. 37) Олигурия (RR 2. 25) ИВЛ (RR 1. 86) Предшествующие нарушения питания, гипоальбумиемия, гипохолестеринемия Chertow G. et al. , 1998; Fiaccadori E et al. , 1999; Obialo C. et al. , 1999
 Диализзависимая ОПН уменьшает выживаемость больных на 50% Maher E. R. et al. - Q. J. Med. – 1989. – 72. – 857 -866
Диализзависимая ОПН уменьшает выживаемость больных на 50% Maher E. R. et al. - Q. J. Med. – 1989. – 72. – 857 -866
 Принципы интенсивной терапии ОПН Восстановление перфузии почек (нефропротекция) Патофизиологически обоснованная медикаментозная терапия Не ВМЕСТО, а Заместительная почечная терапия ВМЕСТЕ
Принципы интенсивной терапии ОПН Восстановление перфузии почек (нефропротекция) Патофизиологически обоснованная медикаментозная терапия Не ВМЕСТО, а Заместительная почечная терапия ВМЕСТЕ
 üПрименение допамина у 328 больных с почечной дисфункцией не выявлено влияния на длительность, тяжесть ОПН, потребности в ЗПТ Australian and New Zealand Intensive Care Society Clinical Trials Group. Lancet 2000 üПри сравнении эффекта фуросемида, торсемида и плацебо у 92 больных с ОКН, леченных низкими дозами допамина в рандомизированном двойном слепом исследовании не установлено разницы в восстановлении почечной функции, потребности в диализе или выживаемости Shilliday IR et al. Nephrol Dial transplant 1997; 12: 2592 -2596 üФуросемид не эффективен в профилактике и лечении ОПН (метаанализ 250 работ с 1966 по 2006 гг. , 849 больных). Kwok M et al. Meta-analysis of frusemide to prevent or treat acute renal failure BMJ 2006
üПрименение допамина у 328 больных с почечной дисфункцией не выявлено влияния на длительность, тяжесть ОПН, потребности в ЗПТ Australian and New Zealand Intensive Care Society Clinical Trials Group. Lancet 2000 üПри сравнении эффекта фуросемида, торсемида и плацебо у 92 больных с ОКН, леченных низкими дозами допамина в рандомизированном двойном слепом исследовании не установлено разницы в восстановлении почечной функции, потребности в диализе или выживаемости Shilliday IR et al. Nephrol Dial transplant 1997; 12: 2592 -2596 üФуросемид не эффективен в профилактике и лечении ОПН (метаанализ 250 работ с 1966 по 2006 гг. , 849 больных). Kwok M et al. Meta-analysis of frusemide to prevent or treat acute renal failure BMJ 2006
 • В двух рандомизированных исследованиях 25 -летней давности увеличение диуреза у больных с олигурической ОПН не влияло на потребность в диализе, восстановление почечной функции и летальность Kleinknecht D et al. Nephron 1976; 17: 51 -58 Brown CB et al. Clin Nephrol 1981; 15: 90 -96 Shilliday IR et al. Nephrol Dial transplant 1997; 12: 2592 -2596
• В двух рандомизированных исследованиях 25 -летней давности увеличение диуреза у больных с олигурической ОПН не влияло на потребность в диализе, восстановление почечной функции и летальность Kleinknecht D et al. Nephron 1976; 17: 51 -58 Brown CB et al. Clin Nephrol 1981; 15: 90 -96 Shilliday IR et al. Nephrol Dial transplant 1997; 12: 2592 -2596
 Рекомендации ADQI по медикаментозной терапии ОПН (адаптация N Gibney, J A Kellum et al ADQI 4, 2005 по Александровой И. В. И др. , 2009) МЕТОД уровень доказательности Изотоническая гидратация снижает риск развития ОПН на введение рентгеноконтрастных препаратов B Раствор натрия бикарбоната может быть более эффективен, чем раствор натрия хлорида, для профилактики ОПН на введение рентгеноконтрастных препаратов C Сохранение почечной перфузии путём поддержания сердечного выброса, АД, внутрисосудистого объёма может способствовать восстановлению почечной функции E В случаях септического шока норэпинефрин препарат выбора для профилактики ОПН C Коллоиды не являются более эффективным средством предупреждения ОПН, чем кристаллоиды A Диуретики не предотвращают развития ОПН A Маннитол не предотвращает развития ОПН C Предсердный натрийуретический пептид не предотвращает развития ОПН A Допамин не предотвращает развития ОПН A
Рекомендации ADQI по медикаментозной терапии ОПН (адаптация N Gibney, J A Kellum et al ADQI 4, 2005 по Александровой И. В. И др. , 2009) МЕТОД уровень доказательности Изотоническая гидратация снижает риск развития ОПН на введение рентгеноконтрастных препаратов B Раствор натрия бикарбоната может быть более эффективен, чем раствор натрия хлорида, для профилактики ОПН на введение рентгеноконтрастных препаратов C Сохранение почечной перфузии путём поддержания сердечного выброса, АД, внутрисосудистого объёма может способствовать восстановлению почечной функции E В случаях септического шока норэпинефрин препарат выбора для профилактики ОПН C Коллоиды не являются более эффективным средством предупреждения ОПН, чем кристаллоиды A Диуретики не предотвращают развития ОПН A Маннитол не предотвращает развития ОПН C Предсердный натрийуретический пептид не предотвращает развития ОПН A Допамин не предотвращает развития ОПН A
 Принципы лечения Острого Почечного Повреждения Согласно KDIGO (Kidney Disease: Improving Global Outcomes) Kidn Int vol 2, Suppl 1, 2012
Принципы лечения Острого Почечного Повреждения Согласно KDIGO (Kidney Disease: Improving Global Outcomes) Kidn Int vol 2, Suppl 1, 2012
 Поддержание внутрисосудистого объёма 3. 1. 1. При отсутствии геморрагического шока использовать гл. о. изотонические растворы кристаллоидов, а не растворы коллоидов (альбумин, крахмал) (2 В) 3. 1. 2. При наличии сосудистого коллапса (+ угроза ОПП) – вазопрессоры в комбинации с растворами (1 С) 3. 3. 1. Поддержание целевого уровня глюкозы: 110149 мг/дл (6, 1 -8, 3 ммоль/л) (2 С)
Поддержание внутрисосудистого объёма 3. 1. 1. При отсутствии геморрагического шока использовать гл. о. изотонические растворы кристаллоидов, а не растворы коллоидов (альбумин, крахмал) (2 В) 3. 1. 2. При наличии сосудистого коллапса (+ угроза ОПП) – вазопрессоры в комбинации с растворами (1 С) 3. 3. 1. Поддержание целевого уровня глюкозы: 110149 мг/дл (6, 1 -8, 3 ммоль/л) (2 С)
 Нутритивное обеспечение при ОПП 3. 3. 2. При любой стадии ОПП калораж = 20 -30 ккал/кг/сут (2 С) 3. 3. 3. Избегать ограничения белка с целью замедления старта ЗПТ (2 D) 3. 3. 4. ОПП, - ЗПТ, - Гиперкатаболизм: белок: 0, 8 -1, 0 г/кг/сут (2 D) ОПП, + ЗПТ, - Гиперкатаболизм: белок 1, 0 -1, 5 г/кг/сут (2 D) ОПП, + ЗПТ, + Гиперкатаболизм: белок 1, 7 г/кг/сут (2 D) 3. 3. 5. Питание преимущественно энтеральное (2 С)
Нутритивное обеспечение при ОПП 3. 3. 2. При любой стадии ОПП калораж = 20 -30 ккал/кг/сут (2 С) 3. 3. 3. Избегать ограничения белка с целью замедления старта ЗПТ (2 D) 3. 3. 4. ОПП, - ЗПТ, - Гиперкатаболизм: белок: 0, 8 -1, 0 г/кг/сут (2 D) ОПП, + ЗПТ, - Гиперкатаболизм: белок 1, 0 -1, 5 г/кг/сут (2 D) ОПП, + ЗПТ, + Гиперкатаболизм: белок 1, 7 г/кг/сут (2 D) 3. 3. 5. Питание преимущественно энтеральное (2 С)
 Аминогликозиды • 3. 8. 1. Не использовать АГ, кроме безальтернативных ситуаций (2 А) • 3. 8. 2. У пациентов без ОПП рекомендуется назначение АГ в однократной суточной дозе (2 В) • 3. 8. 3. Контроль сыв концентрации АГ при многократном (24 ч) введении (1 А) • 3. 8. 4. Контроль сыв концентрации АГ при однократном (>48 ч) введении (2 С) • 3. 8. 5. Во всех оправданных случаях – местное (не в/в) введение АГ (2 В) • 3. 8. 6. Использовать липидную форму амфотер В (2 А) • 3. 8. 7. Во всех возм. ситуациях при лечении системных микозов/паразитарных инфекций отдавать предпочтение азольным лек. средствам (1 А)
Аминогликозиды • 3. 8. 1. Не использовать АГ, кроме безальтернативных ситуаций (2 А) • 3. 8. 2. У пациентов без ОПП рекомендуется назначение АГ в однократной суточной дозе (2 В) • 3. 8. 3. Контроль сыв концентрации АГ при многократном (24 ч) введении (1 А) • 3. 8. 4. Контроль сыв концентрации АГ при однократном (>48 ч) введении (2 С) • 3. 8. 5. Во всех оправданных случаях – местное (не в/в) введение АГ (2 В) • 3. 8. 6. Использовать липидную форму амфотер В (2 А) • 3. 8. 7. Во всех возм. ситуациях при лечении системных микозов/паразитарных инфекций отдавать предпочтение азольным лек. средствам (1 А)
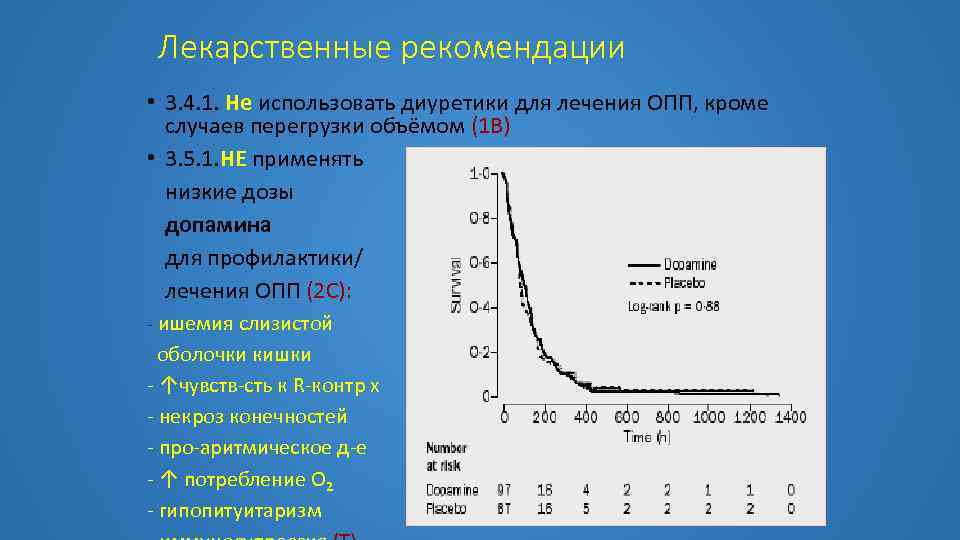 Лекарственные рекомендации • 3. 4. 1. Не использовать диуретики для лечения ОПП, кроме случаев перегрузки объёмом (1 В) • 3. 5. 1. НЕ применять низкие дозы допамина для профилактики/ лечения ОПП (2 С): - ишемия слизистой оболочки кишки - ↑чувств-сть к R-контр х - некроз конечностей - про-аритмическое д-е - ↑ потребление О 2 - гипопитуитаризм
Лекарственные рекомендации • 3. 4. 1. Не использовать диуретики для лечения ОПП, кроме случаев перегрузки объёмом (1 В) • 3. 5. 1. НЕ применять низкие дозы допамина для профилактики/ лечения ОПП (2 С): - ишемия слизистой оболочки кишки - ↑чувств-сть к R-контр х - некроз конечностей - про-аритмическое д-е - ↑ потребление О 2 - гипопитуитаризм
 Не… • 3. 5. 3. Не использовать предсердный натрийуретический пептид (2 В) • 3. 6. 1. Не использовать рекомбинантный человеческий инсулиноподобный фактор роста 1 (рч. ИФР) (1 В) • 3. 7. 1. У новорождённых с тяжёлой перинатальной асфиксией и высоким риском ОПП возможно однократное применение теофиллина (2 В)
Не… • 3. 5. 3. Не использовать предсердный натрийуретический пептид (2 В) • 3. 6. 1. Не использовать рекомбинантный человеческий инсулиноподобный фактор роста 1 (рч. ИФР) (1 В) • 3. 7. 1. У новорождённых с тяжёлой перинатальной асфиксией и высоким риском ОПП возможно однократное применение теофиллина (2 В)
 НЕ… • 3. 9. 2 -3. Не использовать N-ацетил-цистеин для профилактики ОПП у больных в критическом состоянии с гипотензией (-), а также в послеоперационном периоде (1 А) • 3. 9. 1. Не считать выполнение АКШ на работающем сердце тактикой выбора с целью снижения риска ОПП (2 С)
НЕ… • 3. 9. 2 -3. Не использовать N-ацетил-цистеин для профилактики ОПП у больных в критическом состоянии с гипотензией (-), а также в послеоперационном периоде (1 А) • 3. 9. 1. Не считать выполнение АКШ на работающем сердце тактикой выбора с целью снижения риска ОПП (2 С)
 Для больных с риском контрастиндуцированного ОПП 4. 4. 1 -2 Рекомендуется инфузионная терапия (Na. Cl 0, 9%, Na. HCO 3 4, 2%) (-), с сочетанием пар- и энтерального путей введения (1 В) 4. 4. 3. Рекомендуется N-АЦ p/os+крист-ды в/в (2 D) 4. 4. 4. НЕ рекомендуется теофиллин (2 С) 4. 4. 5. НЕ рекомендуется фенилдопам (1 В) 4. 5. 1. Рекомендуется профилактический ГД/ГДФ с целью удаления контрастных препаратов (2 С) 4. 4. 2. По возможности использовать другие визуализирующие методы диагностики (-)
Для больных с риском контрастиндуцированного ОПП 4. 4. 1 -2 Рекомендуется инфузионная терапия (Na. Cl 0, 9%, Na. HCO 3 4, 2%) (-), с сочетанием пар- и энтерального путей введения (1 В) 4. 4. 3. Рекомендуется N-АЦ p/os+крист-ды в/в (2 D) 4. 4. 4. НЕ рекомендуется теофиллин (2 С) 4. 4. 5. НЕ рекомендуется фенилдопам (1 В) 4. 5. 1. Рекомендуется профилактический ГД/ГДФ с целью удаления контрастных препаратов (2 С) 4. 4. 2. По возможности использовать другие визуализирующие методы диагностики (-)
 Диализное лечение при ОПП 5. 1. 1 -2. ЗПТ должна быть начата немедленно при выявлении опасных нарушений водноэлектролитного баланса и КЩС, динамики лабораторных и клинических показателей (-) 5. 2. 2. НЕ использовать диуретики (с целью ↓ t´ и √ ЗПТ) (2 В)
Диализное лечение при ОПП 5. 1. 1 -2. ЗПТ должна быть начата немедленно при выявлении опасных нарушений водноэлектролитного баланса и КЩС, динамики лабораторных и клинических показателей (-) 5. 2. 2. НЕ использовать диуретики (с целью ↓ t´ и √ ЗПТ) (2 В)
 Управляемая гипокоагуляция 5. 3. 2. 1. В общих случаях для ИЗПТ рекомендуется нефракционированный или низкомолекулярный гепарин (1 С) 5. 3. 2. 2. Для ПЗПТ рекомендуется цитратная антикоагуляция (2 В), при наличии противопоказаний к цитрату – гепарины (2 С) 5. 3. 3. 1. При высоком риске кровотечения регионарная цитратная антикоагуляция предпочтительней ПЗПТ без антикоагуляции (2 С) 5. 3. 4. У пациентов с ГИТ предпочтительнее использование прямых ингибиторов тромбина (арготромбан), или ингибиторов ф. Х (данапароид, фондапаринукс), чем ЗПТ без антикоагулянтов (1 А)
Управляемая гипокоагуляция 5. 3. 2. 1. В общих случаях для ИЗПТ рекомендуется нефракционированный или низкомолекулярный гепарин (1 С) 5. 3. 2. 2. Для ПЗПТ рекомендуется цитратная антикоагуляция (2 В), при наличии противопоказаний к цитрату – гепарины (2 С) 5. 3. 3. 1. При высоком риске кровотечения регионарная цитратная антикоагуляция предпочтительней ПЗПТ без антикоагуляции (2 С) 5. 3. 4. У пациентов с ГИТ предпочтительнее использование прямых ингибиторов тромбина (арготромбан), или ингибиторов ф. Х (данапароид, фондапаринукс), чем ЗПТ без антикоагулянтов (1 А)
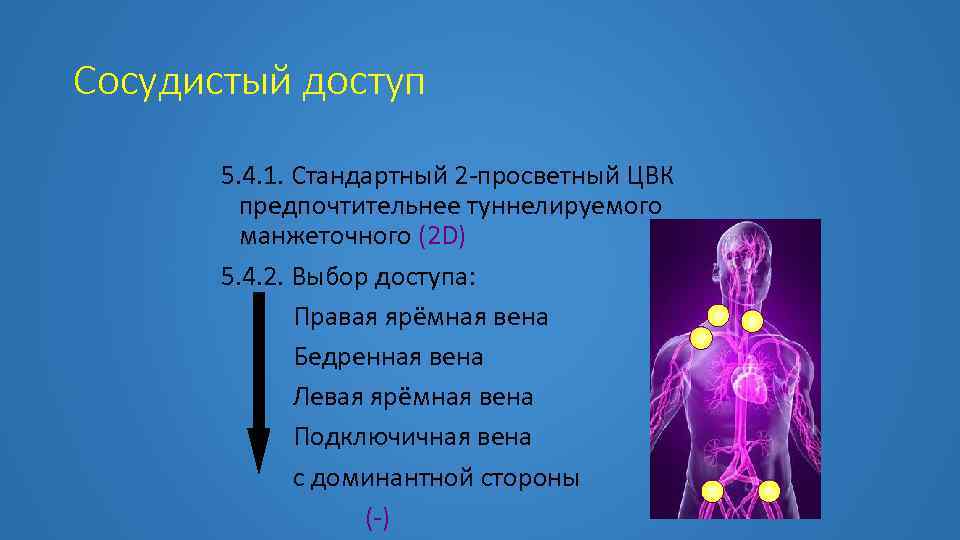 Сосудистый доступ 5. 4. 1. Стандартный 2 -просветный ЦВК предпочтительнее туннелируемого манжеточного (2 D) 5. 4. 2. Выбор доступа: Правая ярёмная вена Бедренная вена Левая ярёмная вена Подключичная вена с доминантной стороны (-)
Сосудистый доступ 5. 4. 1. Стандартный 2 -просветный ЦВК предпочтительнее туннелируемого манжеточного (2 D) 5. 4. 2. Выбор доступа: Правая ярёмная вена Бедренная вена Левая ярёмная вена Подключичная вена с доминантной стороны (-)
 Сосудистый доступ. Вопросы безопасности 5. 4. 3. Рекомендуется установка ЦВК при помощи УЗ наведения (1 А) 5. 4. 4. При имплантации ЦВК в ярёмную/подключичную вену рекомендуется R-контроль п/установки и перед 1 -м использованием (1 В) 5. 4. 5. ОПП+ЗПТ в ОРИТ: Не использовать нанесение а/б препаратов на кожу в месте имплантации нетуннелируемого ЦВК (2 С) 5. 4. 6. Не рекомендуется использовать а/б замки для предотвращения КАИ в нетуннелируемых ЦВК (2 С)
Сосудистый доступ. Вопросы безопасности 5. 4. 3. Рекомендуется установка ЦВК при помощи УЗ наведения (1 А) 5. 4. 4. При имплантации ЦВК в ярёмную/подключичную вену рекомендуется R-контроль п/установки и перед 1 -м использованием (1 В) 5. 4. 5. ОПП+ЗПТ в ОРИТ: Не использовать нанесение а/б препаратов на кожу в месте имплантации нетуннелируемого ЦВК (2 С) 5. 4. 6. Не рекомендуется использовать а/б замки для предотвращения КАИ в нетуннелируемых ЦВК (2 С)
 Диализная доза 5. 8. 3. Рекомендуется обеспеченная диализная доза Kt/V-3, 9 в неделю для ИЗПТ и ПЗПТ (1 А) 5. 8. 4. Рекомендуется достижение Обеспеченного объёма эффлюента = 20 -25 мл/кг/час (-)
Диализная доза 5. 8. 3. Рекомендуется обеспеченная диализная доза Kt/V-3, 9 в неделю для ИЗПТ и ПЗПТ (1 А) 5. 8. 4. Рекомендуется достижение Обеспеченного объёма эффлюента = 20 -25 мл/кг/час (-)

 3. 1. 3: We suggest using protocol-based management of hemodynamic and oxygenation parameters to prevent development or worsening of AKI in high-risk patients in the perioperative setting (2 C) or in patients with septic shock (2 C). 3. 3. 1: In critically ill patients, we suggest insulin therapy targeting plasma glucose 110– 149 mg/dl (6. 1– 8. 3 mmol/l). (2 C) 3. 3. 2: We suggest achieving a total energy intake of 20– 30 kcal/kg/d in patients with any stage of AKI. (2 C) 3. 3. 3: We suggest to avoid restriction of protein intake with the aim of preventing or delaying initiation of RRT. (2 D) 3. 3. 4: We suggest administering 0. 8– 1. 0 g/kg/d of protein in noncatabolic AKI patients without need for dialysis (2 D), 1. 0– 1. 5 g/kg/d in patients with AKI on RRT (2 D), and up to a maximum of 1. 7 g/kg/d in patients on continuous renal replacement therapy (CRRT) and in hypercatabolic patients. (2 D) 3. 3. 5: We suggest providing nutrition preferentially via the enteral route in patients with AKI. (2 C) 3. 4. 1: We recommend not using diuretics to prevent AKI. (1 B) 3. 4. 2: We suggest not using diuretics to treat AKI, except in the management of volume overload. (2 C) 3. 5. 1: We recommend not using low-dose dopamine to prevent or treat AKI. (1 A) 3. 5. 2: We suggest not using fenoldopam to prevent or treat AKI. (2 C) 3. 5. 3: We suggest not using atrial natriuretic peptide (ANP) to prevent (2 C) or treat(2 B) AKI. 3. 6. 1: We recommend not using recombinant human (rh)IGF-1 to prevent or treat AKI. (1 B)
3. 1. 3: We suggest using protocol-based management of hemodynamic and oxygenation parameters to prevent development or worsening of AKI in high-risk patients in the perioperative setting (2 C) or in patients with septic shock (2 C). 3. 3. 1: In critically ill patients, we suggest insulin therapy targeting plasma glucose 110– 149 mg/dl (6. 1– 8. 3 mmol/l). (2 C) 3. 3. 2: We suggest achieving a total energy intake of 20– 30 kcal/kg/d in patients with any stage of AKI. (2 C) 3. 3. 3: We suggest to avoid restriction of protein intake with the aim of preventing or delaying initiation of RRT. (2 D) 3. 3. 4: We suggest administering 0. 8– 1. 0 g/kg/d of protein in noncatabolic AKI patients without need for dialysis (2 D), 1. 0– 1. 5 g/kg/d in patients with AKI on RRT (2 D), and up to a maximum of 1. 7 g/kg/d in patients on continuous renal replacement therapy (CRRT) and in hypercatabolic patients. (2 D) 3. 3. 5: We suggest providing nutrition preferentially via the enteral route in patients with AKI. (2 C) 3. 4. 1: We recommend not using diuretics to prevent AKI. (1 B) 3. 4. 2: We suggest not using diuretics to treat AKI, except in the management of volume overload. (2 C) 3. 5. 1: We recommend not using low-dose dopamine to prevent or treat AKI. (1 A) 3. 5. 2: We suggest not using fenoldopam to prevent or treat AKI. (2 C) 3. 5. 3: We suggest not using atrial natriuretic peptide (ANP) to prevent (2 C) or treat(2 B) AKI. 3. 6. 1: We recommend not using recombinant human (rh)IGF-1 to prevent or treat AKI. (1 B)
 3. 7. 1: We suggest that a single dose of theophylline may be given in neonates with severe perinatal asphyxia, who are at high risk of AKI. (2 B) 3. 8. 1: We suggest not using aminoglycosides for the treatment of infections unless no suitable, less nephrotoxic, therapeutic alternatives are available. (2 A) 3. 8. 2: We suggest that, in patients with normal kidney function in steady state, aminoglycosides are administered as a single dose daily rather than multiple-dose daily treatment regimens. (2 B) 3. 8. 3: We recommend monitoring aminoglycoside drug levels when treatment with multiple daily dosing is used for more than 24 hours. (1 A) 3. 8. 4: We suggest monitoring aminoglycoside drug levels when treatment with single-daily dosing is used for more than 48 hours. (2 C) 3. 8. 5: We suggest using topical or local applications of aminoglycosides (e. g. , respiratory aerosols, instilled antibiotic beads), rather than i. v. application, when feasible and suitable. (2 B) 3. 8. 6: We suggest using lipid formulations of amphotericin B rather than conventional formulations of amphotericin B. (2 A) 3. 8. 7: In the treatment of systemic mycoses or parasitic infections, we recommend using azole antifungal agents and/or the echinocandins rather than conventional amphotericin B, if equal therapeutic efficacy can be assumed. (1 A) 3. 9. 1: We suggest that off-pump coronary artery bypass graft surgery not be selected solely for the purpose of reducing perioperative AKI or need for RRT. (2 C) 3. 9. 2: We suggest not using NAC to prevent AKI in critically ill patients with hypotension. (2 D) 3. 9. 3: We recommend not using oral or i. v. NAC for prevention of postsurgical AKI. (1 A)
3. 7. 1: We suggest that a single dose of theophylline may be given in neonates with severe perinatal asphyxia, who are at high risk of AKI. (2 B) 3. 8. 1: We suggest not using aminoglycosides for the treatment of infections unless no suitable, less nephrotoxic, therapeutic alternatives are available. (2 A) 3. 8. 2: We suggest that, in patients with normal kidney function in steady state, aminoglycosides are administered as a single dose daily rather than multiple-dose daily treatment regimens. (2 B) 3. 8. 3: We recommend monitoring aminoglycoside drug levels when treatment with multiple daily dosing is used for more than 24 hours. (1 A) 3. 8. 4: We suggest monitoring aminoglycoside drug levels when treatment with single-daily dosing is used for more than 48 hours. (2 C) 3. 8. 5: We suggest using topical or local applications of aminoglycosides (e. g. , respiratory aerosols, instilled antibiotic beads), rather than i. v. application, when feasible and suitable. (2 B) 3. 8. 6: We suggest using lipid formulations of amphotericin B rather than conventional formulations of amphotericin B. (2 A) 3. 8. 7: In the treatment of systemic mycoses or parasitic infections, we recommend using azole antifungal agents and/or the echinocandins rather than conventional amphotericin B, if equal therapeutic efficacy can be assumed. (1 A) 3. 9. 1: We suggest that off-pump coronary artery bypass graft surgery not be selected solely for the purpose of reducing perioperative AKI or need for RRT. (2 C) 3. 9. 2: We suggest not using NAC to prevent AKI in critically ill patients with hypotension. (2 D) 3. 9. 3: We recommend not using oral or i. v. NAC for prevention of postsurgical AKI. (1 A)
 Доказательная медицина Почему не удается доказать клиническую эффективность медикаментозной нефропротекции ? ? ? Назначение препаратов производится несвоевременно, в ненадлежащей дозе или последовательности
Доказательная медицина Почему не удается доказать клиническую эффективность медикаментозной нефропротекции ? ? ? Назначение препаратов производится несвоевременно, в ненадлежащей дозе или последовательности
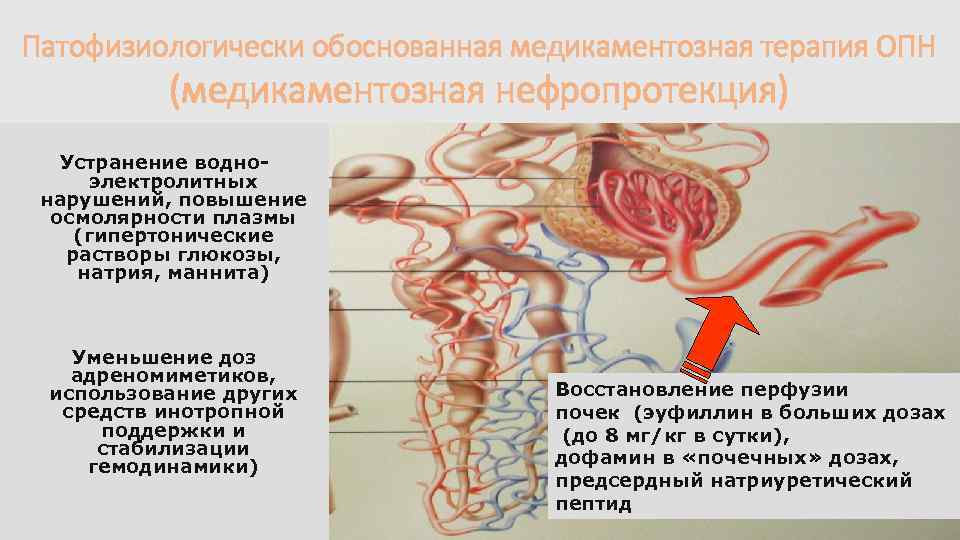 Патофизиологически обоснованная медикаментозная терапия ОПН (медикаментозная нефропротекция) Устранение водноэлектролитных нарушений, повышение осмолярности плазмы (гипертонические растворы глюкозы, натрия, маннита) Уменьшение доз адреномиметиков, использование других средств инотропной поддержки и стабилизации гемодинамики) Восстановление перфузии почек (эуфиллин в больших дозах (до 8 мг/кг в сутки), дофамин в «почечных» дозах, предсердный натриуретический пептид
Патофизиологически обоснованная медикаментозная терапия ОПН (медикаментозная нефропротекция) Устранение водноэлектролитных нарушений, повышение осмолярности плазмы (гипертонические растворы глюкозы, натрия, маннита) Уменьшение доз адреномиметиков, использование других средств инотропной поддержки и стабилизации гемодинамики) Восстановление перфузии почек (эуфиллин в больших дозах (до 8 мг/кг в сутки), дофамин в «почечных» дозах, предсердный натриуретический пептид
 Медикаментозная нефропротекция (продолжение) «Почечные» антигипоксанты – фуросемид 400 – 2000 мг в сутки (блокада канальцевой Na – К АТФазы) Механизм действия • Блокада Na – К АТФазы в восходящем колене петли Генле снижает энергопотребности клеток, может уменьшить «кислородный долг» и защитить клетки в условиях ишемии и гипоксии • Уменьшение реабсорбции воды в канальцах предотвращает гиперконцентрацию фильтрующихся макромолекул ( в т. ч. миоглобина, гемоглобина и т. д. ), образование глобул и обтурацию ими канальцев
Медикаментозная нефропротекция (продолжение) «Почечные» антигипоксанты – фуросемид 400 – 2000 мг в сутки (блокада канальцевой Na – К АТФазы) Механизм действия • Блокада Na – К АТФазы в восходящем колене петли Генле снижает энергопотребности клеток, может уменьшить «кислородный долг» и защитить клетки в условиях ишемии и гипоксии • Уменьшение реабсорбции воды в канальцах предотвращает гиперконцентрацию фильтрующихся макромолекул ( в т. ч. миоглобина, гемоглобина и т. д. ), образование глобул и обтурацию ими канальцев

 Принципы интенсивной терапии острого почечного повреждения 1. Ранняя диагностика 2. Устранение причины – восстановление перфузии почек 3. Недопущение перехода канальцевой дистрофии в канальцевый некроз Неолигурическая ОПН
Принципы интенсивной терапии острого почечного повреждения 1. Ранняя диагностика 2. Устранение причины – восстановление перфузии почек 3. Недопущение перехода канальцевой дистрофии в канальцевый некроз Неолигурическая ОПН
 АКШ с протезированием клапанов (n = 843) • Критерий ОПН - увеличение креатинина 25% в течение 7 дней • Летальность Без ОПН – 2. 7% Неолигурическая ОПН – 14. 5% ОПН, требующая гемодиализа – 83. 3% Loef BG, Epema AH, Smilde TD, et al: Immediate postoperative renal function deterioration in cardiac surgical patients predicts in-hospital mortality and long-term survival. J Am Soc Nephrol 2005; 16: 195 -200
АКШ с протезированием клапанов (n = 843) • Критерий ОПН - увеличение креатинина 25% в течение 7 дней • Летальность Без ОПН – 2. 7% Неолигурическая ОПН – 14. 5% ОПН, требующая гемодиализа – 83. 3% Loef BG, Epema AH, Smilde TD, et al: Immediate postoperative renal function deterioration in cardiac surgical patients predicts in-hospital mortality and long-term survival. J Am Soc Nephrol 2005; 16: 195 -200
 Медикаментозная нефропротекция (продолжение) Препараты эритропоэтина (EPO) Морфологические повреждения (канальцевый некроз) через 48 час после реперфузии у крыс, которым предварительно вводили ЕРО, было достоверно меньше. Цитопротективное действие ЕРО вероятно связано с антиапоптозным эффектом в клетках канальцев. Spandou E et al. Nephrol Dial Transplant 2006; 21: 330 -336 Даже отсроченное введение ЕРО и DPO уменьшало уровень креатинина и мочевины и степень дисфункции при экспериментальном повреждении почек. Морфологически - уменьшение тканевых повреждений (апоптоз) и повышение регенеративных возможностей, особенно в наружной части мозгового слоя. Johnson DW et al. Kidney Int 2006; 69: 1806 -1813
Медикаментозная нефропротекция (продолжение) Препараты эритропоэтина (EPO) Морфологические повреждения (канальцевый некроз) через 48 час после реперфузии у крыс, которым предварительно вводили ЕРО, было достоверно меньше. Цитопротективное действие ЕРО вероятно связано с антиапоптозным эффектом в клетках канальцев. Spandou E et al. Nephrol Dial Transplant 2006; 21: 330 -336 Даже отсроченное введение ЕРО и DPO уменьшало уровень креатинина и мочевины и степень дисфункции при экспериментальном повреждении почек. Морфологически - уменьшение тканевых повреждений (апоптоз) и повышение регенеративных возможностей, особенно в наружной части мозгового слоя. Johnson DW et al. Kidney Int 2006; 69: 1806 -1813
 Медикаментозная нефропротекция (продолжение) N - ацетилцистеин • Анализ 12 исследований (1324 больных) показал уменьшение числа ОПН, потребности в диализе и летальности от ОПН после кардиохирургических вмешательств S. Nigwekar, P. Kandula N-Acetylcysteine in Cardiovascular-Surgery–Associated Renal Failure: A Meta-Analysis Ann Thorac Surg 2009; 87: 139 -147 • Частота ОПН после кардиохирургических вмешательств (повышение Сr на 25% от исходного) уменьшилось с 52 до 40 % при использовании N-ацетилцистеина в качестве антиоксиданта E. Sisillo et al. N-acetylcysteine for prevention of acute renal failure in patients with chronic renal insufficiency undergoing cardiac surgery: a prospective, randomized, clinical trial Crit Care Med. 2008 Jan; 36(1): 81 -6
Медикаментозная нефропротекция (продолжение) N - ацетилцистеин • Анализ 12 исследований (1324 больных) показал уменьшение числа ОПН, потребности в диализе и летальности от ОПН после кардиохирургических вмешательств S. Nigwekar, P. Kandula N-Acetylcysteine in Cardiovascular-Surgery–Associated Renal Failure: A Meta-Analysis Ann Thorac Surg 2009; 87: 139 -147 • Частота ОПН после кардиохирургических вмешательств (повышение Сr на 25% от исходного) уменьшилось с 52 до 40 % при использовании N-ацетилцистеина в качестве антиоксиданта E. Sisillo et al. N-acetylcysteine for prevention of acute renal failure in patients with chronic renal insufficiency undergoing cardiac surgery: a prospective, randomized, clinical trial Crit Care Med. 2008 Jan; 36(1): 81 -6
 Доказательная медицина Почему не удается доказать клиническую эффективность медикаментозной нефропротекции ? ? ? MEDICA MENTE, NON MEDICAMENTE Назначение препаратов производится несвоевременно, в ненадлежащей дозе или последовательности
Доказательная медицина Почему не удается доказать клиническую эффективность медикаментозной нефропротекции ? ? ? MEDICA MENTE, NON MEDICAMENTE Назначение препаратов производится несвоевременно, в ненадлежащей дозе или последовательности
 Нефропротективное действие заместительной почечной терапии (1) Стабилизация системной гемодинамики при септическом шоке в результате проведения высокообъемной гемофильтрации
Нефропротективное действие заместительной почечной терапии (1) Стабилизация системной гемодинамики при септическом шоке в результате проведения высокообъемной гемофильтрации
 Нефропротективное действие заместительной почечной терапии (2) Удаление из крови токсинов, элиминирующимися почками Снижение функциональной нагрузки Предотвращение гиперфильтрации Сохранение функционального резерва
Нефропротективное действие заместительной почечной терапии (2) Удаление из крови токсинов, элиминирующимися почками Снижение функциональной нагрузки Предотвращение гиперфильтрации Сохранение функционального резерва
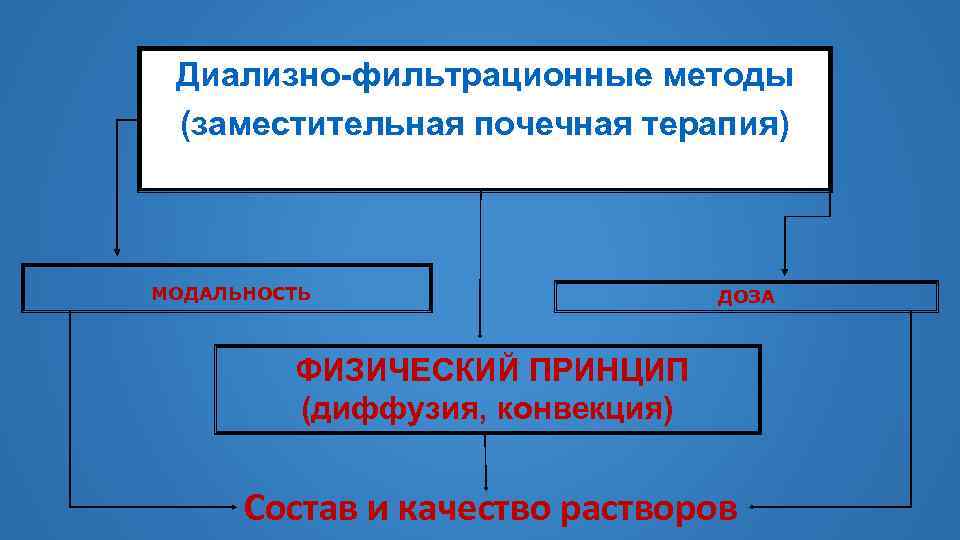 Диализно-фильтрационные методы (заместительная почечная терапия) МОДАЛЬНОСТЬ ДОЗА ФИЗИЧЕСКИЙ ПРИНЦИП (диффузия, конвекция) Состав и качество растворов
Диализно-фильтрационные методы (заместительная почечная терапия) МОДАЛЬНОСТЬ ДОЗА ФИЗИЧЕСКИЙ ПРИНЦИП (диффузия, конвекция) Состав и качество растворов
 Willem Johan Kolff (1911 - 2009) Впервые доказал пользу клинического применения диализа. В 1943 г. он применил диализ и в 1944 г. имел опыт лечения уже 16 больных с ОПН. Первый успешный результат с восстановлением почечной функции получен в 1945 г у больной с ОПН после применения сульфаниламидов по поводу острого холецистита. 1945 г. - J. Fine разработал систему приготовления стерильных растворов и введения их в брюшную полость. 1946 г. -H. Frank, A. Seligman, J. Fine. Излечение от ОПН при помощи ПД 1977 г. - Kramer с соавт. предложили метод CAVH.
Willem Johan Kolff (1911 - 2009) Впервые доказал пользу клинического применения диализа. В 1943 г. он применил диализ и в 1944 г. имел опыт лечения уже 16 больных с ОПН. Первый успешный результат с восстановлением почечной функции получен в 1945 г у больной с ОПН после применения сульфаниламидов по поводу острого холецистита. 1945 г. - J. Fine разработал систему приготовления стерильных растворов и введения их в брюшную полость. 1946 г. -H. Frank, A. Seligman, J. Fine. Излечение от ОПН при помощи ПД 1977 г. - Kramer с соавт. предложили метод CAVH.
 В рандомизированном клиническом исследовании не выявлено достоверных различий в летальности и восстановлении почечной функции в зависимости от сроков начала гемодиализа. Bouman CS et al. Effects of early high-volume continuous venous hemofiltration on survival and recovery of renal function in intensive care patients with acute renal failure. Crit Care Med. 2002 ; 30: 2205 -11 Не выявлено достоверных различий в выживаемости, длительности ЗПТ и длительности стационарного лечения при сравнении методов продленной и интермиттирующей заместительной почечной терапии. Uehlinger D. et al. Comparison of continuous and intermittent renal replacement therapy for acute renal failure. NDT 2005 20: 1630 -1637
В рандомизированном клиническом исследовании не выявлено достоверных различий в летальности и восстановлении почечной функции в зависимости от сроков начала гемодиализа. Bouman CS et al. Effects of early high-volume continuous venous hemofiltration on survival and recovery of renal function in intensive care patients with acute renal failure. Crit Care Med. 2002 ; 30: 2205 -11 Не выявлено достоверных различий в выживаемости, длительности ЗПТ и длительности стационарного лечения при сравнении методов продленной и интермиттирующей заместительной почечной терапии. Uehlinger D. et al. Comparison of continuous and intermittent renal replacement therapy for acute renal failure. NDT 2005 20: 1630 -1637
 Общие критерии начала ЗПТ при ОПН • Анурия/Олигурия (< 400 мл/сут) • Urea > 25 ммоль/л • Crсыв > 600 мкмоль/л/ ↑ 100 мкмоль/сут • Гиперкалиемия (К+ > 6, 0 ммоль/л+ЭКГ) • Отек лёгких, резистентный к диуретикам • Периферические отёки • Метаболический ацидоз: ↓р. Нарт < 7, 2/HCO 3 - <15 • • • Уремическая энцефалопатия Уремический перикардит Дизнатриемия (115>Na>160 ммоль/л) Передозировка диализирующихся лекарственных препаратов Неконтролируемая гипертермия (Т°>39, 5°)
Общие критерии начала ЗПТ при ОПН • Анурия/Олигурия (< 400 мл/сут) • Urea > 25 ммоль/л • Crсыв > 600 мкмоль/л/ ↑ 100 мкмоль/сут • Гиперкалиемия (К+ > 6, 0 ммоль/л+ЭКГ) • Отек лёгких, резистентный к диуретикам • Периферические отёки • Метаболический ацидоз: ↓р. Нарт < 7, 2/HCO 3 - <15 • • • Уремическая энцефалопатия Уремический перикардит Дизнатриемия (115>Na>160 ммоль/л) Передозировка диализирующихся лекарственных препаратов Неконтролируемая гипертермия (Т°>39, 5°)
 Показания для начала заместительной почечной терапии (С. Ronco N. Lamiere) • Urea >25 -30 mmol/L and creatinine >500 -700 micromol/L, unless there is clear evidence that recovery is underway • Refractory hyperkalaemia • Intractable fluid overload • Acidosis producing circulatory compromise • Overt uraemia manifesting as encephalopathy, pericarditis, or uraemic bleeding • Oliguria with urine output less than 200 m. L/12 hours • Acidaemia (p. H<7. 0) • Toxicity with drugs that can be dialysed • Hyperthermia
Показания для начала заместительной почечной терапии (С. Ronco N. Lamiere) • Urea >25 -30 mmol/L and creatinine >500 -700 micromol/L, unless there is clear evidence that recovery is underway • Refractory hyperkalaemia • Intractable fluid overload • Acidosis producing circulatory compromise • Overt uraemia manifesting as encephalopathy, pericarditis, or uraemic bleeding • Oliguria with urine output less than 200 m. L/12 hours • Acidaemia (p. H<7. 0) • Toxicity with drugs that can be dialysed • Hyperthermia
 Заместительная почечная терапия – значение модальности
Заместительная почечная терапия – значение модальности
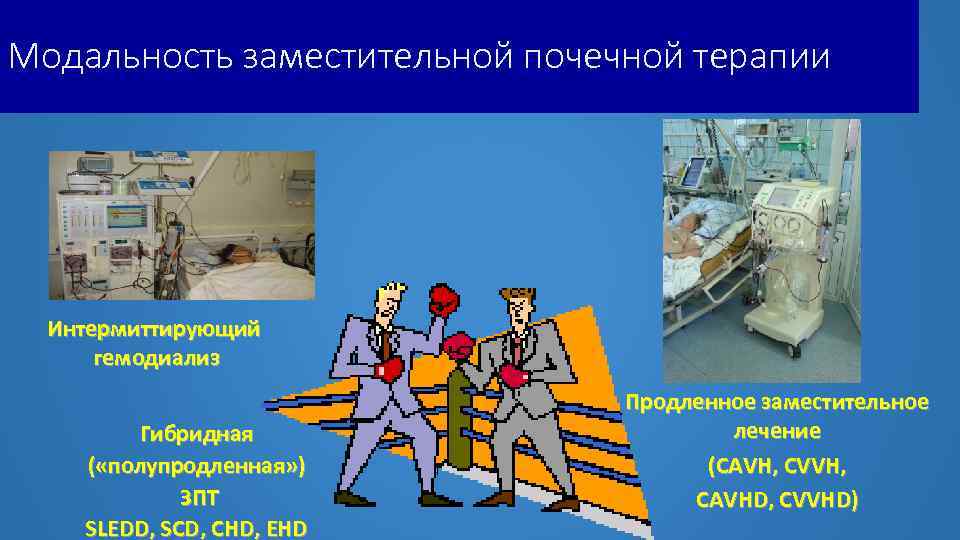 Модальность заместительной почечной терапии Интермиттирующий гемодиализ Гибридная ( «полупродленная» ) ЗПТ SLEDD, SCD, CHD, EHD Продленное заместительное лечение (CAVH, CVVH, CAVHD, CVVHD)
Модальность заместительной почечной терапии Интермиттирующий гемодиализ Гибридная ( «полупродленная» ) ЗПТ SLEDD, SCD, CHD, EHD Продленное заместительное лечение (CAVH, CVVH, CAVHD, CVVHD)
 ПРЕИМУЩЕСТВА ПРОДЛЕННОГО ЛЕЧЕНИЯ ПЕРЕД ПРЕРЫВИСТЫМ üПротезирование не только выделительной, но и гомеостатической функции почек üБольшая стабильность внутрисосудистого объема, состава крови и тканевых жидкостей üЛучший контроль водно-электролитного баланса üВозможность проведения полноценной инфузионнотрансфузионной терапии
ПРЕИМУЩЕСТВА ПРОДЛЕННОГО ЛЕЧЕНИЯ ПЕРЕД ПРЕРЫВИСТЫМ üПротезирование не только выделительной, но и гомеостатической функции почек üБольшая стабильность внутрисосудистого объема, состава крови и тканевых жидкостей üЛучший контроль водно-электролитного баланса üВозможность проведения полноценной инфузионнотрансфузионной терапии
 Ограничения продленной заместительной терапии • Постоянная потеря многих медикаментов, жизненно важных нутриентов и т. д • Круглосуточное применение - нагрузка на персонал - ограничение подвижности больного • Круглосуточная антикоагуляция -риск развития кровотечений, ГИТ, осложнений Ci-Ca антикоагуляции • Высокая стоимость лечения
Ограничения продленной заместительной терапии • Постоянная потеря многих медикаментов, жизненно важных нутриентов и т. д • Круглосуточное применение - нагрузка на персонал - ограничение подвижности больного • Круглосуточная антикоагуляция -риск развития кровотечений, ГИТ, осложнений Ci-Ca антикоагуляции • Высокая стоимость лечения
 Выбор режима диализа при ОПН Мнения диализных врачей на конференциях ERA-EDTA, WCN, ASN, CRRT ISECEM (2005 – 2006) • Западная Европа 1582 • Восточная Европа 1655 • Реаниматологи 1091 • Азия 1008 • Америка 523 • Нефрологи 3206 • Северная Африка 625 • Другие 1076 • Другие страны 484 Нефрологи Реаниматологи Всего CRRT 52% 75% 55% SLEDD 21% 12% 19% 18% 9% 17% Standart HD 5% 3% 6% Другое 3% 2% 4% Daily IHD
Выбор режима диализа при ОПН Мнения диализных врачей на конференциях ERA-EDTA, WCN, ASN, CRRT ISECEM (2005 – 2006) • Западная Европа 1582 • Восточная Европа 1655 • Реаниматологи 1091 • Азия 1008 • Америка 523 • Нефрологи 3206 • Северная Африка 625 • Другие 1076 • Другие страны 484 Нефрологи Реаниматологи Всего CRRT 52% 75% 55% SLEDD 21% 12% 19% 18% 9% 17% Standart HD 5% 3% 6% Другое 3% 2% 4% Daily IHD
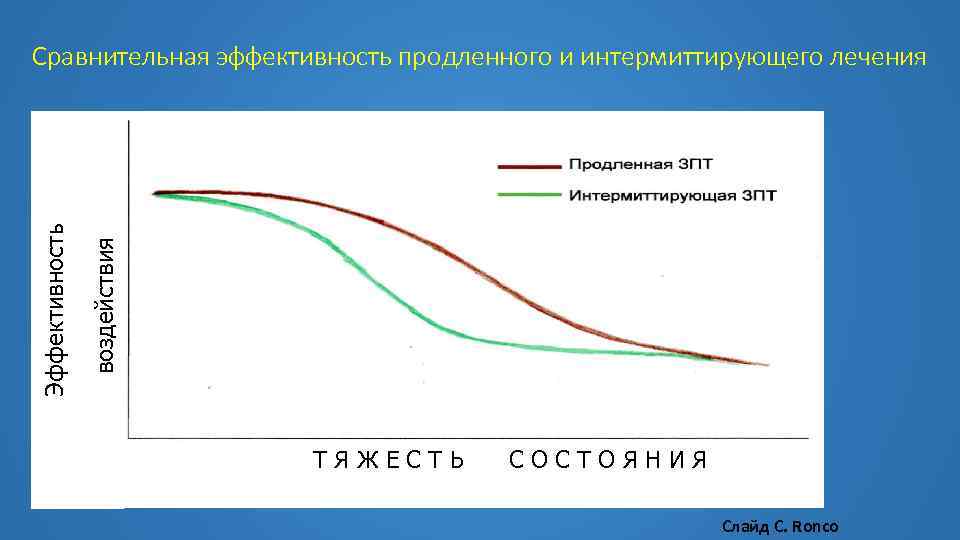 воздействия Эффективность Сравнительная эффективность продленного и интермиттирующего лечения ТЯЖЕСТЬ СОСТОЯНИЯ Слайд С. Ronco
воздействия Эффективность Сравнительная эффективность продленного и интермиттирующего лечения ТЯЖЕСТЬ СОСТОЯНИЯ Слайд С. Ronco
 Мы чувствуем конец доклада! Осталось всего 50 слайдов…
Мы чувствуем конец доклада! Осталось всего 50 слайдов…
 Заместительная почечная терапия – значение дозы
Заместительная почечная терапия – значение дозы
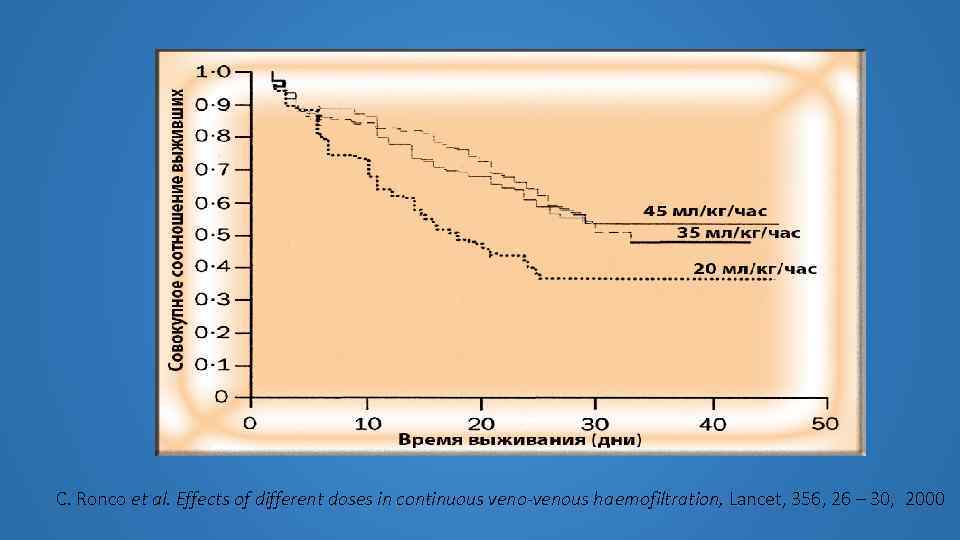 С. Ronco et al. Effects of different doses in continuous veno-venous hаеmоfiltrаtiоn, Lancet, 356, 26 – 30, 2000
С. Ronco et al. Effects of different doses in continuous veno-venous hаеmоfiltrаtiоn, Lancet, 356, 26 – 30, 2000

 Среднее артериальное давление во время высокообъёмной и стандартной гемофильтрации при септическом шоке 1 группа, n = 24 2 группа, n = 17
Среднее артериальное давление во время высокообъёмной и стандартной гемофильтрации при септическом шоке 1 группа, n = 24 2 группа, n = 17
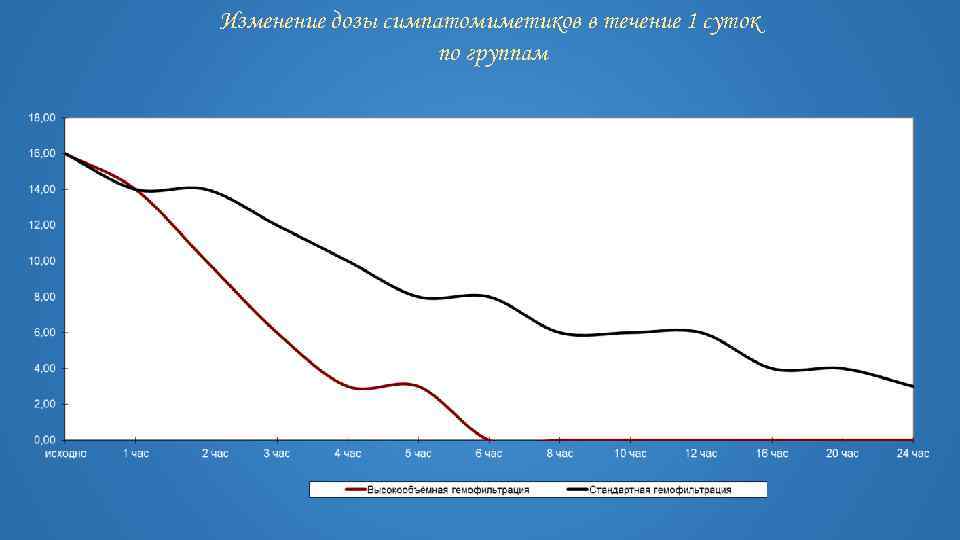 Изменение дозы симпатомиметиков в течение 1 суток по группам
Изменение дозы симпатомиметиков в течение 1 суток по группам
 Эффективность высокообъёмной гемофильтрации для предупреждения повреждения почек при септическом шоке Высокообъёмная ГФ Стандартная ГФ
Эффективность высокообъёмной гемофильтрации для предупреждения повреждения почек при септическом шоке Высокообъёмная ГФ Стандартная ГФ
 Заместительная почечная терапия – значение физического принципа
Заместительная почечная терапия – значение физического принципа
 Гемодиализ Диффузия Гемодиафильтрация Гемофильтрация Конвекция Выведение средних молекул
Гемодиализ Диффузия Гемодиафильтрация Гемофильтрация Конвекция Выведение средних молекул
 Заместительная почечная терапия – значение состава замещающего (диализирующего) раствора
Заместительная почечная терапия – значение состава замещающего (диализирующего) раствора


 Заключение Стратегия терапии при ОПН На основе своевременной функционально обоснованной диагностики содружественное применение двух лечебных воздействий -Патофизиологически обоснованной медикаментозной НЕФРОПРОТЕКЦИИ -Раннего использования индивидуально подобранной заместительной почечной терапии
Заключение Стратегия терапии при ОПН На основе своевременной функционально обоснованной диагностики содружественное применение двух лечебных воздействий -Патофизиологически обоснованной медикаментозной НЕФРОПРОТЕКЦИИ -Раннего использования индивидуально подобранной заместительной почечной терапии
 …Искусство врачевания - не шаблон, не стандарт, а сложнообозримый спектр индивидуальных реакций, индивидуальных вариантов течения болезни. В. Ф. Войно-Ясенецкий святитель Лука, исповедник, Архиепископ Симферопольский и Крымский (19461961) Архиепископ Красноярский и Енисейский (1942 -1944)
…Искусство врачевания - не шаблон, не стандарт, а сложнообозримый спектр индивидуальных реакций, индивидуальных вариантов течения болезни. В. Ф. Войно-Ясенецкий святитель Лука, исповедник, Архиепископ Симферопольский и Крымский (19461961) Архиепископ Красноярский и Енисейский (1942 -1944)
 БЛАГОДАРЮ ЗА ВНИМАНИЕ !
БЛАГОДАРЮ ЗА ВНИМАНИЕ !


