Семинар Комплексные соединения.pptx
- Количество слайдов: 24
 Семинар по неорганической химии: Комплексные соединения Качественный анализ Подготовил: Эшмаков Родион, ученик 11 класса МБОУ «Лицей № 41»
Семинар по неорганической химии: Комплексные соединения Качественный анализ Подготовил: Эшмаков Родион, ученик 11 класса МБОУ «Лицей № 41»
 Комплексные соединения: история открытия и изучения
Комплексные соединения: история открытия и изучения
 История открытия и изучения
История открытия и изучения
 Теория Вернера: термины
Теория Вернера: термины
 Образование комплексной частицы
Образование комплексной частицы
 Изомерия комплексов
Изомерия комплексов
 Номенклатура комплексных соединений
Номенклатура комплексных соединений
 Реакции комплексных соединений Вступают в реакции:
Реакции комплексных соединений Вступают в реакции:
 Примеры реакций комплексных соединений
Примеры реакций комплексных соединений
 Разрушение и получение аквакомплексов При нагревании твердых кристаллогидратов аквакомплекс рушится и изменяется цвет солей: Cu. SO 4*5 H 2 O = Cu. SO 4 + 5 H 2 O Ni. SO 4*7 H 2 O = Ni. SO 4 + 7 H 2 O Co. Cl 2*6 H 2 O = Co. Cl 2 + 6 H 2 O При добавлении воды к безводным солям возвращается прежняя окраска – снова получается аквакомплекс.
Разрушение и получение аквакомплексов При нагревании твердых кристаллогидратов аквакомплекс рушится и изменяется цвет солей: Cu. SO 4*5 H 2 O = Cu. SO 4 + 5 H 2 O Ni. SO 4*7 H 2 O = Ni. SO 4 + 7 H 2 O Co. Cl 2*6 H 2 O = Co. Cl 2 + 6 H 2 O При добавлении воды к безводным солям возвращается прежняя окраска – снова получается аквакомплекс.
 Получение гидроксокомплексов Соли амфотерных металлов способны давать растворимые комплексы в избытке щелочи: Al 3+ + 6 OH- = [Al(OH)6]3 - - гексагидроксоалюминат Zn 2+ + 4 OH- = [Zn(OH)4]2 - - тетрагидроксоцинкат Pb 2+ + 4 OH- = [Pb(OH)4]2 - - тетрагидроксоплюмбат Cr 3+ + 6 OH- = [Cr(OH) 6]3 - - гексагидроксохромит Различение бесцветных катионов амфотерных металлов – непростая задача.
Получение гидроксокомплексов Соли амфотерных металлов способны давать растворимые комплексы в избытке щелочи: Al 3+ + 6 OH- = [Al(OH)6]3 - - гексагидроксоалюминат Zn 2+ + 4 OH- = [Zn(OH)4]2 - - тетрагидроксоцинкат Pb 2+ + 4 OH- = [Pb(OH)4]2 - - тетрагидроксоплюмбат Cr 3+ + 6 OH- = [Cr(OH) 6]3 - - гексагидроксохромит Различение бесцветных катионов амфотерных металлов – непростая задача.
 Получение аммиакатов Многие металлы образуют комплексные соединения с аммиаком. Al 3+, Pb 2+ - не дают аммиакатов! Zn 2+ + 4 NH 3 = [Zn(NH 3)4]2+ Cu 2+ + 4 NH 3 = [Cu(NH 3)4]2+ Ni 2+ + 6 NH 3 = [Ni(NH 3)6]2+ Co 2+ + 6 NH 3 = [Co(NH 3)6]2+
Получение аммиакатов Многие металлы образуют комплексные соединения с аммиаком. Al 3+, Pb 2+ - не дают аммиакатов! Zn 2+ + 4 NH 3 = [Zn(NH 3)4]2+ Cu 2+ + 4 NH 3 = [Cu(NH 3)4]2+ Ni 2+ + 6 NH 3 = [Ni(NH 3)6]2+ Co 2+ + 6 NH 3 = [Co(NH 3)6]2+
 Цианоферратные комплексы
Цианоферратные комплексы
 Образование роданидных комплексов Роданид-анион способен к образованию прочных соединений с ионами кобальта-II и железа-III: Fe 3+ + 3 NCS- = [Fe(NCS)3] - специфическая реакция на ион железа-III Co. SO 4 + 4 NH 4 NCS = (NH 4)2[Co(NCS)4] + (NH 4)2 SO 4 только при экстракции с помощью неводного растворителя
Образование роданидных комплексов Роданид-анион способен к образованию прочных соединений с ионами кобальта-II и железа-III: Fe 3+ + 3 NCS- = [Fe(NCS)3] - специфическая реакция на ион железа-III Co. SO 4 + 4 NH 4 NCS = (NH 4)2[Co(NCS)4] + (NH 4)2 SO 4 только при экстракции с помощью неводного растворителя
 Разрушение роданидных комплексов
Разрушение роданидных комплексов
 Качественная реакция на енолы
Качественная реакция на енолы
 Комплексы с ДМГО Качественная специфичная реакция на Ni 2+ с диметилглиоксимом (ДМГО) – реактивом Чугаева. Розовый осадок Подобную реакцию также дает ион железа-II, образуя виннокрасный раствор.
Комплексы с ДМГО Качественная специфичная реакция на Ni 2+ с диметилглиоксимом (ДМГО) – реактивом Чугаева. Розовый осадок Подобную реакцию также дает ион железа-II, образуя виннокрасный раствор.
 Получение хлоридного комплекса меди-II Гидрат-ион меди-II способен замещать воду в КС на хлорид-ионы при высокой их концентрации: 4 Na. Clтв. + Cu. SO 4 = Na 2 SO 4 + Na 2[Cu. Cl 4] Соединение очень устойчиво и может образовывать самостоятельные кристаллы. На связывании металла в хлоридный комплекс основан механизм действия царской водки.
Получение хлоридного комплекса меди-II Гидрат-ион меди-II способен замещать воду в КС на хлорид-ионы при высокой их концентрации: 4 Na. Clтв. + Cu. SO 4 = Na 2 SO 4 + Na 2[Cu. Cl 4] Соединение очень устойчиво и может образовывать самостоятельные кристаллы. На связывании металла в хлоридный комплекс основан механизм действия царской водки.
 Получение гликолята меди-II Ион меди-II способен реагировать в сильнощелочной среде с гликолями (вицинальными диолами), например – сахарами, глицерином, винной к-той и др. Глицерин Глицерат меди-II
Получение гликолята меди-II Ион меди-II способен реагировать в сильнощелочной среде с гликолями (вицинальными диолами), например – сахарами, глицерином, винной к-той и др. Глицерин Глицерат меди-II
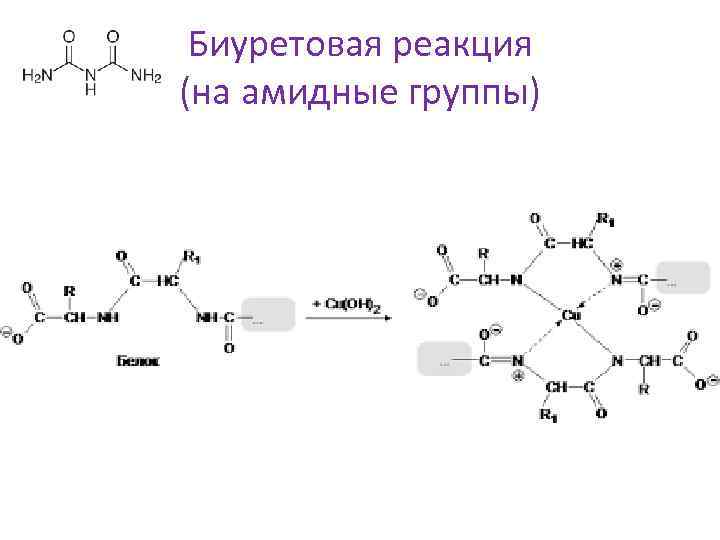 Биуретовая реакция (на амидные группы)
Биуретовая реакция (на амидные группы)
 Качественная реакция на ион калия Для определения она калия в растворе используют кобальтинитрит натрия: 3 K+ + Na 3[Co(NO 2)6] = K 3[Co(NO 2)6] + 3 Na+ Эта реакция не идеальна – мешающий ион аммония дает точно такой же осадок: 3 NH 4+ + Na 3[Co(NO 2)6] = (NH 4)3[Co(NO 2)6] + 3 Na+
Качественная реакция на ион калия Для определения она калия в растворе используют кобальтинитрит натрия: 3 K+ + Na 3[Co(NO 2)6] = K 3[Co(NO 2)6] + 3 Na+ Эта реакция не идеальна – мешающий ион аммония дает точно такой же осадок: 3 NH 4+ + Na 3[Co(NO 2)6] = (NH 4)3[Co(NO 2)6] + 3 Na+
 Качественная реакция на кислород Соединения меди-I неустойчивы на воздухе и легко окисляются кислородом воздуха. На окислении аммиаката меди-I основано колориметрическое определение кислорода. [Cu(NH 3)4](OH) 2 + NH 2 OH = [Cu(NH 3)2]OH + + ½ N 2 + 2 H 2 O + 2 NH 3 2 [Cu(NH 3)2]OH + ½ O 2 + 4 NH 3 + H 2 O = 2 [Cu(NH 3)4](OH) 2
Качественная реакция на кислород Соединения меди-I неустойчивы на воздухе и легко окисляются кислородом воздуха. На окислении аммиаката меди-I основано колориметрическое определение кислорода. [Cu(NH 3)4](OH) 2 + NH 2 OH = [Cu(NH 3)2]OH + + ½ N 2 + 2 H 2 O + 2 NH 3 2 [Cu(NH 3)2]OH + ½ O 2 + 4 NH 3 + H 2 O = 2 [Cu(NH 3)4](OH) 2
 Получение надхромовой кислоты Соединения Cr +6 могут образовывать надхромовую кислоту в реакциях с перекисью водорода. Эта надкислота фиолетового цвета относительно устойчива в неводной среде, для этого экстрагируем ее изоамиловым спиртом. Реакция является специфичной качественной на хроматы или пероксиды.
Получение надхромовой кислоты Соединения Cr +6 могут образовывать надхромовую кислоту в реакциях с перекисью водорода. Эта надкислота фиолетового цвета относительно устойчива в неводной среде, для этого экстрагируем ее изоамиловым спиртом. Реакция является специфичной качественной на хроматы или пероксиды.
 Благодарим за внимание!
Благодарим за внимание!


