биофизика 2.pptx
- Количество слайдов: 15

Семинар Многообразие подходов к секвенированию генома МБФ, отделение биофизики, 4 курс

Стратегии секвенирования геномов Метод дробовика (небольшие геномы) Метод сборки контигов из клонов Секвенирование – определение последовательности нуклеотидов в молекуле ДНК Рутинный метод в проекте «Геном человека» – ферментативный метод Сэнгера
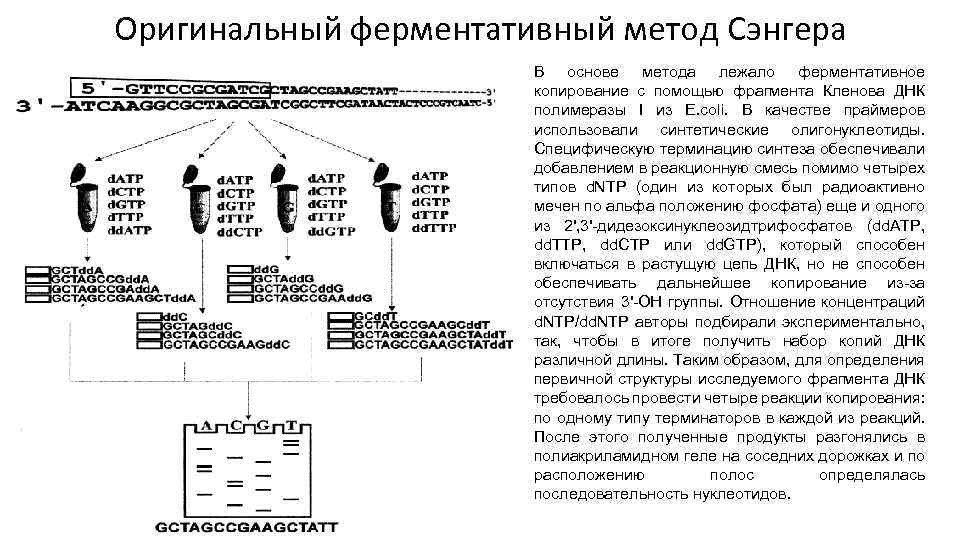
Оригинальный ферментативный метод Сэнгера В основе метода лежало ферментативное копирование с помощью фрагмента Кленова ДНК полимеразы I из E. coli. В качестве праймеров использовали синтетические олигонуклеотиды. Специфическую терминацию синтеза обеспечивали добавлением в реакционную смесь помимо четырех типов d. NTP (один из которых был радиоактивно мечен по альфа положению фосфата) еще и одного из 2', 3'-дидезоксинуклеозидтрифосфатов (dd. ATP, dd. TTP, dd. CTP или dd. GTP), который способен включаться в растущую цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за отсутствия 3'-ОН группы. Отношение концентраций d. NTP/dd. NTP авторы подбирали экспериментально, так, чтобы в итоге получить набор копий ДНК различной длины. Таким образом, для определения первичной структуры исследуемого фрагмента ДНК требовалось провести четыре реакции копирования: по одному типу терминаторов в каждой из реакций. После этого полученные продукты разгонялись в полиакриламидном геле на соседних дорожках и по расположению полос определялась последовательность нуклеотидов.
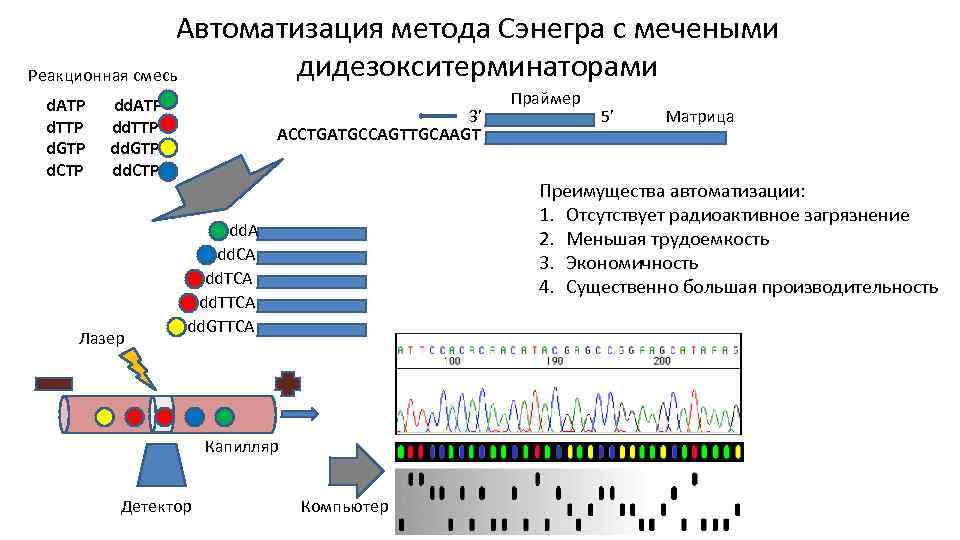
Автоматизация метода Сэнегра с мечеными дидезокситерминаторами Реакционная смесь d. ATP d. TTP d. GTP d. CTP dd. ATP dd. TTP dd. GTP dd. CTP Лазер 3’ ACCTGATGCCAGTTGCAAGT 5’ Матрица Преимущества автоматизации: 1. Отсутствует радиоактивное загрязнение 2. Меньшая трудоемкость 3. Экономичность 4. Существенно большая производительность dd. A dd. CA dd. TTCA dd. GTTCA Капилляр Детектор Праймер Компьютер

Развитие сопутствующих технологий для автоматизации метода Сэнегра Флуорофоры. Первыми флуорофорами, адаптированными к нуждам секвенирования, стали соединения из семейства флуоресцеиновых (FAM, JOE) и родаминовых (TAMRA, ROX, R 110, R 6 G) красителей. Следующее поколение флуорофоров этого семейства - d. TAMRA, d. ROX, d. R 110, d. R 6 G - получило довесок из двух остатков хлора. Это позволило несколько снизить перекрывание спектров испускания и значительно повысить интенсивность флуоресценции, а значит и чувствительность. Еще более высоким выходом флуоресценции характеризуются "трехкомпонентные" красители класса Big. Dye™ (Applied Biosystems), при конструировании которых был использован принцип переноса энергии. Под переносом энергии понимают явление безизлучательного переноса энергии возбужденного состояния от донора к акцептору. Донором в Big. Dye™ является 4'-аминометил-5(или 6)-карбоксифлуоресцеин, который связан с акцептором (представителем семейства d-родаминов) через остаток 4 -аминометилбензойной кислоты. Полимеразы. В оригинальной работе Ф. Сэнгера для проведения сиквенсовых реакций был использован Кленовский фрагмент ДНКполимеразы I из E. Coli. В настоящее время для секвенирования используют рекомбинантные ДНК-полимеразы, отвечающие следующим требованиям: отсутствие 3'- и 5'-экзонуклеазной активности, отсутствие дискриминации по включению в растущую цепь как обычных, так и модифицированных (меченных) dd. NTP. Всего существует два разных подхода. В первом случае (сейчас практически не используется) копирование осуществляется при 37°С высокопроцессивными термолабильными полимеразами (например, T 7 DNA polymerase). Однако наиболее распространен второй способ - циклический процесс, который включает денатурацию, Biosystems). Полимеры для секвенирования. Полученные в реакции секвенирования флуоресцентно меченные одноцепочные фрагменты ДНК разделяют с помощью электрофореза в полиакриламидном геле. Гели, используемые в секвенировании должны уметь разделять фрагменты, отличающиеся друг от друга на один нуклеотид в широком диапазоне длин. Разделение должно проходить в денатурирующих условиях, препятствующих ренатурации и возникновению вторичных структур у разделяемых фрагментов. В общем случае этим требованиям удовлетворяют 5 -8% полиакриламидные гели, содержащие 7 М мочевину. В автоматическом секвенировании используют капиллярный электрофорез в линейном полиакриламиде. Капилляры представляют собой стеклянную трубку длинной 30100 см, закатанную в полимерный пластификатор. Небольшой диаметр капилляра (50 -100 мкм) позволяет проводить разделение значительно быстрее, чем в обычных гелях. Кроме того, капиллярные секвенаторы позволяют обеспечивать гораздо более высокую чувствительность за счет отсутствия горизонтальной диффузии.

Рутинные задачи, решаемые на капиллярных секвенаторах Высокоразрешающий капиллярный электрофорез с детекцией флуоресценции Секвенирование Плазмида Секвенирование участков геномов, проверка вставок при создании генно-инженерных конструкций, разработка положительных контролей в ДНКдиагностике ПЦР-продукт Определение патологических мутаций в ДНКдиагностике, HLAгенотипирование, мт. ДНКгенотипирование Фрагментный анализ STR-маркеры Косвенная ДНКдиагностика, преимплантационная ДНК-диагностика, анализ потери гетерозиготности, микросателлитной нестабильности Минисеквенирование Определение «в одной пробирке» до 10 -12 мутаций (полиморфизмов) с помощью мультиплексной ПЦР и реакции удлинения внутреннего праймера в присутствии меченых дидезоксинуклеотидов
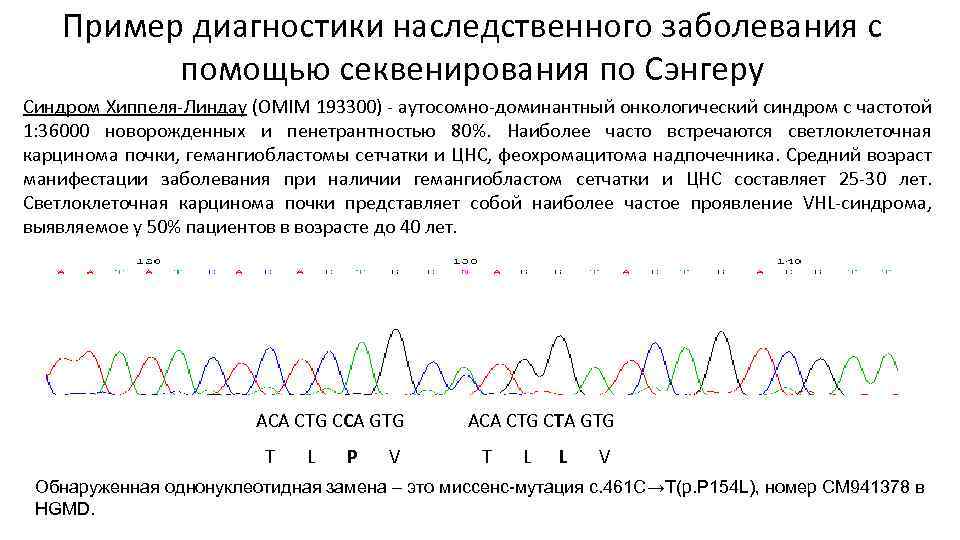
Пример диагностики наследственного заболевания с помощью секвенирования по Сэнгеру Синдром Хиппеля-Линдау (OMIM 193300) - аутосомно-доминантный онкологический синдром с частотой 1: 36000 новорожденных и пенетрантностью 80%. Наиболее часто встречаются светлоклеточная карцинома почки, гемангиобластомы сетчатки и ЦНС, феохромацитома надпочечника. Средний возраст манифестации заболевания при наличии гемангиобластом сетчатки и ЦНС составляет 25 -30 лет. Светлоклеточная карцинома почки представляет собой наиболее частое проявление VHL-синдрома, выявляемое у 50% пациентов в возрасте до 40 лет. ACA CTG CCA GTG T L P V ACA CTG CTA GTG T L L V Обнаруженная однонуклеотидная замена – это миссенс-мутация с. 461 С→Т(p. P 154 L), номер CM 941378 в HGMD.

Секвенирование нового поколения (NGS) Высокопроизводительное параллельное секвенирование или секвенирование следующего поколения (NGS – next generation sequencing), оно же полногеномное секвенирование позволяет определить последовательность нуклеотидов всего генома или его значительной части (например, экзома) в ходе одного эксперимента. Стало возможным благодаря: 1) изобретению микрочипов высокой плотности (в т. ч. проточных микрочипов) 2) развитию биоинформатики У всех методов NGS общий план эксперимента: 1) фрагментирование геномной ДНК 2) лигирование полученных фрагментов с адаптерами 3) клональная амплификация фрагментов (эмульсионная ПЦР, твердофазная амплификация на микрочипе) 4) оценка качества полученной геномной библиотеки 5) секвенирование на микрочипе (здесь как раз и есть все принципиальные методические различия) 6) сборка последовательностей с помощью высокопроизводительных компьютеров, аннотация выявленных мутаций и полиморфизмов
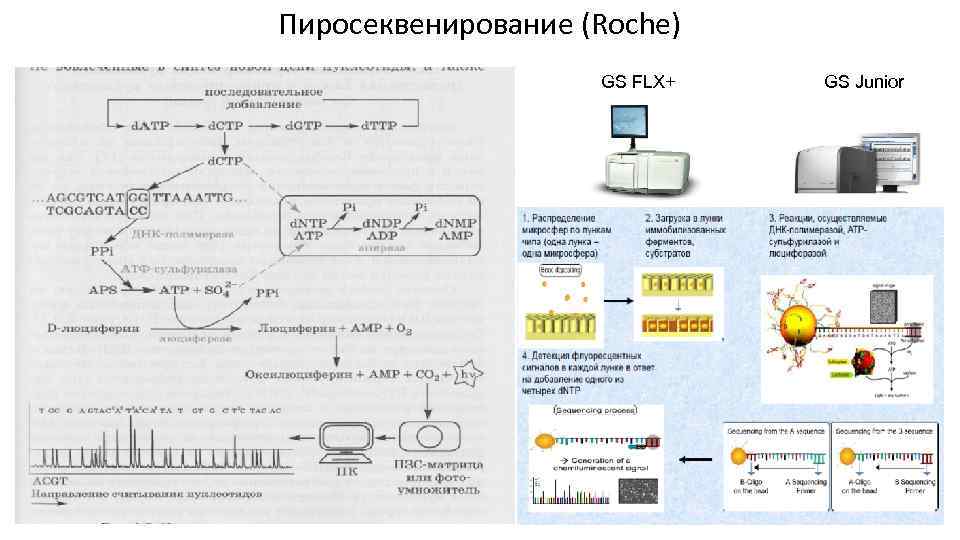
Пиросеквенирование (Roche) GS FLX+ GS Junior

Секвенирование лигированием (SOLi. D) 5500 W Genetic analyser Приготовление геномной библиотеки сначала было в виде эмульсионной ПЦР, а сейчас похоже на Illumina – «перешагивание» новосинтезированной цепи при амплификации на твердой фазе чипа
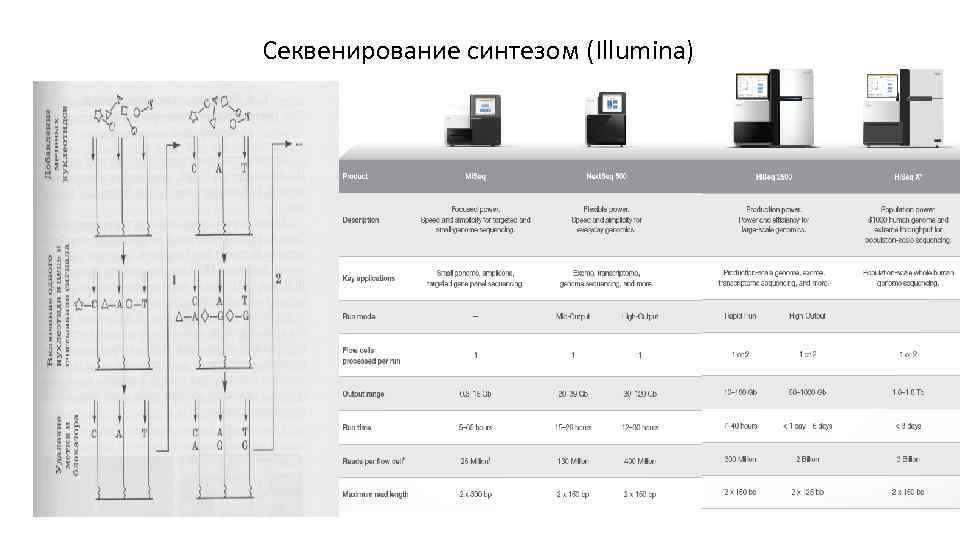
Секвенирование синтезом (Illumina)
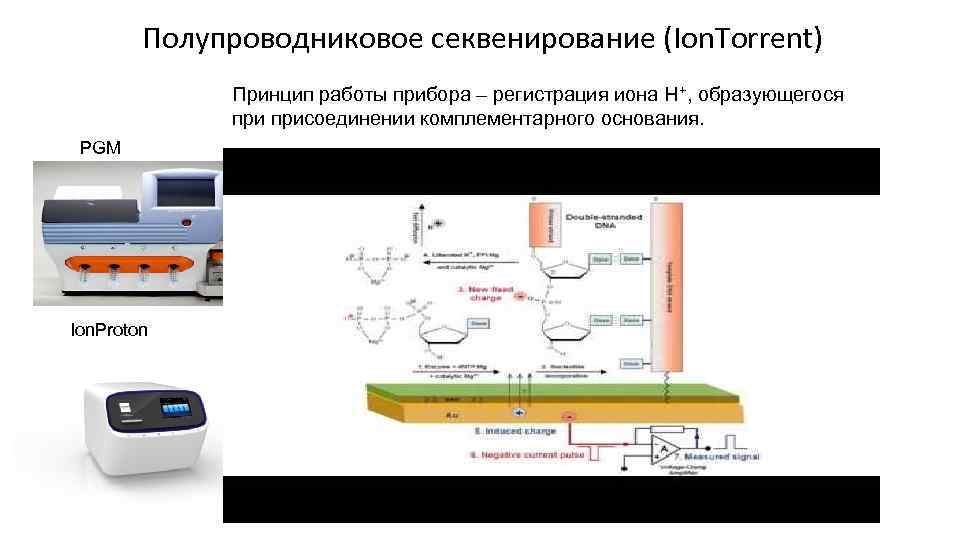
Полупроводниковое секвенирование (Ion. Torrent) Принцип работы прибора – регистрация иона Н+, образующегося присоединении комплементарного основания. PGM Ion. Proton

Пример диагностики наследственного заболевания с помощью NGS Один из первых примеров применения NGS в медицине (сейчас разработаны специальные панели Illumina и Ion. Torrent для диагностики наследственных заболеваний). В прямой ДНК-диагностике NGS нужен тогда, когда: 1. Протяженный исследуемый ген или несколько генов-кандидатов 2. Отсутствуют частые мутации ( «горячие точки» мутагенеза) 3. Секвенирование по Сэнгеру нецелесообразно в силу слишком большой трудоемкости и финансовых затрат в расчете на одного пациента Но: обнаруженную методом NGS мутацию пока надо подтверждать «золотым стандартом» – сиквенсом по Сэнгеру

Анализ соматических мутаций с помощью NGS позволяет выявлять соматические мутации при избытке нормальной ДНК, это позволяет, например, изучать внутриопухолевую генетическую гетерогенность, строить филогенетические деревья прогрессии разных субклонов в опухоли и определять происхождение метастазов

Вопросы по теме к тесту 1. К основным стратегиям секвенирования генома можно отнести: А) метод дробовика Б) выявление регуляторных элементов в генах В) метод сборки контигов из клонов 2. Основным рутинным методом секвенирования в проекте «Геном человека» стал: А) плюс-минус метод Сенгера-Коулсона Б) ферментативный метод Сенгера (метод терминирующих дидезоксинуклеотидов) В) метод химической деградации (метод Максама. Гилберта) 4. Появление методов NGS стало возможным вследствие: А) изобретения микрочипов высокой плотности Б) автоматизации ферментативного метода Сэнгера В) развития биоинформатики 5. К основным этапам полногеномного секвенирования относят: А) фрагментирование геномной ДНК и последующее лигирование с адаптерами Б) клональную амплификацию фрагментов В) сборку геномных последовательностей с помощью методов биоинформатики Г) клонирование фрагмента геномной ДНК в 3. Автоматизация ферментативного метода Сенгера плазмидном векторе в E. coli характеризовалась: А) использованием флуоресцентных красителей 6. Какую практическую задачу решает вместо радиоактивной метки секвенирование в медицине: Б) высоковольтным капиллярным электрофорезом в А) прямая ДНК-диагностика наследственных специальных приборах - секвенаторах заболеваний В) секвенированием на проточных микрочипах Б) генотипирование по STR-маркерам В) построение рестрикционных карт плазмидной ДНК
биофизика 2.pptx