биофизика 1.pptx
- Количество слайдов: 15

Семинар Генетические маркеры и генотипирование МБФ, отделение биофизики, 4 курс

Что такое генетический маркер? Первыми известными маркерами служили гены. Аллели этих генов должны были иметь разное фенотипическое проявление для использования в генетическом картировании. Наиболее интенсивно генетические маркеры стали изучать в контексте физического картирования геномов. Генетический маркер – это участок ДНК с известной локализацией (не обязательно относящийся к гену). Он должен иметь хотя бы два аллеля. В генной инженерии для плазмид и других векторов в качестве маркеров часто используют сайты узнавания рестриктаз. Молекулярно-генетический маркер – это полиморфный признак на уровне нуклеотидной последовательности ДНК, выявляемый методами молекулярной биологии. Методы генотипирования, как правило, основаны на гибридизации с зондами - ПДРФ + Саузерн-блоттинг и ПЦР - ПЦР-ПДРФ - аллель-специфичная ПЦР - ПЦР в реальном времени с Taq. Man-зондами - ПЦР + фрагментный анализ - ПЦР + минисеквенирование

Типы полиморфизма в геноме человека Генетический полиморфизм – существование в популяции разных аллелей одного и того же локуса. На уровне последовательности ДНК выделяют следующие основные типы полиморфизма: 1. Однонуклеотидный полиморфизм (SNP – single nucleotide polymorphism). Самый распространенный тип полиморфизма, встречается, в среднем, через каждый 200 п. н. Локализованы как в кодирующих, так и в некодирующих участках генома (несинонимичные замены в кодирующей части генов могут быть подвержены действию отбора, хотя и некодирующие SNP могут влиять на сплайсинг, деградацию м. РНК или функцию регуляторных элементов). SNP – высокоразрешающие маркеры, разработано много методов их генотипирования. Однако у SNP низкая гетерозиготность по сравнению, например, с STR-маркерами. Основные методы генотипирования: ПЦР-ПДРФ, ПЦР в реальном времени с аллель-специфичными праймерами или Taq. Man-зондами (если изучают несколько SNP), гибридизационные микрочипы, массивное параллельное секвенирование – NGS, next generation sequencing – если нужен высокопроизводительный анализ (все SNP в геноме или его большой части). 2. Полиморфизм длины коротких последовательностей (SSLP – simple sequence length polymorphism). Эти последовательности содержат повторы с различным числом коровых единиц, представлены в популяции серией аллелей, характеризуются высокой гетерозиготностью. В зависимости от длины коровой единицы SSLP делят на 1) минисателлиты (VNTR – variable number tandem repeat), длина единицы повтора может составлять 8 -25 п. н. 2) микросателлиты (STR – short tandem repeat), длина единицы повтора находится в пределах 1 -7 п. н. Основной метод генотипирования в медицине – ПЦР с последующим фрагментным анализом на секвенаторе. Высокопроизводительный анализ в фундаментальных исследованиях в масштабах генома возможен лишь на некоторых NGSплатформах, например, работающих методом «секвенирования синтезом» (Illumina). 3. Инсерционно-делеционный полиморфизм – наличе/отсутствие участка ДНК. Например, I/D-полиморфизм в гене ангиотензинконвертирующего фермента (АСЕ), обусловленный Alu-элементом длиной 287 п. н. в 16 интроне гена, или полиморфизм по наличию делеции 32 п. н. в гене CCR 5, связанный с устойчивостью к HIV.

Характеристика STR-маркеров - Длина единицы повтора 1 -7 п. н. , длина самого STR – от 5 до нескольких десятков повторяющихся единиц - Бывают совершенные (непрерывные) и несовершенные (со вставкой других нуклеотидов между повторяющимися единицами) - Представлены серией аллелей, характеризуются высокой гетерозиготностью (в отличие от SNP) - Встречаются чаще в межгенных участках и интронах, чем в экзонах (из-за действия отбора) - В экзонах наблюдают, в основном, полиморфизм тринуклеотидных повторов (не меняет рамку считывания) - Чем меньше длина повтора (повторяющейся единицы), тем чаще встречается повтор в геноме - Удобные инструменты для анализа наследования аллелей, идентификации индивидуума (высокая гетерозиготность + простота генотипирования)

Косвенная ДНК-диагностика бывает: а) прямая – определение мутации с ее точной идентификацией б) косвенная – определение STR-маркеров, сцепленных с неидентифицированной мутацией Для проведения косвенной ДНК-диагностики необходимы условия: 1. Ген картирован, известна его экзон-интронная структура 2. Известны полиморфные STR-маркеры, локализованные близко от тестируемого гена (или непосредственно в интронах) 3. Требуется анализ членов семьи из 2 -3 поколений (проследить наследование гаплотипа, сцепленного с мутацией) 4. Помимо пробанда и здоровых родственников, необходим еще минимум один родственник, у которого диагностировано заболевание (чтобы определить аллели, сцепленные с мутацией) 5. Существует вероятность (1 -5% для одного фланкирующего ген STR-маркера) того, что в результате кроссинговера у пробанда мутация и первоначально сцепленный с ней аллель STR-маркера разошлись по разным хромосомам (проблема решается использованием панели из нескольких STR-маркеров и выбором маркеров, лежащих как можно ближе к исследуемому гену или внутри него).
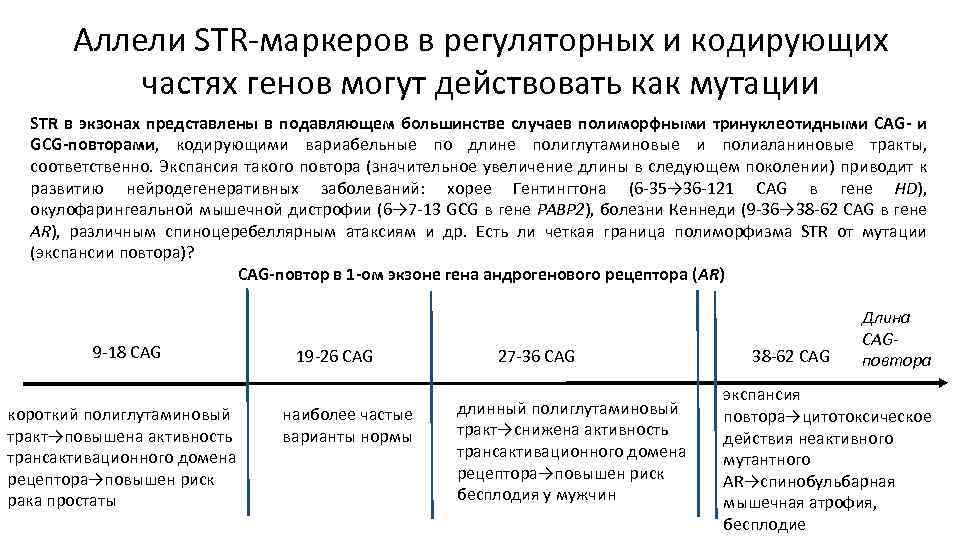
Аллели STR-маркеров в регуляторных и кодирующих частях генов могут действовать как мутации STR в экзонах представлены в подавляющем большинстве случаев полиморфными тринуклеотидными CAG- и GCG-повторами, кодирующими вариабельные по длине полиглутаминовые и полиаланиновые тракты, соответственно. Экспансия такого повтора (значительное увеличение длины в следующем поколении) приводит к развитию нейродегенеративных заболеваний: хорее Гентингтона (6 -35→ 36 -121 CAG в гене HD), окулофарингеальной мышечной дистрофии (6→ 7 -13 GCG в гене РАВР 2), болезни Кеннеди (9 -36→ 38 -62 CAG в гене AR), различным спиноцеребеллярным атаксиям и др. Есть ли четкая граница полиморфизма STR от мутации (экспансии повтора)? CAG-повтор в 1 -ом экзоне гена андрогенового рецептора (AR) 9 -18 CAG короткий полиглутаминовый тракт→повышена активность трансактивационного домена рецептора→повышен риск рака простаты 19 -26 CAG наиболее частые варианты нормы 27 -36 CAG длинный полиглутаминовый тракт→снижена активность трансактивационного домена рецептора→повышен риск бесплодия у мужчин 38 -62 CAG Длина CAGповтора экспансия повтора→цитотоксическое действия неактивного мутантного AR→спинобульбарная мышечная атрофия, бесплодие
Установление родства Для установления родства, как правило, используют STR-маркеры, локализованные на аутосомах. Желательно соблюдение следующих условий: - STR-маркеры должны быть в разных группах сцепления (на разных хромосомах или на противоположных концах хрососомы) - STR-маркеры должны обладать высокой гетерозиготностью в популяции - выбор тетра- и пентануклеотидных повторов предпочтительнее, чем ди- или тринуклеотидных, (меньше ошибок полимеразы и посторонних пиков на фрагментном анализе) Доля использования различных систем генетических маркеров при установлении родства в США *картинка с www. dnalab. ru
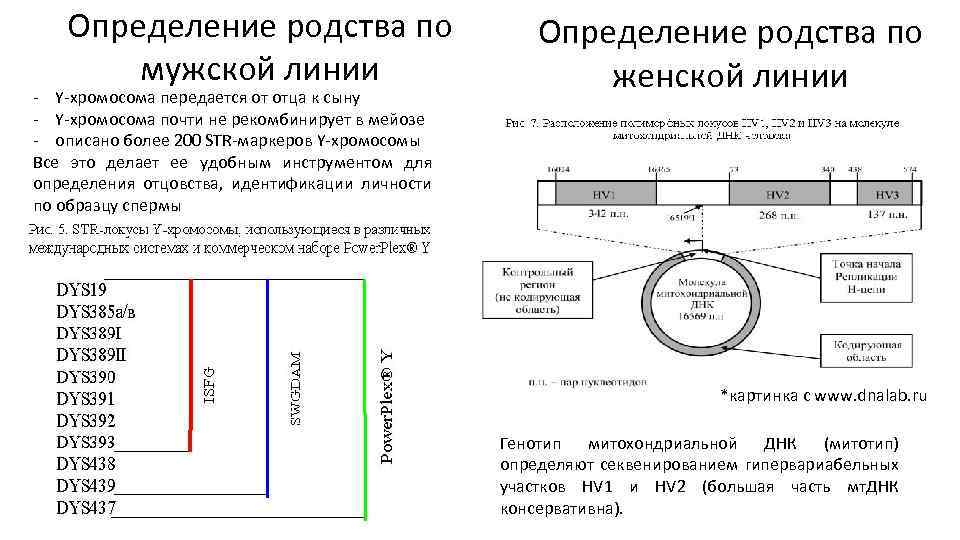
Определение родства по мужской линии - Y-хромосома передается от отца к сыну - Y-хромосома почти не рекомбинирует в мейозе - описано более 200 STR-маркеров Y-хромосомы Все это делает ее удобным инструментом для определения отцовства, идентификации личности по образцу спермы Определение родства по женской линии *картинка с www. dnalab. ru Генотип митохондриальной ДНК (митотип) определяют секвенированием гипервариабельных участков HV 1 и HV 2 (большая часть мт. ДНК консервативна).
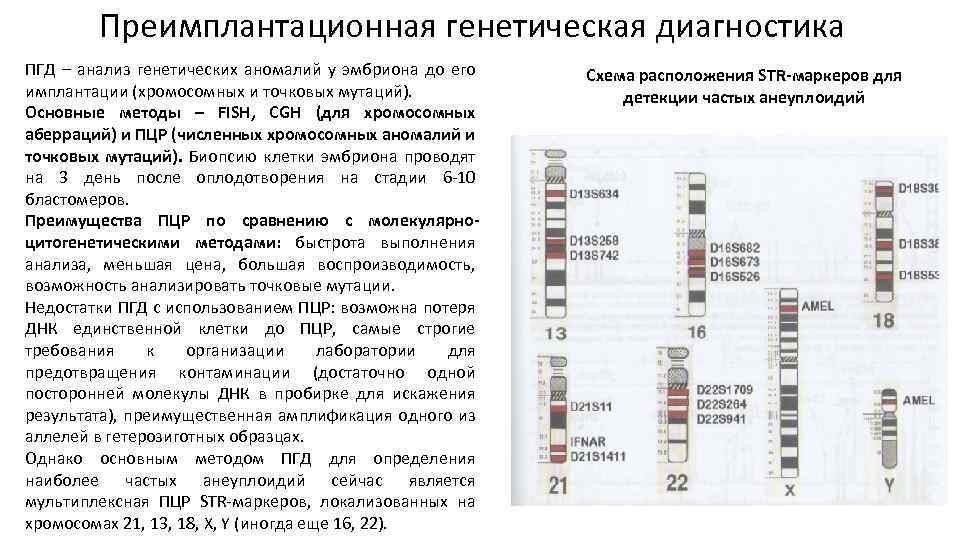
Преимплантационная генетическая диагностика ПГД – анализ генетических аномалий у эмбриона до его имплантации (хромосомных и точковых мутаций). Основные методы – FISH, CGH (для хромосомных аберраций) и ПЦР (численных хромосомных аномалий и точковых мутаций). Биопсию клетки эмбриона проводят на 3 день после оплодотворения на стадии 6 -10 бластомеров. Преимущества ПЦР по сравнению с молекулярноцитогенетическими методами: быстрота выполнения анализа, меньшая цена, большая воспроизводимость, возможность анализировать точковые мутации. Недостатки ПГД с использованием ПЦР: возможна потеря ДНК единственной клетки до ПЦР, самые строгие требования к организации лаборатории для предотвращения контаминации (достаточно одной посторонней молекулы ДНК в пробирке для искажения результата), преимущественная амплификация одного из аллелей в гетерозиготных образцах. Однако основным методом ПГД для определения наиболее частых анеуплоидий сейчас является мультиплексная ПЦР STR-маркеров, локализованных на хромосомах 21, 13, 18, X, Y (иногда еще 16, 22). Схема расположения STR-маркеров для детекции частых анеуплоидий
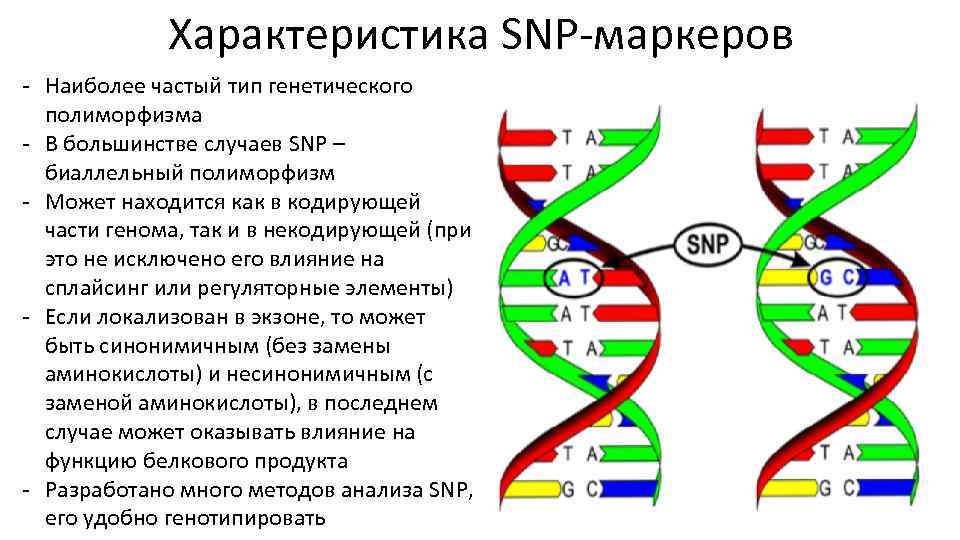
Характеристика SNP-маркеров - Наиболее частый тип генетического полиморфизма - В большинстве случаев SNP – биаллельный полиморфизм - Может находится как в кодирующей части генома, так и в некодирующей (при это не исключено его влияние на сплайсинг или регуляторные элементы) - Если локализован в экзоне, то может быть синонимичным (без замены аминокислоты) и несинонимичным (с заменой аминокислоты), в последнем случае может оказывать влияние на функцию белкового продукта - Разработано много методов анализа SNP, его удобно генотипировать

GWAS – Genome Wide Association Study Основные этапы GWAS: 1. Тщательное описание фенотипов исследуемой когорты. 2. С помощью микрочипов определяют генотипы от нескольких тысяч до миллиона известных SNP. 3. Для каждого SNP вычисляют ассоциацию его аллелей с заболеванием. 4. Значимость ассоциаций между SNP и фенотипом указывают на графике, отражающей расположение SNP вдоль хромосом (от 1 до Х) 5. Регион, превышающий установленный порог по уровню значимости, подвергают более точному картированию и проверке ассоциаций на независимой когорте. Проведены сотни GWAS для сложнонаследуемых признаков и мультифакториальных заболеваний. При этом 43% значимых SNP локализовались в межгенных областях, остальные – в генах. Из них 45% - в интронах, 2% - в нетранслируемых областях, 2% - синонимичные замены и только 9% - замены аминокислот. Ассоциация ≠ причинно-следственная связь!
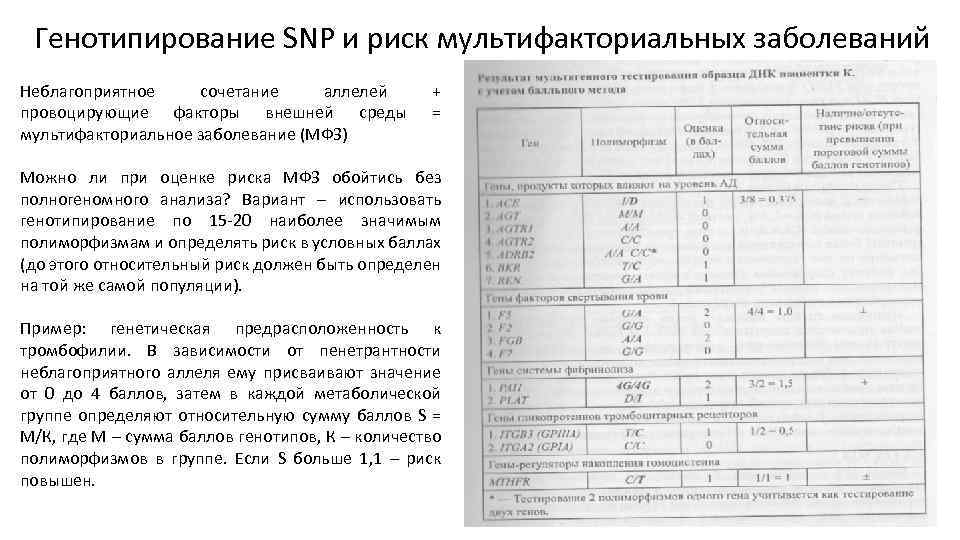
Генотипирование SNP и риск мультифакториальных заболеваний Неблагоприятное сочетание аллелей провоцирующие факторы внешней среды мультифакториальное заболевание (МФЗ) + = Можно ли при оценке риска МФЗ обойтись без полногеномного анализа? Вариант – использовать генотипирование по 15 -20 наиболее значимым полиморфизмам и определять риск в условных баллах (до этого относительный риск должен быть определен на той же самой популяции). Пример: генетическая предрасположенность к тромбофилии. В зависимости от пенетрантности неблагоприятного аллеля ему присваивают значение от 0 до 4 баллов, затем в каждой метаболической группе определяют относительную сумму баллов S = М/К, где М – сумма баллов генотипов, К – количество полиморфизмов в группе. Если S больше 1, 1 – риск повышен.

HLA-генотипирование Основное применение HLA-генотипирования – совместимость донора и реципиента при трансплантации органов, работа со стволовыми клетками, создание банков пуповинной крови. (SSP – sequence specific primers, SSO – sequence specific oligonucleotides, SBT – sequencing-based techniques)
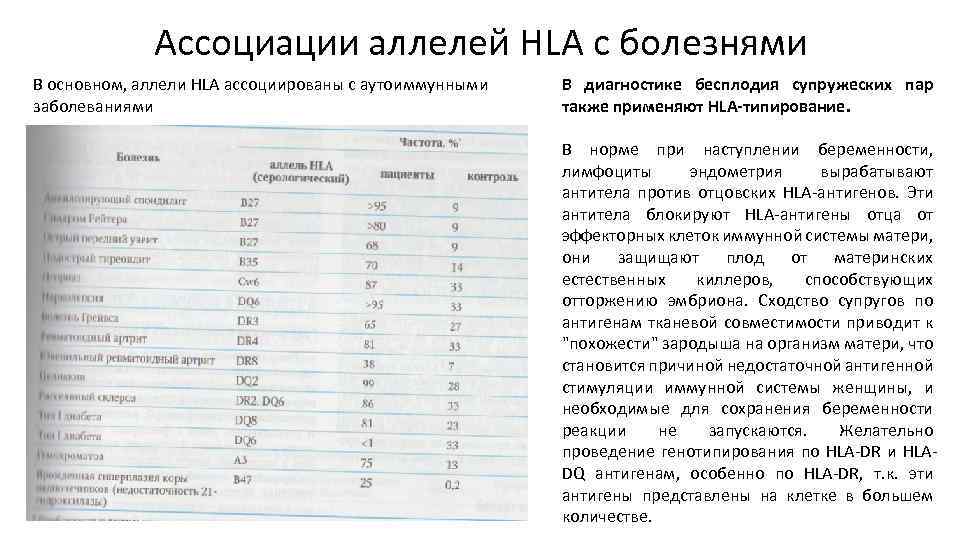
Ассоциации аллелей HLA с болезнями В основном, аллели HLA ассоциированы с аутоиммунными заболеваниями В диагностике бесплодия супружеских пар также применяют HLA-типирование. В норме при наступлении беременности, лимфоциты эндометрия вырабатывают антитела против отцовских HLA-антигенов. Эти антитела блокируют HLA-антигены отца от эффекторных клеток иммунной системы матери, они защищают плод от материнских естественных киллеров, способствующих отторжению эмбриона. Сходство супругов по антигенам тканевой совместимости приводит к "похожести" зародыша на организм матери, что становится причиной недостаточной антигенной стимуляции иммунной системы женщины, и необходимые для сохранения беременности реакции не запускаются. Желательно проведение генотипирования по HLA-DR и HLADQ антигенам, особенно по HLA-DR, т. к. эти антигены представлены на клетке в большем количестве.

Вопросы по теме к тесту 1. К генетическому полиморфизму относят: А) однонуклеотидный полиморфизм (SNP) Б) делеции в экзонах со сдвигом рамки считывания В) вариабельность длины STR-маркера 5. Количество аллелей SNP чаще всего равно: А) 2 Б) 3 В) 4 2. Длина единицы повтора микросателлита составляет: А) 8 -25 п. н. Б) 1 -7 п. н. В) несколько тысяч п. н. 6. Какие условия нужны для проведения косвенной ДНК-диагностики: А) семья должна быть информативна Б) исследуемый ген должен быть картирован В) патологическая мутация должна быть идентифицирована 3. Генотипирование STR-маркеров Y-хромосомы применяют для: А) идентификации личности в криминалистике Б) определения родства по материнской линии В) определения отцовства 7. Какую цель преследует GWAS: А) полногеномный анализ ассоциаций SNP с мультифакториальным заболеванием Б) генотипирование одного конкретного SNP В) мультиплексный анализ нескольких десятков SNP с 4. HLA-генотипирование применяют для: расчетом риска заболевания по относительным А) определения совместимости донора и реципиента баллам Б) выяснения причин бесплодия супружеской пары В) ПЦР-диагностики инфекционных заболеваний
биофизика 1.pptx