Презентация селен.ppt
- Количество слайдов: 18
 Селен, теллур и полоний история, распространенность и нахождение в природе Первым открыт теллур (Ф. Мюллер фон Райхенштайн в 1782 г) Теллур был впервые обнаружен в рудах, добываемых в золотоносном районе Трансильвании. Название тел лур (от латинского tellus — Земля) присвоил элементу другой австрийский химик, М. Клапрот, первооткрыватель элементов циркония и урана. Селен выделен в 1817 г. , оказался похожим на теллур, он получил имя от греческого слова — Луна. Открытие селена — заслуга шведских химиков И. Берцелиуса и Ю. Гана; они наблюдали красно корич невый осадок при сжигании серы, полученной из медных пиритов, осадок оказался лету чим и легко восстанавливался до нового элемента. Полоний (в честь Поль ши от лат. — olonia). Мария Кюри в 1898 г – переработка огромного количества урановой P руды и последовательное разделение продуктов на основе только что открытого явле ния радиоактивности. Первый случай, ког да невидимые количества нового элемента были идентифицированы, выделены и изучены исклю чительно благодаря их радиоактивности. Селен и теллур сравнительно редкие элементы, в ряду распространенности химических элементов в земной коре они занимают соответственно 66 и 73 места; полоний, в связи с его радиоактивным распадом, в природе встречается исключительно редко. 6 Содержание селена в земной коре состав ляет ~5 • 10 % (что близко к содержанию Ag и Hg и Pd. Теллура в земной 7%, что сравнимо с содержанием Au и Ir). коре ~2∙ 10 Оба элемента обычно сопутствуют сере, а многие их минералы встречаются в приро де вместе с сульфидами халькофильных металлов, например Cu, Ag, Au; Zn, Cd, Hg; Fe. Со, Ni; Pb, As, Bi. Иногда эти минералы частично окислены, например MSe. O 3∙ 2 H 2 O (M = Ni, Cu, Pb); Pb. Te. O 3, Fe 2(Te 03)3∙ 2 H 2 O, Fe. Te. O 4, Hg 2 Te. O 4 и т. д. Найдены также селенолит Se. O 2 и теллурит Te. O 2. У полония нет стабильных изотопов, все 27 его изотопов радиоактивны, и только Po встречает ся в природе, будучи предпоследним членом природного радиоактивного ряда радия: Из за быстрого распада 210 Po урановые руды со держат только 0, 1 мг o на тонну руды (т. е. около 10 8%). Суммарное P 14 %. содержание Po в земной коре составляет ~3 • 10
Селен, теллур и полоний история, распространенность и нахождение в природе Первым открыт теллур (Ф. Мюллер фон Райхенштайн в 1782 г) Теллур был впервые обнаружен в рудах, добываемых в золотоносном районе Трансильвании. Название тел лур (от латинского tellus — Земля) присвоил элементу другой австрийский химик, М. Клапрот, первооткрыватель элементов циркония и урана. Селен выделен в 1817 г. , оказался похожим на теллур, он получил имя от греческого слова — Луна. Открытие селена — заслуга шведских химиков И. Берцелиуса и Ю. Гана; они наблюдали красно корич невый осадок при сжигании серы, полученной из медных пиритов, осадок оказался лету чим и легко восстанавливался до нового элемента. Полоний (в честь Поль ши от лат. — olonia). Мария Кюри в 1898 г – переработка огромного количества урановой P руды и последовательное разделение продуктов на основе только что открытого явле ния радиоактивности. Первый случай, ког да невидимые количества нового элемента были идентифицированы, выделены и изучены исклю чительно благодаря их радиоактивности. Селен и теллур сравнительно редкие элементы, в ряду распространенности химических элементов в земной коре они занимают соответственно 66 и 73 места; полоний, в связи с его радиоактивным распадом, в природе встречается исключительно редко. 6 Содержание селена в земной коре состав ляет ~5 • 10 % (что близко к содержанию Ag и Hg и Pd. Теллура в земной 7%, что сравнимо с содержанием Au и Ir). коре ~2∙ 10 Оба элемента обычно сопутствуют сере, а многие их минералы встречаются в приро де вместе с сульфидами халькофильных металлов, например Cu, Ag, Au; Zn, Cd, Hg; Fe. Со, Ni; Pb, As, Bi. Иногда эти минералы частично окислены, например MSe. O 3∙ 2 H 2 O (M = Ni, Cu, Pb); Pb. Te. O 3, Fe 2(Te 03)3∙ 2 H 2 O, Fe. Te. O 4, Hg 2 Te. O 4 и т. д. Найдены также селенолит Se. O 2 и теллурит Te. O 2. У полония нет стабильных изотопов, все 27 его изотопов радиоактивны, и только Po встречает ся в природе, будучи предпоследним членом природного радиоактивного ряда радия: Из за быстрого распада 210 Po урановые руды со держат только 0, 1 мг o на тонну руды (т. е. около 10 8%). Суммарное P 14 %. содержание Po в земной коре составляет ~3 • 10
 Получение и применение простых веществ Основной источник Se и Те — анодный шлам, выпадающий в осадок в ходе электролитического рафинирования меди; эта «грязь» также содержит Ag, Au и платиновые металлы в количествах, имеющих промышленное значение. Селен также извлекают из отходов, собираемых на сернокислотных заводах, и из пыли, накапливаемой на электрофильтрах при производстве Cu и Pb. Типичная последовательность операций включает окисление при обжиге на воздухе с содой с последующим выщелачиванием: Ag 2 Se + Na 2 CO 3 + O 2 → 2 Ag + Na 2 Se. O 3 + CO 2 650 С Cu 2 Se + Na 2 CO 3 + 2 O 2→ 2 Cu. O + Na 2 Se. O 3+CO 2 Cu 2 Te + Na 2 CO 3 + 2 O 2 → 2 Cu. O +Na 2 Te. O 3 + CO 2 При отсутствии соды Se. O 2 может испаряться на прямую при обжиге: 300 C 650 C Cu 2 Se + O 2 → Cu. O + Cu. Se. O 3 → 2 Cu°+Se. O 2 Ag 2 Se. O 3 → 2 Ag + Se. O 2 + O 2 700 C Разделение Se и Те может быть достигнуто путем нейтрализации селенита щелочного металла и теллуритного щелока с помощью H 2 SO 4; при этом геллур осаждается как гидрат диоксида, а более сильная селенистая кислота H 2 Se. O 3 остается в растворе, откуда с помощью SO 2 может быть осажден селен 99, 5% ной чистоты: H 2 Se. O 3 + 2 SO 2 + H 2 O→ Se + 2 H 2 SO 4 Очень чистый селен можно получить нагреванием сырого селена в водороде при 650 0 C с последующим разложением образующегося при этом H 2 Se путем пропускания газа через кварцевую трубку при 1000 °С. Присутствующий H 2 S будучи более устойчивым, чем H 2 Se, проходит через трубку без изменений, а менее устойчивые водородные производные Te, P, As, Sb при 650 °С не образуются. Теллур получают растворением диоксида в водном растворе Na. OH с последующим электролитическим восстановлением: Na 2 Te. O 3 + H 2 O→ Те + 2 Na. OH + O 2 применение селена обесцвечивание стекол (из расчета 0, 01 0, 15 кг/т). Более высокие концент рации (1 2 кг/т) дают ежно розовое стекло н (рубиновые стекла включение Cd(S, Se) около 10% Cd. S) Сульфоселениды кадмия также широко применяются как термостойкие красные пигменты в пластмассах, красках, чернилах и эмалях. фотопроводник (селеновые фотоэлемен ты) и в качестве выпрямителей в полупроводнико вых устройствах. Небольшие количества ферроселена используют для улучшения качества литья, ковкости и способности к обработке нержа веющих сталей дитиокарбамат [Se(S 2 CNEt)4] находит применение в производстве резины из на турального и синтетического каучука. фармацевтические препараты (в малых масштабах) Получение соединений селена: Se. O 2, Na 2 Se. O 3, Na 2 Se. O 4, H 2 Se. O 4 и Se. OCl 2. ксерография
Получение и применение простых веществ Основной источник Se и Те — анодный шлам, выпадающий в осадок в ходе электролитического рафинирования меди; эта «грязь» также содержит Ag, Au и платиновые металлы в количествах, имеющих промышленное значение. Селен также извлекают из отходов, собираемых на сернокислотных заводах, и из пыли, накапливаемой на электрофильтрах при производстве Cu и Pb. Типичная последовательность операций включает окисление при обжиге на воздухе с содой с последующим выщелачиванием: Ag 2 Se + Na 2 CO 3 + O 2 → 2 Ag + Na 2 Se. O 3 + CO 2 650 С Cu 2 Se + Na 2 CO 3 + 2 O 2→ 2 Cu. O + Na 2 Se. O 3+CO 2 Cu 2 Te + Na 2 CO 3 + 2 O 2 → 2 Cu. O +Na 2 Te. O 3 + CO 2 При отсутствии соды Se. O 2 может испаряться на прямую при обжиге: 300 C 650 C Cu 2 Se + O 2 → Cu. O + Cu. Se. O 3 → 2 Cu°+Se. O 2 Ag 2 Se. O 3 → 2 Ag + Se. O 2 + O 2 700 C Разделение Se и Те может быть достигнуто путем нейтрализации селенита щелочного металла и теллуритного щелока с помощью H 2 SO 4; при этом геллур осаждается как гидрат диоксида, а более сильная селенистая кислота H 2 Se. O 3 остается в растворе, откуда с помощью SO 2 может быть осажден селен 99, 5% ной чистоты: H 2 Se. O 3 + 2 SO 2 + H 2 O→ Se + 2 H 2 SO 4 Очень чистый селен можно получить нагреванием сырого селена в водороде при 650 0 C с последующим разложением образующегося при этом H 2 Se путем пропускания газа через кварцевую трубку при 1000 °С. Присутствующий H 2 S будучи более устойчивым, чем H 2 Se, проходит через трубку без изменений, а менее устойчивые водородные производные Te, P, As, Sb при 650 °С не образуются. Теллур получают растворением диоксида в водном растворе Na. OH с последующим электролитическим восстановлением: Na 2 Te. O 3 + H 2 O→ Те + 2 Na. OH + O 2 применение селена обесцвечивание стекол (из расчета 0, 01 0, 15 кг/т). Более высокие концент рации (1 2 кг/т) дают ежно розовое стекло н (рубиновые стекла включение Cd(S, Se) около 10% Cd. S) Сульфоселениды кадмия также широко применяются как термостойкие красные пигменты в пластмассах, красках, чернилах и эмалях. фотопроводник (селеновые фотоэлемен ты) и в качестве выпрямителей в полупроводнико вых устройствах. Небольшие количества ферроселена используют для улучшения качества литья, ковкости и способности к обработке нержа веющих сталей дитиокарбамат [Se(S 2 CNEt)4] находит применение в производстве резины из на турального и синтетического каучука. фармацевтические препараты (в малых масштабах) Получение соединений селена: Se. O 2, Na 2 Se. O 3, Na 2 Se. O 4, H 2 Se. O 4 и Se. OCl 2. ксерография
 Ксерография Ч. Карлсон (США) в 1934 1942 гг. «ксерография» от греческих слов хего— сухой, graphy— записывать. Последовательность стадий процесса 1. Сенсибилизация фоторецептора. Фоторецептор состоит из пленки аморфного селена толщиной примерно 50 мкм, осажденной в вакууме на подложку из алюминия, она сенсибилизируется статическим зарядом от коронного разряда (электр. поле ~105 В/см). 2. Экспозиция и образование скрытого изображения. Сенсибилизированный фоторецептор экспонируют, т. е. проецируют на него копируемое изображение; на светлых участках поверхностный потенциал понижается, что обусловлено разрядом фотопроводника. Поскольку ток может протекать только перпендикулярно поверхности, на этой стадии возникает распре деление электрического потенциала, отражающее особенности копируемого изображения. 3. Обработка изображения. Ее ведут, используя смесь черных (или цветных) частиц тонера, обычно диаметром 10 мкм, и сферических бусинок носителя ( 100 мкм в диаметре). Частицы тонера приобретают заряд трибоэлектрическим путем (т. е. за счет трения) и преимущественно притягиваются или поверхностными силами на границах темного и светлого, или (в системах со встроенным электродом) в соответствии с абсолютным потенциалом в темных областях; они прочно прилипают к фоторецептору. Таким образом формируется видимое изображение, соответствующее скрытому электростатическому ото бражению. 4. Перенос изображения. Эта операция делается электростатически путем зарядки бумаги для печати, чтобы она притяги вала частицы тонера. 5. Фиксирование печати. Порошковое изображение делают постоянным путем сплавлении частиц тонера с бумагой, при помощи нагревания, повышения давления, или обработки парами растворителя. 6. Очистка. Немного тонера все же остается на фоторецепторе после процесса переноса; его удаляют щеткой или кистью либо сочетанием электростатического и механического способов. 7. Стирание изображения. Разности потенциалов, обусловленные образованием скрытого изображения, удаляют, освещая фоторецептор с помощью достаточно интенсивного источника света, чтобы выровнять поверхностный потенциал до неко торого одинаково низкого значения; затем фоторецептор готов к следующему циклу копирования.
Ксерография Ч. Карлсон (США) в 1934 1942 гг. «ксерография» от греческих слов хего— сухой, graphy— записывать. Последовательность стадий процесса 1. Сенсибилизация фоторецептора. Фоторецептор состоит из пленки аморфного селена толщиной примерно 50 мкм, осажденной в вакууме на подложку из алюминия, она сенсибилизируется статическим зарядом от коронного разряда (электр. поле ~105 В/см). 2. Экспозиция и образование скрытого изображения. Сенсибилизированный фоторецептор экспонируют, т. е. проецируют на него копируемое изображение; на светлых участках поверхностный потенциал понижается, что обусловлено разрядом фотопроводника. Поскольку ток может протекать только перпендикулярно поверхности, на этой стадии возникает распре деление электрического потенциала, отражающее особенности копируемого изображения. 3. Обработка изображения. Ее ведут, используя смесь черных (или цветных) частиц тонера, обычно диаметром 10 мкм, и сферических бусинок носителя ( 100 мкм в диаметре). Частицы тонера приобретают заряд трибоэлектрическим путем (т. е. за счет трения) и преимущественно притягиваются или поверхностными силами на границах темного и светлого, или (в системах со встроенным электродом) в соответствии с абсолютным потенциалом в темных областях; они прочно прилипают к фоторецептору. Таким образом формируется видимое изображение, соответствующее скрытому электростатическому ото бражению. 4. Перенос изображения. Эта операция делается электростатически путем зарядки бумаги для печати, чтобы она притяги вала частицы тонера. 5. Фиксирование печати. Порошковое изображение делают постоянным путем сплавлении частиц тонера с бумагой, при помощи нагревания, повышения давления, или обработки парами растворителя. 6. Очистка. Немного тонера все же остается на фоторецепторе после процесса переноса; его удаляют щеткой или кистью либо сочетанием электростатического и механического способов. 7. Стирание изображения. Разности потенциалов, обусловленные образованием скрытого изображения, удаляют, освещая фоторецептор с помощью достаточно интенсивного источника света, чтобы выровнять поверхностный потенциал до неко торого одинаково низкого значения; затем фоторецептор готов к следующему циклу копирования.
 Применение теллура и полония Более 70% теллура потребляется в производстве железа и стали, а также цветных металлов и сплавов, а 25% идет на получение химических реактивов. Небольшое количество Te. O 2 идет на тонирование стекол, соединения теллура имеют некоторое применение как катализаторы и реагенты вулканизации в ре зиновой промышленности. Помимо Те, сплава Fe и Те и Te. O 2 производятся также Na 2 Te. O 4 и [Te(S 2 CNEt 2)]. Полоний из за его очень низкой распространен ности и очень короткого периода полураспада не получают из природного сырья. Практически все знания о физических и химических свойствах этого элемента получены при изучении 210 Po, который образуется при нейтронном облучении 209 Bi в ядерном реакторе: Все области применения полония связаны с его радиоактивностью: он почти чистый α излучатель и только 0. 0011% его активности относится к γ излучению. Из за короткого периода полураспада (138, 38 сут) это влечет за собой громадное выделение энергии (141 Вт на 1 г металла): соответственно происхо дит значительный саморазогрев полония и его соединений. Таким образом, элемент полоний мож но использовать как удобный легкий источник теп ла или термоэлектрической энергии для космиче ских спутников и лунных станций, не включаю щий никаких движущихся частей. Полоний также находит ограниченное применение в качестве ге нератора нейтронов.
Применение теллура и полония Более 70% теллура потребляется в производстве железа и стали, а также цветных металлов и сплавов, а 25% идет на получение химических реактивов. Небольшое количество Te. O 2 идет на тонирование стекол, соединения теллура имеют некоторое применение как катализаторы и реагенты вулканизации в ре зиновой промышленности. Помимо Те, сплава Fe и Те и Te. O 2 производятся также Na 2 Te. O 4 и [Te(S 2 CNEt 2)]. Полоний из за его очень низкой распространен ности и очень короткого периода полураспада не получают из природного сырья. Практически все знания о физических и химических свойствах этого элемента получены при изучении 210 Po, который образуется при нейтронном облучении 209 Bi в ядерном реакторе: Все области применения полония связаны с его радиоактивностью: он почти чистый α излучатель и только 0. 0011% его активности относится к γ излучению. Из за короткого периода полураспада (138, 38 сут) это влечет за собой громадное выделение энергии (141 Вт на 1 г металла): соответственно происхо дит значительный саморазогрев полония и его соединений. Таким образом, элемент полоний мож но использовать как удобный легкий источник теп ла или термоэлектрической энергии для космиче ских спутников и лунных станций, не включаю щий никаких движущихся частей. Полоний также находит ограниченное применение в качестве ге нератора нейтронов.
 Аллотропия Известны по крайней мере восемь разных по структуре модификаций селена. Три красные по лиморфные модификации (α , β, γ) состоят из циклических молекул Se 8 и отличаются только межмолекулярной упаковкой этих циклов в крис таллах. Циклические молекулы другого размера были недавно синтезированы в красных аллотропных формах и цикло~Sе 6, 7, а также в гете роциклических аналогах цикло e 5 S 2. S Серый «металлический» селен — это гексагональная кристаллическая форма, построенная из спиральных полимерных цепочек. Наконец, стекловид ный черный селен, обычная торговая форма селена, обладает исключительно сложной и нерегуляр ной структурой из больших полимерных колец, ко торые содержат до 1000 атомов в цикле. Гексагональный серый ( «металлический» ) селен — термодинамически наиболее устойчивая форма простого вещества. Он образуется при нагревании других модификаций и может быть так же получен медленным охлаждением расплавленного селена или конденсацией пара селена при температуре чуть ниже температуры плавления (220, 5 °С). Он является фотопроводником и единственной модификацией, которая проводит электрический ток. Его структура со стоит из неразветвленных спиральных цепей с рас стоянием e Se и повторяющимся фрагментом из трех атомов). S Серый Sex нерастворим с CS 2 и имеет плотность 4, 82 г/см 3 , это самая тяжелая модификация данного элемента. Родственная аллотропная форма — красный аморфный селен, образующийся при конденсации пара селена на холодной поверхности или при осаждении из водного раствора селенистой кислоты при обработке диоксидом серы или другим восстановителем. Он малора створим в CS 2, имеет деформированную цепочечную структуру и не проводит электрический ток. Стекловидный черный Se обычная торговая форма селена, он получается при быстром охлаждении расплавленного селена; это хрупкое, непрозрачное, сине черное, блестящее твердое вещество, которое немного растворимо в CS 2. Он не плавится, но размягчается примерно при 50 °С и быстро превращается в гексагональный серый Se при нагревании до 180 °С (в присутствии катализаторов, например галогенов, аминов и т. д. , при более низких температурах). Большой интерес к различным аллотропным формам селена, их ста билизации и взаимным превращениям вызван применением селена в фотоэлементах, выпрямителях и в ксерографии. Теллур имеет только одну кристаллическую модификацию, которая представляет собой сетку из спиральных цепей, аналогичных цепям в гексагональном Se. Полоний — уникальный элемент, поскольку в виде простого вещества он единственный кристал лизуется в простой кубической 0 форме (6 ближай ших соседних атомов на расстоянии 0, 335 нм). Эта α модификация искажается при 36 C и превра щается в простую ромбоэдрическую модификацию, в которой атомы Po также имеют 6 ближайших атомов соседей на расстоянии 0, 335 нм. Точную температуру фазового перехода определить трудно ввиду саморазогрева кристаллического полония предполагается, что обе модификации со существуют между 18 и 54 °С. Обе формы полония серебристо белые кристаллы с металличес ким блеском и обладают существенно более высо кой электропроводностью, чем теллур.
Аллотропия Известны по крайней мере восемь разных по структуре модификаций селена. Три красные по лиморфные модификации (α , β, γ) состоят из циклических молекул Se 8 и отличаются только межмолекулярной упаковкой этих циклов в крис таллах. Циклические молекулы другого размера были недавно синтезированы в красных аллотропных формах и цикло~Sе 6, 7, а также в гете роциклических аналогах цикло e 5 S 2. S Серый «металлический» селен — это гексагональная кристаллическая форма, построенная из спиральных полимерных цепочек. Наконец, стекловид ный черный селен, обычная торговая форма селена, обладает исключительно сложной и нерегуляр ной структурой из больших полимерных колец, ко торые содержат до 1000 атомов в цикле. Гексагональный серый ( «металлический» ) селен — термодинамически наиболее устойчивая форма простого вещества. Он образуется при нагревании других модификаций и может быть так же получен медленным охлаждением расплавленного селена или конденсацией пара селена при температуре чуть ниже температуры плавления (220, 5 °С). Он является фотопроводником и единственной модификацией, которая проводит электрический ток. Его структура со стоит из неразветвленных спиральных цепей с рас стоянием e Se и повторяющимся фрагментом из трех атомов). S Серый Sex нерастворим с CS 2 и имеет плотность 4, 82 г/см 3 , это самая тяжелая модификация данного элемента. Родственная аллотропная форма — красный аморфный селен, образующийся при конденсации пара селена на холодной поверхности или при осаждении из водного раствора селенистой кислоты при обработке диоксидом серы или другим восстановителем. Он малора створим в CS 2, имеет деформированную цепочечную структуру и не проводит электрический ток. Стекловидный черный Se обычная торговая форма селена, он получается при быстром охлаждении расплавленного селена; это хрупкое, непрозрачное, сине черное, блестящее твердое вещество, которое немного растворимо в CS 2. Он не плавится, но размягчается примерно при 50 °С и быстро превращается в гексагональный серый Se при нагревании до 180 °С (в присутствии катализаторов, например галогенов, аминов и т. д. , при более низких температурах). Большой интерес к различным аллотропным формам селена, их ста билизации и взаимным превращениям вызван применением селена в фотоэлементах, выпрямителях и в ксерографии. Теллур имеет только одну кристаллическую модификацию, которая представляет собой сетку из спиральных цепей, аналогичных цепям в гексагональном Se. Полоний — уникальный элемент, поскольку в виде простого вещества он единственный кристал лизуется в простой кубической 0 форме (6 ближай ших соседних атомов на расстоянии 0, 335 нм). Эта α модификация искажается при 36 C и превра щается в простую ромбоэдрическую модификацию, в которой атомы Po также имеют 6 ближайших атомов соседей на расстоянии 0, 335 нм. Точную температуру фазового перехода определить трудно ввиду саморазогрева кристаллического полония предполагается, что обе модификации со существуют между 18 и 54 °С. Обе формы полония серебристо белые кристаллы с металличес ким блеском и обладают существенно более высо кой электропроводностью, чем теллур.
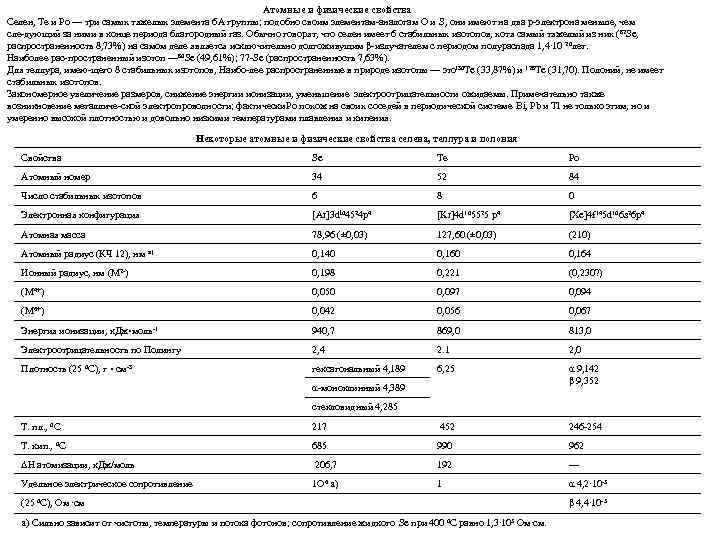 Атомные и физические свойства Селен, Те и Po — три самых тяжелых элемента 6 A группы; подобно своим элементам аналогам О и S, они имеют на два p электрона меньше, чем сле дующий за ними в конце периода благородный газ. Обычно говорят, что селен имеет 6 стабильных изотопов, хотя самый тяжелый из них (82 Se, распространенность 8, 73%) на самом деле является исключительно долгоживущим β излучателем с периодом полураспада 1, 4∙ 10 20 лет. 80 Наиболее рас пространенный изотоп — Se (49, 61%); 77 Se (распространенность 7, 63%). 130 Для теллура, имею щего 8 стабильных изотопов, Наибо лее распространенные в природе изотопы — это Te (33, 87%) и 128 Te (31, 70). Полоний, не имеет стабильных изотопов. Закономерное увеличение размеров, снижение энергии ионизации, уменьшение электроотрицательности ожидаемы. Примечательно также возникновение металличе ской электропроводности; фактически Po похож на своих соседей в периодической системе Bi, Pb и Tl не только этим, но и умеренно высокой плотностью и довольно низкими температурами плавления и кипения. Некоторые атомные и физические свойства селена, теллура и полония Свойства Se Те Po Атомный номер 34 52 84 Число стабильных изотопов 6 8 0 Электронная конфигурация [Ar]3 dl 04524 p 4 [Kr]4 d 105525 p 4 [Xe]4 f 145 d 106 s 26 p 4 Атомная масса 78, 96 (± 0, 03) 127, 60 (± 0, 03) (210) Атомный радиус (КЧ 12), нм а) 0, 140 0, 164 Ионный радиус, нм (M 2 ) 0, 198 0, 221 (0, 230? ) (M 4+) 0, 050 0, 097 0, 094 (M 6+) 0, 042 0, 056 0, 067 Энергия ионизации, к. Дж • моль 1 940, 7 869, 0 813, 0 Электроотрицательность по Полингу 2, 4 2. 1 2, 0 Плотность (25 0 C), г • см 3 гексагональный 4, 189 6, 25 α 9, 142 β 9, 352 α моноклинный 4, 389 стекловидный 4, 285 Т. пл. , 0 C 217 452 246 254 Т. кип. , 0 C 685 990 962 ΔH атомизации, к. Дж/моль 206, 7 192 — Удельное электрическое сопротивление 1 O 6 a) 1 α 4, 2∙ 10 5 (25 0 C), Ом ∙см a) Сильно зависит от чистоты, температуры и потока фотонов; сопротивление жидкого Se при 400 0 C равно 1, 3∙ 105 Ом∙см. β 4, 4∙ 10 5
Атомные и физические свойства Селен, Те и Po — три самых тяжелых элемента 6 A группы; подобно своим элементам аналогам О и S, они имеют на два p электрона меньше, чем сле дующий за ними в конце периода благородный газ. Обычно говорят, что селен имеет 6 стабильных изотопов, хотя самый тяжелый из них (82 Se, распространенность 8, 73%) на самом деле является исключительно долгоживущим β излучателем с периодом полураспада 1, 4∙ 10 20 лет. 80 Наиболее рас пространенный изотоп — Se (49, 61%); 77 Se (распространенность 7, 63%). 130 Для теллура, имею щего 8 стабильных изотопов, Наибо лее распространенные в природе изотопы — это Te (33, 87%) и 128 Te (31, 70). Полоний, не имеет стабильных изотопов. Закономерное увеличение размеров, снижение энергии ионизации, уменьшение электроотрицательности ожидаемы. Примечательно также возникновение металличе ской электропроводности; фактически Po похож на своих соседей в периодической системе Bi, Pb и Tl не только этим, но и умеренно высокой плотностью и довольно низкими температурами плавления и кипения. Некоторые атомные и физические свойства селена, теллура и полония Свойства Se Те Po Атомный номер 34 52 84 Число стабильных изотопов 6 8 0 Электронная конфигурация [Ar]3 dl 04524 p 4 [Kr]4 d 105525 p 4 [Xe]4 f 145 d 106 s 26 p 4 Атомная масса 78, 96 (± 0, 03) 127, 60 (± 0, 03) (210) Атомный радиус (КЧ 12), нм а) 0, 140 0, 164 Ионный радиус, нм (M 2 ) 0, 198 0, 221 (0, 230? ) (M 4+) 0, 050 0, 097 0, 094 (M 6+) 0, 042 0, 056 0, 067 Энергия ионизации, к. Дж • моль 1 940, 7 869, 0 813, 0 Электроотрицательность по Полингу 2, 4 2. 1 2, 0 Плотность (25 0 C), г • см 3 гексагональный 4, 189 6, 25 α 9, 142 β 9, 352 α моноклинный 4, 389 стекловидный 4, 285 Т. пл. , 0 C 217 452 246 254 Т. кип. , 0 C 685 990 962 ΔH атомизации, к. Дж/моль 206, 7 192 — Удельное электрическое сопротивление 1 O 6 a) 1 α 4, 2∙ 10 5 (25 0 C), Ом ∙см a) Сильно зависит от чистоты, температуры и потока фотонов; сопротивление жидкого Se при 400 0 C равно 1, 3∙ 105 Ом∙см. β 4, 4∙ 10 5
 Химические свойства Элементы демонстрируют закономер ность, присущую элементам предыдущих главных групп, а именно: усиление металлического характера с увеличением атомной массы в пределах группы. Так, O и S изоляторы, Se и Те — полу проводники, а o — металл. Параллельно с этим у теллура появляются P катионные (основные) свойства, которые у полония еще более выражены. Например, Se не взаимодействует с разбавленной HCl, в то время как Те растворяется в некоторой степени в присутствии воздуха, а Po растворяется легко, образуя розовые растворы Po. II , который за тем быстро окисляется до желтого Po. IV продуктами радиолитического разложения растворителя. Селен, Те и Po соединяются непосредственно с большинством других элементов, хотя менее активно, чем кислород и сера. К наиболее устойчивым соединениям относятся: а) селениды, теллуриды и полониды (M 2 ) 1 A, 2 A групп б) соединения с электроотрицательными элементами (О, F и Cl), в которых степени окисления селена, теллура и полония равны +2, +4 и +6. Эти соединения менее устойчивы, чем соответствующие соедине ния серы (или кислорода). Подобная закономерность (отмеченная и в предыдущих группах) снижение термической устойчивости водородных соединений: H 2 O > H 2 Se > H 2 Te > H 2 Po. Се лен и теллур в ограниченной степени обладают склонностью к катенации, столь характерной для серы. Окислительно восстановительные свойства эле ментов также демонстрируют интересные законо мерности. Вместе с другими элементами, расположенными в периодической системе после первого (3 d) ряда переходных элементов (особенно Ge, As, Se, Br), селен демонстрирует заметное сопротив ление окислению до максимальной групповой степени окисления, т. е. Se. VI. Например, в то вре мя как NO 3 легко окисляет H S до H 2 SO 4, селен дает H 2 Se. O 3. Кроме того, H 2 SO 4 с P 2 O 5 дает SO 3, в то время как H 2 Se. O 4 дает Se. O 2 и O 2 SO 2 осаждает Se из подкисленных растворов соединений Se. IV.
Химические свойства Элементы демонстрируют закономер ность, присущую элементам предыдущих главных групп, а именно: усиление металлического характера с увеличением атомной массы в пределах группы. Так, O и S изоляторы, Se и Те — полу проводники, а o — металл. Параллельно с этим у теллура появляются P катионные (основные) свойства, которые у полония еще более выражены. Например, Se не взаимодействует с разбавленной HCl, в то время как Те растворяется в некоторой степени в присутствии воздуха, а Po растворяется легко, образуя розовые растворы Po. II , который за тем быстро окисляется до желтого Po. IV продуктами радиолитического разложения растворителя. Селен, Те и Po соединяются непосредственно с большинством других элементов, хотя менее активно, чем кислород и сера. К наиболее устойчивым соединениям относятся: а) селениды, теллуриды и полониды (M 2 ) 1 A, 2 A групп б) соединения с электроотрицательными элементами (О, F и Cl), в которых степени окисления селена, теллура и полония равны +2, +4 и +6. Эти соединения менее устойчивы, чем соответствующие соедине ния серы (или кислорода). Подобная закономерность (отмеченная и в предыдущих группах) снижение термической устойчивости водородных соединений: H 2 O > H 2 Se > H 2 Te > H 2 Po. Се лен и теллур в ограниченной степени обладают склонностью к катенации, столь характерной для серы. Окислительно восстановительные свойства эле ментов также демонстрируют интересные законо мерности. Вместе с другими элементами, расположенными в периодической системе после первого (3 d) ряда переходных элементов (особенно Ge, As, Se, Br), селен демонстрирует заметное сопротив ление окислению до максимальной групповой степени окисления, т. е. Se. VI. Например, в то вре мя как NO 3 легко окисляет H S до H 2 SO 4, селен дает H 2 Se. O 3. Кроме того, H 2 SO 4 с P 2 O 5 дает SO 3, в то время как H 2 Se. O 4 дает Se. O 2 и O 2 SO 2 осаждает Se из подкисленных растворов соединений Se. IV.
 Токсичность Соединения Se, Те и Po следует рассматривать как потенциально токсичные. Летучие соедине ния, такие как H 2 Se, H 2 Te и органические производные, особенно опасны, и максимально допустимые концентрации их в воздухе составляют 0, 1 мг/м 3 (для сравнения: для HCN 10 мг/м 3). Элементы поглощаются почками, селезенкой и печенью, и даже в ничтожной концентрации вы зывают головную боль, тошноту и раздражение слизистых оболочек. В частности, селеноорганические соединения, попав в организм, медленно выводятся из него в течение продолжительного времени и в результате выдыхаемый воздух и испарения тела приобрета ют отвратительный запах. Селен также высокоток сичен для пасущихся овец, крупного рогатого ско та и других животных и при концентрации выше 5∙ 10 4% вызывает серьезные расстройства. Несмотря на это в 1957 г. было обнаружено, что Se играет существенную роль в питании людей и животных: он обеспечивает образование фермента глутатионпероксидазы, который участвует в жировом обмене веществ. Стало также известно, что распространение белковой недостаточности (низкого уровня расщепления белков) у детей связано с неадекватным усвоением селена, и это явление можно использовать для профилактики некоторых видов рака. Считают, что среднесуточное потребление Se ~150 мкг, обычно источником этого элемента служат мясо или морепродукты. Полоний исключительно токсичен при любых концентрациях и никогда не бывает полезен. Введение в организм даже ничтожных количеств Po влечет за собой жесткое действие радиации нa жизненно важные органы. Концентрация летучих соединений Po в воздухе должна быть не выше 1∙ 10 11 мг/м 3.
Токсичность Соединения Se, Те и Po следует рассматривать как потенциально токсичные. Летучие соедине ния, такие как H 2 Se, H 2 Te и органические производные, особенно опасны, и максимально допустимые концентрации их в воздухе составляют 0, 1 мг/м 3 (для сравнения: для HCN 10 мг/м 3). Элементы поглощаются почками, селезенкой и печенью, и даже в ничтожной концентрации вы зывают головную боль, тошноту и раздражение слизистых оболочек. В частности, селеноорганические соединения, попав в организм, медленно выводятся из него в течение продолжительного времени и в результате выдыхаемый воздух и испарения тела приобрета ют отвратительный запах. Селен также высокоток сичен для пасущихся овец, крупного рогатого ско та и других животных и при концентрации выше 5∙ 10 4% вызывает серьезные расстройства. Несмотря на это в 1957 г. было обнаружено, что Se играет существенную роль в питании людей и животных: он обеспечивает образование фермента глутатионпероксидазы, который участвует в жировом обмене веществ. Стало также известно, что распространение белковой недостаточности (низкого уровня расщепления белков) у детей связано с неадекватным усвоением селена, и это явление можно использовать для профилактики некоторых видов рака. Считают, что среднесуточное потребление Se ~150 мкг, обычно источником этого элемента служат мясо или морепродукты. Полоний исключительно токсичен при любых концентрациях и никогда не бывает полезен. Введение в организм даже ничтожных количеств Po влечет за собой жесткое действие радиации нa жизненно важные органы. Концентрация летучих соединений Po в воздухе должна быть не выше 1∙ 10 11 мг/м 3.
 Соединения селена, теллура и полония. Селениды, теллуриды и полониды Все три элемента легко реагируют с большинством металлов и многими неметаллами, образуя бинарные халькогениды. Фактически селениды и теллуриды являются наиболее распространенными минералами этих элементов. Изобилуют нестехиометрические производные, особенно это относится к соединениям с переходными элемен тами (где различие электроотрицательности невелико и меняются степени окисления), и многие халькогениды можно рассматривать как металлические сплавы. Многие такие соединения нашли важное применение в твердотельной оптике, электрических и термоэлектрических устройствах и потому хорошо изучены. Для более электропо ложительных элементов (например, элементов 1 й и 2 й групп) халькогениды могут рассматриваться как «соли» халькогеноводородных кислот H 2 Se, H 2 Te и H 2 Po Селениды и теллуриды щелочных металлов могут быть получены непосредственным взаимодей ствием простых веществ при умеренной температуре. Они бесцветны, растворимы в воде и легко окисляются на воздухе до простого вещества. Полониды также могут быть получены непосредственным взаимодействием простых веществ и относятся к наиболее устойчивым соединениям этого элемента Халькогениды переходных металлов также по лучают непосредственным взаимодействием про стых веществ при 400 1000 0 C и в отсутствие воз духа. Эти соединения часто представляют собой нестехиометрические сплавы, хотя существуют и интерметаллические соединения, например: Ti~2 Se, Ti~3 Se, Ti. Se 0, 95, Ti. Se 1, 05, Ti 0, 9 Se, Ti 3 Se 4, Ti 0, 7 Se, Ti 5 Se 8, Ti. Se 2, Ti. Se 3 и т. д. Большинство селенидов и теллуридов разлага ется под действием воды или разбавленной кисло ты с образованием H 2 Se или H 2 Te, но выход, осо бенно последнего, невелик. Полихалькогениды (Se, Те, Po) менее устойчи вы, чем олисульфиды. Взаимодействие ще лочных металлов п с Se в жидком аммиаке дает M 2 Se 2, M 2 Se 3 и M 2 Se 4. многие из этих соединений весь ма неустойчивы термически и склонны окислять ся на воздухе.
Соединения селена, теллура и полония. Селениды, теллуриды и полониды Все три элемента легко реагируют с большинством металлов и многими неметаллами, образуя бинарные халькогениды. Фактически селениды и теллуриды являются наиболее распространенными минералами этих элементов. Изобилуют нестехиометрические производные, особенно это относится к соединениям с переходными элемен тами (где различие электроотрицательности невелико и меняются степени окисления), и многие халькогениды можно рассматривать как металлические сплавы. Многие такие соединения нашли важное применение в твердотельной оптике, электрических и термоэлектрических устройствах и потому хорошо изучены. Для более электропо ложительных элементов (например, элементов 1 й и 2 й групп) халькогениды могут рассматриваться как «соли» халькогеноводородных кислот H 2 Se, H 2 Te и H 2 Po Селениды и теллуриды щелочных металлов могут быть получены непосредственным взаимодей ствием простых веществ при умеренной температуре. Они бесцветны, растворимы в воде и легко окисляются на воздухе до простого вещества. Полониды также могут быть получены непосредственным взаимодействием простых веществ и относятся к наиболее устойчивым соединениям этого элемента Халькогениды переходных металлов также по лучают непосредственным взаимодействием про стых веществ при 400 1000 0 C и в отсутствие воз духа. Эти соединения часто представляют собой нестехиометрические сплавы, хотя существуют и интерметаллические соединения, например: Ti~2 Se, Ti~3 Se, Ti. Se 0, 95, Ti. Se 1, 05, Ti 0, 9 Se, Ti 3 Se 4, Ti 0, 7 Se, Ti 5 Se 8, Ti. Se 2, Ti. Se 3 и т. д. Большинство селенидов и теллуридов разлага ется под действием воды или разбавленной кисло ты с образованием H 2 Se или H 2 Te, но выход, осо бенно последнего, невелик. Полихалькогениды (Se, Те, Po) менее устойчи вы, чем олисульфиды. Взаимодействие ще лочных металлов п с Se в жидком аммиаке дает M 2 Se 2, M 2 Se 3 и M 2 Se 4. многие из этих соединений весь ма неустойчивы термически и склонны окислять ся на воздухе.
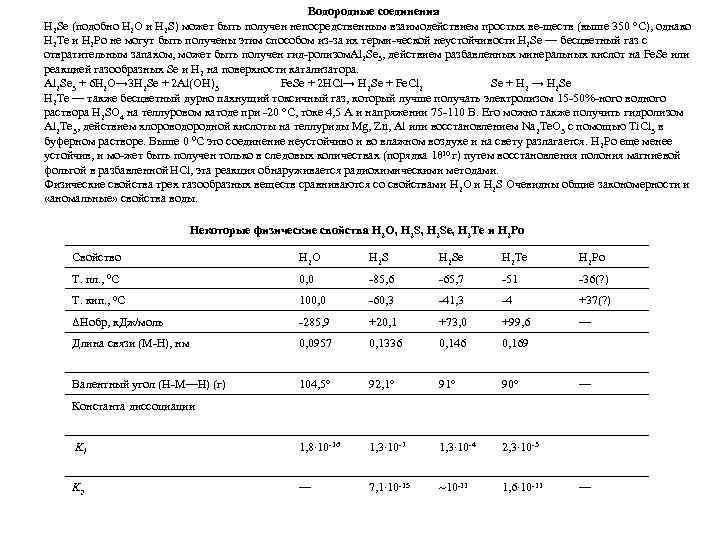 Водородные соединения H 2 Se (подобно H 2 O и H 2 S) может быть получен непосредственным взаимодействием простых ве ществ (выше 350 °С), однако H 2 Te и H 2 Po не могут быть получены этим способом из за их терми ческой неустойчивости. 2 Se — бесцветный газ с H отвратительным запахом, может быть получен гид ролизом l 2 Se 3, действием разбавленных минеральных кислот на Fe. Se или A реакцией газообразных Se и H 2 на поверхности катализатора. Al 2 Se 3 + 6 H 2 O→ 3 H 2 Se + 2 Al(OH)3 Fe. Se + 2 HCl→ H 2 Se + Fe. Cl 2 Se + H 2 → H 2 Se H 2 Te — также бесцветный дурно пахнущий токсичный газ, который лучше получать электролизом 15 50% ного водного раствора H 2 SO 4 на теллуровом катоде при 20 °С, токе 4, 5 А и напряжении 75 110 В. Его можно также получить гидролизом Al 2 Te 3, действием хлороводородной кислоты на теллуриды Mg, Zn, Al или восстановлением Na 2 Te. O 3 с помощью Ti. Cl 3 в буферном растворе. Выше 0 0 C это соединение неустойчиво и во влажном воздухе и на свету разлагается. H 2 Po еще менее 10 устойчив, и мо жет быть получен только в следовых количествах (порядка 10 г) путем восстановления полония магниевой фольгой в разбавленной HCl, эта реакция обнаруживается радиохимическими методами. Физические свойства трех газообразных веществ сравниваются со свойствами H 2 O и H 2 S Очевидны общие закономерности и «аномальные» свойства воды. Некоторые физические свойства H 2 O, H 2 Se, H 2 Te и H 2 Po Свойство H 2 O H 2 Se H 2 Te H 2 Po Т. пл. , 0 C 0, 0 85, 6 65, 7 51 36(? ) Т. кип. , 0 C 100, 0 60, 3 41, 3 4 +37(? ) ΔHoбр, к. Дж/моль 285, 9 +20, 1 +73, 0 +99, 6 — Длина связи (M Н), нм 0, 0957 0, 1336 0, 146 0, 169 Валентный угол (H М—H) (г) 104, 5° 92, 1° 90° K 1 1, 8∙ 10 16 1, 3∙ 10 7 1, 3∙ 10 4 2, 3∙ 10 3 K 2 — 7, 1∙ 10 15 ~10 11 1, 6∙ 10 11 — Константа диссоциации —
Водородные соединения H 2 Se (подобно H 2 O и H 2 S) может быть получен непосредственным взаимодействием простых ве ществ (выше 350 °С), однако H 2 Te и H 2 Po не могут быть получены этим способом из за их терми ческой неустойчивости. 2 Se — бесцветный газ с H отвратительным запахом, может быть получен гид ролизом l 2 Se 3, действием разбавленных минеральных кислот на Fe. Se или A реакцией газообразных Se и H 2 на поверхности катализатора. Al 2 Se 3 + 6 H 2 O→ 3 H 2 Se + 2 Al(OH)3 Fe. Se + 2 HCl→ H 2 Se + Fe. Cl 2 Se + H 2 → H 2 Se H 2 Te — также бесцветный дурно пахнущий токсичный газ, который лучше получать электролизом 15 50% ного водного раствора H 2 SO 4 на теллуровом катоде при 20 °С, токе 4, 5 А и напряжении 75 110 В. Его можно также получить гидролизом Al 2 Te 3, действием хлороводородной кислоты на теллуриды Mg, Zn, Al или восстановлением Na 2 Te. O 3 с помощью Ti. Cl 3 в буферном растворе. Выше 0 0 C это соединение неустойчиво и во влажном воздухе и на свету разлагается. H 2 Po еще менее 10 устойчив, и мо жет быть получен только в следовых количествах (порядка 10 г) путем восстановления полония магниевой фольгой в разбавленной HCl, эта реакция обнаруживается радиохимическими методами. Физические свойства трех газообразных веществ сравниваются со свойствами H 2 O и H 2 S Очевидны общие закономерности и «аномальные» свойства воды. Некоторые физические свойства H 2 O, H 2 Se, H 2 Te и H 2 Po Свойство H 2 O H 2 Se H 2 Te H 2 Po Т. пл. , 0 C 0, 0 85, 6 65, 7 51 36(? ) Т. кип. , 0 C 100, 0 60, 3 41, 3 4 +37(? ) ΔHoбр, к. Дж/моль 285, 9 +20, 1 +73, 0 +99, 6 — Длина связи (M Н), нм 0, 0957 0, 1336 0, 146 0, 169 Валентный угол (H М—H) (г) 104, 5° 92, 1° 90° K 1 1, 8∙ 10 16 1, 3∙ 10 7 1, 3∙ 10 4 2, 3∙ 10 3 K 2 — 7, 1∙ 10 15 ~10 11 1, 6∙ 10 11 — Константа диссоциации —
 Плотность жидкого и твердого H 2 Se составляет 2, 12 и 2, 45 г/см 3. H 2 Te конденсируется в бесцветную жидкость (плотность 4, 4 г/см 3), а затем — лимонно желтые кристаллы. Оба газа растворимы в воде примерно в той же степени, что и H 2 S, при этом получаются растворы с возрастающей кислотностью среды (для сравнения: уксусная кислота имеет K~1. 8∙ 10 5 ). Такие растворы осаждают селениды и теллуриды многих металлов из водных раство ров их солей, но поскольку и H 2 Se, и H 2 Te легко окисляются (например, воздухом), часто одновременно образуются Se и Те. H 2 Se и H 2 Te горят на воздухе синим пламенем, образуя диоксиды. Галогены и другие окис лители (например, NO 3, KMn. O 4) также быстро реагируют с ними в водном растворе, H осаждая про стые вещества. Взаимодействие 2 Se с SO 2 в вод ном растворе идет сложно, H состав образующихся продуктов сильно зависит условий добавление селенида к раствору SO 2 дает смесь S и Se в соотношении 2 : 1 и кислородные кислоты серы, в то время как до бавление O 2 K водному раствору H 2 Se дает пре имущественно e: S S H 2 Se + 5 SO 2 + 2 H 2 O→ 2 S + Se + 3 H 2 SO 4 H 2 Se + 6 SO 2 + 2 H 2 O→ 2 S + Se + H 2 S 2 O 6 +2 H 2 SO 4 H 2 Se + 6 SO 2 + 2 H 2 O→ Se + H 2 S 4 O 6 + 2 H 2 SO 4
Плотность жидкого и твердого H 2 Se составляет 2, 12 и 2, 45 г/см 3. H 2 Te конденсируется в бесцветную жидкость (плотность 4, 4 г/см 3), а затем — лимонно желтые кристаллы. Оба газа растворимы в воде примерно в той же степени, что и H 2 S, при этом получаются растворы с возрастающей кислотностью среды (для сравнения: уксусная кислота имеет K~1. 8∙ 10 5 ). Такие растворы осаждают селениды и теллуриды многих металлов из водных раство ров их солей, но поскольку и H 2 Se, и H 2 Te легко окисляются (например, воздухом), часто одновременно образуются Se и Те. H 2 Se и H 2 Te горят на воздухе синим пламенем, образуя диоксиды. Галогены и другие окис лители (например, NO 3, KMn. O 4) также быстро реагируют с ними в водном растворе, H осаждая про стые вещества. Взаимодействие 2 Se с SO 2 в вод ном растворе идет сложно, H состав образующихся продуктов сильно зависит условий добавление селенида к раствору SO 2 дает смесь S и Se в соотношении 2 : 1 и кислородные кислоты серы, в то время как до бавление O 2 K водному раствору H 2 Se дает пре имущественно e: S S H 2 Se + 5 SO 2 + 2 H 2 O→ 2 S + Se + 3 H 2 SO 4 H 2 Se + 6 SO 2 + 2 H 2 O→ 2 S + Se + H 2 S 2 O 6 +2 H 2 SO 4 H 2 Se + 6 SO 2 + 2 H 2 O→ Se + H 2 S 4 O 6 + 2 H 2 SO 4
 Галогениды 0 +1: Se 2 Cl 2 желто коричневая жид кость, т. пл. 85 °С, т. кип. 130 C (с разложе нием), e 2 Br 2 кроваво красная жидкость, т. S 0 C (с разложением) получение – в ие простых веществ или галоген + Se в CS также известны Te I и Te. I – кип. 225 2 4 4 черные. +2. Установлено существование соединений полония — темно красного Po. Cl 2 и пурпурно коричневого Po. Br 2. Оба они образуются непосредственным взаимодей ствием простых веществ или, вос становлением 4 с помощью SO 2 и Po. Br 4 с Po. Cl по мощью 2 S при 25 °С. H +4 Все 12 тетрагалогенидов Se, Те и Po известны, за исключением, возможно, Se. I 4. Se. F 4 — это бесцвет ная еакционноспособная жидкость, которая дымит на воздухе и кристаллизуется в виде белого р гигро скопичного твердого вещества. Его можно получить фторированием селена (с использованием 2 при О 0 C или F Ag. F) или по реакции SF 4 с Se. O 2 при температуре выше 100 °С. Это удобный фторирующий реагент. Te. F 4 получается в виде бесцветных, гигроско пичных, склонных к возгонке кристаллов путем контролируемого фторирования Те или Te. X 2 с помощью смеси F 2 и N 2 при 00 C или более удобным образом — по реакции Se. F 4 с Te. O 2 при 80 °С. Он разлагается выше 1900 C с образованием Te. F 6 и значительно более реакционноспособен, чем Se. F 4. Например, он легко фторирует Si. O 2 при температуре выше комнатной и реагирует с Cu, Ag, Au и Ni при 185 °С, образуя теллуриды и фториды ме таллов. Известны его ддукты с BF 3, As. F 5 и Sb. F 5. а Другие тетрагалогениды могут легко быть полу чены непосредственным взаимодействием простых веществ. Эти соединения Po. Cl 4 Po. F 4 и Po. I 4 можно получить непосредственным взаимодействием простых веществ или непрямым путем, например хлорированием Po. O 2 с помощью HCl, PCl 5 или SOCl 2, либо по реакции Po. O 2 с HI при 200 0 C Аналогичные методы используют для получения тетрагалогенидов селена и теллура, например: Te. Cl 4; Cl 2+ Те; Se. Cl 2 и Те, Te. O 2 или Te. Cl 2; CCl 4 + Te. O 2 при 500 0 C Te. Br 4: Те+ Br 2 при комн. темп. ; водный раствор. HBr и Te. O 2 Te. I 4: нагревание Те +I 2; Те + Mel; Te. Br 4 + Et. I +6 Из гексагалогенидов известны только бесцветные газообразные фториды Se. F 6 и Te. F 6. Гексафториды получают непосредственным фторированием простых веществ или по реакции Br. F 3 с диоксидами. Se. F 6 похож на SF 6 своей инертностью по отношению к воде, но он разлагается водными растворами KI или тиосульфатов. Te. F 6 полностью гидролизуется за сутки при комнатной температуре.
Галогениды 0 +1: Se 2 Cl 2 желто коричневая жид кость, т. пл. 85 °С, т. кип. 130 C (с разложе нием), e 2 Br 2 кроваво красная жидкость, т. S 0 C (с разложением) получение – в ие простых веществ или галоген + Se в CS также известны Te I и Te. I – кип. 225 2 4 4 черные. +2. Установлено существование соединений полония — темно красного Po. Cl 2 и пурпурно коричневого Po. Br 2. Оба они образуются непосредственным взаимодей ствием простых веществ или, вос становлением 4 с помощью SO 2 и Po. Br 4 с Po. Cl по мощью 2 S при 25 °С. H +4 Все 12 тетрагалогенидов Se, Те и Po известны, за исключением, возможно, Se. I 4. Se. F 4 — это бесцвет ная еакционноспособная жидкость, которая дымит на воздухе и кристаллизуется в виде белого р гигро скопичного твердого вещества. Его можно получить фторированием селена (с использованием 2 при О 0 C или F Ag. F) или по реакции SF 4 с Se. O 2 при температуре выше 100 °С. Это удобный фторирующий реагент. Te. F 4 получается в виде бесцветных, гигроско пичных, склонных к возгонке кристаллов путем контролируемого фторирования Те или Te. X 2 с помощью смеси F 2 и N 2 при 00 C или более удобным образом — по реакции Se. F 4 с Te. O 2 при 80 °С. Он разлагается выше 1900 C с образованием Te. F 6 и значительно более реакционноспособен, чем Se. F 4. Например, он легко фторирует Si. O 2 при температуре выше комнатной и реагирует с Cu, Ag, Au и Ni при 185 °С, образуя теллуриды и фториды ме таллов. Известны его ддукты с BF 3, As. F 5 и Sb. F 5. а Другие тетрагалогениды могут легко быть полу чены непосредственным взаимодействием простых веществ. Эти соединения Po. Cl 4 Po. F 4 и Po. I 4 можно получить непосредственным взаимодействием простых веществ или непрямым путем, например хлорированием Po. O 2 с помощью HCl, PCl 5 или SOCl 2, либо по реакции Po. O 2 с HI при 200 0 C Аналогичные методы используют для получения тетрагалогенидов селена и теллура, например: Te. Cl 4; Cl 2+ Те; Se. Cl 2 и Те, Te. O 2 или Te. Cl 2; CCl 4 + Te. O 2 при 500 0 C Te. Br 4: Те+ Br 2 при комн. темп. ; водный раствор. HBr и Te. O 2 Te. I 4: нагревание Те +I 2; Те + Mel; Te. Br 4 + Et. I +6 Из гексагалогенидов известны только бесцветные газообразные фториды Se. F 6 и Te. F 6. Гексафториды получают непосредственным фторированием простых веществ или по реакции Br. F 3 с диоксидами. Se. F 6 похож на SF 6 своей инертностью по отношению к воде, но он разлагается водными растворами KI или тиосульфатов. Te. F 6 полностью гидролизуется за сутки при комнатной температуре.
 Оксиды-галогениды Для Se. IV и Se. VI известны многочисленные окси ды галогениды. Se. OF 2 и Se. OCl 2 — бесцветные дымящие на воздухе, летучие жидкости, в то время как Se. OBr 2 — значительно менее устойчивое оранжевое твердое вещество, которое разлагается на воздухе при температуре выше 50 0 C. Эти соединения удобно получать по реакции Se. O 2 с соответствующим тетрагалогенидом Se. OF 2 — это агрессивный реагент, который разрушает стекло, бурно реаги рует с красным фосфором и порошкообразным Si. O 2 и медленно — с Si. Оксиды галогениды селена (VI) известны толь ко для фтора. Se. O 2 F 2 — легко гидролизующийся бесцветный газ, который получается при фторировании Se. O 3 с помощью Se. F 4 (или KBF 4 при 70 0 C) либо по реакции Ba. Se. O 4 с HSO 3 F при нагревании с обратным холодильником при 50 °С.
Оксиды-галогениды Для Se. IV и Se. VI известны многочисленные окси ды галогениды. Se. OF 2 и Se. OCl 2 — бесцветные дымящие на воздухе, летучие жидкости, в то время как Se. OBr 2 — значительно менее устойчивое оранжевое твердое вещество, которое разлагается на воздухе при температуре выше 50 0 C. Эти соединения удобно получать по реакции Se. O 2 с соответствующим тетрагалогенидом Se. OF 2 — это агрессивный реагент, который разрушает стекло, бурно реаги рует с красным фосфором и порошкообразным Si. O 2 и медленно — с Si. Оксиды галогениды селена (VI) известны толь ко для фтора. Se. O 2 F 2 — легко гидролизующийся бесцветный газ, который получается при фторировании Se. O 3 с помощью Se. F 4 (или KBF 4 при 70 0 C) либо по реакции Ba. Se. O 4 с HSO 3 F при нагревании с обратным холодильником при 50 °С.
 Оксиды Se. O 2 — белое твердое вещество. Он очень хоро шо растворяется в воде и дает селенистую кислоту H 2 Se. O 3, которая при дегидратации снова превра щается в диоксид селена. Se. O 2 термодина мически менее устойчив, чем SO 2 или Te. O 2, и легко восстанавливается до селена с помощью NH 3, N 2 H 4 или SO 2 в водном растворе. Окислитель в органической химии. Диоксид теллура может быть получен при действии O 2 на Те, путем дегидратации H 2 Te. O 3 или термическим разложе нием основного нитрата при температуре выше 400 °С. Te. O 2 не очень хорошо растворим в воде. Po. O 2 получается при прямом взаимодействии простых веществ при 250 0 C или при термическом разложении гидроксида, нитрата, сульфата, селената полония(IV). Po. O 2 амфотерен, хотя заметно более основен, чем Te. O 2: например, он образует Po(SO 4)2, в то вре мя как аналогичная соль Те неизвестна. Se. O 3 не может быть получен прямым окислением селена или Se. O 2 и даже с трудом образуется при дегидратации H 2 Se. O 4 действием P 2 O 5; лучший способ его получения — обработка K 2 Se. O 4 с помощью SO 3. Se. O 3 представляет собой белое, гиг роскопичное твердое вещество . Te. O 3 α Форму получают дегидратацией Te(OH)6 (с. 130) при 300 360 0 C; β Te. O 3 образуется при нагревании α Te. O 3 или Te(OH)6. Он не взаимодействует с водой, но проявляет свойства сильного окислителя при нагревании со многими металлами и неметалла ми. Te. O 3 растворим также в горячих концентри рованных щелочах и образует с ними теллураты. α Форма этого соединения еще менее реакционноспособна, но может реагировать с рас плавом КОН. Следы o. O 3 могут быть обнаружены, но в весо вых P количествах он не получен.
Оксиды Se. O 2 — белое твердое вещество. Он очень хоро шо растворяется в воде и дает селенистую кислоту H 2 Se. O 3, которая при дегидратации снова превра щается в диоксид селена. Se. O 2 термодина мически менее устойчив, чем SO 2 или Te. O 2, и легко восстанавливается до селена с помощью NH 3, N 2 H 4 или SO 2 в водном растворе. Окислитель в органической химии. Диоксид теллура может быть получен при действии O 2 на Те, путем дегидратации H 2 Te. O 3 или термическим разложе нием основного нитрата при температуре выше 400 °С. Te. O 2 не очень хорошо растворим в воде. Po. O 2 получается при прямом взаимодействии простых веществ при 250 0 C или при термическом разложении гидроксида, нитрата, сульфата, селената полония(IV). Po. O 2 амфотерен, хотя заметно более основен, чем Te. O 2: например, он образует Po(SO 4)2, в то вре мя как аналогичная соль Те неизвестна. Se. O 3 не может быть получен прямым окислением селена или Se. O 2 и даже с трудом образуется при дегидратации H 2 Se. O 4 действием P 2 O 5; лучший способ его получения — обработка K 2 Se. O 4 с помощью SO 3. Se. O 3 представляет собой белое, гиг роскопичное твердое вещество . Te. O 3 α Форму получают дегидратацией Te(OH)6 (с. 130) при 300 360 0 C; β Te. O 3 образуется при нагревании α Te. O 3 или Te(OH)6. Он не взаимодействует с водой, но проявляет свойства сильного окислителя при нагревании со многими металлами и неметалла ми. Te. O 3 растворим также в горячих концентри рованных щелочах и образует с ними теллураты. α Форма этого соединения еще менее реакционноспособна, но может реагировать с рас плавом КОН. Следы o. O 3 могут быть обнаружены, но в весо вых P количествах он не получен.
 Гидроксиды и кислородные кислоты «Po(OH)2» , темно коричневого гидратированного монооксида полония который осаждается при добавлении щелочи к свежеприготовленному раствору Po(II). Se и Te образуют только соединения со степенью окисления элементов +4 и +6. Селенистая кислота H 2 Se. O 3, и теллуристая кислота H 2 Te. O 3 представляют собой белые твердые вещества, которые легко можно де гидратировать до диоксида. H 2 Se. O 3 лучше всего получать мед ленной кристаллизации водного раствора e. O 2 или окислением порошкообразного S Se разбавленной азотной кислотой: 3 Se + 4 HNO 3 + H 2 O → 3 H 2 Se. O 3 + 4 NO Менее устойчивую H 2 Te. O 3 получают гидроли зом етрагалогенида или подкислением охлажден ного водного раствора т теллурита. . Обе кис лоты дают кислые соли HSe. O 3 и MHTe. O 3 при реакции с соответствующей щелочью в водном ра створе. M Средние соли M 2 Se. O 3 и M 2 Te. O 3 можно по лучить аналогичным путем или при нагревании оксидов металлов с соответствующим диоксидом. Приближенные значения константы диссоциации: H 2 Se. O 3: K 1 ~ 3, 5∙ 10 3 K 2 ~ 5∙ 10 8 H 2 Te. O 3: K 1 ~ 3∙ 10 3 K 2 ~ 2∙ 10 8 Селенистая кис лота, в отличие от 2 Te. O 3, может легко окислять ся до 2 Se. O 4 озоном в сильнокислой среде; она H H восстанавливается до элементарного селена дей ствием 2 S, SO 2 или иодида в водном растворе. Гидратированный диоксид H полония Po. O(OH)2 получен в виде светло желтого хлопьевидного осад ка при добавлении разбавленного водного раствора щелочи к раствору, содержащему Po(IV). Его свой ства преимущественно кислотные, например: Po. O(OH)2 + 2 KOH → K 2 Po. O 3+ 2 H 2 O; Кислородные кислоты Se и Те в степени окис ления +6 мало похожи друг на друга. H 2 Se. O 4 по добна 2 SO 4 , в то время как ортотеллуровая кислота Te(OH)6 и полиметателлуровая кислота (H 2 Te. O 4)n H сильно отличаются от них. Безводная H 2 Se. O 4 представляет собой вязкую жидкость, которая кристаллизуется в белое расплывающееся на воздухе твердое вещество (т. пл. 620 C). Она теряет воду при нагревании и легко присоединяет Se. O 3, образуя «пироселеновую» (диселеновую) кислоту H 2 Se 2 O 7 (т. пл. 19 0 C) и триселеновую кислоту H 4 Se 3 O 11 (т. пл. 25 °С). Подобно серной кислоте селеновая кислота образует не сколько гидратов, например 2 Se. O 4∙ H 2 O (т. пл. 26 0 C) и H 2 Se. O 4∙ 4 H 2 O (т. пл. H 0 C). 52
Гидроксиды и кислородные кислоты «Po(OH)2» , темно коричневого гидратированного монооксида полония который осаждается при добавлении щелочи к свежеприготовленному раствору Po(II). Se и Te образуют только соединения со степенью окисления элементов +4 и +6. Селенистая кислота H 2 Se. O 3, и теллуристая кислота H 2 Te. O 3 представляют собой белые твердые вещества, которые легко можно де гидратировать до диоксида. H 2 Se. O 3 лучше всего получать мед ленной кристаллизации водного раствора e. O 2 или окислением порошкообразного S Se разбавленной азотной кислотой: 3 Se + 4 HNO 3 + H 2 O → 3 H 2 Se. O 3 + 4 NO Менее устойчивую H 2 Te. O 3 получают гидроли зом етрагалогенида или подкислением охлажден ного водного раствора т теллурита. . Обе кис лоты дают кислые соли HSe. O 3 и MHTe. O 3 при реакции с соответствующей щелочью в водном ра створе. M Средние соли M 2 Se. O 3 и M 2 Te. O 3 можно по лучить аналогичным путем или при нагревании оксидов металлов с соответствующим диоксидом. Приближенные значения константы диссоциации: H 2 Se. O 3: K 1 ~ 3, 5∙ 10 3 K 2 ~ 5∙ 10 8 H 2 Te. O 3: K 1 ~ 3∙ 10 3 K 2 ~ 2∙ 10 8 Селенистая кис лота, в отличие от 2 Te. O 3, может легко окислять ся до 2 Se. O 4 озоном в сильнокислой среде; она H H восстанавливается до элементарного селена дей ствием 2 S, SO 2 или иодида в водном растворе. Гидратированный диоксид H полония Po. O(OH)2 получен в виде светло желтого хлопьевидного осад ка при добавлении разбавленного водного раствора щелочи к раствору, содержащему Po(IV). Его свой ства преимущественно кислотные, например: Po. O(OH)2 + 2 KOH → K 2 Po. O 3+ 2 H 2 O; Кислородные кислоты Se и Те в степени окис ления +6 мало похожи друг на друга. H 2 Se. O 4 по добна 2 SO 4 , в то время как ортотеллуровая кислота Te(OH)6 и полиметателлуровая кислота (H 2 Te. O 4)n H сильно отличаются от них. Безводная H 2 Se. O 4 представляет собой вязкую жидкость, которая кристаллизуется в белое расплывающееся на воздухе твердое вещество (т. пл. 620 C). Она теряет воду при нагревании и легко присоединяет Se. O 3, образуя «пироселеновую» (диселеновую) кислоту H 2 Se 2 O 7 (т. пл. 19 0 C) и триселеновую кислоту H 4 Se 3 O 11 (т. пл. 25 °С). Подобно серной кислоте селеновая кислота образует не сколько гидратов, например 2 Se. O 4∙ H 2 O (т. пл. 26 0 C) и H 2 Se. O 4∙ 4 H 2 O (т. пл. H 0 C). 52
 H 2 Se. O 4 может быть получена несколькими способами: 1) окисление H 2 Se. O 3 c помощью H 2 O 2, KMn. O 4 или HCl. O 3, которое можно формально пред ставить следующими уравнениями реакций: H 2 Se. O 3+ H 2 O 2 → H 2 Se. O 4+ H 2 O 8 H 2 Se. O 3 + 2 KMn. O 4 → 5 H 2 Se. O 4+ K 2 Se. O 3 + 2 Mn. Se. O 3 + 3 H 2 O 5 H 2 Se. O 3 + 2 HCl. O 3 → 5 H 2 Se. O 4 + Cl 2 + H 2 O 2) окисление селена хлорной или бромной водой, например: Se + 3 Cl 2 + 4 H 2 O → H 2 Se. O 4 + 6 HCl 3) действие бромной воды на суспензию селе нита серебра: Ag 2 Se. O 3 + Br 2 + H 2 O → H 2 Se. O 4 + 2 Ag. Br Константы диссоциации H 2 Se. O 4 близки к констан там для 2 SO 4: H K 2(H 2 Se. O 4) равна 1, 2 ∙ 10 2 Селенаты похожи на сульфаты, и обе кис лоты образуют ряд солей квасцов. Ceленовая кислота, однако, отличается от H 2 SO 4 тем, что относится к сильным окислителям. Наиболее ярко это проявляется в ее способности химически растворять не только Ag, но также Au, Pd (и даже Pt в присутствии Cl ионов): 2 Au + 6 H 2 Se. O 4 → Au 2(Se 04)3+ 3 H 2 Se. O 3 + 3 H 2 O Она окисляет галогенид ионы (за исключением F ) до свободного галогена.
H 2 Se. O 4 может быть получена несколькими способами: 1) окисление H 2 Se. O 3 c помощью H 2 O 2, KMn. O 4 или HCl. O 3, которое можно формально пред ставить следующими уравнениями реакций: H 2 Se. O 3+ H 2 O 2 → H 2 Se. O 4+ H 2 O 8 H 2 Se. O 3 + 2 KMn. O 4 → 5 H 2 Se. O 4+ K 2 Se. O 3 + 2 Mn. Se. O 3 + 3 H 2 O 5 H 2 Se. O 3 + 2 HCl. O 3 → 5 H 2 Se. O 4 + Cl 2 + H 2 O 2) окисление селена хлорной или бромной водой, например: Se + 3 Cl 2 + 4 H 2 O → H 2 Se. O 4 + 6 HCl 3) действие бромной воды на суспензию селе нита серебра: Ag 2 Se. O 3 + Br 2 + H 2 O → H 2 Se. O 4 + 2 Ag. Br Константы диссоциации H 2 Se. O 4 близки к констан там для 2 SO 4: H K 2(H 2 Se. O 4) равна 1, 2 ∙ 10 2 Селенаты похожи на сульфаты, и обе кис лоты образуют ряд солей квасцов. Ceленовая кислота, однако, отличается от H 2 SO 4 тем, что относится к сильным окислителям. Наиболее ярко это проявляется в ее способности химически растворять не только Ag, но также Au, Pd (и даже Pt в присутствии Cl ионов): 2 Au + 6 H 2 Se. O 4 → Au 2(Se 04)3+ 3 H 2 Se. O 3 + 3 H 2 O Она окисляет галогенид ионы (за исключением F ) до свободного галогена.
 две главные формы теллуровой кислоты не похожи на H 2 SO 4 и H 2 Se. O 4. Ортотеллуровая кислота представляет собой белое твердое вещество (т. пл. 136 °С), кристаллическая структу ра которого построена из правильных ктаэдрических молекул Te(OH)6. Такое строение, отражается на о химических свой ствах; например, при нейтрализации бразоются Na. H 5 Te. O 6, Na 2 H 4 Te. O 6, Na 4 H 2 Te. O 6 и Na 6 Te. O 6. К о солям такого типа относятся и Ag 6 Te. O 6 и Hg 3 Te. O 6. Ортотеллуровая кислота может быть получена окислением порошкообразного Те раствором хлор новатой кислоты или окислением e. O 2 перманга натом калия в азотной T кислоте: 5 Te + 6 HCl. O 3 + 12 H 2 O → 5 H 6 Te. O 6 +3 Cl 2 5 Te. O 2 + 2 KMn. O 4 + 6 HNO 3 + 12 H 2 O → 5 H 6 Te. O 6 + 2 KNO 3 + 2 Mn(N 03)2 Можно также окислить Те или Te. O 2 c помощью Cr. O 3 в HNO 3 или 30% ным H 2 O 2. Подкисление теллуратов подходящей кислотой осадителем служит еще одним удобным способом получения ортотеллуровой кислоты: Ba. Te. O 4 + H 2 SO 4 + 2 H 2 O → Ba. SO 4 + H 6 Te. O 6 Ag 2 Te. O 4 + 2 HCi + 2 H 2 O → 2 Ag. CI + H 6 Te. O 6 Безводная кислота устойчива на воздухе при 100 0 C но выше 1200 C постепенно теряет воду, превращаясь в полиметателлуровую кислоту и аллотеллуровую кислоту. В отличие от H 2 SO 4 H H 2 Se. O 4 H 6 Te. O 6 — слабая кислота, прибли зительные значения констант последовательной диссоциации таковы: 1 ~ 2∙ 10 8, K 2 ~ 10 11, K 3 ~ 3∙ 10 15 K Она довольно сильный окислитель и восстанавливается до элементарного теллура под действием SO 2 и до H 2 Te. O 3 горячей HCl: H 6 Te. O 6 + 3 SO 2 → Те + 3 H 2 SO 4 H 6 Te. O 6+ 2 HCl → H 2 Te. O 3+ 3 H 2 O+ Cl 2 Полиметателлуровая кислота (H 2 Te. O 4)n (n≈ 10) — белый аморфный гигроскопичный порошок, обра зующийся при неполной дегидратации 6 Te. O 6 на воздухе при 16 O 0 C С другой стороны, в водном растворе H равновесие H 6 Te. O 6 → (H 2 Te. O 4)n + 2 n. Н 20 можно сместить вправо, повышая температуру; последующее быстрое охлаждение приводит к осаж дению умеренно растворимой олиметателлуровой кислоты. Аллотеллуровая кислота п «(H 2 Te 04)3(H 20)4» — это кислотный «сироп» , получаемый при нагревании Te(OH)6 в запаянной ампуле при 305 °С: это соеди нение не было получено в чистом виде, оно склонно превращаться в 6 Te. O 6 H при комнатной температуре или в (Н 2 Те 04)n при нагревании на воздухе; на самом деле не исключено, что это смесь двух указан ных веществ. еллураты получают сплавлением теллуритов с соответствующими нитратами, Т окислением теллу ритов хлором или нейтрализацией теллуровой кис лоты идроксидами г
две главные формы теллуровой кислоты не похожи на H 2 SO 4 и H 2 Se. O 4. Ортотеллуровая кислота представляет собой белое твердое вещество (т. пл. 136 °С), кристаллическая структу ра которого построена из правильных ктаэдрических молекул Te(OH)6. Такое строение, отражается на о химических свой ствах; например, при нейтрализации бразоются Na. H 5 Te. O 6, Na 2 H 4 Te. O 6, Na 4 H 2 Te. O 6 и Na 6 Te. O 6. К о солям такого типа относятся и Ag 6 Te. O 6 и Hg 3 Te. O 6. Ортотеллуровая кислота может быть получена окислением порошкообразного Те раствором хлор новатой кислоты или окислением e. O 2 перманга натом калия в азотной T кислоте: 5 Te + 6 HCl. O 3 + 12 H 2 O → 5 H 6 Te. O 6 +3 Cl 2 5 Te. O 2 + 2 KMn. O 4 + 6 HNO 3 + 12 H 2 O → 5 H 6 Te. O 6 + 2 KNO 3 + 2 Mn(N 03)2 Можно также окислить Те или Te. O 2 c помощью Cr. O 3 в HNO 3 или 30% ным H 2 O 2. Подкисление теллуратов подходящей кислотой осадителем служит еще одним удобным способом получения ортотеллуровой кислоты: Ba. Te. O 4 + H 2 SO 4 + 2 H 2 O → Ba. SO 4 + H 6 Te. O 6 Ag 2 Te. O 4 + 2 HCi + 2 H 2 O → 2 Ag. CI + H 6 Te. O 6 Безводная кислота устойчива на воздухе при 100 0 C но выше 1200 C постепенно теряет воду, превращаясь в полиметателлуровую кислоту и аллотеллуровую кислоту. В отличие от H 2 SO 4 H H 2 Se. O 4 H 6 Te. O 6 — слабая кислота, прибли зительные значения констант последовательной диссоциации таковы: 1 ~ 2∙ 10 8, K 2 ~ 10 11, K 3 ~ 3∙ 10 15 K Она довольно сильный окислитель и восстанавливается до элементарного теллура под действием SO 2 и до H 2 Te. O 3 горячей HCl: H 6 Te. O 6 + 3 SO 2 → Те + 3 H 2 SO 4 H 6 Te. O 6+ 2 HCl → H 2 Te. O 3+ 3 H 2 O+ Cl 2 Полиметателлуровая кислота (H 2 Te. O 4)n (n≈ 10) — белый аморфный гигроскопичный порошок, обра зующийся при неполной дегидратации 6 Te. O 6 на воздухе при 16 O 0 C С другой стороны, в водном растворе H равновесие H 6 Te. O 6 → (H 2 Te. O 4)n + 2 n. Н 20 можно сместить вправо, повышая температуру; последующее быстрое охлаждение приводит к осаж дению умеренно растворимой олиметателлуровой кислоты. Аллотеллуровая кислота п «(H 2 Te 04)3(H 20)4» — это кислотный «сироп» , получаемый при нагревании Te(OH)6 в запаянной ампуле при 305 °С: это соеди нение не было получено в чистом виде, оно склонно превращаться в 6 Te. O 6 H при комнатной температуре или в (Н 2 Те 04)n при нагревании на воздухе; на самом деле не исключено, что это смесь двух указан ных веществ. еллураты получают сплавлением теллуритов с соответствующими нитратами, Т окислением теллу ритов хлором или нейтрализацией теллуровой кис лоты идроксидами г
 Другие неорганические соединения Соединение красного цвета Se 4 S 4 получено сплав лением квимолярных количеств простых э веществ; это ковалентное молекулярное производное, кото рое кристаллизуется из бензола. Аналогичным спо собом получены e 2 S 6, Se. S 7 и Te. S 7, все они структурно родственны S 8 S Po. S образуется в виде черного осадка, когда к подкисленным растворам соединений полония добавляют сероводород. Органические соединения Химия селенорганических и теллурорганических соединений — обширная область, которая, несмотря на сходство в целом, отличается от химии серо органических соединений. Биохимия селенорганических соединений также хорошо изучена.
Другие неорганические соединения Соединение красного цвета Se 4 S 4 получено сплав лением квимолярных количеств простых э веществ; это ковалентное молекулярное производное, кото рое кристаллизуется из бензола. Аналогичным спо собом получены e 2 S 6, Se. S 7 и Te. S 7, все они структурно родственны S 8 S Po. S образуется в виде черного осадка, когда к подкисленным растворам соединений полония добавляют сероводород. Органические соединения Химия селенорганических и теллурорганических соединений — обширная область, которая, несмотря на сходство в целом, отличается от химии серо органических соединений. Биохимия селенорганических соединений также хорошо изучена.


