тема_14 лекция_14 Сбраживание аминокислот.ppt
- Количество слайдов: 19

Сбраживание аминокислот

• Так как входящие в состав белков 20 аминокислот имеют в среднем ту же степень восстановления, что и сахара, они могут служить субстратами окислительно-восстановительных процессов брожения. • Анаэробные организмы, способные разлагать аминокислоты, были открыты более столетия назад; стехиометрию этого процесса впервые описал Л. Стикланд (Stickland) в 1930 -х гг.
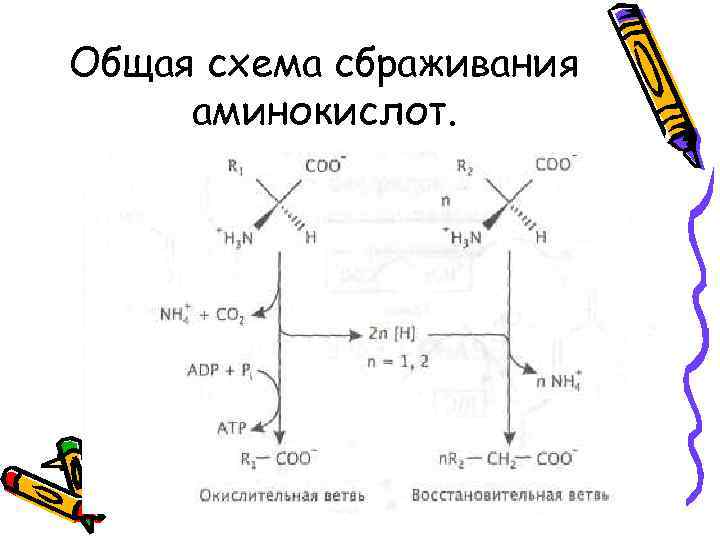
Общая схема сбраживания аминокислот.

• в 1940 -х гг. , Г. Баркер (Barker) с сотрудниками выделил клостридии и родственные им неспорообразующие анаэробные бактерии, способные осуществлять брожение в присутствии только одной аминокислоты. • С. propionicum в качестве единственнного субстрата брожения использует аланин; вид Eubacterium acidaminophilum — глицин. • анализ 16 S-РНК показал, что почти все организмы, способные сбраживать аминокислоты, относятся к клостридиям и родственным им бактериям.

• Процесс сбраживания аминокислот состоит из ряда анаэробных окислительно-восстановительных реакций, и его окислительная ветвь всегда сопряжена с субстратным фосфорилированием, обеспечивающим рост. • R-CO-SCo. A + Ацетат → R-COO- + Ацетил-SCo. A • В реакциях восстановительной ветви брожения АТР обычно не образуется

• В результате сбраживания аминокислот образуются аммиак, СО 2, Н 2, спирты и короткоцепочечные жирные кислоты, которые являются продуктами восстановительной ветви брожения и часто имеют тот же углеродный скелет, что исходные аминокислоты. • Например, лейцин восстанавливается до 4 -метилвалериановой кислоты, триптофан - до индолпропионата. • Энергия запасается путем субстратного фосфорилирования.

• При сбраживании аминокислот, которое осуществляют главным образом клостридии и родственные им бактерии, • одна аминокислота служит донором электронов, другая — акцептором либо одна и та же аминокислота используется и как донор, и как акцептор электронов. • В качестве конечных продуктов образуются аммиак, диоксид углерода, молекулярный водород и короткоцепочечные жирные кислоты, которые обычно сохраняют углеродный скелет исходной аминокислоты. • Энергия запасается при этом путем субстратного фосфорилирования.

• Отщепление аминогрупп от аминокислот в процессе их сбраживания может происходить путем окисления, элиминирования или восстановления. • Два первых пути характерны также для аэробных процессов метаболизирования аминокислот, тогда как восстановительное замещение аминогрупп глицина и пролина характерно только для анаэробов. • Восстановление глицина до ацетилфосфата катализирует глицинредуктаза, представляющая собой комплекс из трех ферментов
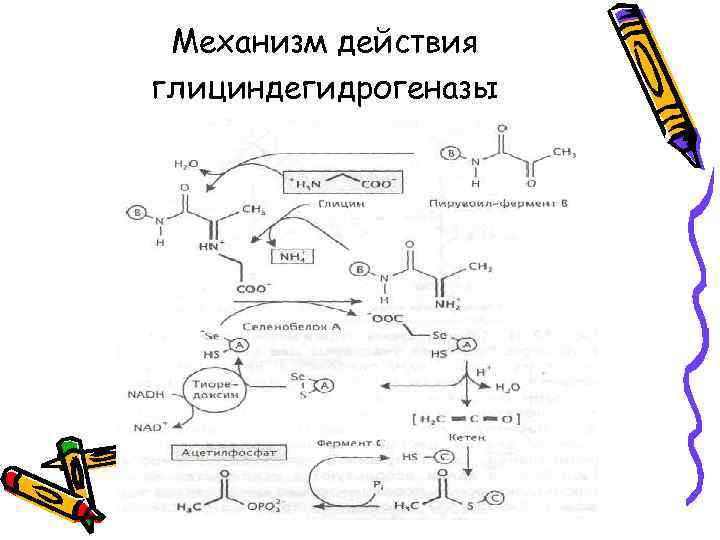
Механизм действия глициндегидрогеназы

• Глицин + NADH + 2 Н+ + НРО 42‾ → Ацетилфосфат2‾ + NH 4+ + Н 2 О + NAD+ • ∆G 0' = -23 к. Дж/моль глицина • D-пролин + 2 Н+ + 2 е‾ → • 5 -Аминовалериановая кислота • L-пролин → D-пролин рацемаза • Без запасания энергии.

• 2 -0 ксокислоты, образующиеся при дезаминировании аминокислот путем окисления, трансаминирования или элиминирования, часто окисляются далее в реакциях декарбоксилирования с образованием Со. А-эфиров соответствующих короткоцепочечных жирных кислот. • Окислителем служит при этом у аэробов NAD+ , у строгих анаэробов — ферредоксин.

• Ферредоксины — это низкомолекулярные (< 10 к. Да) кислые белки, содержащие [4 Fe— 4 S]- или [2 Fе-2 S]-центры; они акцептируют только один электрон на такой центр (Фд‾). • Окислительное декарбоксилирование аминокислот осуществляют 2 -оксокислота: ферредоксиноксидоредуктазы; эти ферменты содержат тиаминдифосфат и в качестве простетических групп — железо-серные центры.

• R-CO-COO‾ + 2 Фд + Co. ASH → • → R-CO-SCo. A + СО 2 + 2 Фд‾ + Н+ (2 -оксокислота: ферредоксиноксидоредуктаза) • ∆G 0' = -20 к. Дж/моль

• Восстановительный 2 гидроксикислотный путь, широко распространенный у анаэробов, включает восстановление 2 оксокислот до (R)-2 гидроксикислот с их последующей активацией (образование Со. Аэфиров) и syn-дегидратацией, при которой образуется еноил-Со. Аэфир

2 -Гидроксикислотный путь сбраживания аминокислот
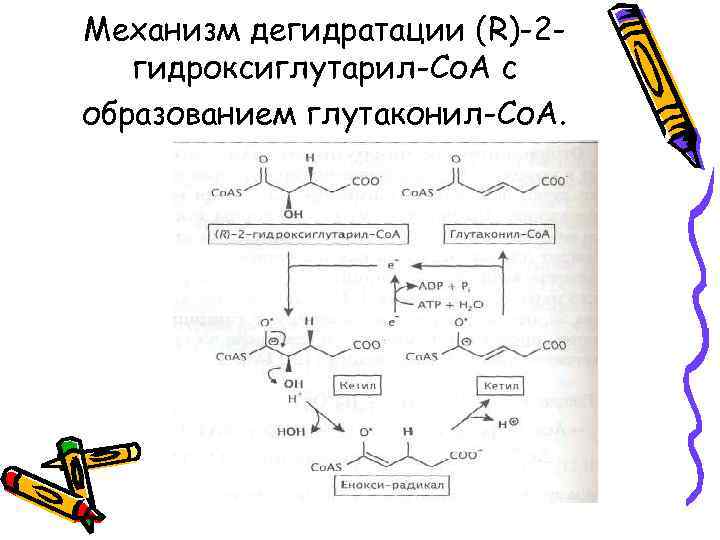
Механизм дегидратации (R)-2 гидроксиглутарил-Со. А с образованием глутаконил-Со. А.

• Кротонил-Со. А (2 -бутеноил-Со. А) образуется как интермедиат в некоторых путях сбраживания глутамата, лизина, треонина и метионина. • Кротонил-Со. А образуется как промежуточнй продукт в различных процессах брожения, поскольку он способен окисляться до ацетата в реакции, сопряженной с субстратным фосфорилированием, либо восстанавливаться до бутирата. • Однако его восстановление, в отличие от восстановления фумарата, не сопряжено с синтезом АТР путем окислительного фосфорилирования

Сбраживание аминокислот происходит по следующим основным путям. • 1. Прямое восстановительное элиминирование аминогруппы в случае глицина и пролина. Восстановление глицина приводит к образованию ацетилфосфата, фосфатная группа которого используется для фосфорилирования ADP. • 2. Реакции окисления, трансаминирования или β-элиминирования с образованием 2 оксокислот, подвергающихся затем окислительному декарбоксилированию с образованием ацил. Со. А или восстановлению до (R)-2 -гидроксикислот, которые активируются путем присоединения Со. А. Это обеспечивает дальнейшее необратимое β-элиминирование воды, с образованием еноил-Со. А, который далее восстанавливается до ацил-Со. А (гидроксикислотный путь, ГКП).

• • • 3. Превращение глутамата и лизина в β -аминокислоты, из которых аминогруппа удаляется путем βэлиминирования. 4. Образование кротонил-Со. А как промежуточного продукта во многих путях сбраживания аминокислот. 5. Аспартат и аспарагин дезаминируются с образованием фумарата, который служит акцептором электронов при анаэробном дыхании
тема_14 лекция_14 Сбраживание аминокислот.ppt