 *
*
 * Сахароза C 12 H 22 O 11, или свекловичный сахар, тростниковый сахар, в быту просто сахар — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов — αглюкозы и β-фруктозы. * Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
* Сахароза C 12 H 22 O 11, или свекловичный сахар, тростниковый сахар, в быту просто сахар — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов — αглюкозы и β-фруктозы. * Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
 * Сахароза имеет высокую растворимость. В химическом отношении сахароза довольно инертна, так как при перемещении из одного места в другое почти не вовлекается в метаболизм. Иногда сахароза откладывается в качестве запасного питательного вещества. * Сахароза, попадая в кишечник, быстро гидролизуется альфа-глюкозидазой тонкой кишки на глюкозу и фруктозу, которые затем всасываются в кровь. Ингибиторы альфаглюкозидазы, такие, как акарбоза, тормозят расщепление и всасывание сахарозы, а также и других углеводов, гидролизуемых альфаглюкозидазой, в частности, крахмала.
* Сахароза имеет высокую растворимость. В химическом отношении сахароза довольно инертна, так как при перемещении из одного места в другое почти не вовлекается в метаболизм. Иногда сахароза откладывается в качестве запасного питательного вещества. * Сахароза, попадая в кишечник, быстро гидролизуется альфа-глюкозидазой тонкой кишки на глюкозу и фруктозу, которые затем всасываются в кровь. Ингибиторы альфаглюкозидазы, такие, как акарбоза, тормозят расщепление и всасывание сахарозы, а также и других углеводов, гидролизуемых альфаглюкозидазой, в частности, крахмала.
 * Внешний вид *Бесцветные моноклинные кристаллы. При застывании расплавленной сахарозы образуется аморфная прозрачная масса
* Внешний вид *Бесцветные моноклинные кристаллы. При застывании расплавленной сахарозы образуется аморфная прозрачная масса
 * Химические и физические свойства * Молекулярная масса 342, 3 а. е. м. Брутто-формула (система Хилла): C 12 H 22 O 11. Вкус сладковатый. Растворимость (в граммах на 100 граммов растворителя): в воде 179 (0 °C) и 487 (100 °C), в этаноле 0, 9 (20 °C). Малорастворима в метаноле. Не растворима в диэтиловом эфире. Плотность 1, 5879 г/см 3 (15 °C). Удельное вращение для D-линии натрия: 66, 53 (вода; 35 г/100 г; 20 °C). При охлаждении жидким воздухом, после освещения ярким светом кристаллы сахарозы фосфоресцируют. Не проявляет восстанавливающих свойств — не реагирует с реактивом Толленса и реактивом Фелинга. Не образует открытую форму, поэтому не проявляет свойств альдегидов и кетонов. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала» , при нагревании с гидроксидом меди (II) не образует красного оксида меди (I). Из числа изомеров сахарозы, имеющих молекулярную формулу С 12 Н 22 О 11, можно выделить мальтозу и лактозу.
* Химические и физические свойства * Молекулярная масса 342, 3 а. е. м. Брутто-формула (система Хилла): C 12 H 22 O 11. Вкус сладковатый. Растворимость (в граммах на 100 граммов растворителя): в воде 179 (0 °C) и 487 (100 °C), в этаноле 0, 9 (20 °C). Малорастворима в метаноле. Не растворима в диэтиловом эфире. Плотность 1, 5879 г/см 3 (15 °C). Удельное вращение для D-линии натрия: 66, 53 (вода; 35 г/100 г; 20 °C). При охлаждении жидким воздухом, после освещения ярким светом кристаллы сахарозы фосфоресцируют. Не проявляет восстанавливающих свойств — не реагирует с реактивом Толленса и реактивом Фелинга. Не образует открытую форму, поэтому не проявляет свойств альдегидов и кетонов. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала» , при нагревании с гидроксидом меди (II) не образует красного оксида меди (I). Из числа изомеров сахарозы, имеющих молекулярную формулу С 12 Н 22 О 11, можно выделить мальтозу и лактозу.
 * Реакция сахарозы с водой * Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор, то появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди (II) до оксида меди (I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
* Реакция сахарозы с водой * Если прокипятить раствор сахарозы с несколькими каплями соляной или серной кислоты и нейтрализовать кислоту щелочью, а после этого нагреть раствор, то появляются молекулы с альдегидными группами, которые и восстанавливают гидроксид меди (II) до оксида меди (I). Эта реакция показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
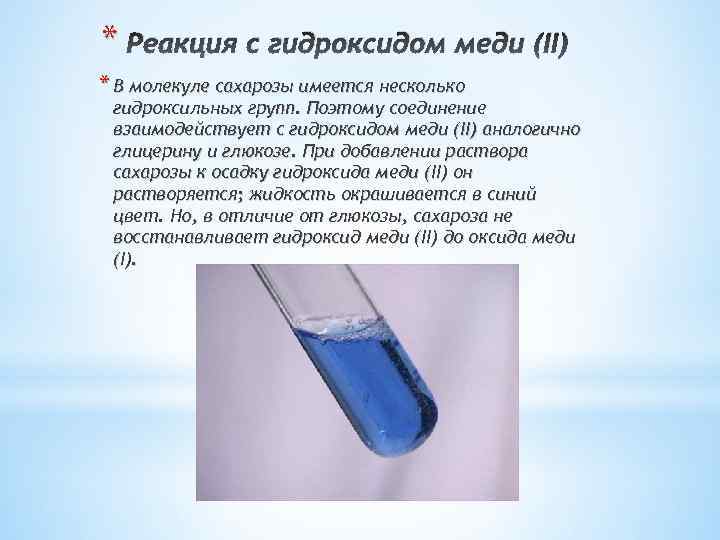 * Реакция с гидроксидом меди (II) * В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с гидроксидом меди (II) аналогично глицерину и глюкозе. При добавлении раствора сахарозы к осадку гидроксида меди (II) он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди (II) до оксида меди (I).
* Реакция с гидроксидом меди (II) * В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с гидроксидом меди (II) аналогично глицерину и глюкозе. При добавлении раствора сахарозы к осадку гидроксида меди (II) он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает гидроксид меди (II) до оксида меди (I).
 * Природные и антропогенные источники * Содержится в сахарном тростнике, сахарной свёкле (до 28 % сухого вещества), соках растений и плодах (например, берёзы, клёна, дыни и моркови). Источник получения сахарозы — из свёклы или из тростника, определяют по соотношению содержания стабильных изотопов углерода 12 C и 13 C. Сахарная свёкла имеет C 3 механизм усвоения углекислого газа (через фосфоглицериновую кислоту) и предпочтительно поглощает изотоп 12 C; сахарный тростник имеет C 4 -механизм поглощения углекислого газа (через щавелевоуксусную кислоту) и предпочтительно поглощает изотоп 13 C.
* Природные и антропогенные источники * Содержится в сахарном тростнике, сахарной свёкле (до 28 % сухого вещества), соках растений и плодах (например, берёзы, клёна, дыни и моркови). Источник получения сахарозы — из свёклы или из тростника, определяют по соотношению содержания стабильных изотопов углерода 12 C и 13 C. Сахарная свёкла имеет C 3 механизм усвоения углекислого газа (через фосфоглицериновую кислоту) и предпочтительно поглощает изотоп 12 C; сахарный тростник имеет C 4 -механизм поглощения углекислого газа (через щавелевоуксусную кислоту) и предпочтительно поглощает изотоп 13 C.



