Сахарный диабет.pptx
- Количество слайдов: 45

Сахарный диабет Каз. НМУ им. Асфендиярова С. Ж. Кафедра ЛД и. ММ Асс. Искакова А. С.

Сахарный диабет Согласно определенению МЭК по диагностике и классификации СД (1997) сахарный диабет – это группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, которая является результатом дефекта секреции инсулина, либо его действия, либо обоих этих факторов


Классификация сахарного диабета (ВОЗ, 1999) Вид диабета Варианты 1. Сахарный диабет типа 1 А. Аутоиммунный (деструкция b-клеток, обычно В. Идиопатический приводящая к абсолютной инсулиновой недостаточности) 2. Сахарный диабет типа 2 (от преимущественной резистентности к инсулину с относительной инсулиновой недостаточностью до преимущественного секреторного дефекта с инсулиновой резистентностью или без нее).

3. Другие специфические типы диабета 4. Гестационный сахарный диабет А. Генетические дефекты bклеточной функции Б. Генетические дефекты в действии инсулина В. Болезни экзокринной части поджелудочной железы Г. Эндокринопатии Д. Диабет, индуцированный лекарствами или химикалиями Е. Инфекции Ж. Необычные формы иммунноопосредованного диабета З. Другие генетические синдромы, иногда сочетающиеся с диабетом

Сахарный диабет 1 типа У 90% пациентов СД 1 типа – заболевание аутоиммунного происхождения, тесно связанное с системой гистосовместимости. Для СД 1 типа характерен специфический HLA фенотип и наличие в сыворотке крови антител к инсулинпродуцирующим бета-клеткам (85% пациентов) В основе заболевания лежит генетический дефект в иммунной системе, заключающийся в недостаточности функции органоспецифических СД 8+ лимфоцитов (Тсупрессоров) и наличием агрессивных органоспецифических СД 4 -лимфоцитов (Т-хелперов), сенсибилизированных к белку 64 к. Да, который находится на мембранах инсулин-продуцирующих бета клеток ПЖ

Сахарный диабет 1 типа Т-хелперы инфильтрируют островки ПЖ совместно с с Влимфоцитами и макрофагами. Они стимулируют выработку Влимфоцитами аутоантител против белка 64 к. Да. В результате – деструкция и гибель бета -клеток островков Лангенрганса. В течение первого года заболевания количество бета клеток снижается у пациента до 10% и меньше. Запуск иммунной атаки может являтся следствием «молекулярной мимикрии» . Так у ряда вирусов (Коксаки, мегаловирусы) часть белковой молекуля состоит из последовательности аминокислот таких же как в декарбоксилазе глютаминовой кислоты бета-клеток. В результате сенсибилизированные к этим вирусам Т-л, при наличие генетического дефекта в иммунной системе, атакуют параллельно с вирусным и собственный белок бета-клеток


Маркеры иммунной деструкции бетаклеток аутоантитела к островковым клеткам (ICAs-islet-cell antibodies), аутоантитела к инсулину и проинсулину (IAAs-insulin autoantibodies) аутоантитела к декарбоксилазе глутаминовой кислоты (GAD 65 -glutamicacid decarboxilase autoantibodies) аутоантитела к тирозин –фосфатазам (IA-2 и IA 2 b) Указанные антитела относятся к иммуноглобулинам класса Ig. D.

Особого внимания заслуживают антитела к глутаматдекарбок-силазе, так как именно они, в отличие от IСА и IAA, ассоциировались непосредственно с риском развития СД 1 типа и сравнительно редко определялись у лиц с другими аутоиммунными заболеваниями. Глутаматдекарбоксилаза - это фермент, катализирующий превращение глутамата в гамма-аминокапроновую кислоту (ГАМК). Данный факт подтверждается тем, что антитела к указанному антигену перекрестно реагировали с ГАМК-ергическими структурами ЦНС больных с редким неврологическим заболеванием. Таким образом, выделяют две изоформы у человека. Панкреатические островки экспрессируют GAD-65 с молекулярной массой 65 000 Мr. Синтез этого фермента кодируется геном, расположенным на 10 -й хромосоме (островковая форма GAD). Мозговая форма GAD-67 экспрессируется ГАМК-ергическими клетками ЦНС, имеет молекулярную массу 67 000 Mr и кодируется геном, расположенным на 2 -й хромосоме. Характерно, что 65% последовательных аминокислотных остатков молекул обеих изоформ GAD-65 и GAD-67 абсолютно идентичны. Следовательно, антитела, направленные против одной из изоформ, перекрестнореагируют с другой изоформой, что неоднократно подтверждалось в исследованиях in vivo и in vitro. Диагностическая ценность антител к GAD-65 как маркеров повышенного риска развития ИЗСД особенно возрастает, если учесть факт экспрессии данного антигена, прежде всего бета-клетками поджелудочной железы человека.

Иммунноопосредованные формы СД 1 типа Чаще всего СД 1 типа встречается у детей и подростков ( «ювенильный диабет» ). Отдельную группу составляют больные , у которых СД развивается в возрасте 35 -75 лет и характеризуется наличием аутоантител к различным антигенам ПЖ. Одна авторы рассматривают его как латентный СД 1 типа – LADA. Другие показали, что данный вид симулирует СД 2 типа и характеризуется постепенным ухудшением и переходом в инсулинзависимость.

Определение диабетассоциированных антител (ДААт) стало обязательным протокольным этапом исследований всех авторитетных международных регистров и проспективных многоцентровых программ по изучению СД 1 Т. Не останавливаясь подробно на характеристике отдельно взятого регистра, хотелось бы отметить, что в создании регистра BABY-DIAB принимал участие метр мировой диабетологической аутоиммунологии, первооткрыватель ДААт – профессор Bonifacio. Он также был наряду с известным иммунологом – профессором Bingley одним из руководителей программы EDNIT.

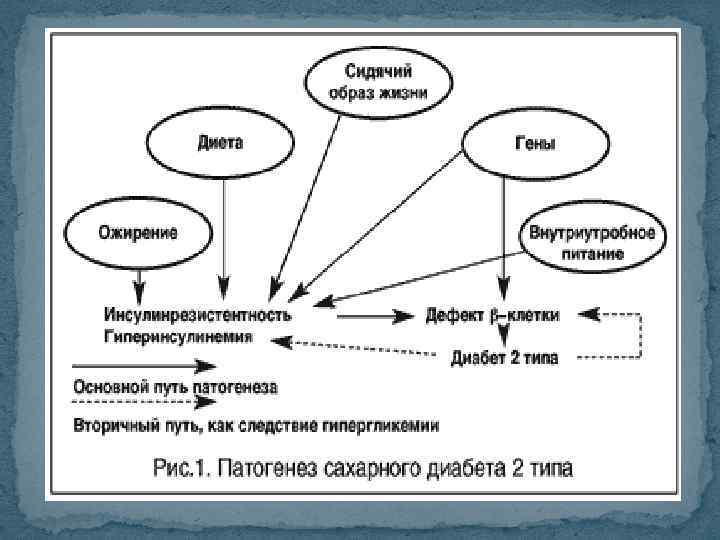
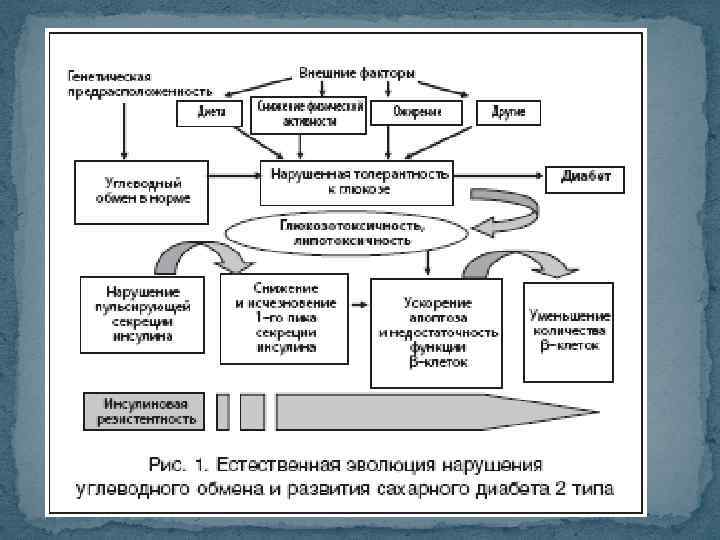
Сахарный диабет 2 типа СД 2 типа, диабет со «взрослым началом – протекает с резистентностью к инсулину и обычно с относительным дефицитом инсулина. Гипергликемия развивается постепенно, вследствие чего долгое время СД 2 типа остается недиагностированным. Нередко развивается у женщин с предшествующим гестационным СД, у пациентов с АГ и дислипидемией. Отмечена и генетическая предрасположенность – более чем у 20% пациентов родственники 1 степени родства также страдают (ли) СД 2 типа.

Специфические типы диабета К специфическим типам сахарного диабета относятся относительно редко встречающиеся случаи заболевания, когда этиологический фактор диабета может быть установлен достаточно. Сюда относятся: выявленные генетические дефекты функции бета-клеток и действия инсулина - MODY диабет (СД взрослого типа, развивающийся у молодежи) Молекулярно-генетические исследования показали наличие по крайней мере 5 синдромов: MODY-1 (сочетается с мутациями гена HNF-4 (на хромосоме 20 ql 2 ql 3. 1), MODY-2 (сочетается с мутациями гена глюкокиназы на хромосоме 7 р15 -р13), МОDY-3 (сочетается с мутациями гена HNF-1 (на хромосоме 12 q 24. 2), MODY-4 (сочетается с мутацией гена IPF-1 на хромосоме 13 ql 2. 1), MODY-5 (сочетается с мутациями гена HNF-1 (на хромосоме 17 cenq 21. 3) К настоящему времени идентифицировано 5 указанных выше генов, мутация которых приводит к развитию различных форм диабета MODYтипа.

MODY-тип сахарного диабета выявляют у лиц в возрасте до 25 лет при некотором увеличении частоты заболеваемости в возрасте 9— 13 лет. Как правило, в течение первых 2 лет от начала заболевания больные обходятся без инсулинотерапии, и при этом у них не развивается кетоацидоз. Точных статистических данных о распространенности диабета MODY-типа нет Результаты исследований, проведенных в последние годы, позволяют считать, что около 2— 5% больных сахарным диабетом типа 2 на самом деле больны диабетом MODYтипа.

Специфические типы диабета Заболевания экзокринной части поджелудочной железы - хронический панкреатит, гемохроматоз, травма, неоплазия Эндокринопатии – синдром Иценко-Кушинга, акромегалия, глюкагонома, гипертиреоз, феохромацитома, соматостатинома Лекарственно или химически индуцированный диабет – гормонально-активные препаратаы, психотропные препараты, диуретики, анальгетики, НСПП Инфекции – эпидемический паротит, вроженная краснуха, цитомегаловирус Иммунные заболевания – СКВ, образуются антитела к инсулину, т. н. синдром инсулиновой резистентности В

Генетические дефекты в действии инсулина 1. Резистентность к инсулину типа А – встречается у девочек пубертантного периода, характеризуется гиперинсулинемией и резистентностью к инсулину. Имеется врожденный дефект механизма, участвующего в передаче биосигнала действия инсулина 2. Лепрехаунизм и синдром Рабсона-Менденхолла – редке семейные заболевания, характеризуется инсулинрезистентностью и вирилизмом 3. Липоатрофический диабет – инсулинрезистентность + полная атрофия или гипотрофия жировой ткани. Причина – мутация гена рецептора к инсулину

Гестационный сахарный диабет - это нарушение углеводного обмена, впервые возникшие или выявленные во время беременности. Гестационным диабетом называют диабет, проявляющийся у беременных женщин в период вынашивания. Период беременности является сильным физиологическим стрессом для клеток поджелудочной железы. Даже если вынашивание проходит нормально, приблизительно с 20 недели чувствительность клеток к инсулину постепенно уменьшается, а секреция инсулина после приема пищи существенно увеличивается (особенно в третьем триместре). Во всем «виноваты» гормоны беременности (эстрогены, кортизол, плацентарные гормоны), которые блокируют действие инсулина.

ФАКТОРЫ РАЗВИТИЯ САХАРНОГО ДИАБЕТА У БЕРЕМЕННЫХ Наследственность (диабет у родственников) Первая беременность в 35 или старше Ожирение или избыточный вес Инфекции Рождение предыдущего ребенка массой тела более 4 кг Выкидыш или замершая беременность в анамнезе Пороки развития плода у предыдущих детей Глюкозурия (обнаружение сахара в моче) Гестационный диабет в предыдущую беременность Многоводие Уровень глюкозы в капиллярной крови натощак выше 5, 5 ммоль/л или через 2 часа после еды более 7, 8 ммоль/л Артериальная гипертензия Тяжелые формы гестоза в анамнезе

Гипергликемия матери приводит к гипергликемии в системе кровообращения ребенка. Глюкоза легко проникает через плаценту и непрерывно переходит к плоду из крови матери. Также происходят активный транспорт аминокислот и перенос кетоновых тел плоду. В отличие от этого инсулин, глюкагон и свободные жирные кислоты матери в кровь плода не попадают.

В первые 9 -12 недель беременности поджелудочная железа плода еще не вырабатывает собственный инсулин. Это время соответствует той фазе органогенеза плода, когда при постоянной гипергликемии у матери могут формироваться различные пороки развития (сердца, позвоночника, спинного мозга, ЖКТ). С 12 -й недели беременности поджелудочная железа плода начинает синтезировать инсулин, и в ответ на гипергликемию развиваются реактивная гипертрофия и гиперплазия бетаклеток фетальной поджелудочной железы. Вследствие гиперинсулинемии развиваются макросомия плода, а также угнетение синтеза лецитина, что объясняет высокую частоту развития респираторного дистресс-синдрома у новорожденных. В результате гиперплазии бета-клеток и гиперинсулинемии появляется склонность к тяжелым и длительным гипогликемиям.

Диагноз гестационного сахарного диабета устанавливается по следующим критериям: глюкоза цельной крови (венозной, капиллярной) натощак > 6, 1 ммоль/л или глюкоза плазмы венозной крови > 7 ммоль/л или глюкоза цельной капиллярной крови или плазмы венозной крови через 2 часа после нагрузки 75 г глюкозы > 7, 8 ммоль/л. если у женщины, которая относится к группе риска, результаты исследования соответствуют норме, тест проводится повторно на 24 -28 неделе беременности.
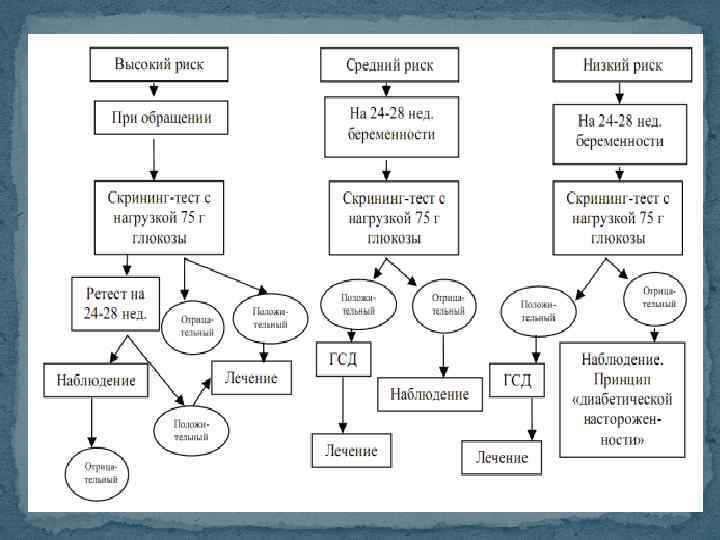

Целью лечения гестационного сахарного диабета и истинного сахарного диабета во время беременности является достижение. следующих лабораторных показателей: гликемия натощак < 5 -5, 8 ммоль/л; гликемия через 1 ч после еды < 7, 8 ммоль/л; гликемия через 2 ч после еды < 6, 7 ммоль/л; уровень Hb. Alc при ежемесячном контроле, как у здоровых (4 -6 %)

Диагностика СД Симптомы диабета + случайное определение уровня глюкозы плазмы более 11, 1 ммоль/л Уровень глюкозы натощак более 7, 0 ммоль/л, в капиллярной крови более 6. 1 ммоль/л Через два часа после проведения теста на толерантность к глюкозе с75 г глюкозы – уровень глюкозы в цельной крови более 10, 0 ммоль/л Для подтверждения диагноза достаточно 2 из приведенных 3 критериев Глюкозурия не может быть использована для постановки диагноза, т. к. глюкоза в моче может появиться в результате нарушения канальцевой реабсорбции.

В неясных случаях необходимо провести тест толерантности к глюкозе (ТТГ) ТТГ необходимо проводить пациентам – при содержании глюкозы в крови натощак от 5, 7 до 6, 9 ммоль/л, неясной глюкозурии, в т. ч. у беременных, при наличие клинических симптомов СД на фоне нормального уровня глюкозы в крови, лицам с выявленными факторами риска в отношении развития сахарного диабета (сахарный диабет у близких родственников, рождение крупного плода, нарушение толерантности к глюкозе в анамнезе, ожирение, гипертоническая болезнь).

ТТГ Пробу проводят утром. Берут исходную порцию крови натощак, больной принимает 75 г глюкозы, растворенной в 200 мл воды, а ребенок - из расчета 1, 75 г глюкозы на 1 кг веса, но не более 75 г. Кровь берут 5 раз: натощак, через 30, 60, 90, 120 мин. Диагноз сахарного диабета выставляется, если натощак концентрация глюкозы в плазме венозной крови составила 7, 0 и более ммоль/л, а через 2 ч - 11, 1 и более ммоль/л. Если натощак уровень глюкозы менее 7 ммоль/л, а через 2 ч в интервале 7, 8 - 11 ммоль/л, то результат трактуется как нарушение толерантности к глюкозе, что соответствует латентной форме сахарного диабета по ранее применявшейся классификации

Гликирование белков Процесс гликирования - формирование устойчивых соединений белковой молекулы с молекулой углевода без участия каких-либо ферментов. Скорость и полнота протекания этого процесса определяются только концентрациями взаимодействующих веществ при условии протекания реакции в живом органзме - «in vivo» . Именно эта реакция и происходит при взаимодействии белков крови (в частности, гемоглобина человека) с глюкозой крови. Чем больше концентрация глюкозы и чем более долгим будет действие этой концентрации глюкозы, тем большее количество гемоглобина вступит в реакцию гликирования, образовав неразрушаемый гликированный гемоглобин - Hb. A 1 c
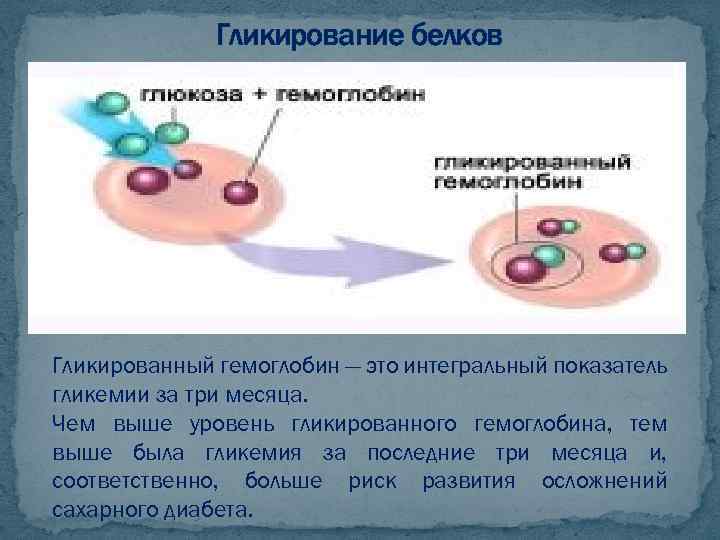
Гликирование белков Гликированный гемоглобин — это интегральный показатель гликемии за три месяца. Чем выше уровень гликированного гемоглобина, тем выше была гликемия за последние три месяца и, соответственно, больше риск развития осложнений сахарного диабета.
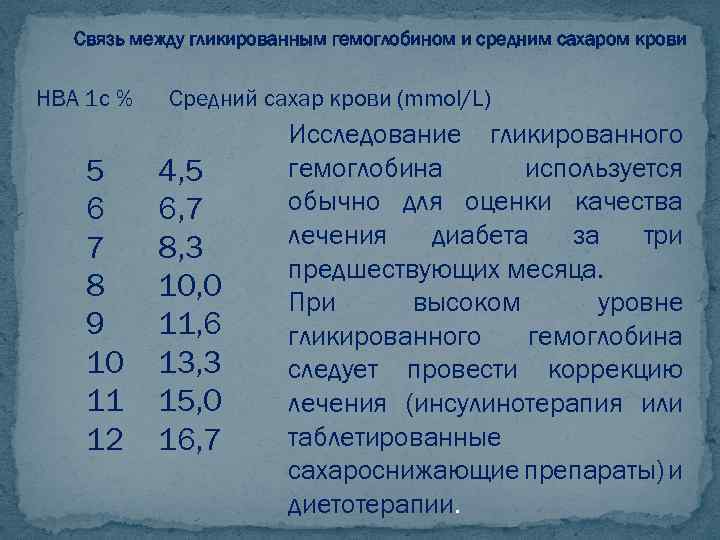
Связь между гликированным гемоглобином и средним сахаром крови HBA 1 с % 5 6 7 8 9 10 11 12 Средний сахар крови (mmol/L) 4, 5 6, 7 8, 3 10, 0 11, 6 13, 3 15, 0 16, 7 Исследование гликированного гемоглобина используется обычно для оценки качества лечения диабета за три предшествующих месяца. При высоком уровне гликированного гемоглобина следует провести коррекцию лечения (инсулинотерапия или таблетированные сахароснижающие препараты) и диетотерапии.

Фруктозамин представляет собой продукт гликозилирования альбумина плазмы крови. Степень гликозилирования зависит от концентрации глюкозы в крови и длительности полураспада белков. Для альбумина этот период составляет около 20 дней. Таким образом, фруктозамин является достоверным показателем для ретроспективного контроля содержания глюкозы за последние 2 -3 недели. В этом плане определение фруктозамина имеет определенные преимущества перед исследованием- гликолизированного гемоглобина, который отражает степень постоянного или транзиторного повышения уровня глюкозы за последние 3 -4 месяца. Поэтому определение фруктозамина выглядит более предпочтительным при сахарном диабете, где возникает необходимость получения информации об относительно коротком промежутке времени течения углеводных нарушений (подбор режима сахароснижающей терапии, наличие осложнений диабета, требующих постоянного гибкого управления гликемией и т. д). На концентрацию гликированных белков не влияет характер питания в предыдущие перед исследованием дни и прием пищи непосредственно перед забором крови.

Диабетический кетоацидоз (ДКА) Главной причиной развития ДК является абсолютный дефицит инсулина в организме, обычно провоцируемый различными заболеваниями (воспалительные процессы, инфекции, острый инфаркт миокарда, нарушение мозгового кровообращения и т. д. ), хирургическими вмешательствами, травмами, а также нарушениями режима лечения (введение просроченного или неправильно хранившегося инсулина, неадекватная доза инсулина), эмоциональными стрессами и беременностью. Абсолютный дефицит инсулина приводит к снижению утилизации глюкозы клетками, гипергликемии, гиперосмолярности, выраженной дегидратации, гиповолемическому шоку и серьезным электролитным нарушениям. Дефицит инсулина и, соответственно, дефицит энергии в клетках ведут к мобилизации всех контринсулиновых гормонов, активации липолиза, повышению уровня свободных жирных кислот (СЖК), продукции кетоновых тел и развитию тяжелого метаболического ацидоза.

Ранними клиническими симптомами ДК являются типичные признаки декомпенсации СД, такие как нарастающие жажда, полиурия, сухость слизистых и кожи, слабость, головная боль, сонливость. В связи с нарастающей интоксикацией появляются тошнота и рвота, которая вскоре учащается и приобретает неукротимый характер. По мере нарастания ДКА запах ацетона в выдыхаемом воздухе усиливается, а дыхание становится частым, шумным и глубоким (респираторная компенсация, дыхание Куссмауля). У многих больных наблюдается так называемый «абдоминальный синдром» , проявляющийся клиникой «острого живота» . Нередко сочетание болей в животе, рвоты и обычно наблюдаемого при кетоацидозе лейкоцитоза приводит к диагностическим ошибкам и недопустимым в данном состоянии хирургическим вмешательствам, часто заканчивающимся летально.
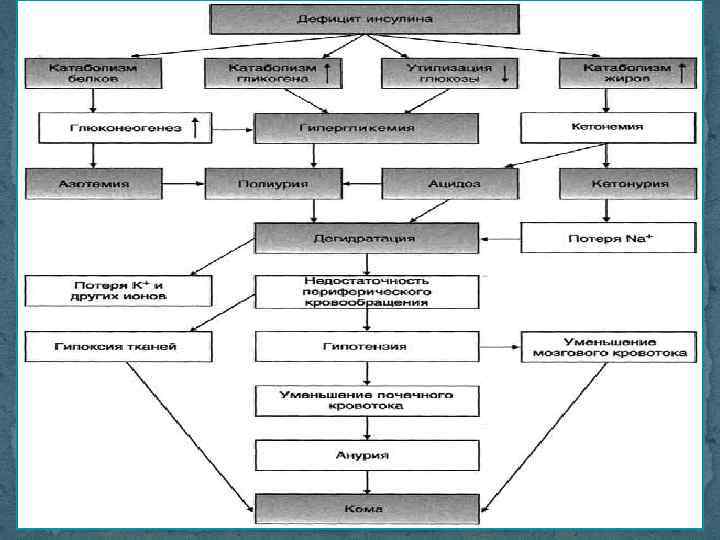

Гиперосмолярная некетотическая кома (ГОНК) встречается примерно в 10 раз реже, чем ДКА. Ацидоза нет, но присутствуют резко выраженная гипергликемия (вплоть до 55, 5 ммоль/л и более), гиперосмолярность, дегидратация, нарушение сознания. Большинство больных с гиперосмолярными состояниями старшего возраста, причем чаще всего с сахарным диабетом II типа. Факторами, способствующими развитию гиперосмолярной комы, являются сопутствующие заболевания (инфекции, панкреатит, инсульт и т. д). Усиливающийся глюкозурический (осмотический) диурез ведет к тяжелой дегидратации. С патофизиологической точки зрения, в условиях относительной инсулиновой недостаточности секреции инсулина еще хватает, чтобы подавить липолиз и, следовательно, образование кетоновых тел, но недостаточно, чтобы подавить продукцию глюкозы печенью.

Клиническая картина характеризуется крайней степенью дегидратации, которая обусловлена массивной глюкозурией, угрожающей недостаточностью кровообращения, часто - олиго- и анурией после периода массивной полиурии. Особенность гиперосмолярной комы - частое наличие полиморфной неврологической симптоматики, которая не укладывается в какой-либо стойкий синдром и исчезает после выведения из гиперосмолярного состояния. Иногда ее ошибочно трактуют как симптомы начинающегося отека мозга и вместо регидратации начинают проводить форсированный диурез (!). При позднем начале терапии летальность от гиперосмолярной комы достигает 5 -50%.

Нормальное значение осмолярности крови - 285295 мосмоль/л. Этот показатель рассчитывают по следующей формуле: 2 (Na+ ммоль/л + К+ ммоль/л) + глюкоза (ммоль/л) + мочевина (ммоль/л) + 0, 03 х общий белок (г/ л) = осмолярность (мосмоль/л). Концентрацию мочевины и белка можно и не учитывать, так как они очень слабо влияют на итоговый показатель, в то время как решающей для осмолярности является степень гипернатриемии и гипергликемии.
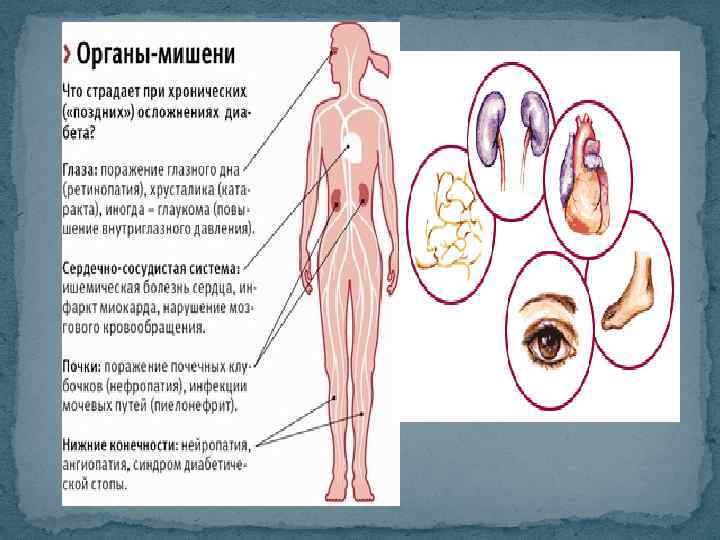

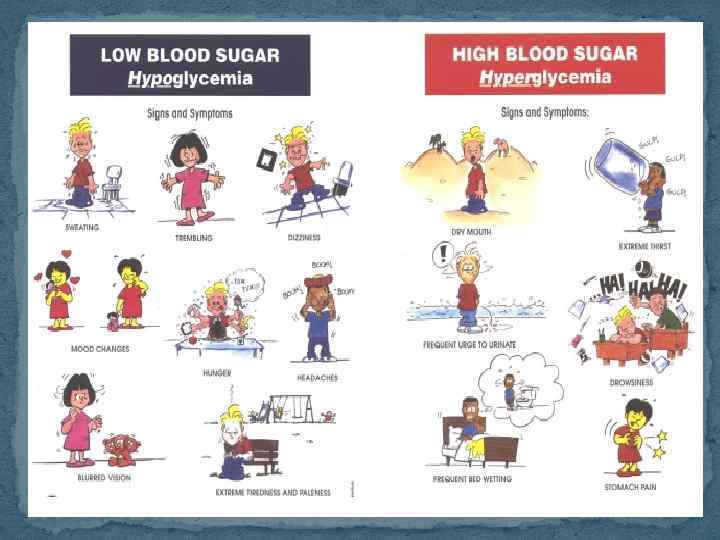
Сахарный диабет.pptx