Гликоконъюгаты.pptx
- Количество слайдов: 20

Санкт-Петербургский государственный университет Гликоконъюгаты: структура и функции протеогликанов и гликопротеинов. Презентацию выполнил: Кренев Илья, 2 курс
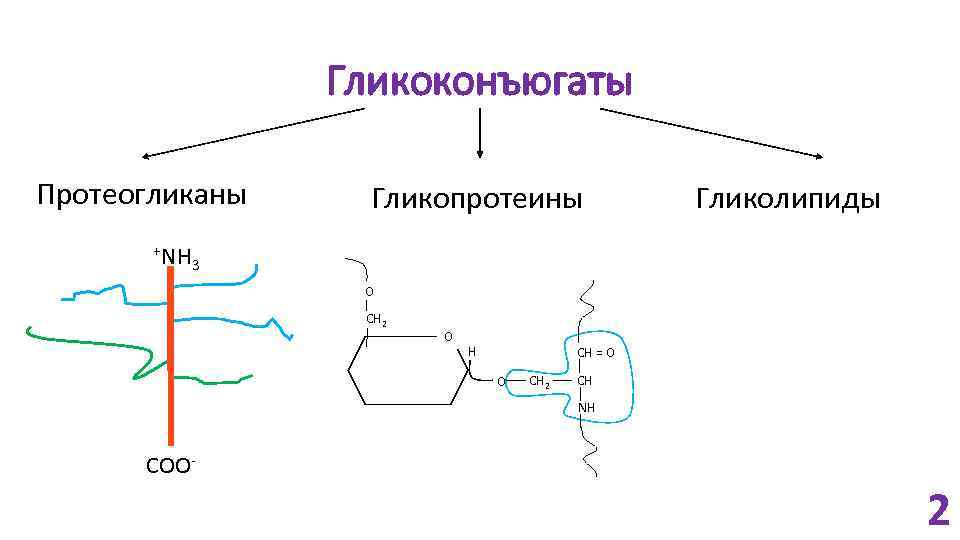
Гликоконъюгаты Протеогликаны +NH Гликопротеины Гликолипиды 3 O CH 2 O H CH = O O CH 2 CH NH COO- 2

Протеогликаны • На поверхности клеток и во внеклеточном матриксе (основной компонент); • Одна или несколько цепей ГАГ связаны ковалентной связью с мембранным или секретируемым белком; • Цепь ГАГ может прикрепляться к внеклеточным белкам за счёт электростатических взаимодействий; • Клетки млекопитающих синтезируют около 40 типов ПГ. 3
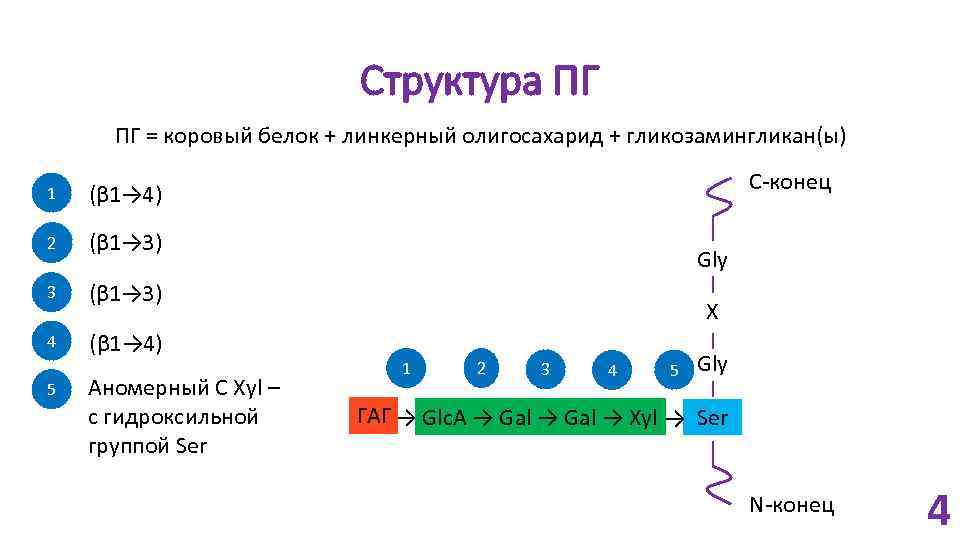
Структура ПГ ПГ = коровый белок + линкерный олигосахарид + гликозамингликан(ы) 1 1 2 (β 1→ 3) 3 (β 1→ 3) 4 (β 1→ 4) C-конец (β 1→ 4) 5 Аномерный C Xyl – с гидроксильной группой Ser Gly X 1 2 3 4 5 Gly ГАГ → Glc. A → Gal → Xyl → Ser N-конец 4
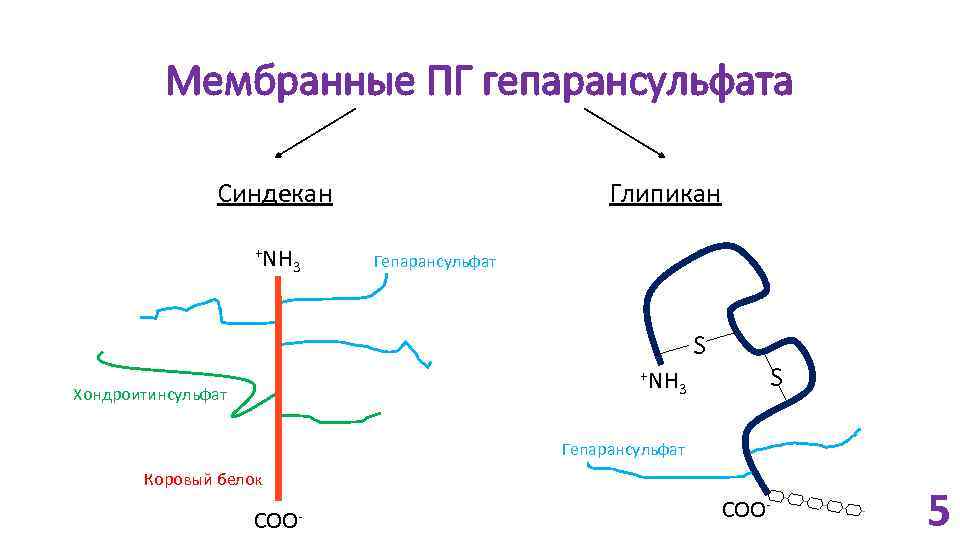
Мембранные ПГ гепарансульфата Синдекан +NH 3 Глипикан Гепарансульфат S +NH Хондроитинсульфат 3 S Гепарансульфат Коровый белок COO- 5
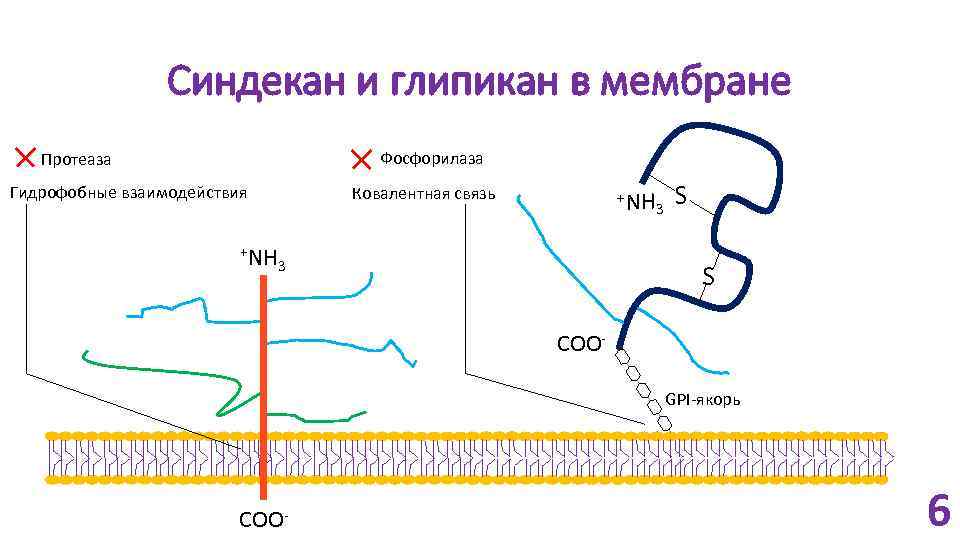
Синдекан и глипикан в мембране Фосфорилаза Протеаза Гидрофобные взаимодействия +NH Ковалентная связь +NH 3 3 S S COOGPI-якорь COO- 6
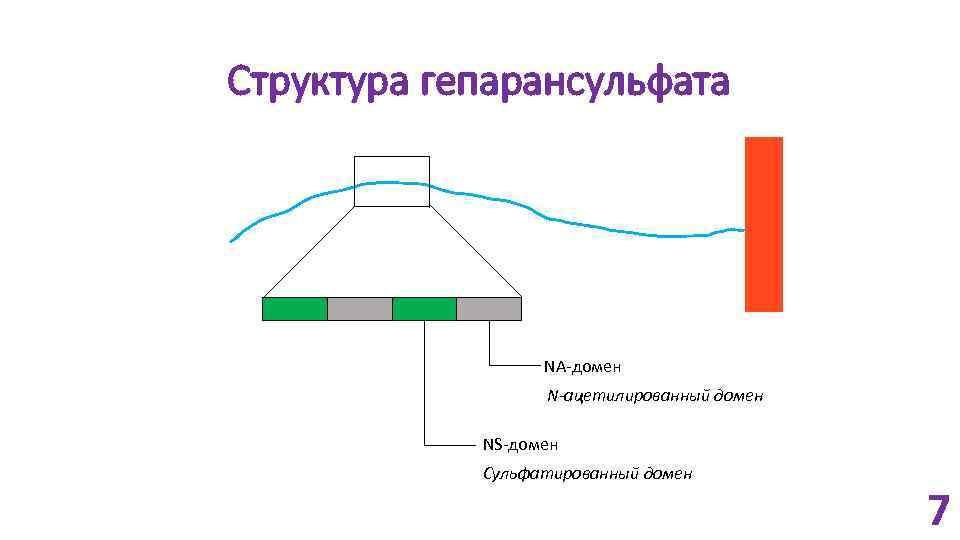
Структура гепарансульфата NA-домен N-ацетилированный домен NS-домен Сульфатированный домен 7
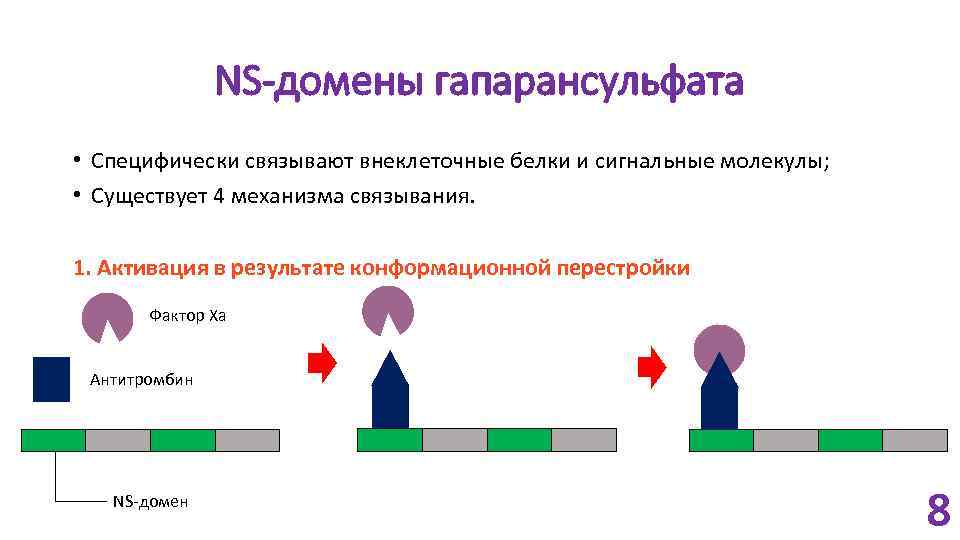
NS-домены гапарансульфата • Специфически связывают внеклеточные белки и сигнальные молекулы; • Существует 4 механизма связывания. 1. Активация в результате конформационной перестройки Фактор Xa Антитромбин NS-домен 8
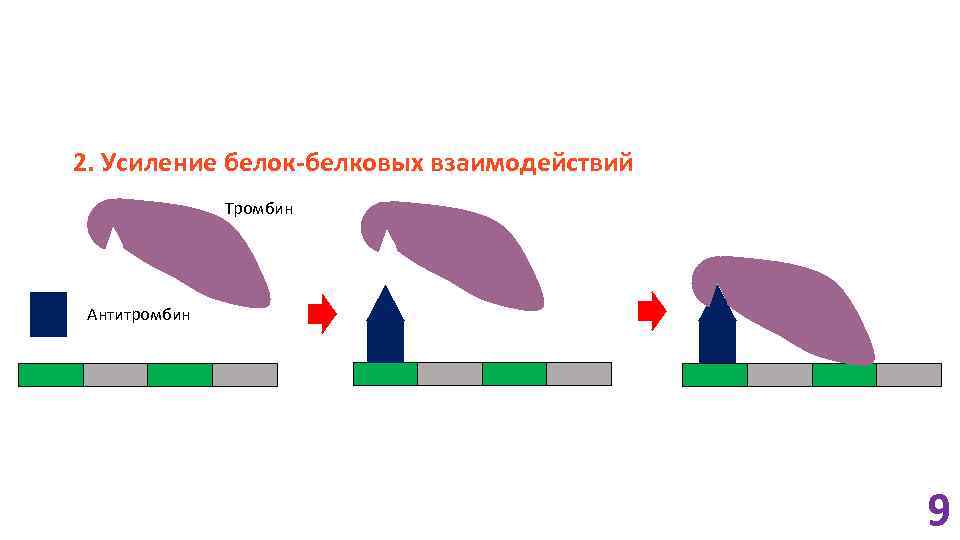
2. Усиление белок-белковых взаимодействий Тромбин Антитромбин 9
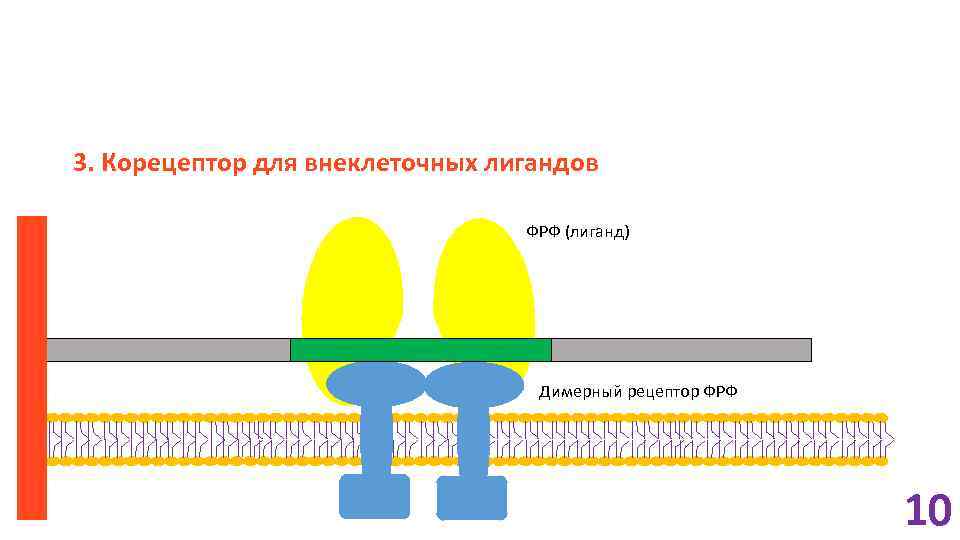
3. Корецептор для внеклеточных лигандов ФРФ (лиганд) Димерный рецептор ФРФ 10
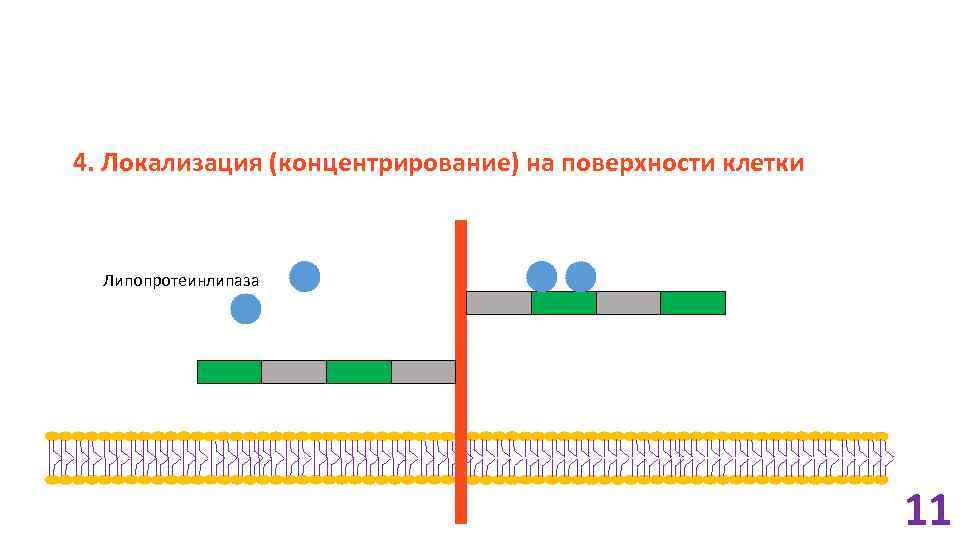
4. Локализация (концентрирование) на поверхности клетки Липопротеинлипаза 11
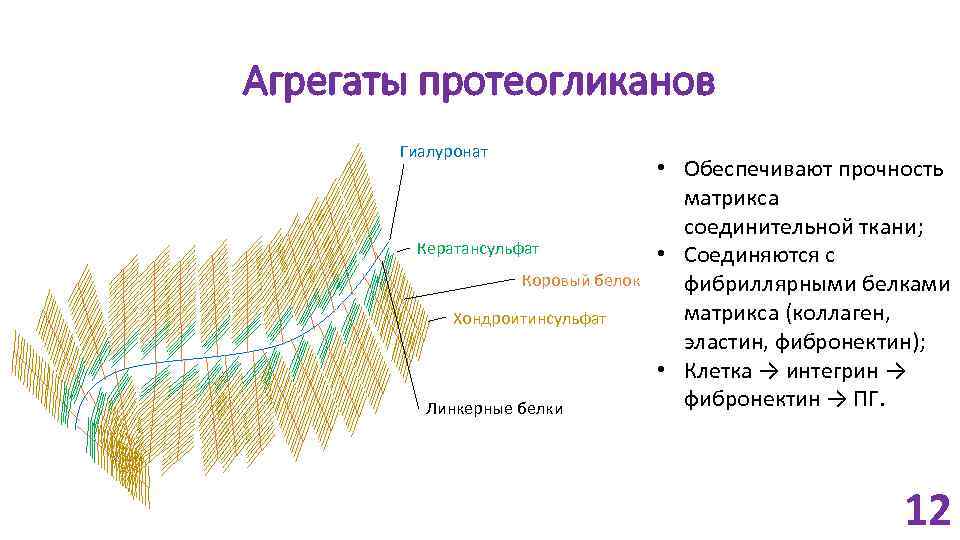
Агрегаты протеогликанов Гиалуронат Кератансульфат Коровый белок Хондроитинсульфат Линкерные белки • Обеспечивают прочность матрикса соединительной ткани; • Соединяются с фибриллярными белками матрикса (коллаген, эластин, фибронектин); • Клетка → интегрин → фибронектин → ПГ. 12

Гликопротеины • Конъюгаты белков и углеводов (ковалентная связь); • На внешней поверхности ЦПМ, во внеклеточном матриксе и в крови; • Углеводные цепи короче и разнообразнее, чем цепи ГАГ в ПГ; • Углеводная часть может составлять от 1 до 70% массы ГП; • Олигосахариды ГП несут много информации, образуют высокоспецифичные сайты узнавания и высокоафинные центры связывания лектинов; • Примерно половина белков Mm гликозилированы; • Около 1% генов Mm: ферменты синтеза и прикрепления олигосахаридов. 13
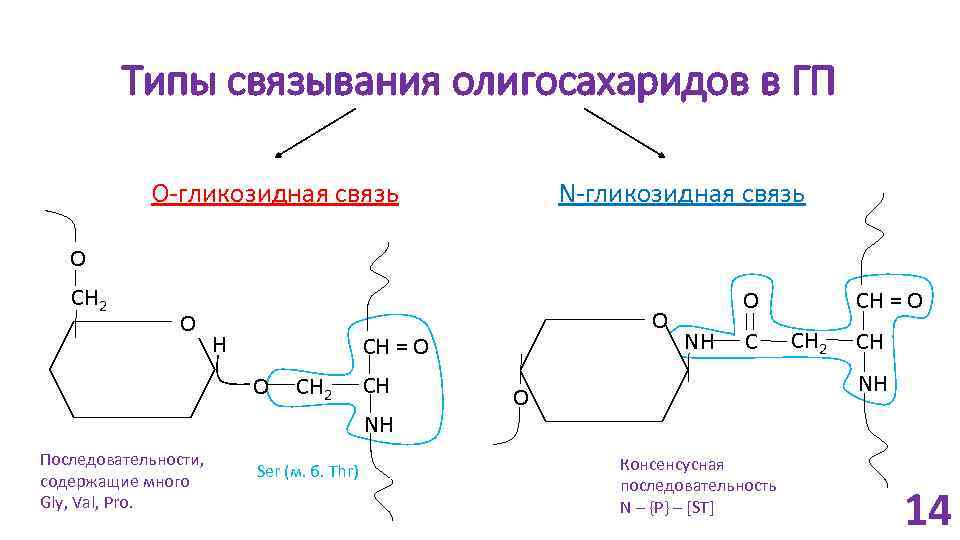
Типы связывания олигосахаридов в ГП O-гликозидная связь N-гликозидная связь O CH 2 O H CH = O O CH 2 CH NH Последовательности, содержащие много Gly, Val, Pro. O Ser (м. б. Thr) O NH C CH = O CH 2 CH NH O Консенсусная последовательность N – {P} – [ST] 14
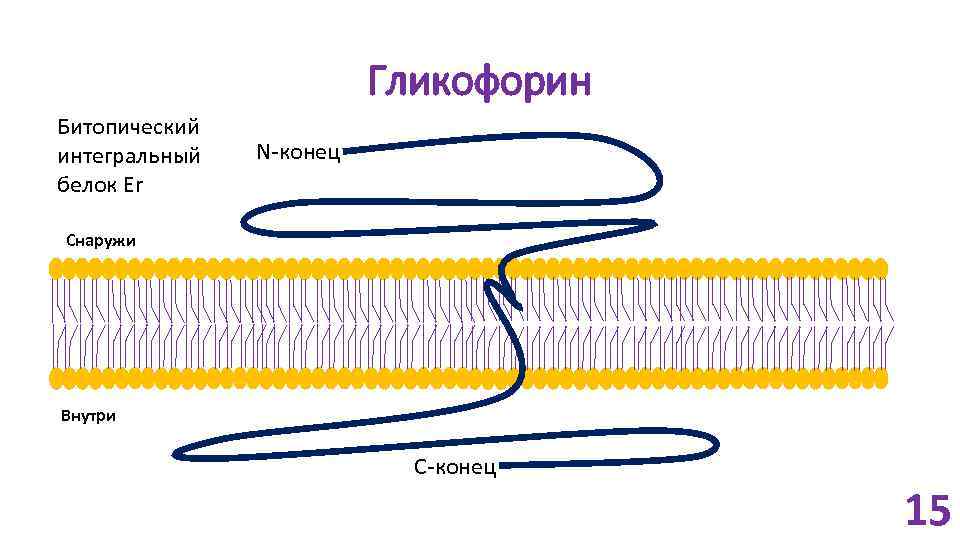
Гликофорин Битопический интегральный белок Er N-конец Снаружи Внутри C-конец 15

Гликофорин 16 олигосахаридных цепей (все – к внешнему домену). N-гликозидная связь: O-гликозидная связь: 2 S 3 T 4 T 10 T 11 T 12 T 13 S 14 S 15 S 22 S 25 T 37 T 44 S 47 S 50 T 26 N 16

Примеры гликопротеинов • Большинство белков крови (в т. ч. Ig); • Гормоны: фолликулостимулирующий, лютеинизирующий, тиреостимулирующий; • Многие белки молока (в т. ч. лактальумин); • Некоторые белки поджелудочной железы (в т. ч. рибонуклеаза); • Большинство белков лизосом. 17

Функции гликозилирования белков • Углеводородные кластеры гидрофильны → изменение растворимости; • Указывают на подлежащие уничтожению неправильно свёрнутые белки; • Отрицательно заряженные олигосахариды кластера из-за взаимного отталкивания способствуют формированию на данном участке вытянутой структуры; • Иногда – защита от действия протеаз; • Формируют «код сахаров» . 18

Гликолипиды • Мембранные сфинголипиды; • Гидрофильная головка, образованная олигосахаридами, распознаёт лектины; • В мозге и нервной ткани: проведение нервного импульса и образование миелиновой оболочки; • Участвуют в передаче клеточных сигналов. 19

БЛАГОДАРЮ ЗА ВНИМАНИЕ
Гликоконъюгаты.pptx