ter_stom_osteoplast_mat-lyre-12.pptx
- Количество слайдов: 80

Санкт-Петербургский государственный медицинский университет имени И. П. Павлова ОСТЕОПЛАСТИЧЕСКИЕ МАТЕРИАЛЫ Подготовили врачи-интерны кафедры хирургической стоматологии и челюстно-лицевой хирургии: Гасилина Л. А. , Иванов В. В. , Клещева В. И. , Лебедев Д. В. , Савицкая А. Б. , Садилина С. В. , Траньков Я. В.

Остеопластические материалы. Классификация 1. 2. Остеоиндуктивные. Способствуют регенерации кости путём прямой стимуляции процесса трансформации недифференцированных мезенхимальных клеток в остеобласты. Остеокондуктивные. Используются в качестве матрикса, на основе которого происходит рост костной ткани и её дальнейшая дифференцировка.

Остеопластические материалы. Классификация 3. Остеонейтральные. Это биоинтертные, как правило, нерезорбируемые материалы, которые применяются для заполнения полостей.

Классификация в зависимости от происхождения 1. 2. 3. 4. Аутогенные (от самого пациента) Аллогенные (от другого человека) Ксеногенные (от животного) Аллопластические (изготовлены искусственно)

Аутогенный костный материал Из внеротовых зон: Подвздошная кость Ребро Лопатка Малая берцовая кость И другие Из внутриротовых зон: • Ветви нижней челюсти • Подбородок • Бугры верхней челюсти • Из оперативной зоны (костная стружка, костные обломки)

Аллогенные материалы

Аллогенные материалы Это лиофилизированная кость, либо предварительно деминерализованная, а затем лиофилизированная кость. Для их производства используют трупный материал. По данным М. Ю. Назаренко если остеобразование при пересадке губчатого аллотрансплантата принять за 100%, то при использовании лиофилизированной кости оно составит 68, 7%, а депротеинизированной и обезжиренной кости – только 45, 3%.
Материалы на основе костной ткани эмбрионов человека – брефопласт и брефоостеопласт Максимально снижен риск иммунного ответа, при том, что обменные процессы активизируются быстрее, чем при использовании других аллопластических материалов.

Брефопласт является активным стимулятором репаративного остеогенеза, а также проявляет низкую иммуногенность за счет упрощенной антигенной структуры. Одна из методик получения материала была разработана в ЦНИИС, где препараты изготавливали посредством гомогенизации костной и хрящевой ткани плода человека с последующей лиофилизацией. Полученные в результате этой обработки пористые брикеты выдерживали в парах формальдегида и пакетировали, стерилизуя γ-облучением. В экспериментах на животных и при хирургических вмешательствах у больных с пародонтитом было продемонстрировано выраженное остеогенное действие брефопласта. Негативные свойства: низкая биомеханическая прочность, сложность адаптации по форме дефекта, быстрое рассасывание в костной ране. Кроме того, за 3 мес внутриутробного развития полноценный костный материал не успевал сформироваться.

Брефоостеопласт Получают не только из хрящевой, но и из костной ткани 5– 7 -месячных плодов. Он отличается пластичностью. Однако брефоостеопласт, как и брефопласт, имеет низкую биомеханическую прочность и достаточно быстро рассасывается в кости. Последнее обстоятельство объясняет и еще один недостаток препарата: недостаточную синхронизацию процессов резорбции самого материала с этапами формирования новой костной ткани реципиента.

Ксеногенные подсадочные материалы

Ксеногенные подсадочные материалы Для получения ксеногенных материалов чаще всего используют кости рогатого скота. К наиболее известным материалам этого типа относятся зарубежные препараты Biо-Оss, Osteo. Graft N, Pep. Gen, отечественные «Алломатрикс-имплант» , «Биоматриксимплант» и ряд других. Эти биогенные препараты рассасываются путем клеточной резорбции при одновременном замещении собственной костью пациента.

«Biо-Оss» Он представляет собой минеральный компонент костной ткани быков, т. е. является гидроксиапатитом естественного происхождения, из которого удалены практически все После завершения органические компоненты. формирования кости Bio. Структура Bio-Oss, а именно система Oss подвергается полной взаимосвязанных макро- и микропор, резорбции, которая повторяющих губчатое вещество кости, длится от 20 мес. Полное способствует быстрой удаление всех реваскуляризации материала. Уже иммунореактивных через 2 мес в микропространствах органических определяются мелкие капилляры и компонентов исключает мезенхимальные клетки. Примерно с риск развития этого же времени на поверхности воспалительных реакций материала начинается и переноса возбудителей остеообразование с постепенной болезней. резорбцией материала и замещением его структур собственной костной тканью.

«Osteo. Graft N» Является практически копией препарата Bio-Oss, но отличается от Bio-Oss способом производства: в отличие от Bio-Oss, который получают, используя низкие температуры и химические растворители, Osteo. Graft N получают при помощи высоких температур и воды. Такой способ производства гарантирует 100% удаление всех белков и позволяет создать материал, практически полностью состоящий из неорганической матрицы. Osteo. Graft N содержится в удобной упаковке, откуда его забирают специальными шприцами, что позволяет вводить его в труднодоступные зоны практически без потерь и дополнительного инфицирования.

«Pep. Gen» Сравнительно схожими характеристиками с Osteo. Graft N и Biо-Оss обладает препарат Pep. Gen американской компании Ceramed, также изготовленный из бычьей кости. В отличие от других препаратов в состав Pep. Gen включен синтетический пептид P-15, стимулирующий костную регенерацию за счет миграции предшественников остеобластов.

Резорбирующиеся мембраны «Bio. Guide» и резорбирующиеся винты для фиксации мембран «Resor-Pin» фирма Geistlich

Коллагеновые мембраны «Biocollagen» (Bioteck - Италия) Biocollagen (Биоколлаген) – это тонкая коллагеновая мембрана из ахиллова сухожилия конского происхождения, быстро разлагающаяся в течение 4 -6 недель после пересадки в качестве заменителя периостальной мембраны, покрывающей имплантаты.

Мембраны «Biocollagen» и два вида подсадочных материалов «Bio-Gen» В этот набор, кроме мембран Biocollagen, входит два вида ксеногенного подсадочного материала Bio-Gen: один выполнен из спонгиозной кости, другой — из кости смешанного типа: из спонгиозной и кортикальной кости

Биокомпозиционные материалы с включением сульфатированных гликозаминогликанов

Биокомпозиционные материалы с включением сульфатированных гликозаминогликанов Сульфатированные гликозаминогликаны (компоненты межклеточного матрикса) включены в состав остеопластических материалов с целью повышения их биологической активности. Известно, что органическая часть межклеточного вещества костной ткани на 90% состоит из коллагена I типа, коллаген других типов занимает 5%. Оставшиеся 5% представлены белковополисахаридными комплексами, главной структурной единицей которых являются сульфатированные гликозаминогликаны.

Роль сульфатированных гликозаминогликанов подавление активности провоспалительных медиаторов и антигенных детерминант участие в межклеточной сигнализации регуляция активности факторов роста активация синтеза гликозаминогликанов фибриллогенез
«Алломатрикс-имплант» (Конектбиофарм, РФ) Остеоиндуктивный и остеокондуктивный материал с пористой губчатой структурой "Алломатрикс-имплант" разработан, совместно с ГУН ЦИТО им. Н. Н. Приорова Биоматериал разработан на основе донорского костного аллоколлагена и аллосульфатированных гликозаминогликанов кости Форма выпуска: полоски

«Биоматрикс» (Конектбиофарм, РФ) Биоматериал на основе костного ксеноколлагена и ксеногликозаминогликанов Остеоиндуктивный и остеокондуктивный материал с противовоспалительным действием Губчатая, естественно-пористая структура материала повторяет архитектонику и структуру кости, что обеспечивает возможность заполнения всего объема костного дефекта Форма выпуска: блоки, полоски, шайбы
«Биоматрикс-имплант» (Конектбиофарм, РФ) Традиционный остеоиндуктивный материал Разработан совместно с ГУН ЦИТО им. Н. Н. Приорова Композиционный биоматериал на основе костного ксено-коллагена, костных гликозаминогликанов и натурального минерального ГА из ксенокости Форма выпуска: блоки, крошка

Аллопластические материалы

Аллопластические материалы в отличие от биогенных препаратов получают из минерального сырья В настоящее время искусственно синтезировано множество аллопластических материалов. Наиболее изученными из них являются препараты на основе фосфата кальция, главным образом, гидроксиапатит, который используют в реконструктивной костно-пластической хирургии с 20 -х годов ХХ века

Гидроксиапатит кальция Гидроксиапатит кальция (ГА) — Ca 10(PO 4)6(OH)4 — является типичным апатитом с соотношением Ca / P = 1, 67, содержанием воды 2% и плотностью 3, 0 г/см 3. ГА включает в себя целый класс соединений с вариабельностью соотношения Ca / P (в зависимости от обжига) от 1, 4 до 2, 0, т. е. аналогично соотношению минералов в естественной костной ткани. Различные соотношения Са / Р при сохранении общих для этого класса кристаллографических характеристик дают широкие возможности изоморфного замещения кальция на воду и на ион водорода — как на поверхности, так и внутри кристаллов, что в ране является одной из важнейших характеристик материала, определяющей возможность удержания кровяного сгустка.

Свойства гидроксиапатита кальция 1. 2. 3. 4. 5. Остеотропное действие за счет активизации дифференцировки остеогенных клеток Остеоинтегративное действие за счёт образования прочной химической связи с костью и последующей резорбцией с полным замещением костной тканью Высокая биологическая совместимость с тканями реципиента: практически отсутствуют воспалительная реакция, а также системная и местная токсичность При имплантации биодеградирующегося ГА в сыворотке крови сохраняется нормальное содержание кальция и фосфатов за счет поступления ионов кальция из ГА в специализированный костный пул Резорбция гидроксиапатита проходит без образования фиброзной капсулы вокруг имплантата.

Исследования эффективности применения гидроксиапатита 1. 2. 3. Результаты клинических исследований С. Yukna и соавторов (1996) показали, что использование ГА для заполнения костных дефектов приводило к росту костной ткани в области оперативного вмешательства в среднем на 2, 0 ± 0, 5 мм. Исследования M. Suzuki и соавторов (1993) в аналогичной ситуации показали результат свыше 3 мм. Отечественные исследователи продемонстрировали еще более высокую активность препаратов ГА. Так, по данным Ю. И. Воробьева (1995), прирост кости при использовании препаратов на основе ГА в ряде случаев достигал 4, 5 мм.

Препараты на основе гидроксиапатита 1. 2. Неотожженный (резорбирующийся) гидроксиапатит (зарубежный Osteo. Gen, отечественные ГА-100, Остим-100 и др) Отожженный (нерезорбирующийся) гидроксиапатит, или высокотемпературная керамика (Perma Ridge, Interpore, Osteo. Graft D, Capset и ряд других) Микроморфологическая структура гидроксиапатита кальция

Неотожженный (резорбирующийся) гидроксиапатит Синтезируют в жидкофазной реакции при комнатной температуре. Он характеризуется низкой кристалличностью, высокой сорбционной способностью, относительно высокой скоростью резорбции в тканевой среде. Нерезорбирующийся ГА получают после нагревания при 800– 1000°С. При этом происходит фазовый переход в конденсационнокристаллическую форму, химически стабильную, практически нерастворимую в воде. Мелкодисперсный ГА получают при включении криогенного этапа в процесс изготовления.

«Osteo. Gen» Состоит из спекшегося гидроксиапатита и деминерализованной кортикальной кости. Резорбирующийся материал.
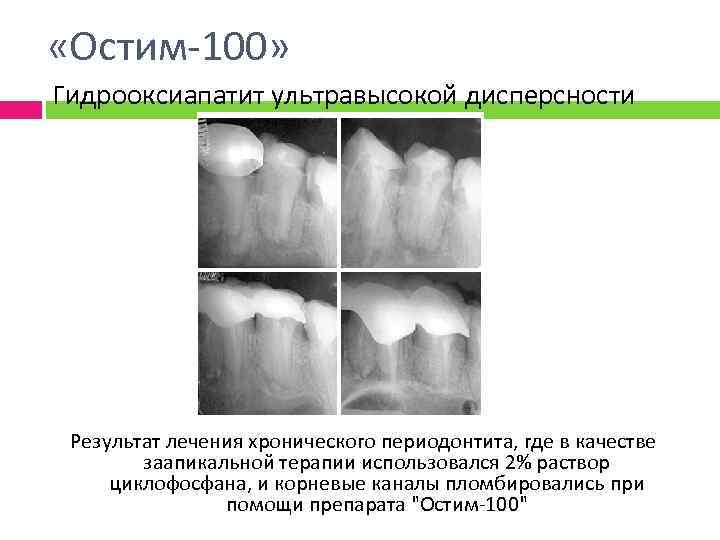
«Остим-100» Гидрооксиапатит ультравысокой дисперсности Результат лечения хронического периодонтита, где в качестве заапикальной терапии использовался 2% раствор циклофосфана, и корневые каналы пломбировались при помощи препарата "Остим-100"

"Interpore-200" Основу его составляет нерастворимый производный кораллового скелетного карбоната, преобразованного в неорганический трансплантат гидроксиапатита. Эта комбинированная формация, по мнению D. Smiller и соавт. , имеет достаточные остеоиндуктивные свойства. Структура его пористая, диаметр порядка 200 мкм. Поскольку на поры приходится 60 % поверхности, условия для прорастания кости в этот материал благоприятны. Экспериментальные исследования показали, что остеогенез при этом достаточно традиционный. Вначале возникает выраженная сосудистая реакция с образованием фиброзной ткани, а в дальнейшем — остеобластическая с дифференцировкой клеток. Образование кости нормального строения и достижение ею максимального объема происходят за 12 мес. При пересадке таких аллопластиков для увеличения количества кости и закрытия ее дефекта они подвергаются биорезорбции, в ответ на которую от ложа начинается образование кости.

«Capset» (Lifecore, США) 1. 2. 3. 4. 5. 6. 7. 8. Порошок с размерами частиц 40 мкм; Биодеградация неклеточная — 6 недель; Барьерные свойства — 4 недели; Легкость в работе: возможно нанесение в виде порошка или пастообразной формы после смешивания с растворителем; Резервный бокс используется как костнопластический материал в комбинации 1: 4 с другими и при затвердевании предупреждает миграцию частиц; Образует при застывании монолитный барьер, удерживает форму; Применяется только с остеопластическими материалами из-за малого срока резорбции; Является источником ионов кальция.

Препараты, созданные на основе ГА и коллагена Среди многочисленных биокомпозиционных материалов наиболее эффективным для хирургической практики оказалось включение в состав ГА коллагена. Это связано с тем, что пептид Р-15 обладает способностью к таксису и фиксации на своей поверхности клеток-предшественников остеобластов. Комплекс ГА с коллагеном обладает выраженным остеогенным потенциалом. Остеопластические материалы на основе коллагена хорошо моделируются в костных полостях, сохраняют пористую структуру, обеспечивают гемостатическую функцию. Вместе с тем в условиях выраженного воспаления и протеолиза, особенно активно протекающих в послеоперационный период, препараты ГА с включенным в состав коллагеном быстро рассасываются, не оказывая длительного противовоспалительного и стимулирующего репарацию действия (Иванов А. С. , 1978; Леонтьев В. К. и др. , 1995).

«Колапол» По данным Ю. И. Воробьева (1995), В. К. Леонтьева (1995), «Колапол» оказывает позитивное воздействие на репаративный остеогенез как в опытах на животных, так и в клинике. Гистоморфологические исследования подтвердили, что он играет роль имплантата и матрицы для строительства новой кости, что приводит к нарастанию общего объема костного регенерата. При хирургических вмешательствах по поводу пародонтита «Колапол» позволяет устранять костные дефекты, способствует ускорению процессов репаративного остеогенеза, обеспечивая при этом пролонгированный антимикробный эффект сроком до 20 сут.

«Аvitene» Аvitene изначально использовали как гемостатик для покровных ран. После создания композиции из коллагена, гидроксиапатита, кальций-фосфатной керамики, синтетических волокон из нейлона Аvitene успешно применяют в хирургической стоматологии.

Материалы на основе сульфата кальция — хирургического гипса — широко используют в качестве подсадочных материалов из-за относительной доступности материалов этой группы. Материалы, состоящие из чистого сульфата кальция (Capset, Lifecore), полностью замещаются новообразованной костью.

Материалы на основе трикальцийфосфата: «Cerasorb» Он представляет собою ßтрикальцийфосфатную керамику, имеющую выраженную микропористую структуру, что позволяет материалу эффективно удерживать кровяной сгусток и включаться в процессы регенерации пародонтальных структур. Производитель рекомендует перед введением материала в костный дефект смачивать его кровью из операционной раны или использовать аутотромбоцитарную массу для включения в процесс регенераторного остеообразования тромбоцитарного фактора роста.
Материалы на основе трикальцийфосфата: «Bio-Resorb» Еще одним эффективным материалом на основе кальцийфосфатной керамики является Bio-Resorb (Oraltronics). Он имеет самый широкий спектр применения: его используют для закрытия дефектов после цистэктомии и удаления зубов, при проведении синуслифтинга, при установке имплантатов, а также как подсадочный материал в методике направленной регенерации тканей.

Материалы на основе трикальцийфосфата: «Poresorb-Tcp» В Чехии выпускается материал Poresorb-Tcp (Lasak) на основе ß-трикальцифосфата. Материал признан одним из лучших в своем классе для восстановления пародонтальных дефектов и проведения операции синуслифтинга. При его производстве строго соблюдается международный стандарт ASTM F 1088 (для материалов, используемых в хирургической имплантологии), а также директива Евросоюза 91/356/ЕЕС (об обязательном тестировании готовой продукции).

Биоситаллы

Биоситаллы получают из природных полимеров — водорослей, хитина и т. п. Научные сообщения, касающиеся биоситаллов, как правило, относятся к препаратам, находящимся на стадии экспериментальных разработок. Одним из немногочисленных материалов этой группы, доведенных до промышленного производства, является американский Algipore, производимый из кораллов. По своей эффективности препарат сопоставим с лучшими представителями группы аллопластических материалов, при этом гарантированно лишен микроорганизмов, опасных для человека.

Мембраны Нерезорбирующиеся мембраны (политетрафторэтилен, силикон) Резорбирующиеся мембраны (коллаген, полимолочная кислота, викрил, деминерализованная кость, «диплен» )

Нерезорбирующиеся мембраны: Политетрафторэтилен (ПТФЭ) В 1982 г. исследователи компании Gore (США) продемонстрировали способность мембран из биосовместимого политетрафторэтилена (ПТФЭ) предотвращать миграцию эпителия в область пародонтальных дефектов (Scantlebury T. V. , 1993). Первый коммерчески доступный барьер из ПТФЭ, специально предназначенный для НРТ, был запатентован Gore и одобрен Американской стоматологической ассоциацией в 1986 году (коммерческое название материала «Gore-Tex Regenerative Material» ).

Нерезорбирующиеся мембраны: мембраны Gore. Tex Мембраны Gore-Tex считаются «золотым стандартом» для нерезорбирующихся мембран. ПТФЭ-мембраны, несмотря на неизменность используемого для производства материала, продолжают оставаться источником модернизации. В 1999 г. В. П. Лошкарев и соавт. продемонстрировали результаты использования микропористых ПТФЭ-мембран (торговая марка Tef. Gen). Показано, что Tef. Gen-мембраны не нуждаются в первичном закрытии и удаляются без повторного оперативного вмешательства и, следовательно, без дополнительной травмы тканей. В 1995 г. C. Quinones и соавторы смоделировали и показали поэтапное образование костной ткани при использовании ПТФЭ-мембран с перфорированной структурой. Было доказано, что такая подготовка мембран улучшает их физиологические свойства и ускоряет процесс формирования новой кости.

Нерезорбирующиеся мембраны: силикон В практическом плане безусловным достоинством силикона является возможность создать мембрану непосредственно под данный дефект, с учетом местных факторов. Мембраны из силикона демонстрируют эффективность на уровне мембран Gore-Tex, а по техническим характеристикам и удобству применения во многом их превосходят.

Сравнение 4 видов нерезорбирующихся мембран В 1993 г. V. Lecovic и соавт. для закрытия искусственных костных дефектов применили 4 различных вида мембран — поликарбонатную, силиконовую, ПТФЭ и поликапролактановую. Через 6 мес мембраны из силикона и ПТФЭ показали схожие результаты: прирост кости на 2, 3– 2, 5 мм (0, 5– 0, 7 мм в контроле), при этом воспаление во время установки мембран в ране было выражено минимально. При использовании поликарбонатной и поликапролактановой мембраны отмечено выраженное воспаление прилежащих к мембране тканей, а прирост кости составил 1, 5– 1, 7 мм. Таким образом, продемонстрирована эффективность силиконовых барьеров как минимум на уровне ПТФЭ-мембран.

Резорбирующиеся мембраны Применение Рассасывающихся мембран позволяют избежать проведения повторных операций с целью их удаления и исключить дополнительную хирургическую травму. Рассасывание барьеров in vivo определяется рядом факторов, таких как реакция тканей организма, p. H среды, химический состав и строение мембран, место расположения мембран в тканях и т. д. В ряде случаев возникает несвоевременная резорбция мембран. Одним из достоинств резорбирующихся мембран является возможность включения в их состав препаратов, влияющих на остеогенез, противовоспалительных и противомикробных средств и т. д.

Резорбирующиеся мембраны Для пролонгирования разделяющего действия: на одну из поверхностей мембраны наносят биосовместимые медленнорезорбирущиеся препараты (например, ГА) Вводят медленнорезорбирущиеся материалы в состав мембран используют методику послойного наложения мембран одна на другую (НО возможно развитие патогенной микрофлоры между слоями мембран, а также взаимное смещение мембран относительно друга)

«Коллаген» Биорезорбция материала почти всегда сопровождается воспалительным ответом окружающих тканей. Для снижения воспалительной реакции в качестве материала для мембран НРТ наиболее доступным остается нативный коллаген в связи с практически идентичным строением его у животных и у человека. В процессе биорезорбции структуры ксеноколлагена включаются в структуры кровяного сгустка и регенерирующих тканей пациента, положительно влияют на рост и организацию фибриллярных структур. . Успех применения коллагеновых мембран неоднократно демонстрировался различными исследователями. C. Yukna и соавторы (1996) сравнивали результаты применения коллагеновых мембран в методике НРТ и стандартных лоскутных операций, а также эффективность мембран из коллагена и ПТФЭ при устранении дефектов фуркаций II класса. Лучший результат по приросту тканей оказался в случаях использования мембран из коллагена и ПТФЭ, чем при стандартных операциях (50% у мембран против 7% при стандартных операциях), а эффективность использования коллагена и ПТФЭ была практически одинаковой. Таким образом, коллагеновые мембраны остаются перспективным средством для методики НРТ.

«Полимолочная кислота» В последнее время появляются сообщения об успешном применении в качестве мембран полимолочной кислоты (биодеградирующего полиэфира). T. Teparat и соавторы (1998), P. Trejo и соавторы (1998) исследовали сравнительную эффективность применения мембран НРТ из ПТФЭ и полимолочной кислоты и не выявили значительных различий между используемыми материалами. J. Mattson и соавт. (1999) сравнивали два типа резорбирующихся мембран — из полимолочной кислоты и коллагеновых

Интересное решение по формированию барьера в ране предложили Atrix Laboratories при производстве материала Atrisorb. Он изготовлен из полимера молочной кислоты в виде жидкого раствора, отвердевающего при контакте с жидкостью. Полужесткий барьер формируют и придают ему необходимую конфигурацию вне полости рта, после чего устанавливают в зоне дефекта, где он окончательно отвердевает in situ. К положительным качествам материала можно отнести отсутствие необходимости фиксировать мембрану

Полимолочная кислота: «Resolut» Мембраны Resolut имеют сложную структуру и состав. Верхний слой, обращенный к эпителиальным тканям, состоит из гликолида и триметилена, а так называемый окклюзионный слой, обращенный к кости, включает в себя гликолид и собственно полимолочную кислоту. Сроки резорбции мембран Resolut, по данным производителя, составляют от 1, 5 до 2, 5 мес.

Полимолочная кислота: «Resolut» В качестве немаловажного дополнения к мембране в комплекте прилагается резорбируемая нить также из полимолочной кислоты

Сомнения по поводу эффективности применения мембран из полимолочной кислоты M. Casari и соавторы (2000) при сравнительном изучении эффективности закрытия рецессий с помощью молочных мембран и коронарной репозиции лоскутов не обнаружили разницы: эффект составлял 90, 5 и 91, 9% соответственно. D. Tatakis и соавторы (2000) изучили эффективность молочных мембран и соединительно-тканного трансплантата при лечении рецессий и выявили более высокую эффективность методики с использованием соединительно-тканного трансплантата — 96% положительных результатов против 81% при НРТ.

«Викрил» Викриловая масса (коммерческое название «Polyglactin -910» ) состоит из гликолида и лактида в соотношении 9: 1. Смесь успешно используют в качестве шовного материала. При сопоставлении результатов применения Polyglactin 910 -синтетических барьеров и стандартных лоскутных операций показатели по приросту костной ткани были лучше при использовании мембран. Положительные результаты получены E. Machtei с соавт. (1996), D. Lundgren и соавт. (1999) и др. В настоящий момент показания к применению Polyglactin-910 уточняются.

«Деминерализованная кость» Деминерализованная кость или деминерализованные костные аллографты могут быть использованы в виде мембран, что вполне оправдано, поскольку деминерализованную кость успешно используют в качестве подсадочного материала при лоскутных операциях. Деминерализованная кость обладает доказанными остекондуктивными свойствами. P. Rosen и соавт. (1999) показали, что использование формируемой in situ мембраны, состоящей из деминерализованной кости, смешанной с сульфатом кальция и тетрациклином в пропорции 7: 2: 1, и полимолочных мембран приводит к значительному повышению уровня клинического прикрепления и уменьшению глубины пародонтальных карманов (4, 4 мм и 5, 0 мм соответственно). Средний прирост костной ткани, по данным A. Gagll и соавт. (1999), при использовании деминерализованной кости составляет 4, 2 мм. Таким образом, использование деминерализованных костных аллографтов является перспективным направлением исследований.

«Диплен» Эти барьеры изготавливают из биополимеров. Мембраны имеют двухслойную структуру, причем поверхность, обращенная к мягким тканям гидрофобная, а поверхность, обращенная к кости, имеет гидрофильный слой, за счет которого мембрана фиксируется к подлежащим тканям.
«Диплен» Сроки резорбции мембраны составляют в зависимости от условий от 1 до 2 мес. Немаловажным качеством предложенного материала является возможность его использования при значительной протяженности дефекта. При этом последующая рецессия десневого края, характерная для использования мембраной техники, минимальна.

Методика проведения операций по направленной регенерации тканей пародонта 1. 2. 3. 4. 5. 6. Отслойка слизисто-надкостничного лоскута Механическая и медикаментозная обработка пародонтального дефекта Определение его размеров и формы Подбор соответствующей мембран Края мембраны формируют с учетом того, чтобы они перекрывали края костного дефекта не менее чем на 2– 3 мм. Фиксация мембраны различными способами.

Способы фиксации мембраны 1. 2. Если используют эластичную мембрану, то перед фиксацией в ней создают отверстие и надевают на зуб по принципу кофердама. При этом края фиксируют винтами к кости, предварительно формируя в ней отверстия борами определенной толщины, а также шовным материалом к надкостнице. Если мембрана представляет собой самоотверждаемую смесь или пленку с клеевым слоем, то она фиксируется непосредственно на альвеолярный отросток.
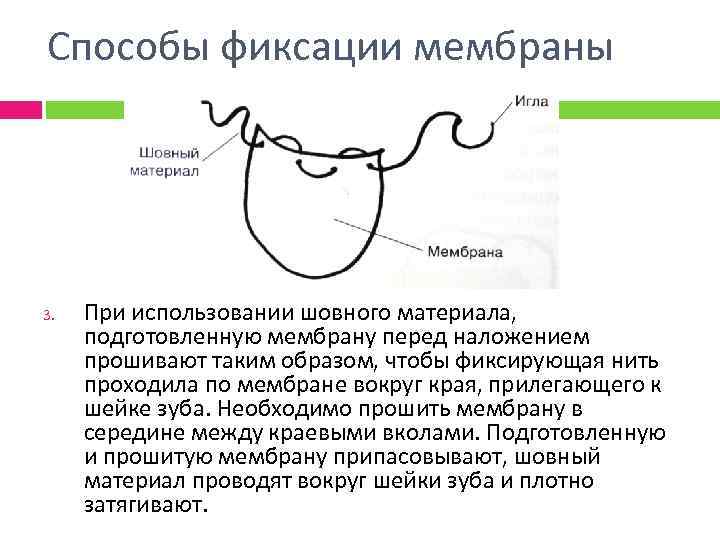
Способы фиксации мембраны 3. При использовании шовного материала, подготовленную мембрану перед наложением прошивают таким образом, чтобы фиксирующая нить проходила по мембране вокруг края, прилегающего к шейке зуба. Необходимо прошить мембрану в середине между краевыми вколами. Подготовленную и прошитую мембрану припасовывают, шовный материал проводят вокруг шейки зуба и плотно затягивают.

Требования, предъявляемые к шовному материалу 1. 2. 3. 4. Если мембрана нерезорбирующаяся, то шовный материал должен сохранять фиксирующую функцию до момента снятия мембраны. Узлы должны быть состоятельны, иначе произойдет нарушение фиксации мембраны. Для резорбирующихся мембран выбор шовного материала не столь критичен, поскольку уже через 1– 2 недели они начинают интегрироваться с окружающими тканями и вследствие этого имеют определенную фиксацию на месте установки. До и после наложения мембраны под нее в области костных дефектов укладывают остеотропный материал. Мембрану закрывают лоскутами, которые затем ушивают.

Послеоперационный период Применябт местные противовоспалительные, обезболивающие, кератопластические средства. Фиксирующий лоскуты шовный материал удаляют на 9– 12 -е сутки после операции. Нерезорбирующуюся мембрану удаляют не ранее 6– 8 нед. после операции. В случае глубокого расположения фиксирующих винтов после удаления винтов и мембраны рану ушивают и еще 1– 2 недели.

Послеоперационный период Сроки резорбции различных остеотропных препаратов значительно отличаются друг от друга. По разным данным, полная резорбция подсадочного материала с превращением его структур в структуры собственной кости может занимать от 2 мес ( «Колапол» ) до 4 лет (Bio-Oss) (Лосев Ф. Ф. , 2000; Чупахин П. В. , 2001; Becker W. , 1999; Karring T. , 1992).
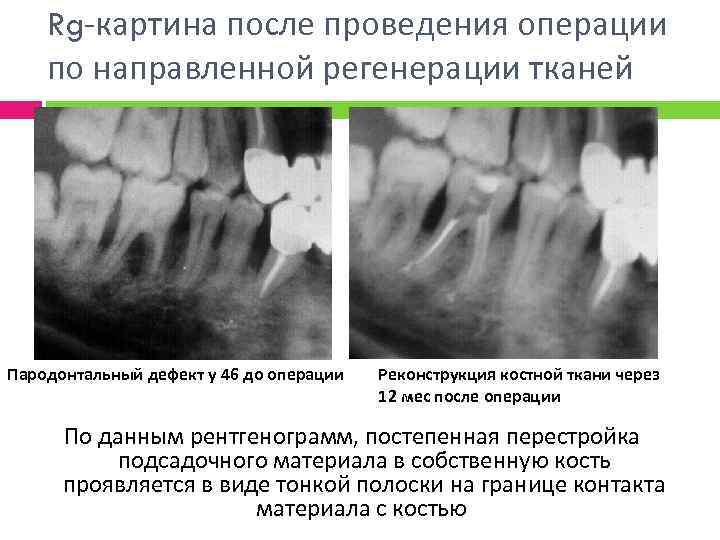
Rg-картина после проведения операции по направленной регенерации тканей Пародонтальный дефект у 46 до операции Реконструкция костной ткани через 12 мес после операции По данным рентгенограмм, постепенная перестройка подсадочного материала в собственную кость проявляется в виде тонкой полоски на границе контакта материала с костью
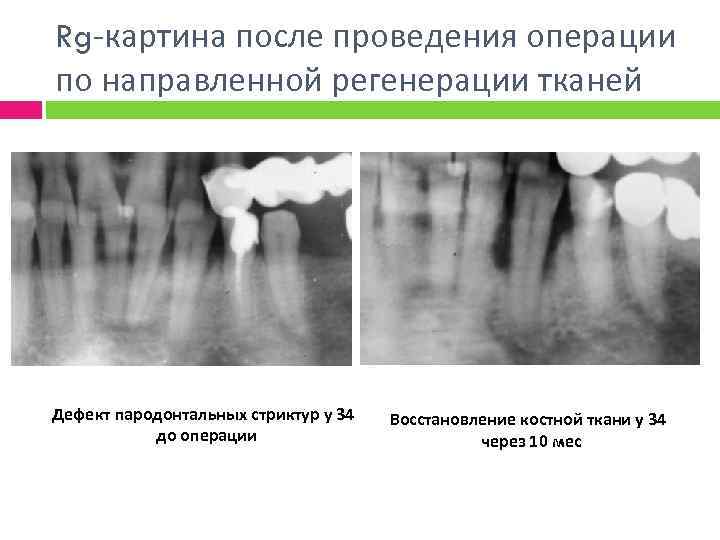
Rg-картина после проведения операции по направленной регенерации тканей Дефект пародонтальных стриктур у 34 до операции Восстановление костной ткани у 34 через 10 мес

Клинический пример 1
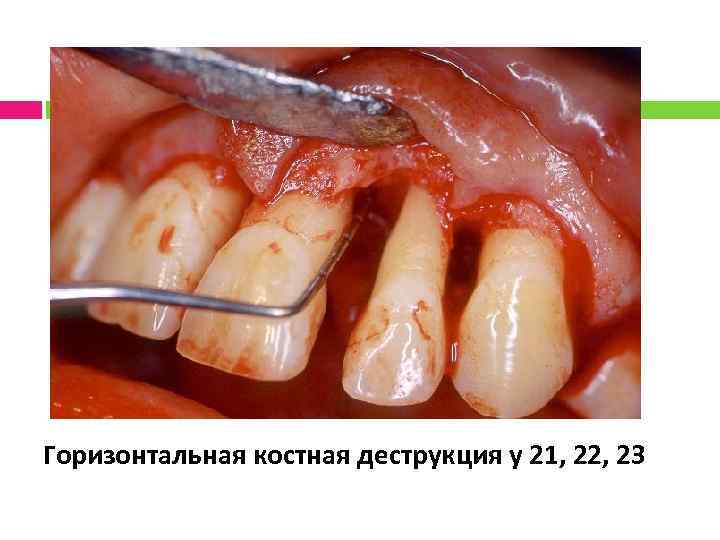
Горизонтальная костная деструкция у 21, 22, 23
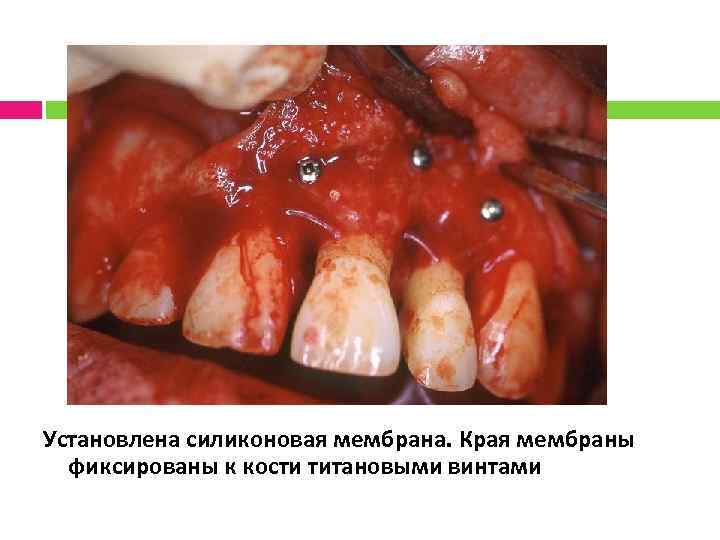
Установлена силиконовая мембрана. Края мембраны фиксированы к кости титановыми винтами
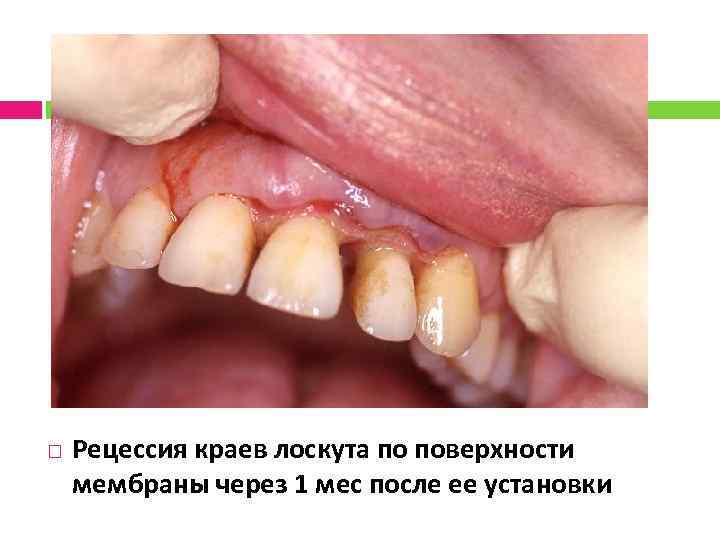
Рецессия краев лоскута по поверхности мембраны через 1 мес после ее установки
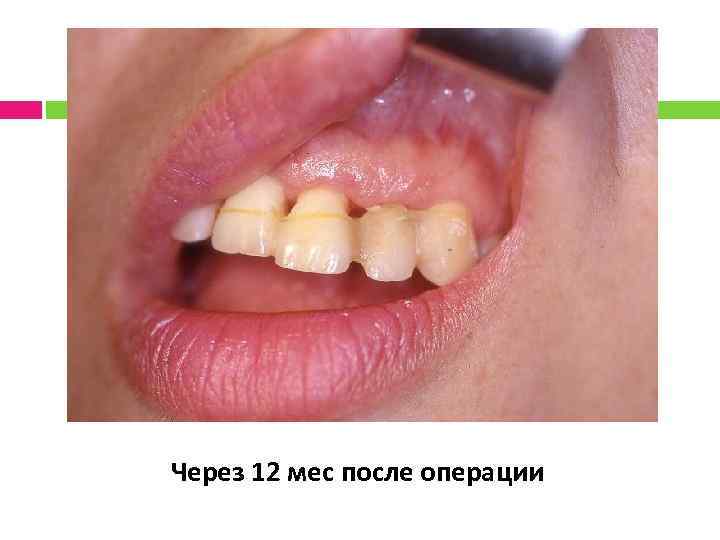
Через 12 мес после операции

Клинический пример 2
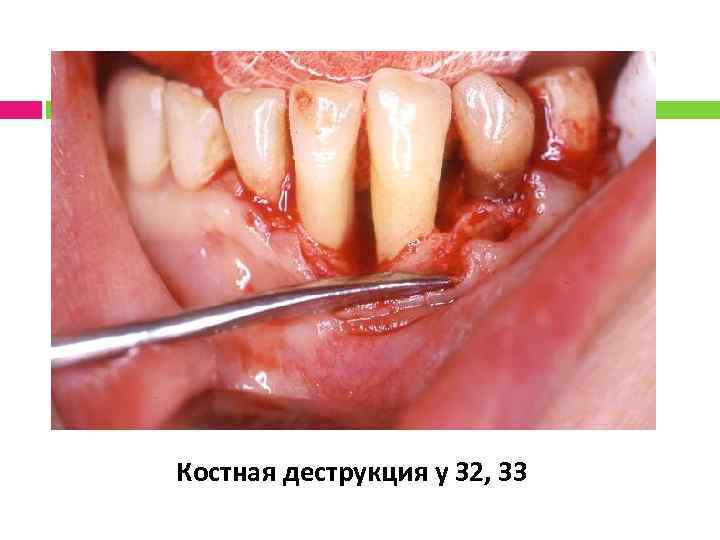
Костная деструкция у 32, 33
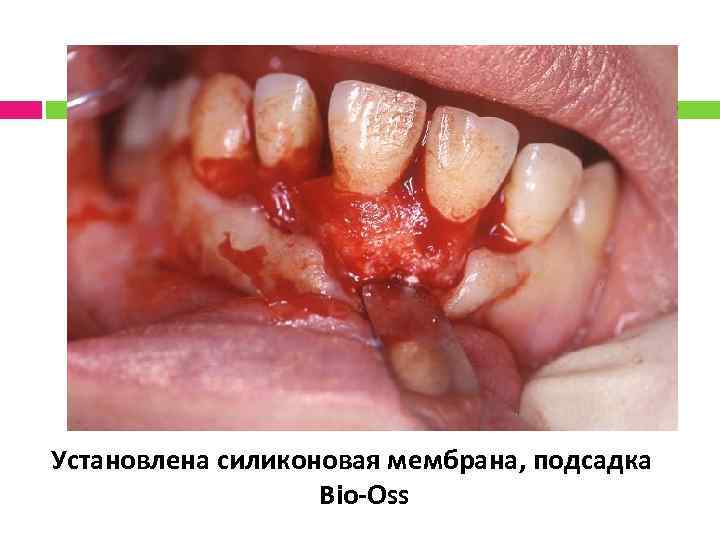
Установлена силиконовая мембрана, подсадка Bio-Oss
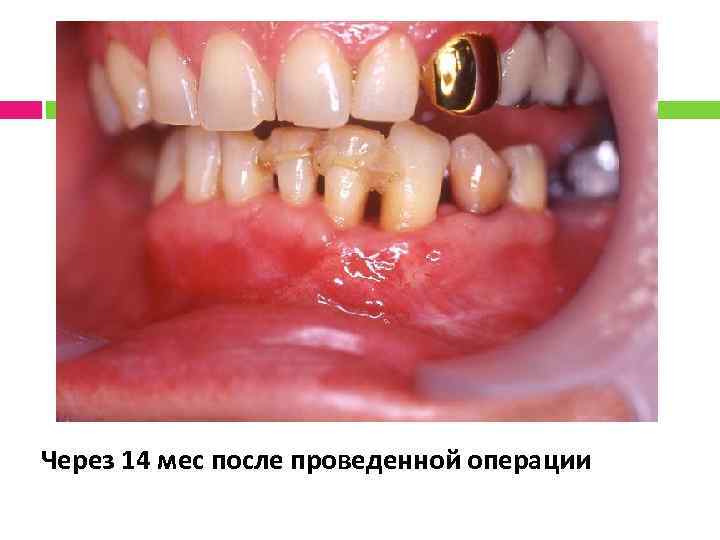
Через 14 мес после проведенной операции

Спасибо за внимание!

Источники 1. 2. 3. Грудянов А. И. , Чупахин П. В. «Методика направленной регенерации тканей. Подсадочные материалы» http: //ipst. com. ua/helpinfo/spetcialist/konnaptka nreg-parodontologicheskie_membrani. html http: //gvolozhin. narod. ru/osnovnie_vidi_materialo v_dlya_kostnoi_plastiki/
ter_stom_osteoplast_mat-lyre-12.pptx