Sera_Soedinenia_sery.ppt
- Количество слайдов: 45

Самостоятельная работа «Кислород и его соединения» Напишите продукты и уравняйте реакцию. Назовите продукт. Определите окислитель и восстановитель. Вариант 1 to C K + O 2 → … KCl. O 3 →… Вариант 2 to C Fe + O 2 → … KNO 3 →… Вариант 3 to C S + O 2 → … to C KMn. O 4 →…
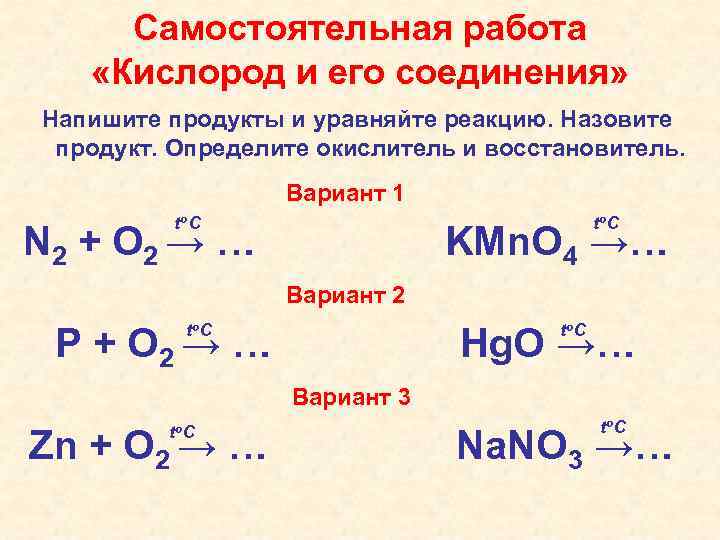
Самостоятельная работа «Кислород и его соединения» Напишите продукты и уравняйте реакцию. Назовите продукт. Определите окислитель и восстановитель. Вариант 1 to C N 2 + O 2 → … KMn. O 4 →… Вариант 2 to C P + O 2 → … Hg. O →… Вариант 3 to C Zn + O 2 → … to C Na. NO 3 →…

Д/з - проверка конспекта «Сера» и «Соединения серы» ; - написать реакции к опыту «Идентификация» в молекулярном и ионно-молекулярном виде; - тема «Серная кислота» - разобрать самостоятельно по презентации - алгоритм ОВР (слайд 28)

СЕРА. СОЕДИНЕНИЯ СЕРЫ Основные соединения: - сероводород, сероводородная кислота и её соли; - сернистый газ, сернистая кислота и её соли; - серный ангидрид, серная кислота и её соли.

СЕРОВОДОРОД H 2 S 1. Получение (в лаборатории): Na 2 S + 2 HCl = 2 Na. Cl + H 2 S↑ Na 2 S + H 2 SO 4 (разб. ) = Na 2 SO 4 + H 2 S↑ Na 2 S + 2 H 2 SO 4 (к. ) = Na 2 SO 4 + S↓ + SO 2↑ + 2 H 2 O

Опыт Получение сероводорода Na 2 S + 2 HCl = 2 Na. Cl + H 2 S↑ Налейте в пробирку 3 мл сульфида натрия и прилейте к нему 1 -2 мл раствора кислоты (соляной или серной) – что наблюдаете?

СЕРОВОДОРОД H 2 S 2. Физические свойства: г, ц, «запах тухлых яиц» , горюч, хорошо растворим в воде 1: 2, 5 – раствор называется «сероводородная вода» или сероводородная кислота; яд(!) – разрушает гемоглобин, в больших концентрациях смертелен – стр. 134.

СЕРОВОДОРОД H 2 S 3. Химические свойства: В х/реакциях сильнейший восстановитель! 0 -2 0 -1 Cl 2 + H 2 S = S↓ + 2 HCl Горит «частично» или «полностью» : -2 0 0 -2 2 H 2 S + O 2 = S + 2 H 2 O -2 +4 -2 0 2 H 2 S + 3 O 2 = 2 SO 2↑ + 2 H 2 O

СЕРОВОДОРОД H 2 S В воде образует очень слабую сероводородную кислоту, которая плохо диссоциирует: → H 2 S → H+ + HSHSH+ + S 2→ → её соли – сульфиды и гидросульфиды.

СЕРОВОДОРОД H 2 S 4. Качественные реакции: образует с ионами тяжёлых металлов (в частности, серебра, свинца и др. ) цветные осадки сульфидов! H 2 S + Pb(NO 3)2 = 2 HNO 3 + Pb. S↓ Чёрный Pb 2+ + H 2 S = 2 H+ + Pb. S↓ H 2 S + 2 Ag. NO 3 = 2 HNO 3 + Ag 2 S↓ Чёрный 2 Ag+ + H 2 S = 2 H+ + Ag 2 S↓

Опыт Обнаружение сероводорода H 2 S + Pb 2+ = Pb. S↓ + 2 H+ Чёрный На отверстие пробирки положите кусок фильтровальной бумаги, смоченный несколькими каплями нитрата свинца

Опыт Отбеливание Pb. S + 4 H 2 O 2 = Pb. SO 4↓ + 4 H 2 O Чёрный Белый Этот приём используется в реставрации старых картин – при восстановлении белого цвета свинцовых белил 2 Рb. СО 3∙Рb(ОН)2, которые со временем темнеют из-за содержащегося в воздухе сероводорода.

СЕРОВОДОРОД H 2 S Cd. S↓– жёлтый; Sb 2 S 3↓– оранж. ; Mn. S↓ – телесно-розовый; Zn. S↓ – белый; Sn. S↓, Bi 2 S 3↓ – коричневый; Cu. S↓, Co. S↓, Hg. S↓, Fe. S↓ – чёрный.

Опыт «Идентификация» К раствору хлорида неизвестного металла под № (1, 2, 3, 4, 5) добавьте раствор сульфида натрия Na 2 S и по цвету образовавшегося осадка установите формулу исходного вещества – Д/з: напишите реакцию! Cd. S↓– жёлтый; Sb 2 S 3↓– оранж. ; Mn. S↓ – телесно-розовый; Zn. S↓ – белый; Sn. S↓, Bi 2 S 3↓ – коричневый; Cu. S↓, Co. S↓, Hg. S↓, Fe. S↓ – чёрный.

ОКСИД СЕРЫ (IV) SO 2 (сернистый газ, сернистый ангидрид) 1. Получение: S + O 2 = SO 2 ( «голубое пламя» ) Na 2 SO 3 + 2 HCl = 2 Na. Cl + H 2 O + SO 2↑

Опыт Получение сернистого газа Na 2 SO 3 + 2 HCl = 2 Na. Cl + H 2 O + SO 2↑

ОКСИД СЕРЫ (IV) SO 2 (сернистый газ, сернистый ангидрид) 2. Физические свойства (стр. 135): г, ц, резкий, сухой, удушающий, раздражающий «запах жжёной серы» , хорошо растворим в воде 1: 40 – раствор – сернистая кислота; яд(!); разрушает природные красители, используется как «мягкий» отбеливатель ткани, консервант

ОКСИД СЕРЫ (IV) SO 2 (сернистый газ, сернистый ангидрид) 3. Химические свойства: В х/реакциях проявляет ОВД +4 -2 0 SO 2 + 2 H 2 S = 3 S↓ + 2 H 2 O +4 +6 t C, V O 2 SO 2 + O 2 → 2 SO 3 + Q 2 → o 5

ОКСИД СЕРЫ (IV) SO 2 (сернистый газ, сернистый ангидрид) В воде образует слабую сернистую кислоту, которая плохо диссоциирует, легко разлагается снова на оксид и воду: H 2 O + SO 2 → H 2 SO 3 → кислотная среда (Ind) H 2 SO 3 → H+ + HSO 3 - → H+ + SO 32→ → её соли – сульфиты и гидросульфиты.

ОКСИД СЕРЫ (IV) SO 2 (сернистый газ, сернистый ангидрид) 4. Качественные реакции: – по запаху, меняет цвет индикаторной бумаги на кислотную среду, а затем «обесцвечивает» её; – на сульфиты и гидросульфиты – реакция с растворами сильных кислот, в результате чего образуется SO 2: Na 2 SO 3 + 2 HCl = 2 Na. Cl + H 2 O + SO 2↑ SO 32 - + 2 H+ = H 2 O + SO 2↑

Опыт Обнаружение и свойства сернистого газа Na 2 SO 3 + 2 HCl = 2 Na. Cl + H 2 O + SO 2↑ Смочите индикаторную бумагу водой и внесите в сосуд заполненный сернистым газом – что наблюдаете?

ОКСИД СЕРЫ (VI) SO 3 (серный ангидрид) 1. Получение (стр. 136): to. C, V 2 O 5 2 SO 2 + O 2 → 2 SO 3 + Q → Получают при производстве серной кислоты контактным способом

ОКСИД СЕРЫ (VI) SO 3 (серный ангидрид) 2. Физические свойства: ж, ц, з – резкий, удушающий, раздражающий; неограниченно растворим в воде – раствор – серная кислота; яд(!); токсичен, ожогоопасен, особенно для верхних дыхательных путей

ОКСИД СЕРЫ (VI) SO 3 (серный ангидрид) 3. Химические свойства: В воде образует сильную серную кислоту, которая хорошо диссоциирует на ионы, является сильным электролитом: H 2 O + SO 3 = H 2 SO 4 + Q H 2 SO 4 → H+ + HSO 4 - → H+ + SO 42→ её соли – сульфаты и гидросульфаты.

СЕРНАЯ КИСЛОТА H 2 SO 4 ( «купоросное масло» ) 1. Физические свойства: ж, ц, з, неограниченно растворима в воде – с выделением теплоты; ρ=1, 84 г/см 3; едкое вещество обугливает ткани и кожу; Способна растворять в себе SO 3 , такой раствор называют «олеум»

СЕРНАЯ КИСЛОТА H 2 SO 4 ( «купоросное масло» ) 2. Химические свойства: В х/реакциях является окислителем. В разбавленных растворах окислитель за счёт иона водорода H+, реагирует с металлами только слева в ряду напряжений: 2 K + H 2 SO 4 = K 2 SO 4 + H 2↑ Fe + H 2 SO 4 (разб. ) = Fe. SO 4 + H 2↑ Ag + H 2 SO 4 (разб. ) = (разб. )

СЕРНАЯ КИСЛОТА H 2 SO 4 ( «купоросное масло» ) 2. Химические свойства: В концентрированных растворах окислитель за счёт атома S+6, реагирует со всеми металлами, кроме золота, платины. На холоду не реагирует с Fe, Al, Cr, W. Окисляет неметаллы: С до CO 2 и воды, S до SO 2 и воды, P до H 3 PO 4, при этом сама серная кислота восстанавливается до SO 2

В реакциях с металлами образуется три продукта (учебник, стр. 138): Me + H 2 SO 4 (к) = Me. SO 4 + H 2 O + X Me ряд напряжений Li……Na Mg……(H 2)……Ag не реагируют H 2 SO 4 (к) X=H 2 S↑ или S X=SO 2↑ или H 2 S X=SO 2↑ Al, Cr, Fe, Ni, W + благородные металлы (Au, Pt и др. )

Алгоритм «Как уравнивать окислительно-восстановительные реакции!»

Окислительно-восстановительные реакции (ОВР) – те, в которых элементы меняют свои степени окисления (с. о. ). Вещества в таких реакциях делятся на окислители (они в ОВР восстанавливаются – получают электроны) и восстановители (они окисляются – теряют электроны).
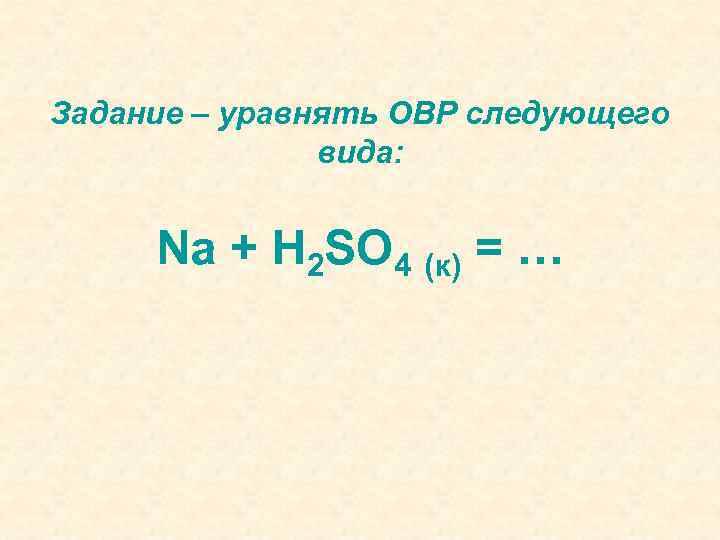
Задание – уравнять ОВР следующего вида: Na + H 2 SO 4 (к) = …

Итак, смотрим на уравнение реакции – кислота концентрированная: Na + H 2 SO 4 (к) = … Значит, она будет реагировать с натрием без выделения водорода. Смотрим на продукты по таблице – слайд 28. Это соль, вода и S (или H 2 S). Заполняем пропуск и выбираем свой вариант - сера: Na + H 2 SO 4 (к) = Na 2 SO 4 + H 2 O + S↓ Правильно проставляем степени окисления элементов. Руководствуются при этом следующими правилами: - У простых веществ степень окисления (с. о. ) = 0; - У кислорода в солях, кислотах, основания, оксидах: -2; - У водорода в солях, кислотах, основаниях, воде: +1. - Любая молекула имеет нейтральный заряд! - с. о. металлов в соединениях совпадает с зарядом катиона по таблице растворимости;
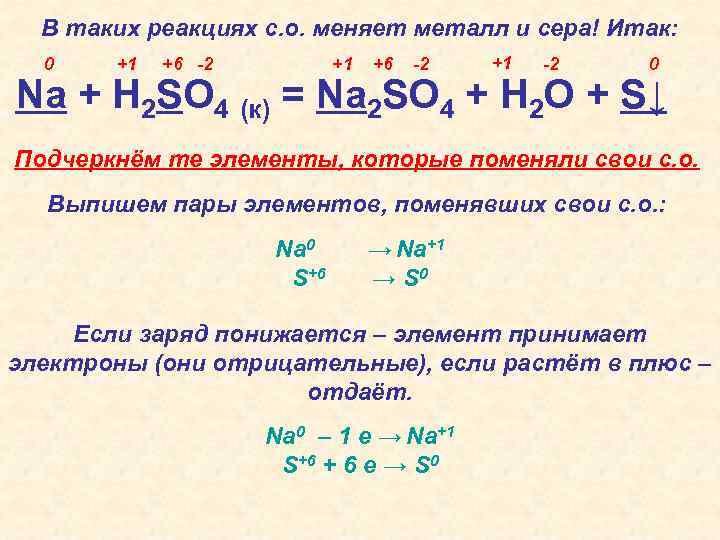
В таких реакциях с. о. меняет металл и сера! Итак: 0 +1 +6 -2 +1 -2 0 Na + H 2 SO 4 (к) = Na 2 SO 4 + H 2 O + S↓ Подчеркнём те элементы, которые поменяли свои с. о. Выпишем пары элементов, поменявших свои с. о. : Na 0 S+6 → Na+1 → S 0 Если заряд понижается – элемент принимает электроны (они отрицательные), если растёт в плюс – отдаёт. Na 0 – 1 е → Na+1 S+6 + 6 е → S 0

Найдём целое минимальное число, которое делилось бы без остатка и на « 1» и на « 6» . Это « 6» . Делим числа электронов на него и получаем «коэффициенты» отгораживаем их вертикальной чертой: Na 0 – 1 е → Na+1 S+6 + 6 е → S 0 6 6 1 восстановитель окислитель Ставить полученные коэффициенты можно только перед элементами своего ряда, встречающимися один раз в уравнении.

Натрий Na 0 и Na+ встречается один раз, значит перед нужно поставить « 6» . Однако в сульфате натрия у Na+ есть индекс, который следует учесть, тогда « 6» превратится в « 3» : 6 Na + H 2 SO 4 (к) = 3 Na 2 SO 4 + H 2 O + S↓ А вот с серой проблема. S+6 есть и в кислоте и в сульфате – её мы трогать не будем и уравняем только S 0 – перед ней будет стоять « 1» , который обычно не пишут. Таким образом уравнено только три формулы: 6 Na + H 2 SO 4 (к) = 3 Na 2 SO 4 + H 2 O + S↓ Осталось уравнять остальные формулы – серы справа 4 штуки, значит перед серной кислотой ставим – 4: 6 Na + 4 H 2 SO 4 (к) = 3 Na 2 SO 4 + H 2 O + S↓

Воде по закону сохранения достанется 4: 6 Na + 4 H 2 SO 4 (к) = 3 Na 2 SO 4 + 4 H 2 O + S↓ Окислительно-восстановительная реакция уравнена, проверка достигается подсчётом кислорода и водорода слева и справа. Числа должны совпасть. Всё, что касается темы «ОВР» 8 класса!

Теперь сами!

Металлы железо и алюминий пассивируются серной кислотой на холоду, но реагируют с ней при нагревании, при этом железо окисляется до Fe 3+ to C Fe + H 2 SO 4 (к) = … Ag + H 2 SO 4 (к) = … K + H 2 SO 4 (к) = …+ H 2 S↑ +… Ca + H 2 SO 4 (к) = … + S↓ + … S + H 2 SO 4 (к) = …

Серная кислота способна вытеснять из солей более слабые кислоты, в конц. состоянии – хлороводород из хлоридов. H 2 SO 4 + 2 Na. HCO 3 = Na 2 SO 4 + H 2 O + CO 2↑ H 2 SO 4(к. ) + Na. Cl = Na. HSO 4 + HCl↑

СЕРНАЯ КИСЛОТА H 2 SO 4 ( «купоросное масло» ) 3. Качественные реакции: – на кислоту, сульфаты и гидросульфаты – реакция с растворами растворимых солей бария – выпадает белый осадок: Na 2 SO 4 + Ba. Cl 2 = 2 Na. Cl + Ba. SO 4↓ SO 42 - + Ba 2+ = Ba. SO 4↓ белый осадок

Опыт На столе образцы под № 1, 2, 3, установите с помощью хлорида бария Ba. Cl 2 в каком из них находится сульфат калия K 2 SO 4?

СЕРНАЯ КИСЛОТА H 2 SO 4 ( «купоросное масло» ) 4. Соли серной кислоты: – некоторые гидратированные сульфаты называются «купоросами» – Cu. SO 4 ∙ 5 H 2 O медный купорос Fe. SO 4 ∙ 7 H 2 O железный купорос Na 2 SO 4 ∙ 10 H 2 O мирабилит Ca. SO 4 ∙ 2 H 2 O гипс

«Озеро смерти» (о. Сицилия, Италия)


СЕРНАЯ КИСЛОТА H 2 SO 4 ( «купоросное масло» ) 5. Производство серной кислоты: – с. 140 -141 самостоятельно законспектировать
Sera_Soedinenia_sery.ppt