Урок 4 Химические реакции. Скорость химической реакции.pptx
- Количество слайдов: 17

Самостоятельная работа № 2

Химические реакции. Скорость химической реакции 13. 09. 2017

Классификации химических реакций По числу реагентов и продуктов реакции • • По направлению Соединения Разложения Замещения Обмена • Прямые • Обратные По изменению степени окисления По агрегатному состоянию реагентов • Окислительновосстановительные • Не окислительновосстановительные • Гомогенные • Гетерогенные По тепловому эффекту • Экзотермические • Эндотермические Участие катализатора • Каталитические • Не каталитические



Скорость химической реакции Взрыв Получение гидроксида алюминия Естественное окисление Вывод – некоторые реакции протекают очень быстро, другие – за значительные промежутки времени Ржавление

Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени С – концентрация (отношение количества вещества к объему, которое оно занимает) Единица измерения – моль/(л*с) Раздел химии, в котором изучается скорость химической называется химическая кинетика

Факторы, влияющие на скорость химических реакций Природа реагирующих веществ
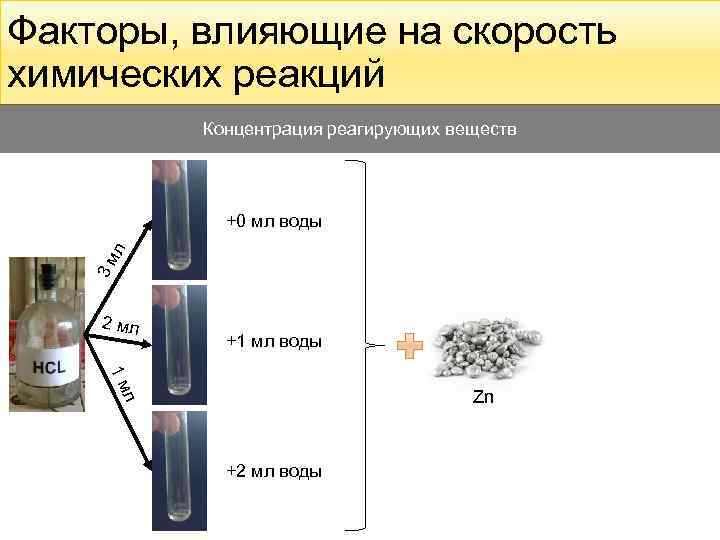
Факторы, влияющие на скорость химических реакций Концентрация реагирующих веществ 3 м л +0 мл воды 2 мл +1 мл воды 1 м л Zn +2 мл воды

Факторы, влияющие на скорость химических реакций Площадь соприкосновения реагирующих веществ

Факторы, влияющие на скорость химических реакций Температура Правило Вант-Гоффа При повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2 -4 раза (величина называется температурным коэффициентом) Якоб Вант-Гофф



Решение задач

Решение задач

Решение задач

Решение задач
Урок 4 Химические реакции. Скорость химической реакции.pptx