 S - ЭЛЕМЕНТЫ
S - ЭЛЕМЕНТЫ
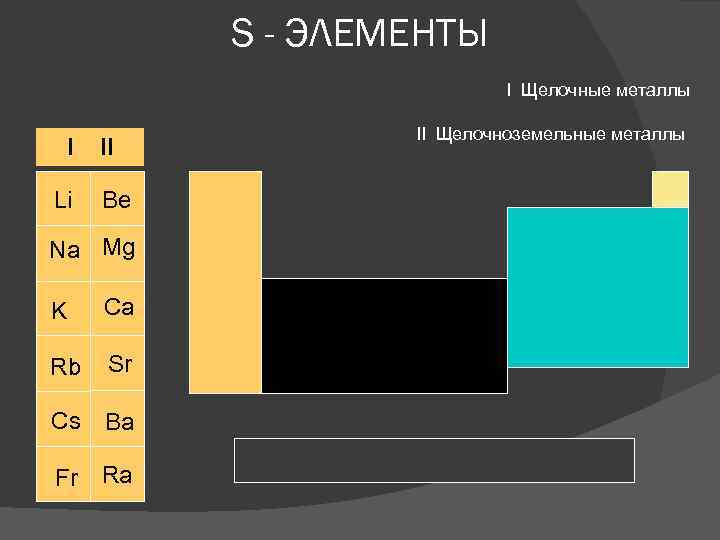 S - ЭЛЕМЕНТЫ I Щелочные металлы I II Li Be Na Mg K Ca Rb Sr Cs Ba Fr Ra II Щелочноземельные металлы
S - ЭЛЕМЕНТЫ I Щелочные металлы I II Li Be Na Mg K Ca Rb Sr Cs Ba Fr Ra II Щелочноземельные металлы
 Элементы I группы ПСЭ: Литий Рубидий 3 Натрий Калий Цезий
Элементы I группы ПСЭ: Литий Рубидий 3 Натрий Калий Цезий
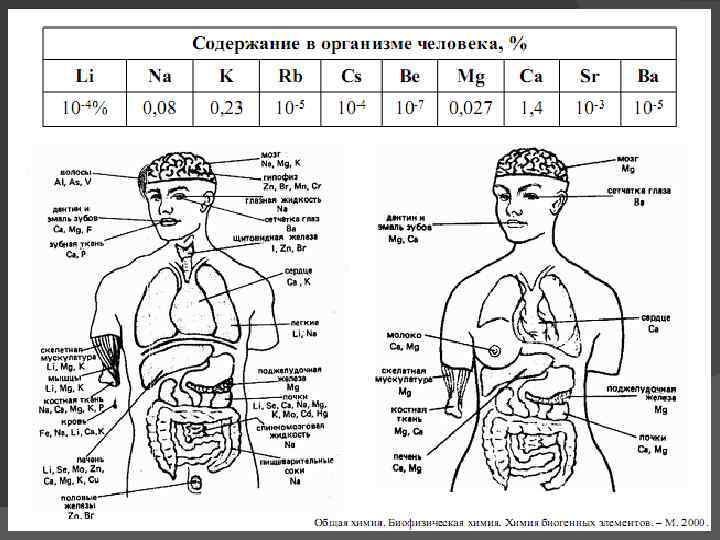
 НАХОЖДЕНИЕ В ПРИРОДЕ Элемент Кларк, % Минералы Функции Li 6, 5 • 10 -3 Na 2, 64 Галит Na. Cl Мирабилит Na 2 SO 4 • 10 H 2 O Активирует ферменты, компонент плазмы крови К 2, 41 Сильвин КCl Карналлит КCl • Mg. Cl 2 • 6 H 2 O Компонент цитоплазмы, необходим для нервной и сердечной деятельности Сподумен Li. Al[Si 206] Rb 1, 5 • 10 -2 Встречается с рудами Na и K Не известны Cs 3, 7 • 10 -4 Встречается с рудами Na и K Не известны Fr 2 мг Радиоактивный металл Не известны
НАХОЖДЕНИЕ В ПРИРОДЕ Элемент Кларк, % Минералы Функции Li 6, 5 • 10 -3 Na 2, 64 Галит Na. Cl Мирабилит Na 2 SO 4 • 10 H 2 O Активирует ферменты, компонент плазмы крови К 2, 41 Сильвин КCl Карналлит КCl • Mg. Cl 2 • 6 H 2 O Компонент цитоплазмы, необходим для нервной и сердечной деятельности Сподумен Li. Al[Si 206] Rb 1, 5 • 10 -2 Встречается с рудами Na и K Не известны Cs 3, 7 • 10 -4 Встречается с рудами Na и K Не известны Fr 2 мг Радиоактивный металл Не известны
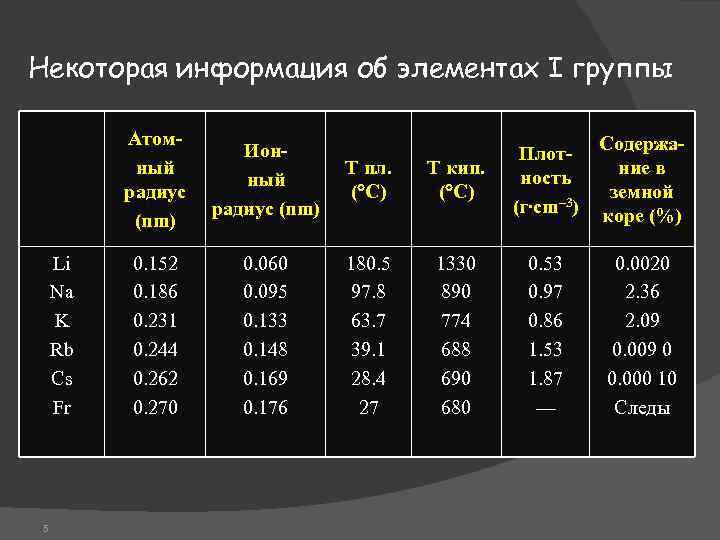 Некоторая информация об элементах I группы Атомный радиус (nm) Li Na K Rb Cs Fr 5 Ионный радиус (nm) Т пл. ( C) 0. 152 0. 186 0. 231 0. 244 0. 262 0. 270 0. 060 0. 095 0. 133 0. 148 0. 169 0. 176 180. 5 97. 8 63. 7 39. 1 28. 4 27 Т кип. ( C) Плотность (г∙cm– 3) Содержание в земной коре (%) 1330 890 774 688 690 680 0. 53 0. 97 0. 86 1. 53 1. 87 — 0. 0020 2. 36 2. 09 0. 009 0 0. 000 10 Следы
Некоторая информация об элементах I группы Атомный радиус (nm) Li Na K Rb Cs Fr 5 Ионный радиус (nm) Т пл. ( C) 0. 152 0. 186 0. 231 0. 244 0. 262 0. 270 0. 060 0. 095 0. 133 0. 148 0. 169 0. 176 180. 5 97. 8 63. 7 39. 1 28. 4 27 Т кип. ( C) Плотность (г∙cm– 3) Содержание в земной коре (%) 1330 890 774 688 690 680 0. 53 0. 97 0. 86 1. 53 1. 87 — 0. 0020 2. 36 2. 09 0. 009 0 0. 000 10 Следы
 Элементы II группы ПСЭ: Кальций Бериллий Стронций 6 Магний Барий Радий
Элементы II группы ПСЭ: Кальций Бериллий Стронций 6 Магний Барий Радий
 НАХОЖДЕНИЕ В ПРИРОДЕ Элемент Кларк, % Минералы Функции Be 6 • 10 -4 Сподумен (берилл) Al 2[Be 3(Si 6018)] Все соединения токсичны, ингибирует ферменты Mg 2, 35 Оливин (Mg, Fe 2[Si 04)] Доломит Mg. CO 3 • Ca. CO 3 Активирует ферменты, фотосинтез, стабилизация клеток Са 3, 38 Анортит Ca[Al 2(Si 208)] Sr 3, 4 • 10 -2 Целестин Sr. S 04 Стронцианит Sr. CO 3 Ba 6, 5 • 10 -2 Барит Ba. S 04 Витерит Ba. CO 3 Структурный компонент стенок клеток, костей и раковин Sr+2 накапливается в костях, избыток вреден Ba+2 замещает К+, мускульный яд
НАХОЖДЕНИЕ В ПРИРОДЕ Элемент Кларк, % Минералы Функции Be 6 • 10 -4 Сподумен (берилл) Al 2[Be 3(Si 6018)] Все соединения токсичны, ингибирует ферменты Mg 2, 35 Оливин (Mg, Fe 2[Si 04)] Доломит Mg. CO 3 • Ca. CO 3 Активирует ферменты, фотосинтез, стабилизация клеток Са 3, 38 Анортит Ca[Al 2(Si 208)] Sr 3, 4 • 10 -2 Целестин Sr. S 04 Стронцианит Sr. CO 3 Ba 6, 5 • 10 -2 Барит Ba. S 04 Витерит Ba. CO 3 Структурный компонент стенок клеток, костей и раковин Sr+2 накапливается в костях, избыток вреден Ba+2 замещает К+, мускульный яд
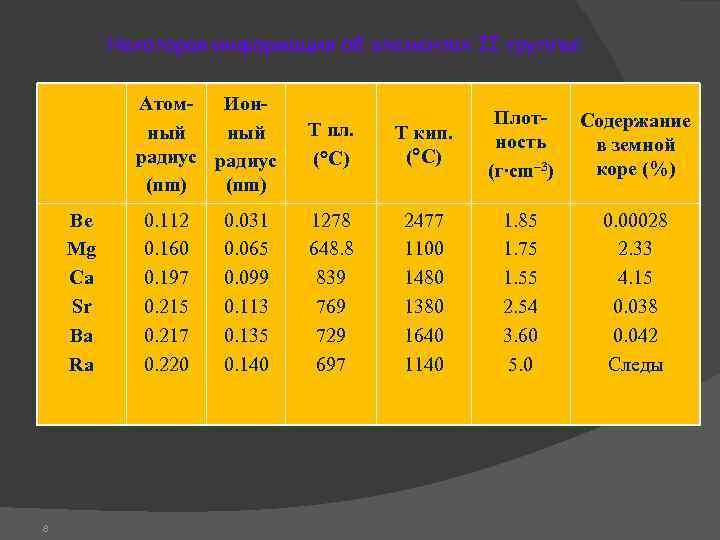 Некоторая информация об элементах II группы: Атом. Ионный радиус (nm) Be Mg Ca Sr Ba Ra 8 0. 112 0. 160 0. 197 0. 215 0. 217 0. 220 0. 031 0. 065 0. 099 0. 113 0. 135 0. 140 Т пл. ( C) Т кип. ( C) Плотность (г∙cm– 3) Содержание в земной коре (%) 1278 648. 8 839 769 729 697 2477 1100 1480 1380 1640 1140 1. 85 1. 75 1. 55 2. 54 3. 60 5. 0 0. 00028 2. 33 4. 15 0. 038 0. 042 Следы
Некоторая информация об элементах II группы: Атом. Ионный радиус (nm) Be Mg Ca Sr Ba Ra 8 0. 112 0. 160 0. 197 0. 215 0. 217 0. 220 0. 031 0. 065 0. 099 0. 113 0. 135 0. 140 Т пл. ( C) Т кип. ( C) Плотность (г∙cm– 3) Содержание в земной коре (%) 1278 648. 8 839 769 729 697 2477 1100 1480 1380 1640 1140 1. 85 1. 75 1. 55 2. 54 3. 60 5. 0 0. 00028 2. 33 4. 15 0. 038 0. 042 Следы
 Литий был открыт в 1817 году шведским химиком А. Арфведсоном. Металлический литий впервые получил Хемфри Дэви в 1825 году. Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион» , современное название было предложено Берцелиусом.
Литий был открыт в 1817 году шведским химиком А. Арфведсоном. Металлический литий впервые получил Хемфри Дэви в 1825 году. Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион» , современное название было предложено Берцелиусом.
 Натрий был открыт в 1807 году английским химиком Хемфри Дэви. Название «натрий» происходит от латинского слова natrium (ср. др. -греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода» , «едкий натр» .
Натрий был открыт в 1807 году английским химиком Хемфри Дэви. Название «натрий» происходит от латинского слова natrium (ср. др. -греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода» , «едкий натр» .
 Калий В 1807 году английский химик Хемфри Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
Калий В 1807 году английский химик Хемфри Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
 Рубидий В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, изучая с помощью спектрального анализа природные алюмосиликаты, обнаружили в них новый элемент. Название дано по цвету наиболее характерных красных линий спектра (от лат. rubidus — красный, тёмно-красный).
Рубидий В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, изучая с помощью спектрального анализа природные алюмосиликаты, обнаружили в них новый элемент. Название дано по цвету наиболее характерных красных линий спектра (от лат. rubidus — красный, тёмно-красный).
 Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (Cs. CN) и бария. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (Cs. CN) и бария. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
 Франций Был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции. Франций — один из редчайших элементов. Это второй самый редкий элемент в природе, после астата, который постоянно находится в земной коре.
Франций Был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции. Франций — один из редчайших элементов. Это второй самый редкий элемент в природе, после астата, который постоянно находится в земной коре.
 БЕРИЛЛИЙ Бериллий – хрупкий твердый металл светлосерого цвета. При хранении на воздухе покрывается оксидной пленкой. Открыт в 1798 г. французским химиком Луи Никола Вокленом. Название бериллия произошло от названия минерала берилла, которое восходит к названию города Белур (Веллуру) в Южной Индии.
БЕРИЛЛИЙ Бериллий – хрупкий твердый металл светлосерого цвета. При хранении на воздухе покрывается оксидной пленкой. Открыт в 1798 г. французским химиком Луи Никола Вокленом. Название бериллия произошло от названия минерала берилла, которое восходит к названию города Белур (Веллуру) в Южной Индии.
 Магний, кальций Магний – открыт В 1808 году. Английский химик Хемфри Дэви при электролизе слегка увлажнённой белой магнезии с ртутным катодом получил амальгаму нового металла (она содержит до 3 % магния), который выделил отгонкой ртути и назвал магнезием. Название элемента происходит от греческого calcis — «мягкий камень» . Оно было предложено английским химиком Хэмфри Дэви в 1808 году выделившим металлический кальций электролизом.
Магний, кальций Магний – открыт В 1808 году. Английский химик Хемфри Дэви при электролизе слегка увлажнённой белой магнезии с ртутным катодом получил амальгаму нового металла (она содержит до 3 % магния), который выделил отгонкой ртути и назвал магнезием. Название элемента происходит от греческого calcis — «мягкий камень» . Оно было предложено английским химиком Хэмфри Дэви в 1808 году выделившим металлический кальций электролизом.
 Стронций обнаружил Адер Кроуфорд в минерале – стронцианите - Sr. CO 3, найденном близ шотландской деревни Строншиан, давшей впоследствии название новому элементу.
Стронций обнаружил Адер Кроуфорд в минерале – стронцианите - Sr. CO 3, найденном близ шотландской деревни Строншиан, давшей впоследствии название новому элементу.
 В 1808 году английский химик Хемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
В 1808 году английский химик Хемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
 Получить чистый радий в 1902 году стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить всего 1 г чистого радия: нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота. За открытие радия и полония супруги Кюри получили Нобелевскую премию.
Получить чистый радий в 1902 году стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить всего 1 г чистого радия: нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота. За открытие радия и полония супруги Кюри получили Нобелевскую премию.
 Хемфри Дэви (1778 -1829) Однажды профессор Хемфри Дэви получил письмо от одного из студентов - Майкла Фарадея. Он писал, что прослушал курс лекций уважаемого профессора и хотел бы поработать у него в лаборатории Королевского института. Профессор вслух прочитал письмо и спросил своего ассистента: "Как вы полагаете, что мне ответить этому студенту? " Ассистент сказал: "Возьмите его и поручите ему для начала мыть колбы и пробирки. Если он согласится, то в будущем из него выйдет толк"
Хемфри Дэви (1778 -1829) Однажды профессор Хемфри Дэви получил письмо от одного из студентов - Майкла Фарадея. Он писал, что прослушал курс лекций уважаемого профессора и хотел бы поработать у него в лаборатории Королевского института. Профессор вслух прочитал письмо и спросил своего ассистента: "Как вы полагаете, что мне ответить этому студенту? " Ассистент сказал: "Возьмите его и поручите ему для начала мыть колбы и пробирки. Если он согласится, то в будущем из него выйдет толк"
 Получение элементов I группы Электролизом расплавов солей. Na. Cl = Na + Cl
Получение элементов I группы Электролизом расплавов солей. Na. Cl = Na + Cl

 Получение элементов II группы Be: минерал берил (3 Be. O·Al 2 O 3· 6 Si. O 2) вначале преобразуется в Be. F 2, который восстанавливается до Be магнием Mg: электролизом расплава Mg. Cl 2 Ca: электролизом расплава Ca. Cl 2 Sr и Ba: электролизом раславов солей или из оксидов восстановлением Al при высокой температуре
Получение элементов II группы Be: минерал берил (3 Be. O·Al 2 O 3· 6 Si. O 2) вначале преобразуется в Be. F 2, который восстанавливается до Be магнием Mg: электролизом расплава Mg. Cl 2 Ca: электролизом расплава Ca. Cl 2 Sr и Ba: электролизом раславов солей или из оксидов восстановлением Al при высокой температуре
 Характерные свойств s-элементов I и II групп Металлический характер Низкая электроотрицательность Основные оксиды, гидроксиды Ионные соединения с фиксированной степенью окисления Характерная окраска пламени Слабая тенденция к образованию комплексов
Характерные свойств s-элементов I и II групп Металлический характер Низкая электроотрицательность Основные оксиды, гидроксиды Ионные соединения с фиксированной степенью окисления Характерная окраска пламени Слабая тенденция к образованию комплексов
 Металлические свойства Высокая способность к потере электронов и образованию положительно заряженных ионов Металлические свойства в обеих группах увеличивается сверху вниз
Металлические свойства Высокая способность к потере электронов и образованию положительно заряженных ионов Металлические свойства в обеих группах увеличивается сверху вниз
 Электроотрицательность Слабое притяжение ядром внешних электронов Высокая электроположительность Низкая электроотрицательность I II Li 1. 0 Be 1. 5 Na 0. 9 Mg 1. 2 K 0. 8 Ca 1. 0 Rb 0. 8 Sr 1. 0 Cs 0. 7 Ba 0. 9 Fr 0. 7 Ra 0. 9
Электроотрицательность Слабое притяжение ядром внешних электронов Высокая электроположительность Низкая электроотрицательность I II Li 1. 0 Be 1. 5 Na 0. 9 Mg 1. 2 K 0. 8 Ca 1. 0 Rb 0. 8 Sr 1. 0 Cs 0. 7 Ba 0. 9 Fr 0. 7 Ra 0. 9
 Основные оксиды, гидроксиды Оксиды Гидроксиды Оксиды Li 2 O Li. OH Be. O Be(OH)2 Na 2 O Na. OH Mg. O Mg(OH)2 K 2 O KOH Ca. O Ca(OH)2 Rb 2 O Rb. OH Sr. O Sr(OH)2 Cs 2 O Cs. OH Ba. O Ba(OH)2 Гидроксиды
Основные оксиды, гидроксиды Оксиды Гидроксиды Оксиды Li 2 O Li. OH Be. O Be(OH)2 Na 2 O Na. OH Mg. O Mg(OH)2 K 2 O KOH Ca. O Ca(OH)2 Rb 2 O Rb. OH Sr. O Sr(OH)2 Cs 2 O Cs. OH Ba. O Ba(OH)2 Гидроксиды
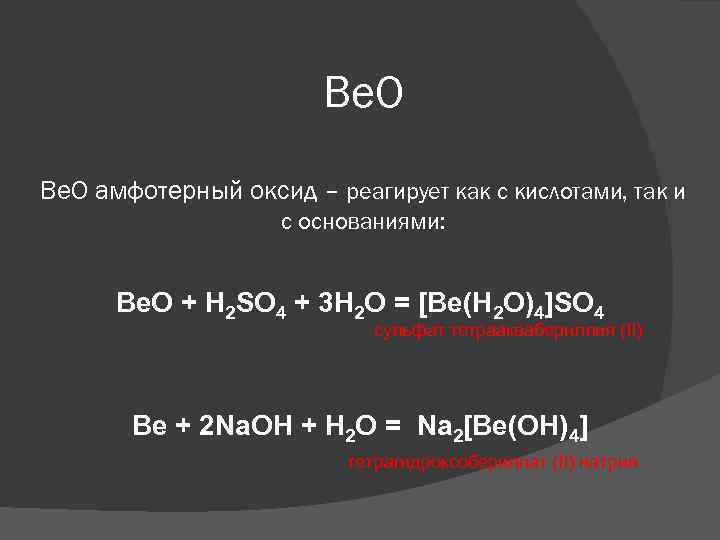 Ве. О Be. O амфотерный оксид – реагирует как с кислотами, так и с основаниями: Be. O + H 2 SO 4 + 3 H 2 O = [Be(H 2 O)4]SO 4 сульфат тетрааквабериллия (II) Be + 2 Na. OH + H 2 O = Na 2[Be(OH)4] тетрагидроксобериллат (II) натрия
Ве. О Be. O амфотерный оксид – реагирует как с кислотами, так и с основаниями: Be. O + H 2 SO 4 + 3 H 2 O = [Be(H 2 O)4]SO 4 сульфат тетрааквабериллия (II) Be + 2 Na. OH + H 2 O = Na 2[Be(OH)4] тетрагидроксобериллат (II) натрия
 Оксиды, пероксиды, надпероксиды Реакции с водой: Оксиды: O 2 - + H 2 O 2 OHПероксиды: O 22 - + 2 H 2 O 2 + 2 OHНадпероксиды: 2 O 2 - + 2 H 2 O 2 OH- + H 2 O 2 + O 2 . . 2: O: O: . . Пероксид ион . . : O: . . Надпероксид ион Li не образует пероксид и надпероксид Li 2 O 2 Li 2 O + ½ O 2
Оксиды, пероксиды, надпероксиды Реакции с водой: Оксиды: O 2 - + H 2 O 2 OHПероксиды: O 22 - + 2 H 2 O 2 + 2 OHНадпероксиды: 2 O 2 - + 2 H 2 O 2 OH- + H 2 O 2 + O 2 . . 2: O: O: . . Пероксид ион . . : O: . . Надпероксид ион Li не образует пероксид и надпероксид Li 2 O 2 Li 2 O + ½ O 2
 Гидроксиды металлов I группы Li Na K Rb Cs Все растворимы, сила оснований увеличивается Гидроксиды металлов II группы Be Mg Ca Sr Ba Растворимость увеличивается от амфотерных к основным, сила оснований увеличивается
Гидроксиды металлов I группы Li Na K Rb Cs Все растворимы, сила оснований увеличивается Гидроксиды металлов II группы Be Mg Ca Sr Ba Растворимость увеличивается от амфотерных к основным, сила оснований увеличивается
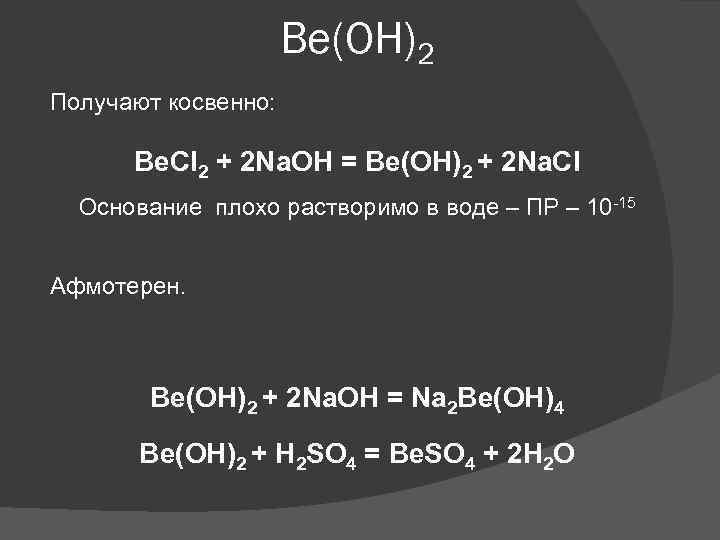 Ве(ОН)2 Получают косвенно: Be. Cl 2 + 2 Na. OH = Be(OH)2 + 2 Na. Cl Основание плохо растворимо в воде – ПР – 10 -15 Афмотерен. Ве(ОН)2 + 2 Na. OH = Na 2 Be(OH)4 Ве(ОН)2 + H 2 SO 4 = Be. SO 4 + 2 H 2 O
Ве(ОН)2 Получают косвенно: Be. Cl 2 + 2 Na. OH = Be(OH)2 + 2 Na. Cl Основание плохо растворимо в воде – ПР – 10 -15 Афмотерен. Ве(ОН)2 + 2 Na. OH = Na 2 Be(OH)4 Ве(ОН)2 + H 2 SO 4 = Be. SO 4 + 2 H 2 O
 Ионные соединения с фиксированной степенью окисления Группа I: Сильно электроположительные металлы. Образуют преимущественно ионные соединения с не металлами, теряя один электрон. Фиксированная степень окисления +1. Низкое значение 1 -го П. И. Очень высокое значение 2 -го П. И. Группа II: Электроположительные металлы. Фиксированная степень окисления + 2. Соединения Be и Mg и обладают некоторыми ковалентными свойствами. Низкое значение 1 -го и 2 -го П. И. Экстремально высокое значение 3 -го П. И.
Ионные соединения с фиксированной степенью окисления Группа I: Сильно электроположительные металлы. Образуют преимущественно ионные соединения с не металлами, теряя один электрон. Фиксированная степень окисления +1. Низкое значение 1 -го П. И. Очень высокое значение 2 -го П. И. Группа II: Электроположительные металлы. Фиксированная степень окисления + 2. Соединения Be и Mg и обладают некоторыми ковалентными свойствами. Низкое значение 1 -го и 2 -го П. И. Экстремально высокое значение 3 -го П. И.
 Характерные цвета пламени Na+ Cl- (г) Na (г) + Cl (г) Na(г) Na* (г) [Ne]3 s 1 [Ne]3 p 1 Na*(г) Na(г) + h (589 нм, желтый)
Характерные цвета пламени Na+ Cl- (г) Na (г) + Cl (г) Na(г) Na* (г) [Ne]3 s 1 [Ne]3 p 1 Na*(г) Na(г) + h (589 нм, желтый)
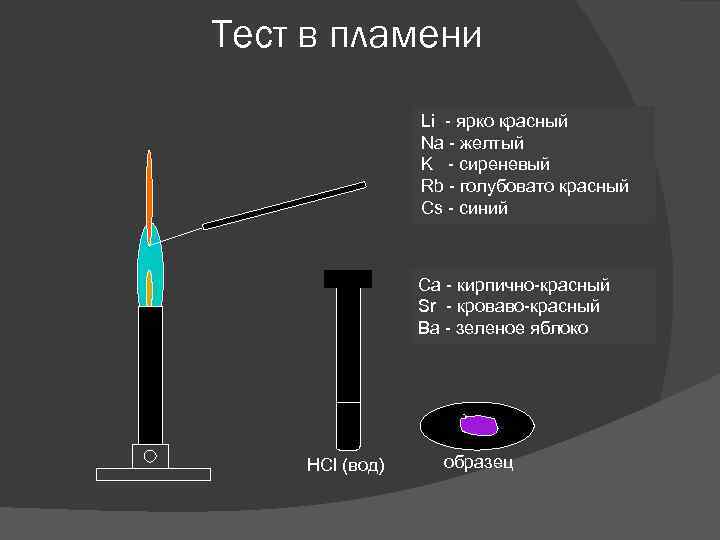 Тест в пламени Li - ярко красный Na - желтый K - сиреневый Rb - голубовато красный Cs - синий Ca - кирпично-красный Sr - кроваво-красный Ba - зеленое яблоко HCl (вод) образец
Тест в пламени Li - ярко красный Na - желтый K - сиреневый Rb - голубовато красный Cs - синий Ca - кирпично-красный Sr - кроваво-красный Ba - зеленое яблоко HCl (вод) образец
 Идентификация IА элементов по цвету пламени Цвет пламени
Идентификация IА элементов по цвету пламени Цвет пламени
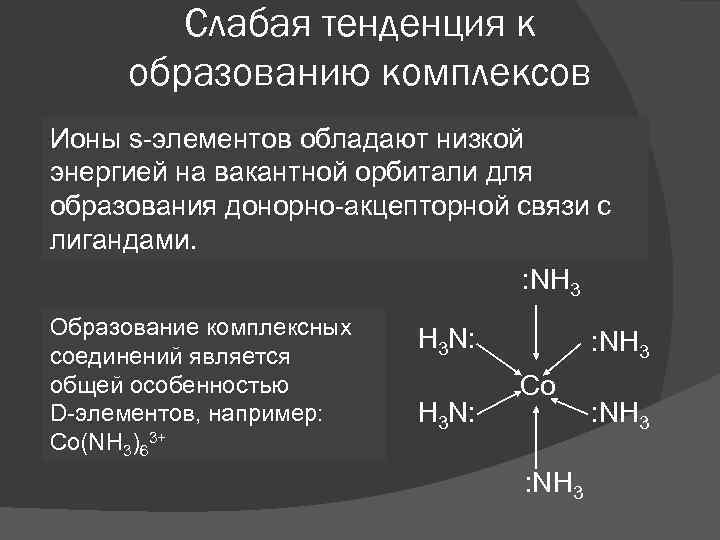 Слабая тенденция к образованию комплексов Ионы s-элементов обладают низкой энергией на вакантной орбитали для образования донорно-акцепторной связи с лигандами. : NH 3 Образование комплексных соединений является общей особенностью D-элементов, например: Co(NH 3)63+ H 3 N: : NH 3 Co : NH 3
Слабая тенденция к образованию комплексов Ионы s-элементов обладают низкой энергией на вакантной орбитали для образования донорно-акцепторной связи с лигандами. : NH 3 Образование комплексных соединений является общей особенностью D-элементов, например: Co(NH 3)63+ H 3 N: : NH 3 Co : NH 3
 Изменение свойств элементов Атомный радиус Энергия (потенциал) ионизации Энергия гидратации Температура плавления
Изменение свойств элементов Атомный радиус Энергия (потенциал) ионизации Энергия гидратации Температура плавления
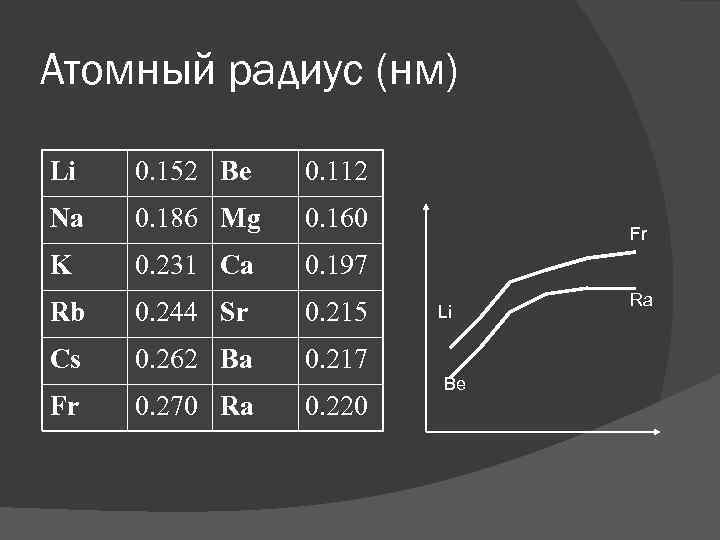 Атомный радиус (нм) Li 0. 152 Be 0. 112 Na 0. 186 Mg 0. 160 K 0. 231 Ca 0. 197 Rb 0. 244 Sr 0. 215 Cs 0. 262 Ba 0. 217 Fr 0. 270 Ra 0. 220 Fr Li Be Ra
Атомный радиус (нм) Li 0. 152 Be 0. 112 Na 0. 186 Mg 0. 160 K 0. 231 Ca 0. 197 Rb 0. 244 Sr 0. 215 Cs 0. 262 Ba 0. 217 Fr 0. 270 Ra 0. 220 Fr Li Be Ra
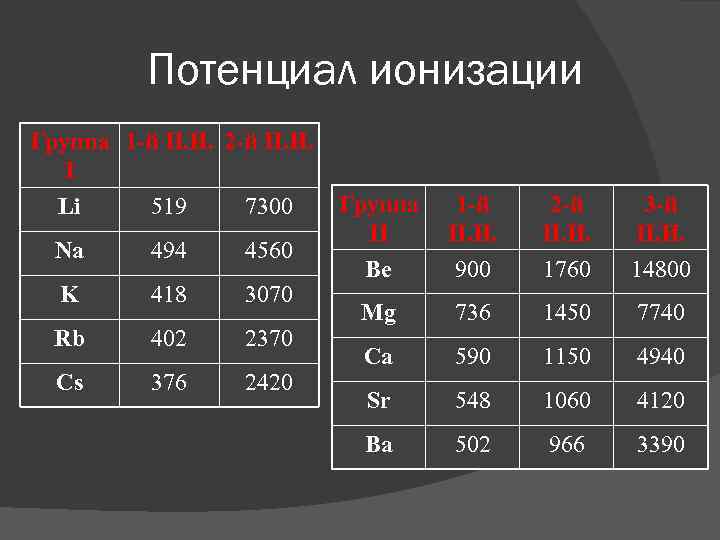 Потенциал ионизации Группа 1 -й П. И. 2 -й П. И. I Li 519 7300 Na 494 4560 K 418 3070 Rb 402 2370 Cs 376 2420 Группа II 1 -й П. И. 2 -й П. И. 3 -й П. И. Be 900 1760 14800 Mg 736 1450 7740 Ca 590 1150 4940 Sr 548 1060 4120 Ba 502 966 3390
Потенциал ионизации Группа 1 -й П. И. 2 -й П. И. I Li 519 7300 Na 494 4560 K 418 3070 Rb 402 2370 Cs 376 2420 Группа II 1 -й П. И. 2 -й П. И. 3 -й П. И. Be 900 1760 14800 Mg 736 1450 7740 Ca 590 1150 4940 Sr 548 1060 4120 Ba 502 966 3390
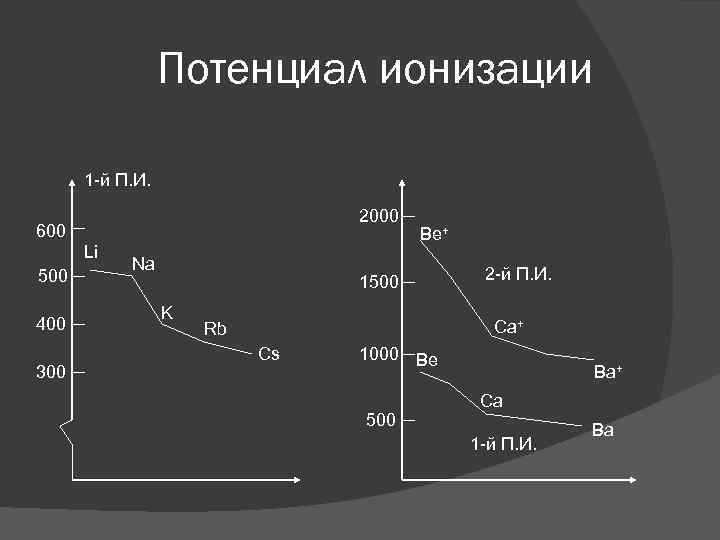 Потенциал ионизации 1 -й П. И. 2000 600 Li 500 400 300 Na Be+ 1500 K 2 -й П. И. Ca+ Rb Cs 1000 Be 500 Ba+ Ca 1 -й П. И. Ba
Потенциал ионизации 1 -й П. И. 2000 600 Li 500 400 300 Na Be+ 1500 K 2 -й П. И. Ca+ Rb Cs 1000 Be 500 Ba+ Ca 1 -й П. И. Ba
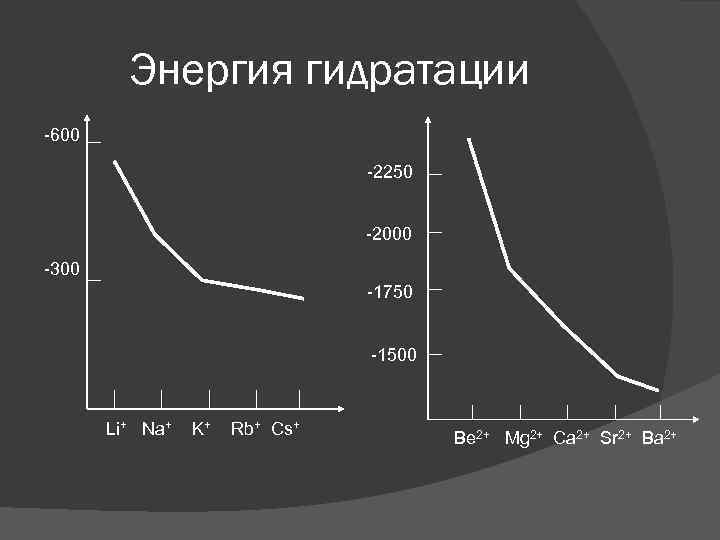
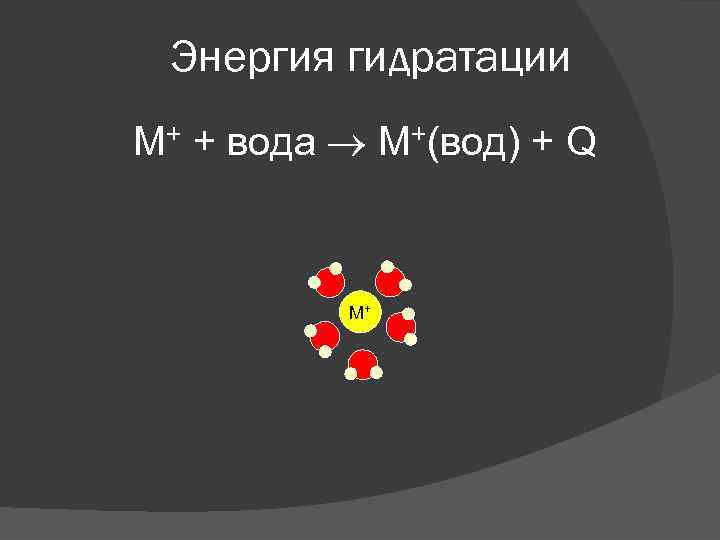 Энергия гидратации M+ + вода M+(вод) + Q M+
Энергия гидратации M+ + вода M+(вод) + Q M+
 Энергия гидратации Общие тенденции: 1. При переходе вниз в обеих группах, энергия гидратации уменьшается. (Когда ионы увеличиваются, плотность заряда уменьшается, электростатическое притяжение между ионами и молекулами воды становится слабее. ) 2. Энергия гидратации для ионов металлов 2 А группы выше, чем для ионов 1 А группы. (катионы 2 А группы двузарядные и имеют меньшие размеры)
Энергия гидратации Общие тенденции: 1. При переходе вниз в обеих группах, энергия гидратации уменьшается. (Когда ионы увеличиваются, плотность заряда уменьшается, электростатическое притяжение между ионами и молекулами воды становится слабее. ) 2. Энергия гидратации для ионов металлов 2 А группы выше, чем для ионов 1 А группы. (катионы 2 А группы двузарядные и имеют меньшие размеры)
 Энергия гидратации -600 -2250 -2000 -300 -1750 -1500 Li+ Na+ K+ Rb+ Cs+ Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+
Энергия гидратации -600 -2250 -2000 -300 -1750 -1500 Li+ Na+ K+ Rb+ Cs+ Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+
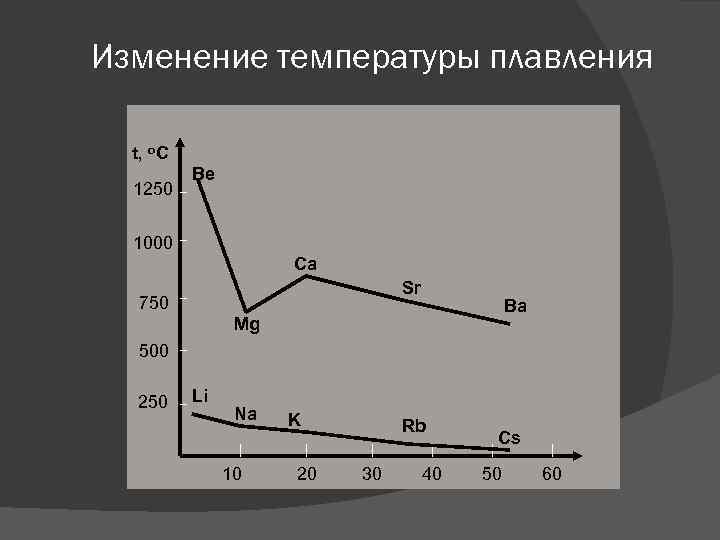
 Изменение температуры плавления Низкие значения tпл обьясняются слабыми металлическими свойствами в кристаллических решетках. Металлические связи образуются делокализованными внешними s-электронами, образующими «клей» , который удерживает вместе все ионы. С увеличением размера атома связь слабее. Прочность металлической связи (ПМС): число делокализованных e- на 1 атом ПМС = ________________ радиус атома металла
Изменение температуры плавления Низкие значения tпл обьясняются слабыми металлическими свойствами в кристаллических решетках. Металлические связи образуются делокализованными внешними s-электронами, образующими «клей» , который удерживает вместе все ионы. С увеличением размера атома связь слабее. Прочность металлической связи (ПМС): число делокализованных e- на 1 атом ПМС = ________________ радиус атома металла
 Изменение температуры плавления t, o. C 1250 Be 1000 Ca Sr 750 Mg Ba 500 250 Li Na K Rb Cs 10 20 30 40 50 60
Изменение температуры плавления t, o. C 1250 Be 1000 Ca Sr 750 Mg Ba 500 250 Li Na K Rb Cs 10 20 30 40 50 60
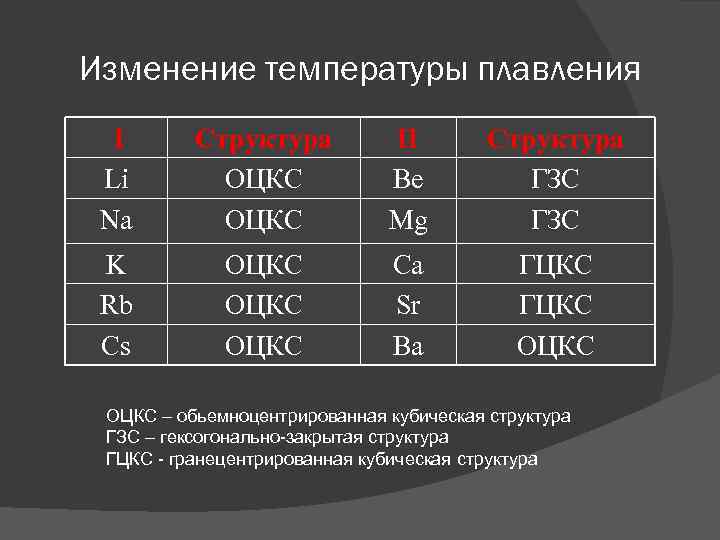 Изменение температуры плавления I Li Na Структура ОЦКС II Be Mg Структура ГЗС K Rb Cs ОЦКС Ca Sr Ba ГЦКС ОЦКС – обьемноцентрированная кубическая структура ГЗС – гексогонально-закрытая структура ГЦКС - гранецентрированная кубическая структура
Изменение температуры плавления I Li Na Структура ОЦКС II Be Mg Структура ГЗС K Rb Cs ОЦКС Ca Sr Ba ГЦКС ОЦКС – обьемноцентрированная кубическая структура ГЗС – гексогонально-закрытая структура ГЦКС - гранецентрированная кубическая структура
 ОЦКС ГЗС
ОЦКС ГЗС
 Реакционная способность s-металлов S-элементы сильные восстановители. Их восстанавливающая способность увеличивается сверху вниз в обеих группах. (С увеличением размера атома легче отдача внешнего электрона)
Реакционная способность s-металлов S-элементы сильные восстановители. Их восстанавливающая способность увеличивается сверху вниз в обеих группах. (С увеличением размера атома легче отдача внешнего электрона)
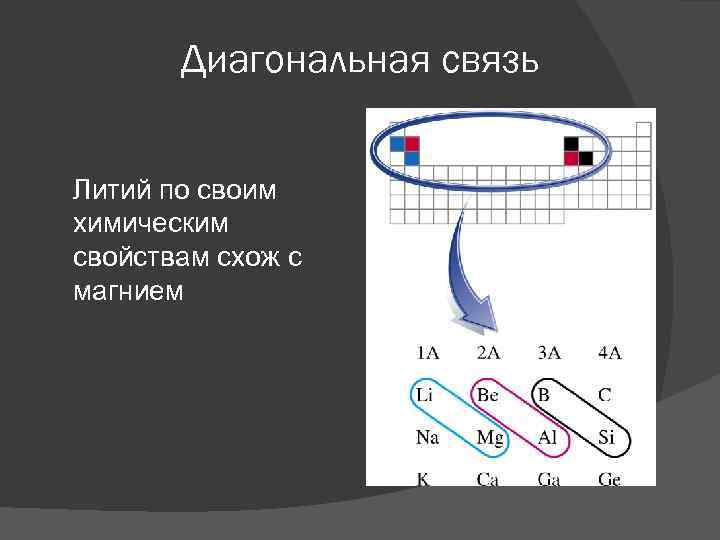 Диагональная связь Литий по своим химическим свойствам схож с магнием
Диагональная связь Литий по своим химическим свойствам схож с магнием
 Доказательства Карбонат лития разлагается с выделением СО 2 Li 2 CO 3 → Li 2 O + CO 2 Литий реагирует с азотом при нормальной температуре 6 Li + N 2 = 2 Li 3 N Литий – единственный щелочной металл, который образует имид Li 2 NH. Получают из амида Li. NH 2: 2 Li. NH 2 = Li 2 NH + NH 3 Гидроксид лития разлагается до оксида 2 Li. ОН → Li 2 O + Н 2 O
Доказательства Карбонат лития разлагается с выделением СО 2 Li 2 CO 3 → Li 2 O + CO 2 Литий реагирует с азотом при нормальной температуре 6 Li + N 2 = 2 Li 3 N Литий – единственный щелочной металл, который образует имид Li 2 NH. Получают из амида Li. NH 2: 2 Li. NH 2 = Li 2 NH + NH 3 Гидроксид лития разлагается до оксида 2 Li. ОН → Li 2 O + Н 2 O
 Реакции с кислородом S-элементы легко реагируют с кислородом. Кроме Be и Mg, они должны храниться в керосине, чтобы предотвратить контакт с атмосферой. 4 Li + O 2 = 2 Li 2 O 2 Na + O 2 = Na 2 O 2 K + O 2 = KO 2 2 Ca + O 2 = 2 Ca. O
Реакции с кислородом S-элементы легко реагируют с кислородом. Кроме Be и Mg, они должны храниться в керосине, чтобы предотвратить контакт с атмосферой. 4 Li + O 2 = 2 Li 2 O 2 Na + O 2 = Na 2 O 2 K + O 2 = KO 2 2 Ca + O 2 = 2 Ca. O
 Реакции с кислородом Нормальный оксид Структура Пероксид Надпероксид . . 2 - : O: . . Образует . . 2 - : O-O: . . Li, Na и группа IIА Na и Ba . . : O: . . K, Rb, Cs
Реакции с кислородом Нормальный оксид Структура Пероксид Надпероксид . . 2 - : O: . . Образует . . 2 - : O-O: . . Li, Na и группа IIА Na и Ba . . : O: . . K, Rb, Cs
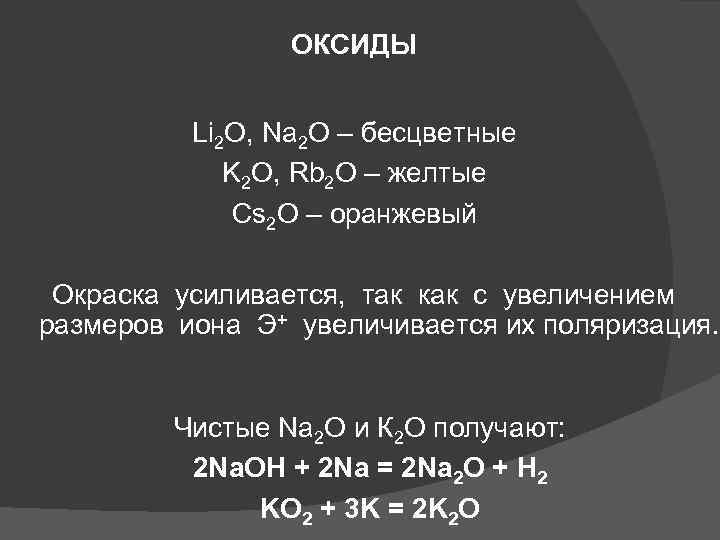 ОКСИДЫ Li 2 O, Na 2 O – бесцветные K 2 O, Rb 2 O – желтые Cs 2 O – оранжевый Окраска усиливается, так как с увеличением размеров иона Э+ увеличивается их поляризация. Чистые Na 2 O и К 2 О получают: 2 Na. OH + 2 Na = 2 Na 2 O + H 2 KO 2 + 3 K = 2 K 2 O
ОКСИДЫ Li 2 O, Na 2 O – бесцветные K 2 O, Rb 2 O – желтые Cs 2 O – оранжевый Окраска усиливается, так как с увеличением размеров иона Э+ увеличивается их поляризация. Чистые Na 2 O и К 2 О получают: 2 Na. OH + 2 Na = 2 Na 2 O + H 2 KO 2 + 3 K = 2 K 2 O
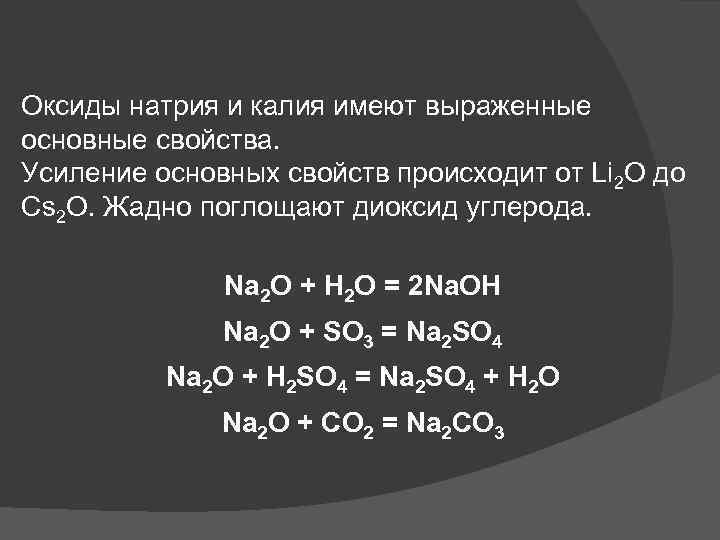 Оксиды натрия и калия имеют выраженные основные свойства. Усиление основных свойств происходит от Li 2 O до Cs 2 O. Жадно поглощают диоксид углерода. Na 2 O + H 2 O = 2 Na. OH Na 2 O + SO 3 = Na 2 SO 4 Na 2 O + H 2 SO 4 = Na 2 SO 4 + H 2 O Na 2 O + CO 2 = Na 2 CO 3
Оксиды натрия и калия имеют выраженные основные свойства. Усиление основных свойств происходит от Li 2 O до Cs 2 O. Жадно поглощают диоксид углерода. Na 2 O + H 2 O = 2 Na. OH Na 2 O + SO 3 = Na 2 SO 4 Na 2 O + H 2 SO 4 = Na 2 SO 4 + H 2 O Na 2 O + CO 2 = Na 2 CO 3
 ОКСИДЫ Be. O, Ca. O – белые Mg. O, Sr. O, Ba. O – бесцветные Оксиды получают сжиганием соответствующего металла в кислороде (Mg при температуре 600 о. С, разрушение оксидной пленки) или термическим разложением кислородсодержащих солей Ca. CO 3 = Ca. O + CO 2 негашеная известь Особо чистые оксиды получают из нитратов: 2 Mg(NO 3)2 = 2 Mg. O + 4 NO 2 + O 2
ОКСИДЫ Be. O, Ca. O – белые Mg. O, Sr. O, Ba. O – бесцветные Оксиды получают сжиганием соответствующего металла в кислороде (Mg при температуре 600 о. С, разрушение оксидной пленки) или термическим разложением кислородсодержащих солей Ca. CO 3 = Ca. O + CO 2 негашеная известь Особо чистые оксиды получают из нитратов: 2 Mg(NO 3)2 = 2 Mg. O + 4 NO 2 + O 2
 Химические свойства оксидов металлов II группы Mg. O (аморф) + 2 HCl = Mg. Cl 2 + H 2 O Са. О + Н 2 О = Са(ОН)2 Са. О + СО 2 = Са. СО 3 Са. О + 2 НCl = Ca. Cl 2 + H 2 O t Сa. O + Al 2 O 3 = Ca(Al. O 2)2 Ca. O + Fe 2 O 3 = Ca(Fe. O 2)2
Химические свойства оксидов металлов II группы Mg. O (аморф) + 2 HCl = Mg. Cl 2 + H 2 O Са. О + Н 2 О = Са(ОН)2 Са. О + СО 2 = Са. СО 3 Са. О + 2 НCl = Ca. Cl 2 + H 2 O t Сa. O + Al 2 O 3 = Ca(Al. O 2)2 Ca. O + Fe 2 O 3 = Ca(Fe. O 2)2
 Пероксиды, надпероксиды Сильные окислители: 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 → 5 O 2 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O Na 2 О 2 + 2 Н 2 О = 2 Na. OН+ H 2 О 2 К 2 О 4 + 2 Н 2 О = КOН+ H 2 О 2 + О 2 Применение: 2 Na 2 О 2 + 2 СО 2 = 2 Na 2 СО 3+ О 2 4 КО 2 + 2 СО 2 = 2 К 2 СО 3+ 3 О 2
Пероксиды, надпероксиды Сильные окислители: 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 → 5 O 2 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O Na 2 О 2 + 2 Н 2 О = 2 Na. OН+ H 2 О 2 К 2 О 4 + 2 Н 2 О = КOН+ H 2 О 2 + О 2 Применение: 2 Na 2 О 2 + 2 СО 2 = 2 Na 2 СО 3+ О 2 4 КО 2 + 2 СО 2 = 2 К 2 СО 3+ 3 О 2
 Реакция с водой M (тв) M+(водн) + e. H 2 O (ж) + e- OH-(водн) + ½ H 2 Реакционная способность по отношению к воде возрастает сверху вниз в группах. Представители 1 А группы активнее реагируют с водой по сравнению с металлами 2 А группы. Ве с трудом реагирует даже с паром (Be и Mg образуют оксиды, остальные гидроксиды): H 2 O (г) + Be Be. O (тв) + H 2 Na + H 2 O = Na. OH + H 2
Реакция с водой M (тв) M+(водн) + e. H 2 O (ж) + e- OH-(водн) + ½ H 2 Реакционная способность по отношению к воде возрастает сверху вниз в группах. Представители 1 А группы активнее реагируют с водой по сравнению с металлами 2 А группы. Ве с трудом реагирует даже с паром (Be и Mg образуют оксиды, остальные гидроксиды): H 2 O (г) + Be Be. O (тв) + H 2 Na + H 2 O = Na. OH + H 2
 Химические свойства оснований Na. OH + HCl = Na. Cl + H 2 O 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O KOH + NH 4 Cl = KCl + NH 3 + H 2 O 2 KOH + Fe. SO 4 = Fe(OH)2 + K 2 SO 4 Al. Cl 3 + 3 Na. OH = Al(OH)3↓ + 3 Na. Cl Al(OH)3 + Na. OH = Na[Al(OH)4]
Химические свойства оснований Na. OH + HCl = Na. Cl + H 2 O 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O KOH + NH 4 Cl = KCl + NH 3 + H 2 O 2 KOH + Fe. SO 4 = Fe(OH)2 + K 2 SO 4 Al. Cl 3 + 3 Na. OH = Al(OH)3↓ + 3 Na. Cl Al(OH)3 + Na. OH = Na[Al(OH)4]
 В щелочах растворяются некоторые неметаллы и амфотерные металлы: 2 KOH + Cl 2 = KCl + KCl. O + H 2 O 6 KOH + 3 S = 2 H 2 S + K 2 SO 3 + 3 H 2 O 3 KOH + 4 P + 3 H 2 O = PH 3 + 3 KH 2 PO 2 Si + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 2 H 2 Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2 t 2 Al + 2 Na. OH + 2 H 2 O = 2 Na. Al. O 2 + 3 H 2
В щелочах растворяются некоторые неметаллы и амфотерные металлы: 2 KOH + Cl 2 = KCl + KCl. O + H 2 O 6 KOH + 3 S = 2 H 2 S + K 2 SO 3 + 3 H 2 O 3 KOH + 4 P + 3 H 2 O = PH 3 + 3 KH 2 PO 2 Si + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 2 H 2 Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2 t 2 Al + 2 Na. OH + 2 H 2 O = 2 Na. Al. O 2 + 3 H 2
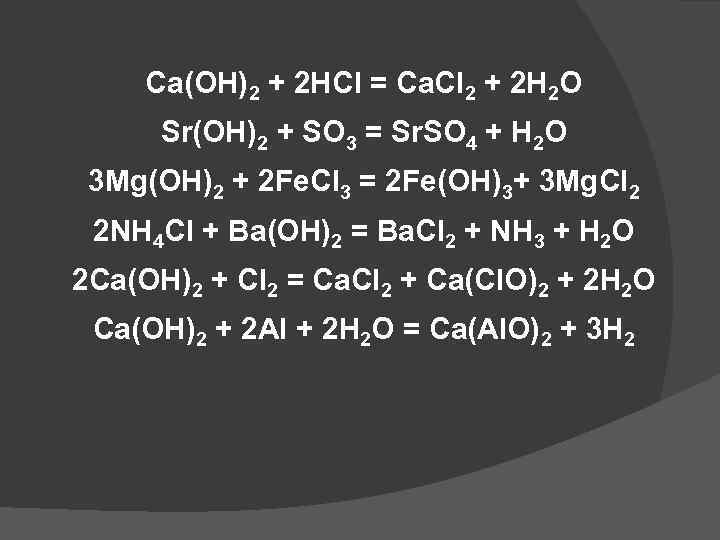 Са(ОН)2 + 2 HCl = Ca. Cl 2 + 2 H 2 O Sr(OH)2 + SO 3 = Sr. SO 4 + H 2 O 3 Mg(OH)2 + 2 Fe. Cl 3 = 2 Fe(OH)3+ 3 Mg. Cl 2 2 NH 4 Cl + Ba(OH)2 = Ba. Cl 2 + NH 3 + H 2 O 2 Са(ОН)2 + Сl 2 = Ca. Cl 2 + Ca(Cl. O)2 + 2 H 2 O Са(ОН)2 + 2 Al + 2 H 2 O = Ca(Al. O)2 + 3 H 2
Са(ОН)2 + 2 HCl = Ca. Cl 2 + 2 H 2 O Sr(OH)2 + SO 3 = Sr. SO 4 + H 2 O 3 Mg(OH)2 + 2 Fe. Cl 3 = 2 Fe(OH)3+ 3 Mg. Cl 2 2 NH 4 Cl + Ba(OH)2 = Ba. Cl 2 + NH 3 + H 2 O 2 Са(ОН)2 + Сl 2 = Ca. Cl 2 + Ca(Cl. O)2 + 2 H 2 O Са(ОН)2 + 2 Al + 2 H 2 O = Ca(Al. O)2 + 3 H 2
 Реакция с водородом Все s-элементы за исключением Be непосредственно реагируют с водородом: 2 Na + H 2 2 Na. H Ca + H 2 Ca. H 2 Be(CH 3)2 Be. H 2 + C 2 H 6 Реакционная способность увеличивается сверху вниз по группам. Только в Be. H 2 и Mg. H 2 ковалентная связь, в остальных - ионная.
Реакция с водородом Все s-элементы за исключением Be непосредственно реагируют с водородом: 2 Na + H 2 2 Na. H Ca + H 2 Ca. H 2 Be(CH 3)2 Be. H 2 + C 2 H 6 Реакционная способность увеличивается сверху вниз по группам. Только в Be. H 2 и Mg. H 2 ковалентная связь, в остальных - ионная.
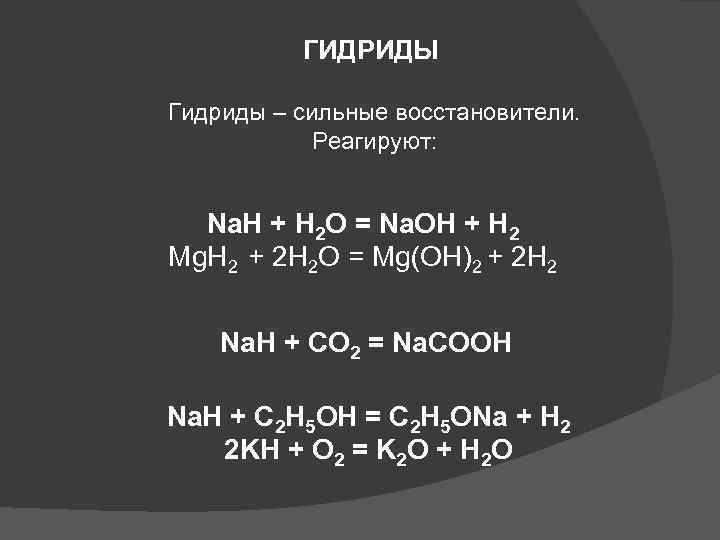 ГИДРИДЫ Гидриды – сильные восстановители. Реагируют: Na. H + H 2 O = Na. OH + H 2 Mg. H 2 + 2 H 2 O = Mg(OH)2 + 2 H 2 Na. H + CO 2 = Na. COOH Na. H + C 2 H 5 OH = C 2 H 5 ONa + H 2 2 KH + O 2 = K 2 O + H 2 O
ГИДРИДЫ Гидриды – сильные восстановители. Реагируют: Na. H + H 2 O = Na. OH + H 2 Mg. H 2 + 2 H 2 O = Mg(OH)2 + 2 H 2 Na. H + CO 2 = Na. COOH Na. H + C 2 H 5 OH = C 2 H 5 ONa + H 2 2 KH + O 2 = K 2 O + H 2 O
 Взаимодействие с галогенами. Щелочные металлы сгорают в атмосфере хлора и фтора и легко соединяются с бромом или иодом при обычной температуре. 2 Na + Cl 2 = 2 Na. Cl 2 K + Br 2 = 2 KBr
Взаимодействие с галогенами. Щелочные металлы сгорают в атмосфере хлора и фтора и легко соединяются с бромом или иодом при обычной температуре. 2 Na + Cl 2 = 2 Na. Cl 2 K + Br 2 = 2 KBr
 Взаимодействие с другими неметаллами Щелочные металлы непосредственно соединяются с серой, фосфором, а при нагревании – с азотом и углеродом. 2 Na + S = Na 2 S 3 K + P = K 3 P 6 Na + N 2 = 2 Na 3 N 2 Na + 2 C = Na 2 C 2 Нитриды, фосфиды, гидролизуются: карбиды нестойкие Li 3 N + 3 H 2 O = 3 Li. OH + NH 3 Na 2 C 2 + 2 H 2 O = 2 Na. OH + C 2 H 2 и легко
Взаимодействие с другими неметаллами Щелочные металлы непосредственно соединяются с серой, фосфором, а при нагревании – с азотом и углеродом. 2 Na + S = Na 2 S 3 K + P = K 3 P 6 Na + N 2 = 2 Na 3 N 2 Na + 2 C = Na 2 C 2 Нитриды, фосфиды, гидролизуются: карбиды нестойкие Li 3 N + 3 H 2 O = 3 Li. OH + NH 3 Na 2 C 2 + 2 H 2 O = 2 Na. OH + C 2 H 2 и легко
 Щелочные металлы растворяются в кислотахнеокислителях вытесняя водород и в кислотахокислителях, глубоко восстанавливая их: 2 Na + H 3 PO 4 = Na 2 HPO 4 + H 2 2 Na + H 2 SO 4(р) = Na 2 SO 4 + H 2 10 Na + 12 HNO 3(р) = 10 Na. NO 3 + N 2 + 6 H 2 O 8 Na + 5 H 2 SO 4 (к) = 4 Na 2 SO 4 + H 2 S + 4 H 2 O
Щелочные металлы растворяются в кислотахнеокислителях вытесняя водород и в кислотахокислителях, глубоко восстанавливая их: 2 Na + H 3 PO 4 = Na 2 HPO 4 + H 2 2 Na + H 2 SO 4(р) = Na 2 SO 4 + H 2 10 Na + 12 HNO 3(р) = 10 Na. NO 3 + N 2 + 6 H 2 O 8 Na + 5 H 2 SO 4 (к) = 4 Na 2 SO 4 + H 2 S + 4 H 2 O
 Щелочные металлы вытесняют из расплавов солей или оксидов менее активные металлы: t Mg. Cl 2 + 2 Na = Mg + 2 Na. Cl t Al 2 O 3 + 6 Na = 2 Al + 3 Na 2 O
Щелочные металлы вытесняют из расплавов солей или оксидов менее активные металлы: t Mg. Cl 2 + 2 Na = Mg + 2 Na. Cl t Al 2 O 3 + 6 Na = 2 Al + 3 Na 2 O
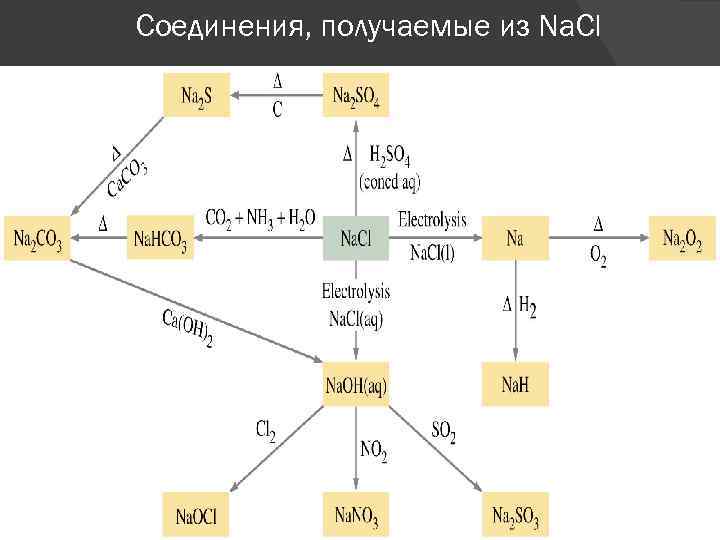
 Соли лития, натрия и калия Практически все соли легкорастворимы (труднорастворимыми солями являются: перхлорат калия - KCl. O 4, фторид лития – Li. F, фосфат лития – Li 3 PO 4, силикат лития - Li 2 Si. O 3. Хлорид натрия - приправа к пище, сырье для получения многих неорганических соединений, в том числе, соды.
Соли лития, натрия и калия Практически все соли легкорастворимы (труднорастворимыми солями являются: перхлорат калия - KCl. O 4, фторид лития – Li. F, фосфат лития – Li 3 PO 4, силикат лития - Li 2 Si. O 3. Хлорид натрия - приправа к пище, сырье для получения многих неорганических соединений, в том числе, соды.
 Соединения, получаемые из Na. Cl
Соединения, получаемые из Na. Cl
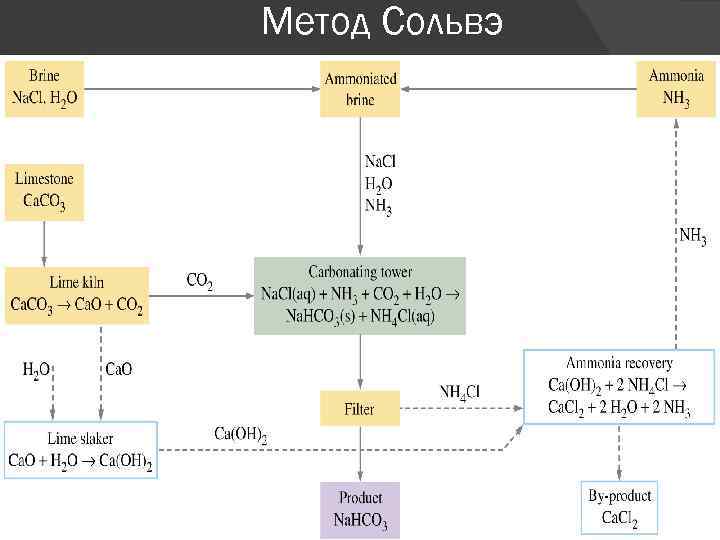 Метод Сольвэ
Метод Сольвэ


 Сульфат натрия - Na 2 SO 4 и его кристаллическая соль Na 2 SO 4 × 10 H 2 O применяют в производстве стекла и соды, в медицине как слабительное. Соли калия более дорогие, чем соли натрия и используются как удобрение, т. к. доступного для растений калия в почве недостаточно (неионообменный калий связан в силикатах и алюмосиликатах).
Сульфат натрия - Na 2 SO 4 и его кристаллическая соль Na 2 SO 4 × 10 H 2 O применяют в производстве стекла и соды, в медицине как слабительное. Соли калия более дорогие, чем соли натрия и используются как удобрение, т. к. доступного для растений калия в почве недостаточно (неионообменный калий связан в силикатах и алюмосиликатах).
 Применяются следующие калийные удобрения: 1. Сырые соли - используют в размолотом виде - сильвинит KCl × Na. Cl, каинит Mg. SO 4 × KCl × 3 H 2 O, карналлит Mg. Cl 2 × KCl × 6 H 2 O и другие. 2. Концентрированные соли, получают переработкой сырых солей. Наиболее часто используют хлорид или сульфат калия, а также нитрат калия (калийную селитру). 3. Древесная и торфяная зола - содержит поташ (К 2 СО 3).
Применяются следующие калийные удобрения: 1. Сырые соли - используют в размолотом виде - сильвинит KCl × Na. Cl, каинит Mg. SO 4 × KCl × 3 H 2 O, карналлит Mg. Cl 2 × KCl × 6 H 2 O и другие. 2. Концентрированные соли, получают переработкой сырых солей. Наиболее часто используют хлорид или сульфат калия, а также нитрат калия (калийную селитру). 3. Древесная и торфяная зола - содержит поташ (К 2 СО 3).
 Соли: Сульфаты – существуют в виде кристаллгидратов: - эпсомит (горькая соль) - Mg. SO 4∙ 7 H 2 O - гипс - Ca. SO 4∙ 2 H 2 O При нагревании до 120 о. С гипс частично теряет воду и превращается в 2 Ca. SO 4∙H 2 O. Быстро затвердевает в результате протекания реакции: 2 Ca. SO 4∙H 2 O + 3 H 2 O = 2 Ca. SO 4∙ 2 H 2 O Сульфат кальция – малорастворимая соль, сульфат магния легко растворяется в воде. При 1100 о. С сульфаты разлагаются: 2 Mg. SO 4 = 2 Mg. O + 2 SO 2 + O 2
Соли: Сульфаты – существуют в виде кристаллгидратов: - эпсомит (горькая соль) - Mg. SO 4∙ 7 H 2 O - гипс - Ca. SO 4∙ 2 H 2 O При нагревании до 120 о. С гипс частично теряет воду и превращается в 2 Ca. SO 4∙H 2 O. Быстро затвердевает в результате протекания реакции: 2 Ca. SO 4∙H 2 O + 3 H 2 O = 2 Ca. SO 4∙ 2 H 2 O Сульфат кальция – малорастворимая соль, сульфат магния легко растворяется в воде. При 1100 о. С сульфаты разлагаются: 2 Mg. SO 4 = 2 Mg. O + 2 SO 2 + O 2
 Карбонаты – труднорастворимые соединения. При прокаливании с углем карбонаты щелочноземельных металлов образуют карбиды, которые представляют собой соединения нестехиометрического состава, т. е. не отвечающие правилу формальной валентности: Ca. CO 3 + 3 C = Ca. C 2 + CO 2 При взаимодействии Ca. C 2 с водой получается ацетилен: Ca. C 2 + 2 H 2 O = Ca(OH)2 + C 2 H 2 При обжиге карбонатов образуются оксиды: Ca. CO 3 = Ca. O + CO 2
Карбонаты – труднорастворимые соединения. При прокаливании с углем карбонаты щелочноземельных металлов образуют карбиды, которые представляют собой соединения нестехиометрического состава, т. е. не отвечающие правилу формальной валентности: Ca. CO 3 + 3 C = Ca. C 2 + CO 2 При взаимодействии Ca. C 2 с водой получается ацетилен: Ca. C 2 + 2 H 2 O = Ca(OH)2 + C 2 H 2 При обжиге карбонатов образуются оксиды: Ca. CO 3 = Ca. O + CO 2
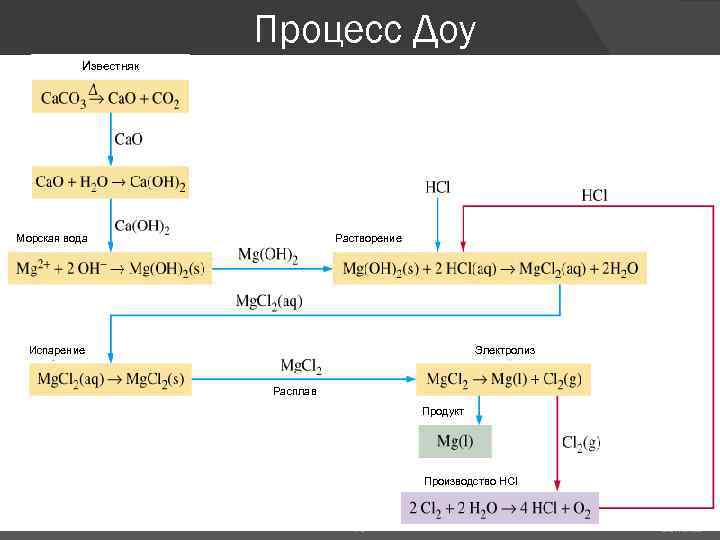 Процесс Доу Известняк Морская вода Растворение Электролиз Испарение Расплав Продукт Производство HCl 78 EOS Chapter 20: s-Block Elements
Процесс Доу Известняк Морская вода Растворение Электролиз Испарение Расплав Продукт Производство HCl 78 EOS Chapter 20: s-Block Elements
 Жесткость воды Обусловлена присутствием в воде катионов Ca+2 и Mg+2. Суммарная молярная концентрация эквивалентов катионов Ca+2 и Mg+2 называется общей жесткостью. Она складывается из карбонатной (временная) и некарбонатной (постоянная). Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбонатов кальция и магния. Способы ее устранения основаны на выводе катионов Ca 2+ и Mg 2+ из воды в виде нерастворимых солей: - кипячение (используется в быту): Ca(HCO 3)2 = Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 = Mg(OH)2 + 2 CO 2
Жесткость воды Обусловлена присутствием в воде катионов Ca+2 и Mg+2. Суммарная молярная концентрация эквивалентов катионов Ca+2 и Mg+2 называется общей жесткостью. Она складывается из карбонатной (временная) и некарбонатной (постоянная). Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбонатов кальция и магния. Способы ее устранения основаны на выводе катионов Ca 2+ и Mg 2+ из воды в виде нерастворимых солей: - кипячение (используется в быту): Ca(HCO 3)2 = Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 = Mg(OH)2 + 2 CO 2
 - действие известкового молока Ca(OH)2 или соды Na 2 CO 3 (используется в промышленности): Ca(HCO 3)2 + Ca(OH)2 = 2 Ca. CO 3 + 2 H 2 O Ca(HCO 3)2 + Na 2 CO 3 = Ca. CO 3 + 2 Na. HCO 3 Mg(HCO 3)2 + Ca(OH)2 = Mg(OH)2 + Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 + Na 2 CO 3 = Mg. CO 3 + 2 Na. HCO 3 Некарбонатная, или постоянная, жесткость обусловлена присутствием сульфатов, хлоридов, нитратов и фосфатов кальция и магния. Постоянная жесткость при кипячении воды не устраняется. Ее устраняют добавлением соды или фосфата натрия: Ca. SO 4 + Na 2 CO 3 = Ca. CO 3 + Na 2 SO 4 3 Ca. SO 4 + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 3 Na 2 SO 4
- действие известкового молока Ca(OH)2 или соды Na 2 CO 3 (используется в промышленности): Ca(HCO 3)2 + Ca(OH)2 = 2 Ca. CO 3 + 2 H 2 O Ca(HCO 3)2 + Na 2 CO 3 = Ca. CO 3 + 2 Na. HCO 3 Mg(HCO 3)2 + Ca(OH)2 = Mg(OH)2 + Ca. CO 3 + CO 2 + H 2 O Mg(HCO 3)2 + Na 2 CO 3 = Mg. CO 3 + 2 Na. HCO 3 Некарбонатная, или постоянная, жесткость обусловлена присутствием сульфатов, хлоридов, нитратов и фосфатов кальция и магния. Постоянная жесткость при кипячении воды не устраняется. Ее устраняют добавлением соды или фосфата натрия: Ca. SO 4 + Na 2 CO 3 = Ca. CO 3 + Na 2 SO 4 3 Ca. SO 4 + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 3 Na 2 SO 4
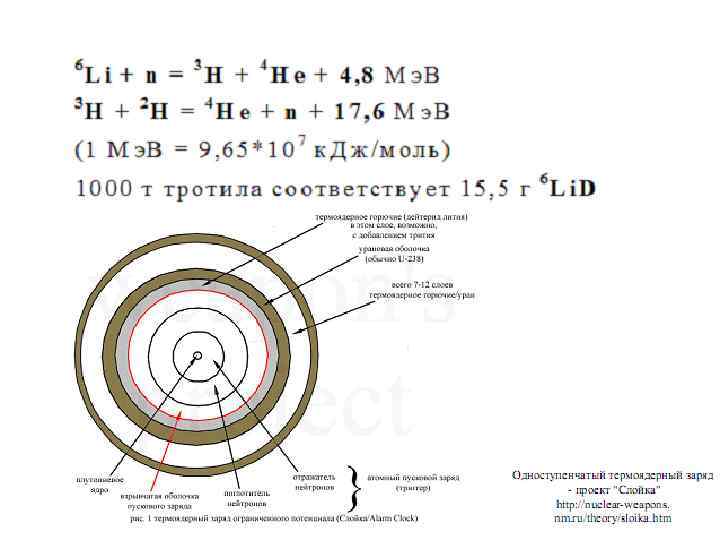
 Появление термоядерного оружия стало возможным только благодаря разновидности гидрида лития — дейтериду лития-6. Это соединение тяжёлого изотопа водорода — дейтерия и изотопа лития с массовым числом 6. Дейтерид лития-6 — твёрдое вещество, которое позволяет хранить дейтерий (обычное состояние которого в нормальных условиях — газ) при плюсовых температурах, и, кроме того, второй его компонент — литий 6 — это сырьё для получения самого дефицитного изотопа водорода — трития. Собственно, 6 Li — единственный промышленный источник получения трития.
Появление термоядерного оружия стало возможным только благодаря разновидности гидрида лития — дейтериду лития-6. Это соединение тяжёлого изотопа водорода — дейтерия и изотопа лития с массовым числом 6. Дейтерид лития-6 — твёрдое вещество, которое позволяет хранить дейтерий (обычное состояние которого в нормальных условиях — газ) при плюсовых температурах, и, кроме того, второй его компонент — литий 6 — это сырьё для получения самого дефицитного изотопа водорода — трития. Собственно, 6 Li — единственный промышленный источник получения трития.
 Гидрид лития
Гидрид лития

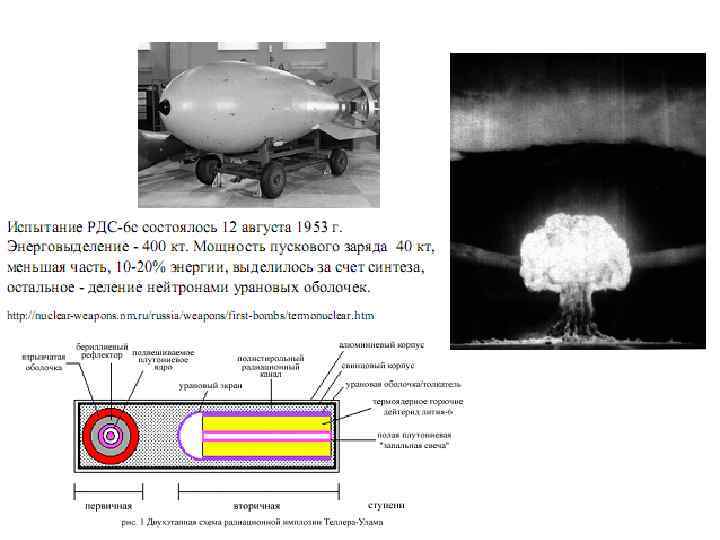

 Для того, чтобы создать необходимые для начала термоядерной реакции нейтроны и температуру (порядка 50 млн градусов), в водородной бомбе сначала взрывается небольшая по мощности атомная бомба. Образуется тритий, идет термоядерная реакция, которая и даёт основное выделение энергии при взрыве водородной (термоядерной) бомбы. Если корпус бомбы изготовлен из природного урана, то быстрые нейтроны (уносящие 70 % энергии, выделяющейся при реакции вызывают в нём новую цепную неуправляемую реакцию деления. Возникает третья фаза взрыва водородной бомбы.
Для того, чтобы создать необходимые для начала термоядерной реакции нейтроны и температуру (порядка 50 млн градусов), в водородной бомбе сначала взрывается небольшая по мощности атомная бомба. Образуется тритий, идет термоядерная реакция, которая и даёт основное выделение энергии при взрыве водородной (термоядерной) бомбы. Если корпус бомбы изготовлен из природного урана, то быстрые нейтроны (уносящие 70 % энергии, выделяющейся при реакции вызывают в нём новую цепную неуправляемую реакцию деления. Возникает третья фаза взрыва водородной бомбы.
 A Боеголовка перед взрывом. B Взрывчатое вещество подрывает первую ступень, сжимая ядро плутония до сверхкритического состояния и инициируя цепную реакцию расщепления. C Происходит импульс рентгеновского излучения, который распространяется вдоль внутренней части оболочки. D Вторая ступень сжимается под воздействием рентгеновского излучения, плутониевый стержень внутри второй ступени переходит в сверхкритическое состояние, инициируя цепную реакцию, выделяя огромное количество тепла. E В сжатом и разогретом дейтериде лития-6 происходит реакция слияния. Огненный шар расширяется…
A Боеголовка перед взрывом. B Взрывчатое вещество подрывает первую ступень, сжимая ядро плутония до сверхкритического состояния и инициируя цепную реакцию расщепления. C Происходит импульс рентгеновского излучения, который распространяется вдоль внутренней части оболочки. D Вторая ступень сжимается под воздействием рентгеновского излучения, плутониевый стержень внутри второй ступени переходит в сверхкритическое состояние, инициируя цепную реакцию, выделяя огромное количество тепла. E В сжатом и разогретом дейтериде лития-6 происходит реакция слияния. Огненный шар расширяется…
 Андрей Дмитриевич Сахаров (1921 -1989) Советский физиктеоретик, академик АН СССР, доктор физикоматематических наук (1953), лауреат Нобелевской премии мира (1975).
Андрей Дмитриевич Сахаров (1921 -1989) Советский физиктеоретик, академик АН СССР, доктор физикоматематических наук (1953), лауреат Нобелевской премии мира (1975).
 Виталий Лазаревич Гинзбург (1916 -2009) Советский и российский физик-теоретик, академик АН СССР и РАН, доктор физикоматематических наук (1942), лауреат Нобелевской премии по физике (2003).
Виталий Лазаревич Гинзбург (1916 -2009) Советский и российский физик-теоретик, академик АН СССР и РАН, доктор физикоматематических наук (1942), лауреат Нобелевской премии по физике (2003).
 Лев Андреевич Арцимович (1909 -1973) Советский физик, академик АН СССР. Под руководством Арцимовича впервые в мире в лабораторных условиях осуществлена термоядерная реакция. «Наука — лучший способ удовлетворения личного любопытства за государственный счёт» .
Лев Андреевич Арцимович (1909 -1973) Советский физик, академик АН СССР. Под руководством Арцимовича впервые в мире в лабораторных условиях осуществлена термоядерная реакция. «Наука — лучший способ удовлетворения личного любопытства за государственный счёт» .


