MedChem_2-2.ppt
- Количество слайдов: 18
 РОЗЧИНИ ЕЛЕКТРОЛІТІВ. ЕЛЕКТРОЛІТИ В ОРГАНІЗМІ ЛЮДИНИ
РОЗЧИНИ ЕЛЕКТРОЛІТІВ. ЕЛЕКТРОЛІТИ В ОРГАНІЗМІ ЛЮДИНИ
 Електрохімія 1 Електрохімія - розділ хімічної науки, в якому розглядаються області поділу фаз при протіканні через них електричного струму, досліджуються процеси в провідниках (у т. ч. йонних провідниках – електролітах) та на електродах. Електрохімія досліджує процеси окислення і відновлення, що протікають на просторово розділених електродах внаслідок перенесення йонів та електронів. Пряме перенесення заряду з молекули на молекулу в електрохімії не розглядається. • • • Прикладна електрохімія: хімічні джерела струму; гальванопластика; електрохімічне виробництво та виробництво електричних плат тощо. Медико-біологічне значення електрохімічних процесів: мембранні процеси, обумовлені різницею потенціалів. Негативний електрохімічний процес: корозія.
Електрохімія 1 Електрохімія - розділ хімічної науки, в якому розглядаються області поділу фаз при протіканні через них електричного струму, досліджуються процеси в провідниках (у т. ч. йонних провідниках – електролітах) та на електродах. Електрохімія досліджує процеси окислення і відновлення, що протікають на просторово розділених електродах внаслідок перенесення йонів та електронів. Пряме перенесення заряду з молекули на молекулу в електрохімії не розглядається. • • • Прикладна електрохімія: хімічні джерела струму; гальванопластика; електрохімічне виробництво та виробництво електричних плат тощо. Медико-біологічне значення електрохімічних процесів: мембранні процеси, обумовлені різницею потенціалів. Негативний електрохімічний процес: корозія.
 Історія електрохімії 2 1791 - Л. Гальвані встановив, що, коли торкатися м’яза жаби з’єднаними між собою мідною та залізною деталлю, м’яз скорочується; та пояснив це «тваринною електрикою» . А. Вольта дав інше пояснення: скорочення м’язу відбувалось внаслідок електричного процесу на поверхні металів. 1800 – «Вольтів стовп» , перше хімічне джерело струму, послідовно з’єднані елементи із мідної та цинкової пластин зі змоченою електролітом тканиною між ними. 1800 – електролітичний розклад води. 1807 – добування калію шляхом електролізу розплаву КОН (Х. Деві). 1833 – М. Фарадей встановив основні закони електрохімії та розробив її термінологію.
Історія електрохімії 2 1791 - Л. Гальвані встановив, що, коли торкатися м’яза жаби з’єднаними між собою мідною та залізною деталлю, м’яз скорочується; та пояснив це «тваринною електрикою» . А. Вольта дав інше пояснення: скорочення м’язу відбувалось внаслідок електричного процесу на поверхні металів. 1800 – «Вольтів стовп» , перше хімічне джерело струму, послідовно з’єднані елементи із мідної та цинкової пластин зі змоченою електролітом тканиною між ними. 1800 – електролітичний розклад води. 1807 – добування калію шляхом електролізу розплаву КОН (Х. Деві). 1833 – М. Фарадей встановив основні закони електрохімії та розробив її термінологію.
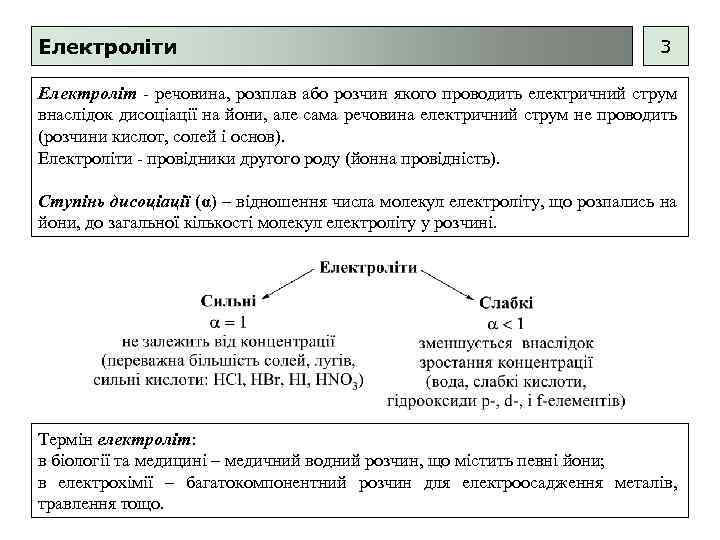 Електроліти 3 Електроліт - речовина, розплав або розчин якого проводить електричний струм внаслідок дисоціації на йони, але сама речовина електричний струм не проводить (розчини кислот, солей і основ). Електроліти - провідники другого роду (йонна провідність). Ступінь дисоціації (α) – відношення числа молекул електроліту, що розпались на йони, до загальної кількості молекул електроліту у розчині. Термін електроліт: в біології та медицині – медичний водний розчин, що містить певні йони; в електрохімії – багатокомпонентний розчин для електроосадження металів, травлення тощо.
Електроліти 3 Електроліт - речовина, розплав або розчин якого проводить електричний струм внаслідок дисоціації на йони, але сама речовина електричний струм не проводить (розчини кислот, солей і основ). Електроліти - провідники другого роду (йонна провідність). Ступінь дисоціації (α) – відношення числа молекул електроліту, що розпались на йони, до загальної кількості молекул електроліту у розчині. Термін електроліт: в біології та медицині – медичний водний розчин, що містить певні йони; в електрохімії – багатокомпонентний розчин для електроосадження металів, травлення тощо.
 Електроліти в живому організмі 4 Основні катіони органіму: Na+, K+, Ca 2+, Mg 2+; аніони: Cl-, CO 32 -, PO 43 -, аніони органічних кислот. Роль електролітів в живому організмі: відповідають за осмос, тобто за транспорт води між тканинами; визначають р. Н біологічних рідин; беруть участь у метаболічних процесах (активація ферментів тощо); забезпечують різницю потенціалів на мембранах, стінках судин, можливість передачі електронного імпульсу.
Електроліти в живому організмі 4 Основні катіони органіму: Na+, K+, Ca 2+, Mg 2+; аніони: Cl-, CO 32 -, PO 43 -, аніони органічних кислот. Роль електролітів в живому організмі: відповідають за осмос, тобто за транспорт води між тканинами; визначають р. Н біологічних рідин; беруть участь у метаболічних процесах (активація ферментів тощо); забезпечують різницю потенціалів на мембранах, стінках судин, можливість передачі електронного імпульсу.
 Електропровідність 5 Питома електропровідність (κ) – міра здатності речовини проводити електричний струм, величина, обернена питомому опору. Вимірюється в Ом-1 м-1. Молярна (еквівалентна) електропровідність ( ) – електропровідність 1 н розчину електроліту. У дуже розведених розчинах (гранично розведених) еквівалентна електропровідність (λ 0) є постійною характеристикою розчину, залежною лише від кількості заряджених частинок - йонів. Область граничного розведення – 0, 0001 н (з невеликою похибкою можна вважати межею граничного розведення концентрацію 0, 001 н). Зменшення електропровідності концентрованих розчинів відбувається через взаємодію аніону та катіону між собою (утворення т. з. зв’язаних електронних пар).
Електропровідність 5 Питома електропровідність (κ) – міра здатності речовини проводити електричний струм, величина, обернена питомому опору. Вимірюється в Ом-1 м-1. Молярна (еквівалентна) електропровідність ( ) – електропровідність 1 н розчину електроліту. У дуже розведених розчинах (гранично розведених) еквівалентна електропровідність (λ 0) є постійною характеристикою розчину, залежною лише від кількості заряджених частинок - йонів. Область граничного розведення – 0, 0001 н (з невеликою похибкою можна вважати межею граничного розведення концентрацію 0, 001 н). Зменшення електропровідності концентрованих розчинів відбувається через взаємодію аніону та катіону між собою (утворення т. з. зв’язаних електронних пар).
 Електропровідність 6 Закон Кольрауша λ 0 = λ 0 + + λ 0 (закон незалежності руху йонів): Електропровідність розчину електроліту: κ = (λ 0+ + λ 0 -) С (не виконується для високих концентрацій)
Електропровідність 6 Закон Кольрауша λ 0 = λ 0 + + λ 0 (закон незалежності руху йонів): Електропровідність розчину електроліту: κ = (λ 0+ + λ 0 -) С (не виконується для високих концентрацій)
 Електрохімічна комірка, електроди 7 Електроди: електрод І роду – метал, занурений у розчин солі, що містить йони цього металу електрод ІІ роду – метал та кристали малорозчинної солі цього металу, занурені у розчин солі, що містить йони цього металу газовий електрод – пластинка інертного металу, що омивається газом. Газ на пластинці утворює йони, які входять до складу розчину
Електрохімічна комірка, електроди 7 Електроди: електрод І роду – метал, занурений у розчин солі, що містить йони цього металу електрод ІІ роду – метал та кристали малорозчинної солі цього металу, занурені у розчин солі, що містить йони цього металу газовий електрод – пластинка інертного металу, що омивається газом. Газ на пластинці утворює йони, які входять до складу розчину
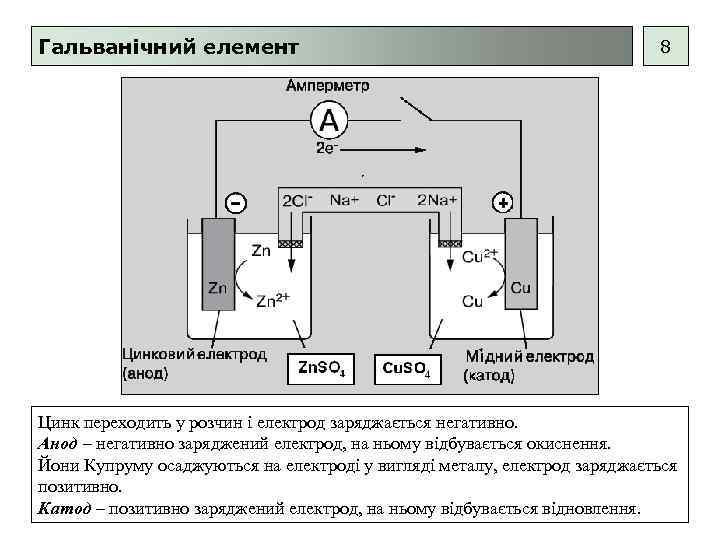 Гальванічний елемент 8 Цинк переходить у розчин і електрод заряджається негативно. Анод – негативно заряджений електрод, на ньому відбувається окиснення. Йони Купруму осаджуються на електроді у вигляді металу, електрод заряджається позитивно. Катод – позитивно заряджений електрод, на ньому відбувається відновлення.
Гальванічний елемент 8 Цинк переходить у розчин і електрод заряджається негативно. Анод – негативно заряджений електрод, на ньому відбувається окиснення. Йони Купруму осаджуються на електроді у вигляді металу, електрод заряджається позитивно. Катод – позитивно заряджений електрод, на ньому відбувається відновлення.
 Електродний потенціал 9 Електродний потенціал (Е, ) – різниця потенціалів між електродом та розчином, що містить його йони. ЕРС (електрорушійна сила електролітичної комірки) (Е) – різниця потенціалів аноду та катоду (домовились розташовувати комірку так, що струм проходить зліва на право). Стандартний електродний потенціал – електродний потенціал, виміряний за стандартних умов: температура – 298 К (25 о. С); концентрація йону – 1 моль/л; тиск (для газоподібних речовин) – 1, 03 105 Па (1 атм). Напрямок окисно-відновних реакцій – окисником буде та сполука, потенціал відновлення якої більший.
Електродний потенціал 9 Електродний потенціал (Е, ) – різниця потенціалів між електродом та розчином, що містить його йони. ЕРС (електрорушійна сила електролітичної комірки) (Е) – різниця потенціалів аноду та катоду (домовились розташовувати комірку так, що струм проходить зліва на право). Стандартний електродний потенціал – електродний потенціал, виміряний за стандартних умов: температура – 298 К (25 о. С); концентрація йону – 1 моль/л; тиск (для газоподібних речовин) – 1, 03 105 Па (1 атм). Напрямок окисно-відновних реакцій – окисником буде та сполука, потенціал відновлення якої більший.
 Стандартні електроди (електроди порівняння) 10 Електродний потенціал визначають відносно електрода, потенцал якого прийнято за стандарт.
Стандартні електроди (електроди порівняння) 10 Електродний потенціал визначають відносно електрода, потенцал якого прийнято за стандарт.
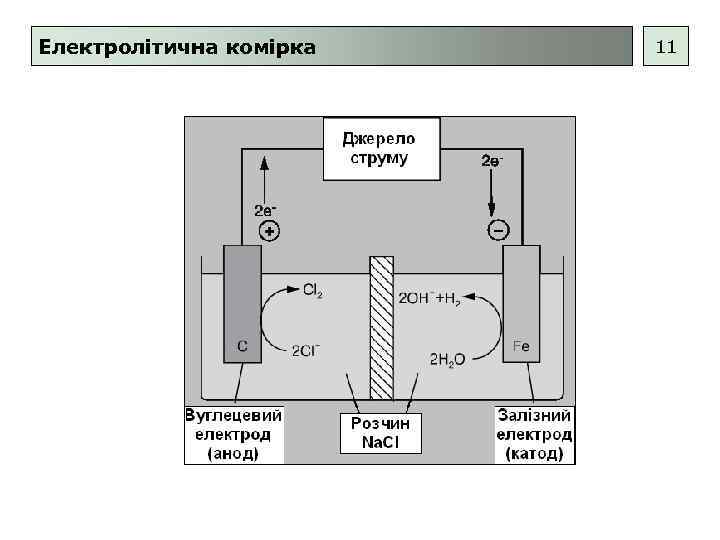 Електролітична комірка 11
Електролітична комірка 11
 Свинцевий акумулятор 12
Свинцевий акумулятор 12
 Залежність електродного потенціалу від температури та концентрації йонів 13
Залежність електродного потенціалу від температури та концентрації йонів 13
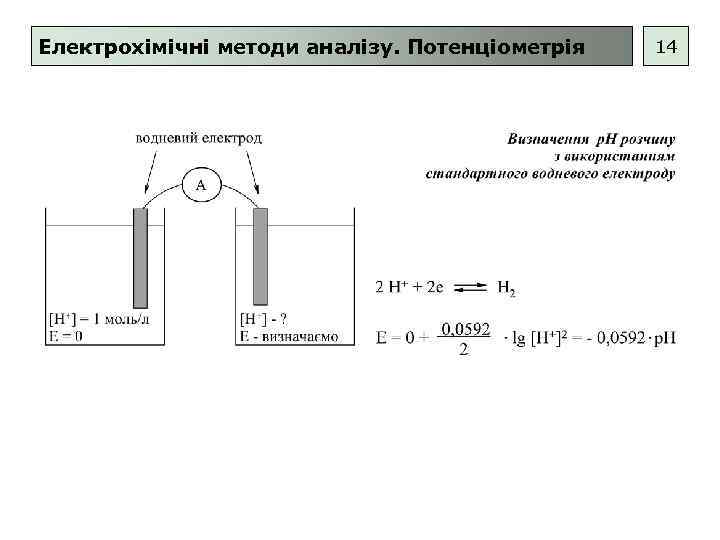 Електрохімічні методи аналізу. Потенціометрія 14
Електрохімічні методи аналізу. Потенціометрія 14
 Йонселективні електроди 15 Йонселективні електроди – електроди, що дозволяють селективно визначати певний йон у розчині та складаються із: • електроду порівняння (найчастіше, хлорсрібного), у розчині, який містить йони, що ми визначаємо; • мембрани, що пропускає до електрода лише ті йони, які визначаємо. Види мембран для йонселективних електродів: • металічні (Ag); • тверді неметалічні (La. F 3, Ag 2 S); • рідкі органічні мембрани (утримуються навколо електрода за допомогою напівпроникних плівок); • скляні. Переваги йонселективних електродів: дозволяють визначити певний йон в середовищі, що містить інші йони (наприклад, йон Са 2+ у крові).
Йонселективні електроди 15 Йонселективні електроди – електроди, що дозволяють селективно визначати певний йон у розчині та складаються із: • електроду порівняння (найчастіше, хлорсрібного), у розчині, який містить йони, що ми визначаємо; • мембрани, що пропускає до електрода лише ті йони, які визначаємо. Види мембран для йонселективних електродів: • металічні (Ag); • тверді неметалічні (La. F 3, Ag 2 S); • рідкі органічні мембрани (утримуються навколо електрода за допомогою напівпроникних плівок); • скляні. Переваги йонселективних електродів: дозволяють визначити певний йон в середовищі, що містить інші йони (наприклад, йон Са 2+ у крові).
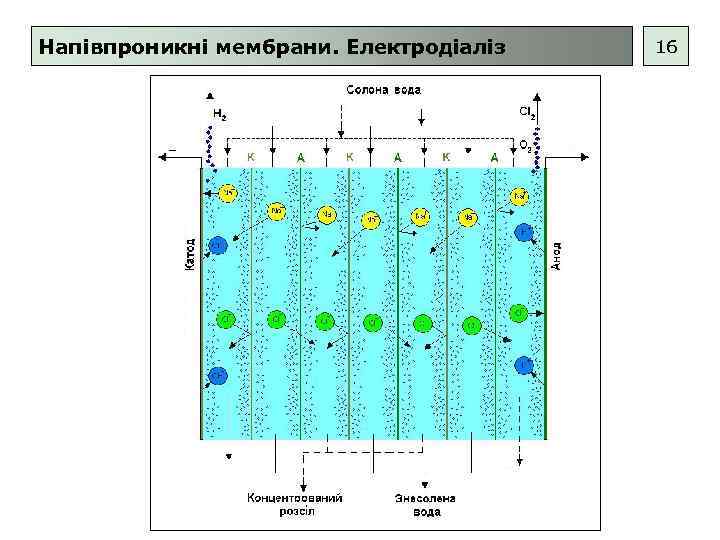 Напівпроникні мембрани. Електродіаліз 16
Напівпроникні мембрани. Електродіаліз 16
 Дифузні та мембранні потенціали 17 Дифузний потенціал – виникає в місці контакту електролітів різного якісного чи (та) кількісного складу. Причина: різна рухливість йонів. Дифузний потенціал значно зростає, якщо між розчинами електролітів встановлена напівпроникна мембрана, що пропускає лише певні йони. Ефект Донана – нерівномірний розподіл електролітів між клітинами та живлячим їх розчином.
Дифузні та мембранні потенціали 17 Дифузний потенціал – виникає в місці контакту електролітів різного якісного чи (та) кількісного складу. Причина: різна рухливість йонів. Дифузний потенціал значно зростає, якщо між розчинами електролітів встановлена напівпроникна мембрана, що пропускає лише певні йони. Ефект Донана – нерівномірний розподіл електролітів між клітинами та живлячим їх розчином.


