10-Роль железа в биологических процессах (53).ppt
- Количество слайдов: 55

Роль железа в биологических системах

Использование железа в биосистемах включает: (1 ) Обратимое связывание, транспорт и сохранение кислорода - гемоглобин и миоглобин - гемэритрин (2 ) Обратимый перенос электронов - железо-серные белки - цитохромы a, b, c - цитохром с оксидаза (3 ) Функционирование активных центров редокс-ферментов -окисление биомолекул (цитохромы P 450, пероксидазы) - разложение активных метаболитов кислорода (АМК, ROS) (каталаза, супероксиддисмутаза) -образование активных метаболитов кислорода (оксидаза фагоцитов) -образование реакционноспособных азотсодержащих частиц (NO-синтаза)

Основные характеристики железа в биосистемах (1 ) степени окисления: +2, Fe(II) +3, Fe(III) +4, Fe(IV) (2 ) типы геометрии: тетраэдр октаэдр (3 ) кинетическая лабильность обратимое связывание различных лигандов Fe + O 2 → Fe…. . O 2 → Fe + O 2 (4 ) термодинамическая стабильность комплексов (5 ) регулирование свойств комплексов железа путем изменения белкового окружения (атомов лигандов)

Две наиболее распространенные Fe-содержащие простетические группы S Fe Гем Fe кубан (Fe 4 S 4) Железо-серные кластеры • железо в окружении • железо координирует сульфид, S 2 - порфиринового лиганда • белок поставляет 1 или 2 донорных атома для координации в аксиальных положениях • каждый атом Fe находится в тетраэдрическом окружениии • белок поставляет остатки цистеина Cys для завершения координационного окружения • типы кластеров: Fe, Fe 2 S 2, Fe 3 S 4 и Fe 4 S 4

Железо в организме человека • Металл, наиболее распространенный в живых организмах • 70% общего содержания железа приходится на гемоглобин, oдин из наиболее распространенных протеинов в организме • При недостатке железа возникают патологии (например, анемия) • При избытке железа возникают патологии (например, окислительный стресс)

КРОВЬ Красные кровяные тельца (эритроциты) Белые кровяные тельца (лейкоциты) Кровяные пластинки (тромбоциты)

ТРАНСПОРТ И СОХРАНЕНИЕ ЖЕЛЕЗА Ферритин (Ferritin) и трансферрин (Transferrin) (транспорт и сохранение Fe у млекопитающих) Сидерофоры (Siderophores) (транспорт Fe в бактериях)
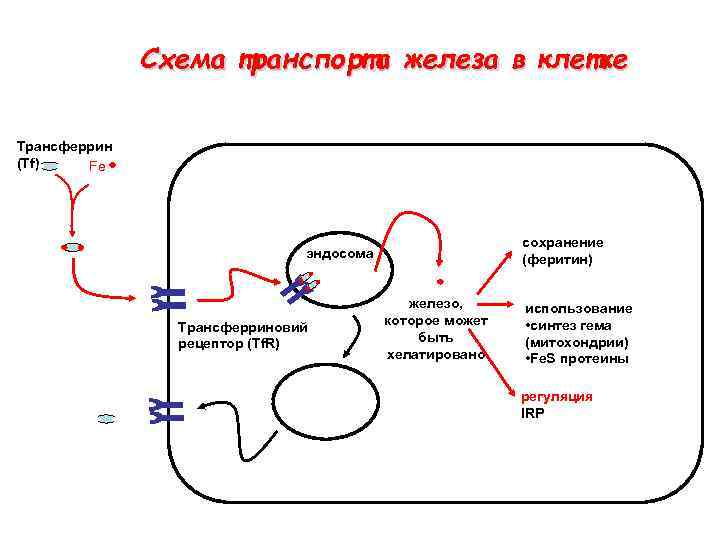
Схема транспорта железа в клетке Tрансферрин (Tf) Fe сохранение (феритин) эндосома Tрансферриновий рецептор (Tf. R) железо, которое может быть хелатировано использование • синтез гема (митохондрии) • Fe. S протеины регуляция IRP

Tрансферрин • Важнейший железо-транспортный белок у млекопитающих • M = 80 k. Da • Два домена • ~ 1020 • Перенос двух Fe(III) катионов • Важно наличие противоиона (аниона)

Tрансферрин в организме человека PDB code: 1 D 3 K HUMAN TRANSFERRIN

Конформационные изменения в трансферрине при связывании Fe(III) + 2 Fe(III) апотрансферрин Fe-трансферрин

Aктивный центр Fe(III)-трансферрина Asp 63 Карбонат-ион Протеин обеспечивает 4 донорных атома: • 3 О (2 Tyr, 1 Asp) • 1 N (His) His 249 Два донорных атома предоставляет карбонат: • 2 О Fe Tyr 188 Tyr 95 КЧ Fe(III) = 6 октаэдрическая геометрия искажена Связывание карбоната и Fe(III) является синэргическим процессом, т. е. связывание одного промотирует связывание другого


Связывание Fe и бикарбонат-иона является кооперативным процессом CO 32 - Fe Лактоферрин — Полифункциональный белок из семейства трансферринов Лактоферрин один из компонентов иммунной системы организма.

ЦИКЛ ТРАНСФЕРРИНА Diferric transferrin binds to the transferrin receptor expressed on the cellular surface. Clathrin facilitates endocytosis of the pit, forming an endosome. Transferrin, while remaining bound to the receptor, releases the iron upon acidification of the endosome. Ferrous ion leaves the endosome via a metal transporter (DMT 1). The endosome is exocytosed, and the apo-transferrin is released


Взаимодействие Fe-Tf с трансферриновым рецептором (Tf. R) Для удаления Fe(III) необходим ATФ – для понижения р. Н внутреннего пространства эндосомы (при связывании Н+) Tf и Tf. R рециклизуются после удаления Fe(III) переходит в ферритин для сохранения Открытый вопрос: Как железо «уходит» из эндосом?

Транспорт и накопление железа в клетке

Ферритин LIP – labile iron pool (лабильный пул железа)

Ферритин - важнейший железосберегающий белок • ~175 аминокислотных остатков (20 k. Da) • Структура - 4 -спиральный узел • Известны две модификации, которые отличаются по размеру (H и L) * В органах млекопитающих железо запасается в двух формах – ферритине и гемосидерине. Гемосидерин изучен не достаточно хорошо и, возможно, является продуктом распада ферритина.

24 субъединиц ферритина • структура как апельсин: протеин – шкурка, железо - центр • может связывать до 4500 ионов Fe(III) (около 1 атома на 1 аминокислотный остаток) 6 из 24 субъодиниц

Ферритин (Ferritin)
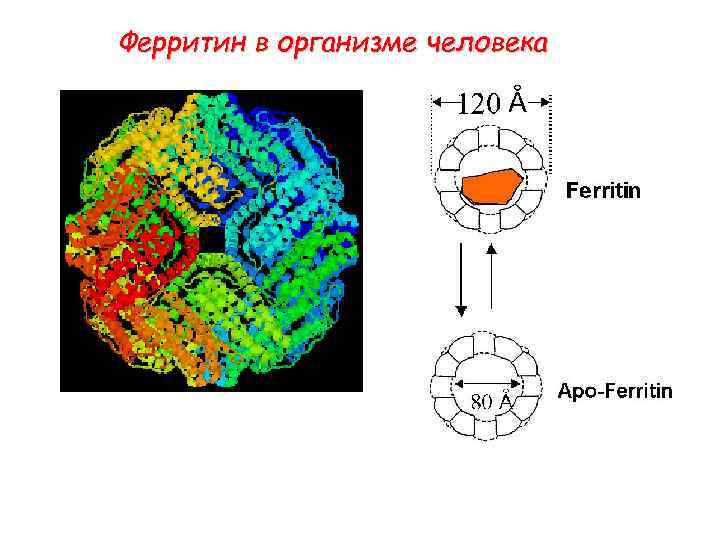
Ферритин в организме человека




“железное ядро” ферритина - полиядерний оксо-кластер Лиганды: (-OH), (O 2 -) КЧ = 6 Октаэдрическое окружение каждого иона Fe(III) Некоторые лиганды – мостиковые O Fe 3+ Модельный комплекс, подобный ядру ферритина

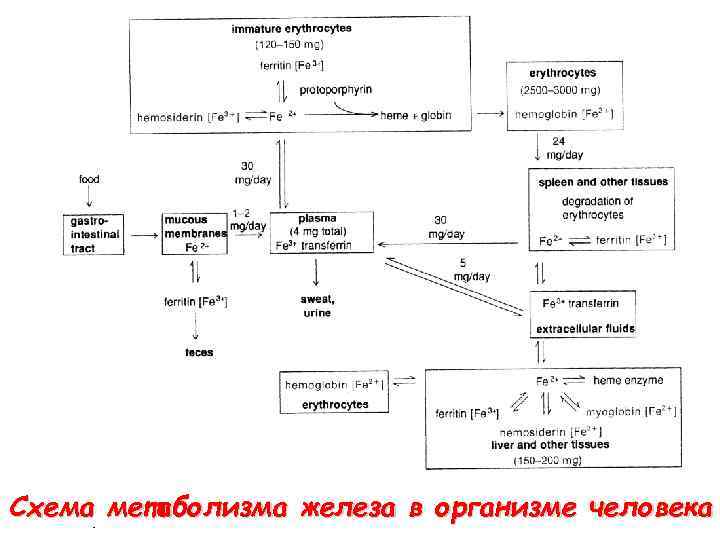
Схема метаболизма железа в организме человека

Транспорт железа у микробов Проблема: железо присутствует везде, но не в растворах ! [O 2] Fe (II) (растворимо) Fe(III) (малорастворимо) p. Ka Fe 3+ + H 2 O Fe(OH)2+ +H+ 2. 2 Fe(OH)2+ + H 2 O Fe(OH)2+ +H+ 3. 5 Fe(OH)2+ + H 2 O Fe(OH)3 +H+ 6. 0 Осаждается при физиологических значениях p. H

Как проблему недостатка железа решают микробы Использование низкомолекулярных, ультра-высокоэффективных хелатирующих агентов для Fe(III) - сидерофоров Типы лигандов: пирокатехины гидроксамовые кислоты a-гидроксикислоты секреция, связывание Fe, извлечение Fe

Захват Fe 3+-содержащего сидерофора в грамм-отрицательных бактериях рецептор внешней мембраны внешняя мембрана периплазмат периплазма транспортный протеин Ton. B Exb. D внутренняя мембрана рецептор внутренней мембраны ATФP-зависимый активный транспорт ATP Цитоплазма ADP + Pi Exb. B Ton. B /Exb. B/ Exb. D комплекс связывает перемещение протона вдоль внутренней мембраны с конформационным изменением в рецепторе внешней мембраны

Свойства сидерофоров (1) Малые молекулы (≤ 1 к. Да) небелковой природы, но могут быть производными аминокислот энтеробактин (2) Высокоселективны по отношению к Fe(III) (3) Исключительно высокое сродство к Fe(III) ( ~ 1025) (4) Функционируют по принципу хелатного эффекта каждая молекула сидерофора содержит 6 донорных атомов для связывания железа (набор 3 пар) каждая пара донорных атомов образует устойчивый 5 -членный хелатный цикл трансферрин


Функциональные группы для связвания Fe в сидерофорах: катехолаты, гидроксаматы, карбоксилаты

Сидерофоры гидроксаматного типа гидроксамовая кислота гидроксамат +H+ • гидроксаматная группа предоставляет два донорных атома • 3 гидроксаматных группы найдены в природных сидерофорах

Строение Fe(III)-содержащего феррихрома О О N Fe О О О N
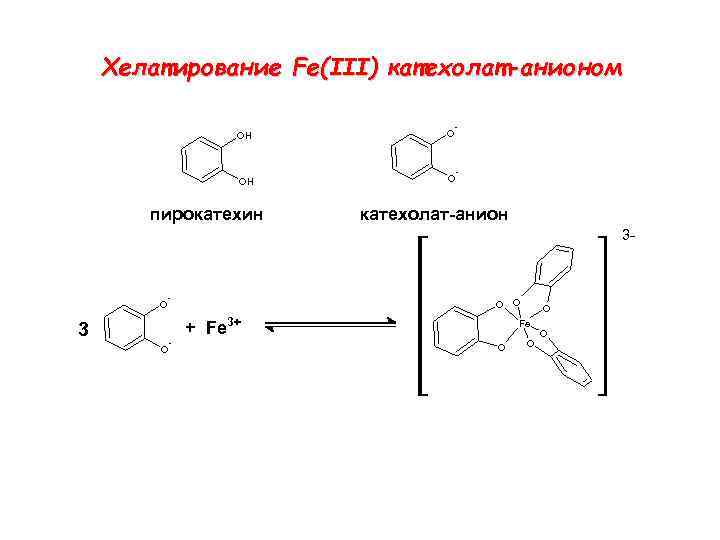
Хелатирование Fe(III) катехолат-анионом - OH O пирокатехин - катехолат-анион 3 - O O + Fe 3+ 3 O - O Fe O O O

Энтеробактин, катехол-содержащий сидерофор

O - - O O HN O O O - Fe O O - O NH NH O Fe(III) O O -

Схема АТФ-зависимого проникновения энтеробактина через клеточную мембрану с участием специфичного белка-рецептора

Рецептор феррихрома E. coli со связанным сидерофором

Как железо извлекается из сидерофоров? O Возможный путь 1: восстановление Fe(III) дo Fe(II) - O O HN O O O - C O O O - NH - C O NH O O O - O Возможный путь 2: гидролиз эфирных групп сидерофора -

Модельные соединения

Модельные соединения The complex is a Δ isomer

Модельные соединения Fe(III) – ent has a Δ configuration (by analogy with crystallized vanadium complex, and spectroscopically characterized, kinetically inert Cr(III) complex)

Транспорт сидерофора

Fe. III(ent)/Fe. II(ent): E = -0. 75 V No common biological reducing agent is thermodynamically competent to reduce Fe. III(ent)! (Partial) hydrolysis of enterobactin must occur for intracellular iron release Fe. Ent is a substrate for the cytoplasmic esterase, which is even more effective in hydrolyzing the free enterobactin than the Fe. Ent complex

K. N. Raymond et al. 3584– 3588 PNAS April 1, 2003 vol. 100 no. 7 A pictorial scheme shows the transmembrane topology of the Fe. Ent uptake proteins and how they function. In an iron-deficient state, iron receptors proliferate among the outer membrane (OM) proteins. Fep. A is a channel protein composed of a-barrel and an N-terminal gate protein (see Fig. 3). The Fep. A receptor is highly specific and recognizes the iron binding domain and amide linkage domains of Fe. Ent. The gating movement of Fep. A is transduced by the complex Ton. B–Exb. D, which is anchored in the cytoplamic membrane (CM). Fep. B delivers Fe. Ent to the cytoplasmic pores formed by Fep. D and Fep. G. It appears that the cytoplasmic ATPase, Fep. C, provides energy to assist the uptake through the inner membrane. Fe. Ent esterase, which is encoded by the fes gene, catalyzes hydrolytic cleavage of the backbone, leading to the intracellular release of iron.

Транспорт Fe(III) - энтеробактина Ribbon diagram of Fep. A. The extracellular space is located at the top of the figure, and the periplasmic space is at the bottom. The position of the membrane bilayer is delineated by horizontal lines, as determined from the hydrophobic area found on the molecular surface. The putative iron position of ferric enterobactin is indicated by the red sphere. Crystal structure of the outer membrane active transporter Fep. A from E. coli S. K. Buchanan et al. Nature Structural Biology 6, 56 - 63 (1999)

Siderophore-Mediated Iron Transport: Crystal Structure of Fhu. A with Bound Lipopolysaccharide Membrane protein Fhu. A with bound ferrichrome Ferrichrome binding is a two-step process, with hydrophobic interactions being important at the first step, and multiple H-bonding at the next step. Ferrichrome binding induces conformational changes in the protein (induced fit). Andrew D. Ferguson, Eckhard Hofmann, James W. Coulton, Kay Diederichs, Wolfram Welte. Science 1998, 283, 2215 -2220

Anomalous scattering difference Fourier map contoured Fe(III)-ent has a 3 -fold symmetry, but the binding site in the protein lacks any symmetry Crystal structure of the outer membrane active transporter Fep. A from Escherichia coli. Nature Structural Biology 6, 56 - 63 (1999) S. K. Buchanan, B. S. Smith, L. Venkatramani, Di Xia, L. Esser, M. Palnitkar, R. Chakraborty, D. van der Helm & Johann Deisenhofer

The first structure of a siderophore-binding periplasmic protein in its complex with the guest. Ga(III) was used in place of Fe because it is an anomalous scatterer for X-ray crystallography. Gallichrome binding is only 4 times weaker than ferrichrome binding Both hydrophobic interactions and H-bonding are important T. E. Clarke et al. Nature Struct. Biol. 2000, 7, 287 -291

Некоторые патогенные микрооганизмы могут использовать организм человека как удобный источник железа • Гем: источник железа для Yersinia pestis, Shigella dysenteriae, E. coli 0157, Vibrio cholerae • Гемоглобин, трансферрин и лактоферрин: источники железа для Hemophilus influenzae, Neisseria meningititis, N. gonorhoeae Plasmodium falciparum: возбудитель малярии: 120 000 заболеваний ежегодно 1 000 летальных исходов/год Красные: регионы распространения малярии

10-Роль железа в биологических процессах (53).ppt