 Роль воды в химических реакциях
Роль воды в химических реакциях
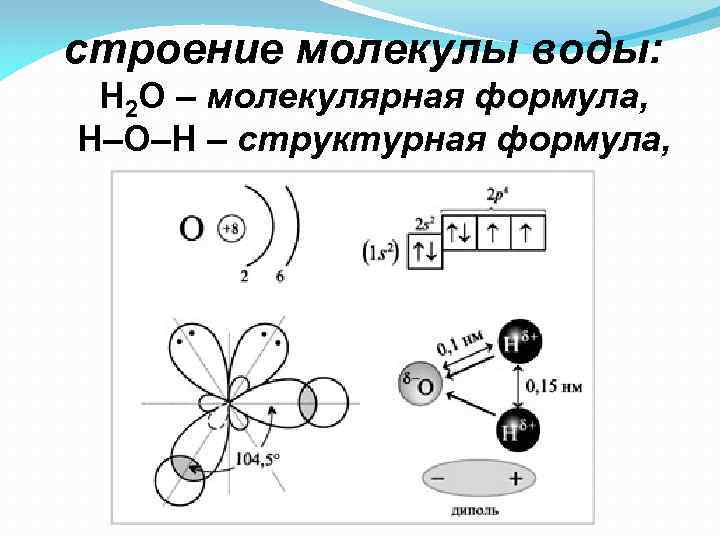 строение молекулы воды: Н 2 О – молекулярная формула, Н–О–Н – структурная формула,
строение молекулы воды: Н 2 О – молекулярная формула, Н–О–Н – структурная формула,
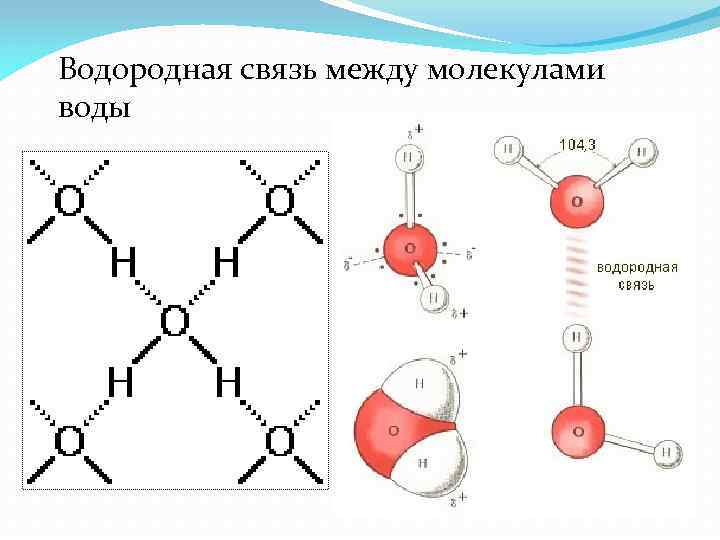 Водородная связь между молекулами воды
Водородная связь между молекулами воды
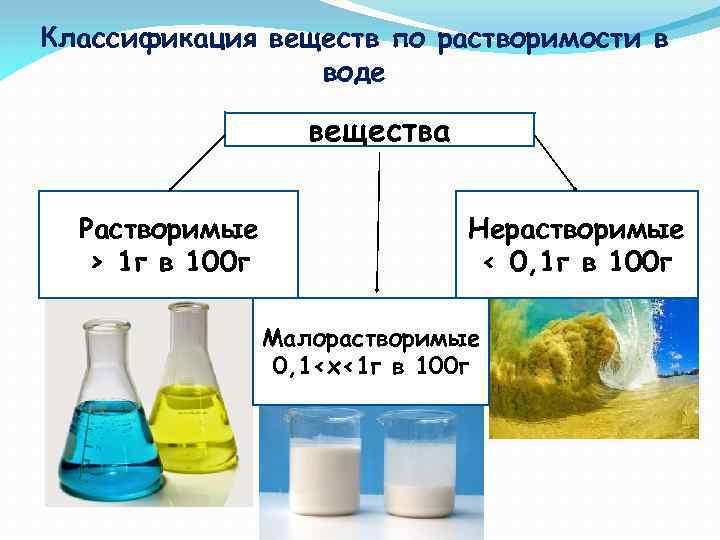 Классификация веществ по растворимости в воде вещества Растворимые > 1 г в 100 г Нерастворимые < 0, 1 г в 100 г Малорастворимые 0, 1
Классификация веществ по растворимости в воде вещества Растворимые > 1 г в 100 г Нерастворимые < 0, 1 г в 100 г Малорастворимые 0, 1
 Растворение Физическая теория Вант-Гофф Я. Х. Оствальд Вильгельм Аррениус С. А.
Растворение Физическая теория Вант-Гофф Я. Х. Оствальд Вильгельм Аррениус С. А.
 Химическая теория Д. И. Менделеев
Химическая теория Д. И. Менделеев
 Физико-химическая теория Каблуков И. А. Кистяковский В. А.
Физико-химическая теория Каблуков И. А. Кистяковский В. А.
 Физико–химическая теория растворов. Растворение – физико-химический процесс. Растворы – гомогенная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия (гидратов).
Физико–химическая теория растворов. Растворение – физико-химический процесс. Растворы – гомогенная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия (гидратов).
 Кристаллогидраты Cu. SO 4*5 H 2 O- медный купорос; Ca. SO 4*2 H 2 O –гипс; Na 2 CO 3*10 H 2 Oкристаллическая сода
Кристаллогидраты Cu. SO 4*5 H 2 O- медный купорос; Ca. SO 4*2 H 2 O –гипс; Na 2 CO 3*10 H 2 Oкристаллическая сода
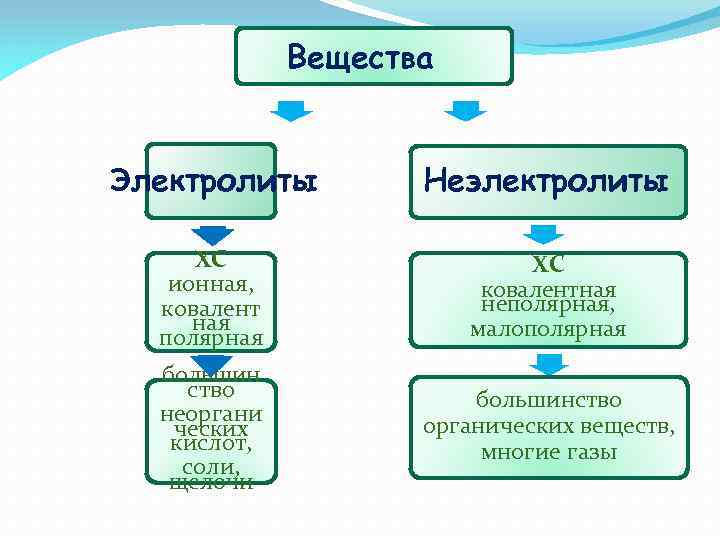 Вещества Электролиты Неэлектролиты ХС ионная, ковалент ная полярная ХС ковалентная неполярная, малополярная большин ство неоргани ческих кислот, соли, щелочи большинство органических веществ, многие газы
Вещества Электролиты Неэлектролиты ХС ионная, ковалент ная полярная ХС ковалентная неполярная, малополярная большин ство неоргани ческих кислот, соли, щелочи большинство органических веществ, многие газы
 Электролиты это вещества, растворы и расплавы которых проводят электрический ток. Кислоты: HCl; HNO 3; H 2 SO 4 Щелочи: Na. OH; KOH; Ba(OH)2 Na. Cl; Cu. SO 4; Al(NO 3)3 Соли:
Электролиты это вещества, растворы и расплавы которых проводят электрический ток. Кислоты: HCl; HNO 3; H 2 SO 4 Щелочи: Na. OH; KOH; Ba(OH)2 Na. Cl; Cu. SO 4; Al(NO 3)3 Соли:
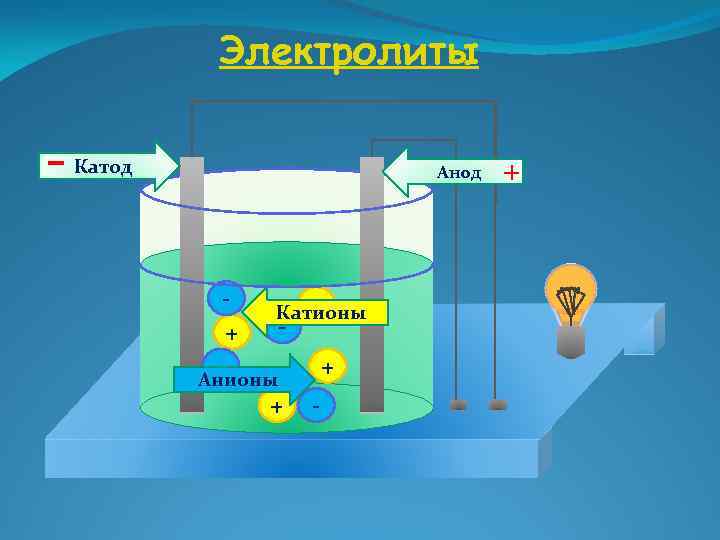 Электролиты - Катод Анод + - + Катионы - Анионы + + - +
Электролиты - Катод Анод + - + Катионы - Анионы + + - +
 Неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Органические вещества: сахар, ацетон, бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот и др.
Неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Органические вещества: сахар, ацетон, бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот и др.
 Неэлектролиты - Катод Анод +
Неэлектролиты - Катод Анод +
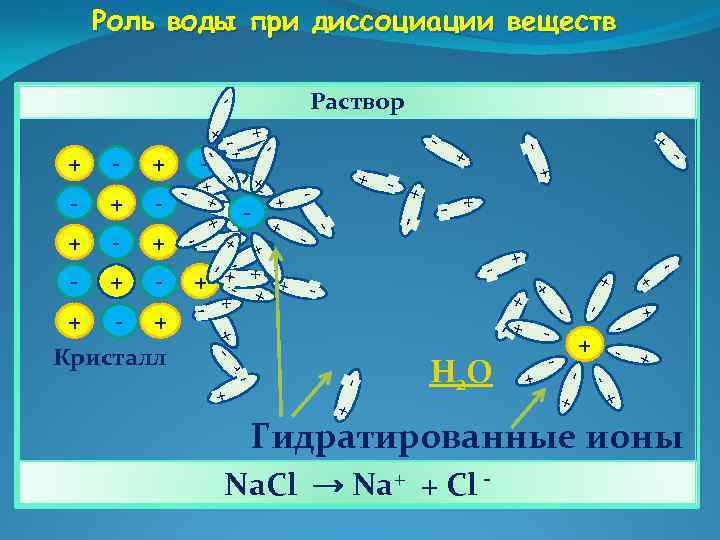 Роль воды при диссоциации веществ + + + - + - - - + + + - + Н 2 О - + + - + - - - + Кристалл + - - + + - + - -+ - + - - + + - - + - + + - + - - + + + - Раствор - . Гидратированные ионы Na. Cl → Na+ + Cl -
Роль воды при диссоциации веществ + + + - + - - - + + + - + Н 2 О - + + - + - - - + Кристалл + - - + + - + - -+ - + - - + + - - + - + + - + - - + + + - Раствор - . Гидратированные ионы Na. Cl → Na+ + Cl -
 Степень электролитической диссоциации (α) - отношение числа молей вещества, распавшегося на ионы, к общему количеству растворенного вещества. n α= N
Степень электролитической диссоциации (α) - отношение числа молей вещества, распавшегося на ионы, к общему количеству растворенного вещества. n α= N
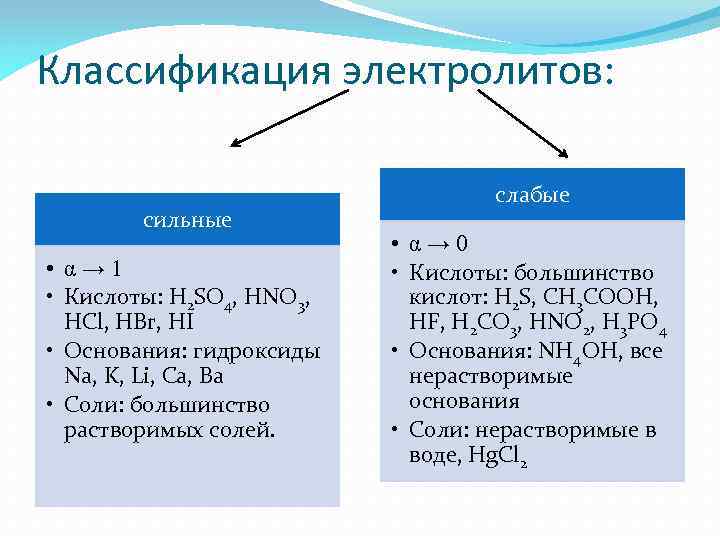 Классификация электролитов: сильные • α→ 1 • Кислоты: H 2 SO 4, HNO 3, HCl, HBr, HI • Основания: гидроксиды Na, K, Li, Ca, Ba • Соли: большинство растворимых солей. слабые • α→ 0 • Кислоты: большинство кислот: H 2 S, CH 3 COOH, HF, H 2 CO 3, HNO 2, H 3 PO 4 • Основания: NH 4 OH, все нерастворимые основания • Соли: нерастворимые в воде, Hg. Cl 2
Классификация электролитов: сильные • α→ 1 • Кислоты: H 2 SO 4, HNO 3, HCl, HBr, HI • Основания: гидроксиды Na, K, Li, Ca, Ba • Соли: большинство растворимых солей. слабые • α→ 0 • Кислоты: большинство кислот: H 2 S, CH 3 COOH, HF, H 2 CO 3, HNO 2, H 3 PO 4 • Основания: NH 4 OH, все нерастворимые основания • Соли: нерастворимые в воде, Hg. Cl 2
 Классификация электролитов по характеру образующихся при диссоциации ионов электролиты кислоты основания соли
Классификация электролитов по характеру образующихся при диссоциации ионов электролиты кислоты основания соли
 Запишите определения кислот, оснований и солей со стр. 147
Запишите определения кислот, оснований и солей со стр. 147
 Домашнее задание: § 17, № 10, с. 150
Домашнее задание: § 17, № 10, с. 150