 Роль воды в химических реакциях Автор : Масловская И. Е. , учитель химии
Роль воды в химических реакциях Автор : Масловская И. Е. , учитель химии
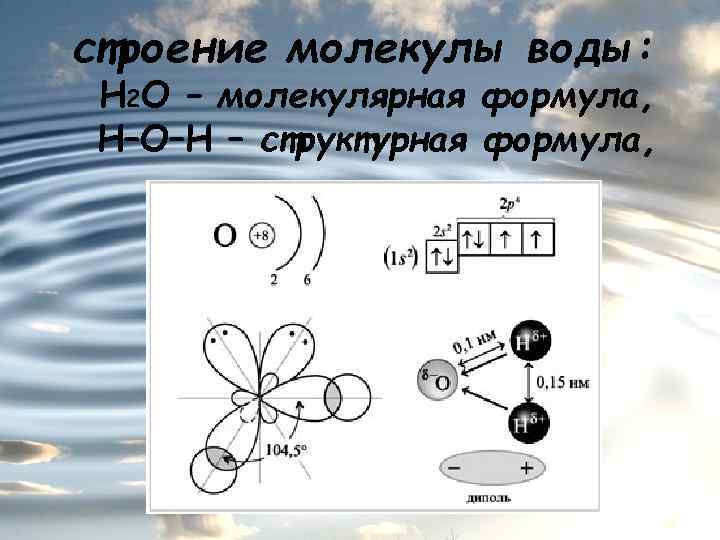 строение молекулы воды: Н 2 О – молекулярная формула, Н–О–Н – структурная формула,
строение молекулы воды: Н 2 О – молекулярная формула, Н–О–Н – структурная формула,
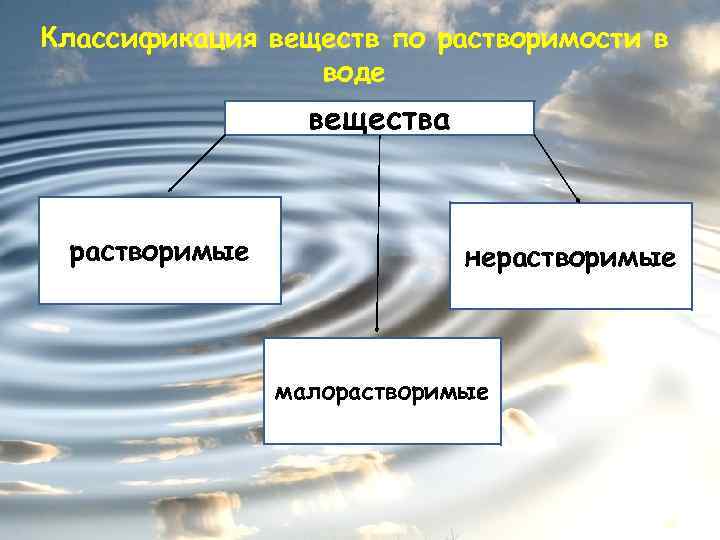 Классификация веществ по растворимости в воде вещества растворимые нерастворимые малорастворимые
Классификация веществ по растворимости в воде вещества растворимые нерастворимые малорастворимые
 Растворение Физическая теория Вант-Гофф Я. Х. Оствальд Вильгельм Аррениус С. А.
Растворение Физическая теория Вант-Гофф Я. Х. Оствальд Вильгельм Аррениус С. А.
 Химическая теория Д. И. Менделеев
Химическая теория Д. И. Менделеев
 Кристаллогидраты Cu. SO 4*5 H 2 O- медный купорос; Ca. SO 4*2 H 2 O –гипс; Na 2 CO 3*10 H 2 O- кристаллическая сода
Кристаллогидраты Cu. SO 4*5 H 2 O- медный купорос; Ca. SO 4*2 H 2 O –гипс; Na 2 CO 3*10 H 2 O- кристаллическая сода
 Каблуков И. А. Кистяковский В. А.
Каблуков И. А. Кистяковский В. А.
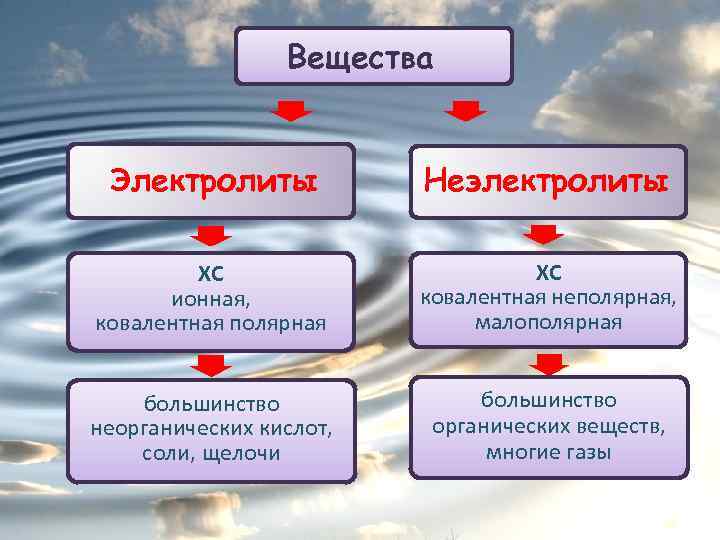 Вещества Электролиты Неэлектролиты ХС ионная, ковалентная полярная ХС ковалентная неполярная, малополярная большинство неорганических кислот, соли, щелочи большинство органических веществ, многие газы
Вещества Электролиты Неэлектролиты ХС ионная, ковалентная полярная ХС ковалентная неполярная, малополярная большинство неорганических кислот, соли, щелочи большинство органических веществ, многие газы
 Электролиты это вещества, растворы и расплавы которых проводят электрический ток. Кислоты: HCl; HNO 3; H 2 SO 4 Щелочи: Na. OH; KOH; Ba(OH)2 Na. Cl; Cu. SO 4; Al(NO 3)3 Соли:
Электролиты это вещества, растворы и расплавы которых проводят электрический ток. Кислоты: HCl; HNO 3; H 2 SO 4 Щелочи: Na. OH; KOH; Ba(OH)2 Na. Cl; Cu. SO 4; Al(NO 3)3 Соли:
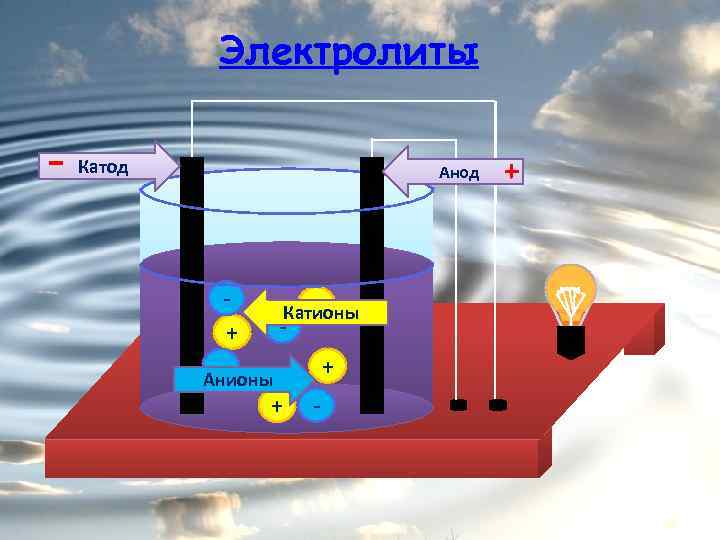 Электролиты - Катод Анод + - + Катионы - Анионы + + - +
Электролиты - Катод Анод + - + Катионы - Анионы + + - +
 Неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Органические вещества: сахар, ацетон, бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот и др.
Неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Органические вещества: сахар, ацетон, бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот и др.
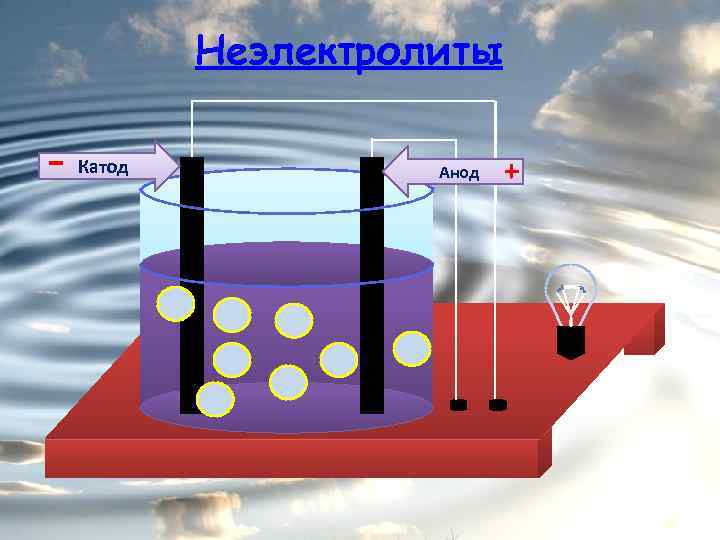 Неэлектролиты - Катод Анод +
Неэлектролиты - Катод Анод +
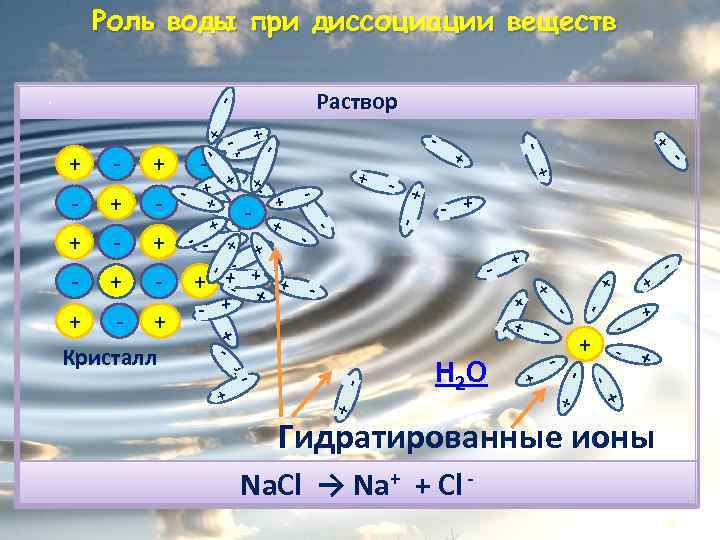 Роль воды при диссоциации веществ + + + - + - - + + + - - + + Н 2 О - + + - + - - - + Кристалл + - - + + + + - - - + + + - - + + - - Гидратированные ионы Na. Cl → Na+ + Cl - - + + - - - + - Раствор + . -
Роль воды при диссоциации веществ + + + - + - - + + + - - + + Н 2 О - + + - + - - - + Кристалл + - - + + + + - - - + + + - - + + - - Гидратированные ионы Na. Cl → Na+ + Cl - - + + - - - + - Раствор + . -
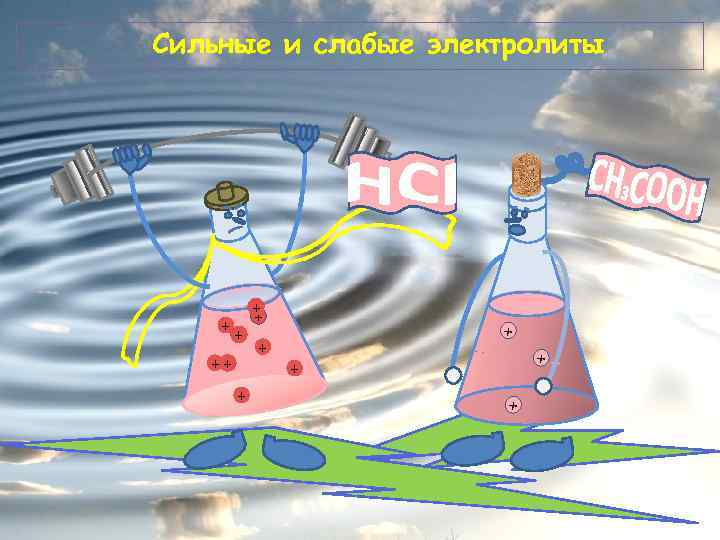 Сильные и слабые электролиты + + +
Сильные и слабые электролиты + + +
 Степень электролитической диссоциации (α) - отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. n α= N
Степень электролитической диссоциации (α) - отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. n α= N
 Классификация электролитов по характеру образующихся при диссоциации ионов электролиты кислоты основания соли
Классификация электролитов по характеру образующихся при диссоциации ионов электролиты кислоты основания соли
 Роль воды как транспортного средства Выделение растением капелек воды — гуттация — демонстрирует наличие корневого давления. системы водяного охлаждения, где хладагент (вода)
Роль воды как транспортного средства Выделение растением капелек воды — гуттация — демонстрирует наличие корневого давления. системы водяного охлаждения, где хладагент (вода)
 Вода как катализатор
Вода как катализатор