Роль лучевой терапии русский вариант.ppt
- Количество слайдов: 51

Роль лучевой терапии в лечении злокачественных новообразований. Методы лучевой терапии
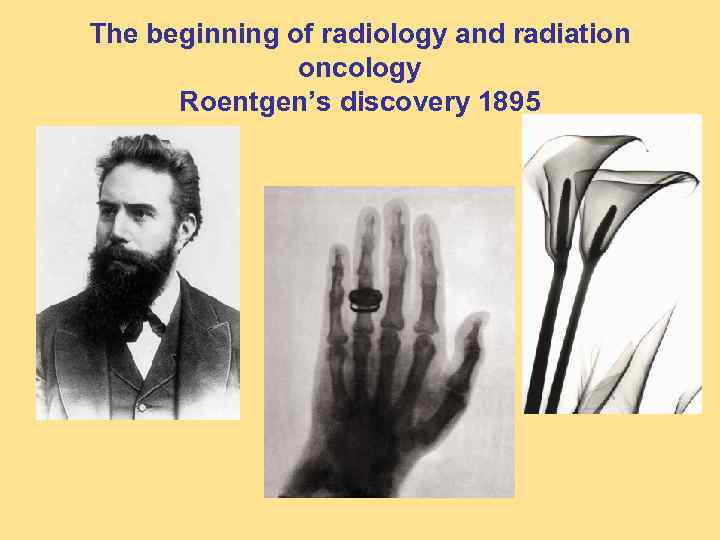
The beginning of radiology and radiation oncology Roentgen’s discovery 1895
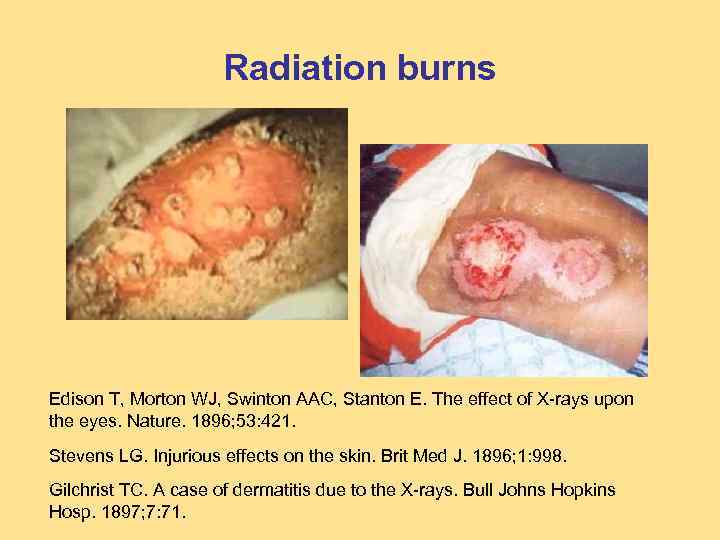
Radiation burns Edison T, Morton WJ, Swinton AAC, Stanton E. The effect of X-rays upon the eyes. Nature. 1896; 53: 421. Stevens LG. Injurious effects on the skin. Brit Med J. 1896; 1: 998. Gilchrist TC. A case of dermatitis due to the X-rays. Bull Johns Hopkins Hosp. 1897; 7: 71.

Leopold Freund, first successful X-ray therapy in 1896
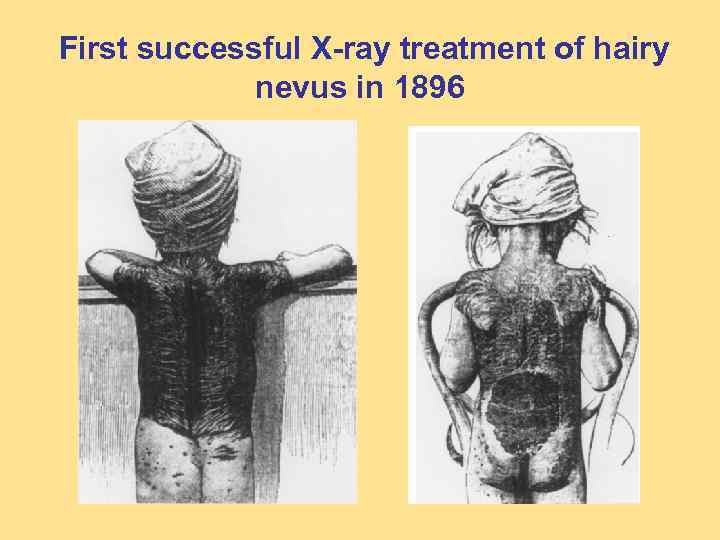
First successful X-ray treatment of hairy nevus in 1896
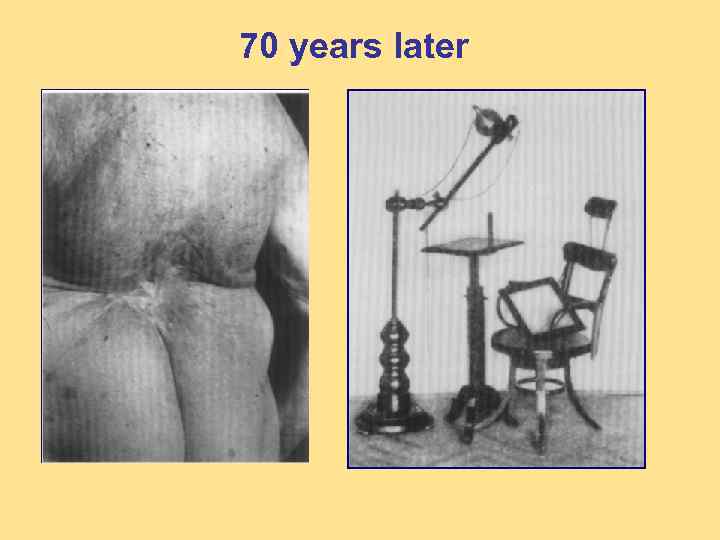
70 years later
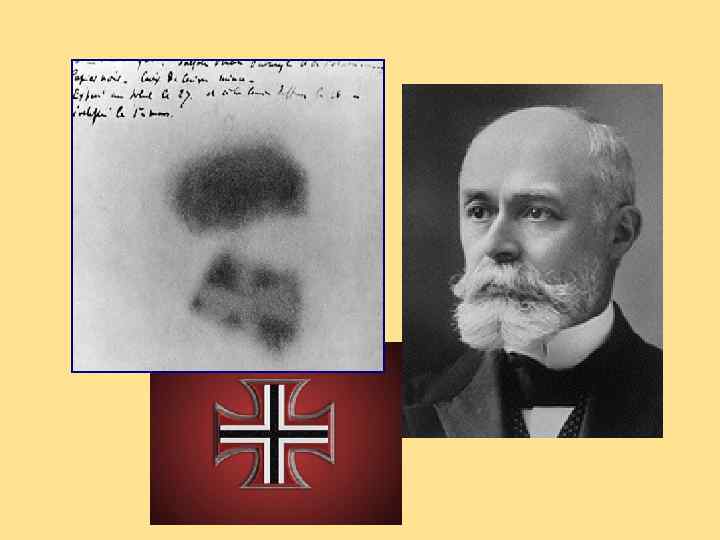

Radium discovery Pierre and Marie Curie, 1898

Dr. Danlos and assistants treating a lupus patient with radium
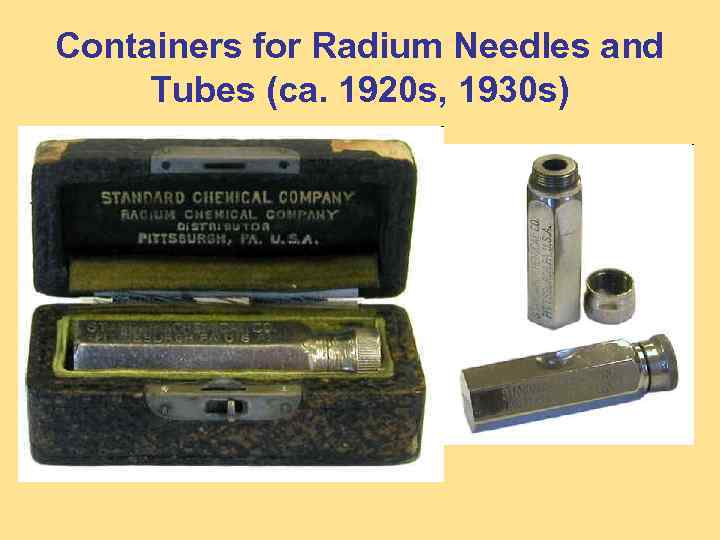
Containers for Radium Needles and Tubes (ca. 1920 s, 1930 s)

Лучевая терапия – метод лечения злокачественных опухолей, основанный на относительно избирательном повреждающем действии ионизирующего излучения в отношении злокачественных опухолей

ЗАКОН БЕРГОНЬЕ-ТРИБОНДО (1906) Радиочувствительность клеток и тканей прямо пропорциональна их митотической активности и обратно пропорциональна степени дифференцировки

РОЛЬ ЛУЧЕВОЙ ТЕРАПИИ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ • Лучевая (химиолучевая) терапия как самостоятельный радикальный метод лечения • Лучевая (химиолучевая) терапия как компонент комбинированного лечения • Паллиативная лучевая терапия

Целью радикального лечения oнкологических заболеваний является излечение пациента • Возможность органосохранного лечения. • Нерезектабельность новообразования • Противопоказания к хирургическому лечению вследствие выраженной сопутствующей патологии (высокий уровень анестезиологического риска) • Отказ пациента от операции

Целью паллиативного лечения является продление жизни больного и улучшение ее качества

Лучевая терапия как компонент комбинированного лечения Предоперационная лучевая терапия в случае резектабельной опухоли • Подавление биологической активности низкодифференцированных наиболее агрессивных опухолевых клеток с целью снижения риска интраоперационной диссеминации • Воздействие на клинические неопределяемые микрометастазы в органе и регионарных лимфатических узлах с целью снижения риска локо-регионарного рецидива Предоперационная лучевая терапия в случае нерезектабельной опухоли • Попытка «снижения стадии» опухоли с целью достижения резектабельности

Лучевая терапия как компонент комбинированного лечения Послеоперационная лучевая терапия имеет целью воздействие на остаточные опухолевые комплексы в ложе опухоли с целью снижения риска локального рецидива.

Лучевая терапия как компонент комбинированного лечения Интраоперационная ЛТ проводится непосредственно во время операции.
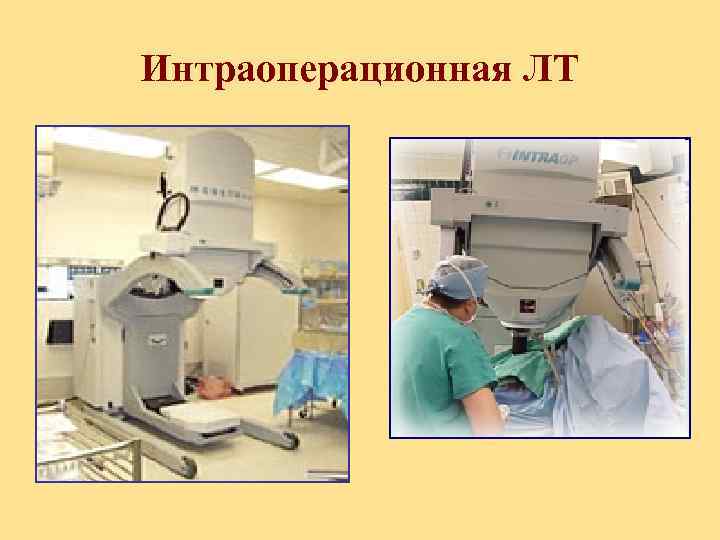
Интраоперационная ЛТ
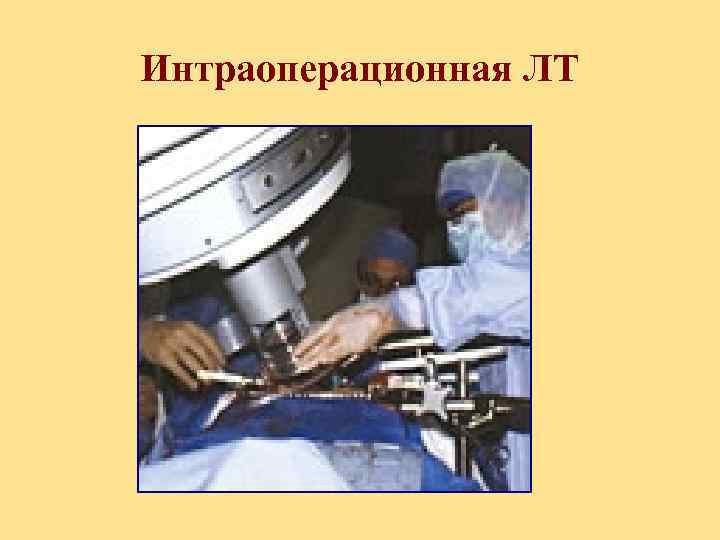
Интраоперационная ЛТ
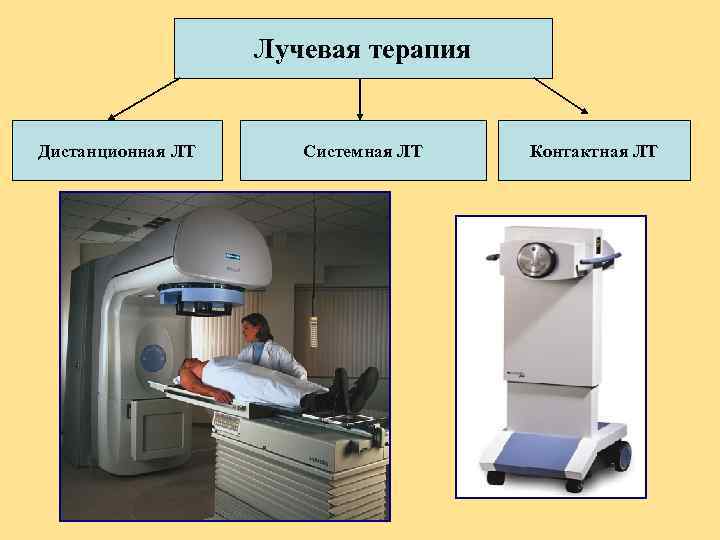
Лучевая терапия Дистанционная ЛТ Системная ЛТ Контактная ЛТ

Дистанционная лучевая терапия – источник находится на расстоянии от тела пациента Линейные ускорители электронов – тормозное фотонное излучение энергией 5 -25 Me. V. Аппараты с использованием Со-60 – фотонное излучение энергией 1. 25 Me. V. Линейные ускорители электронов – пучок ускоренных электронов энергией 4 -20 Me. V. Адронная терапия – использование нейтронов, протонов и тяжелых ионов
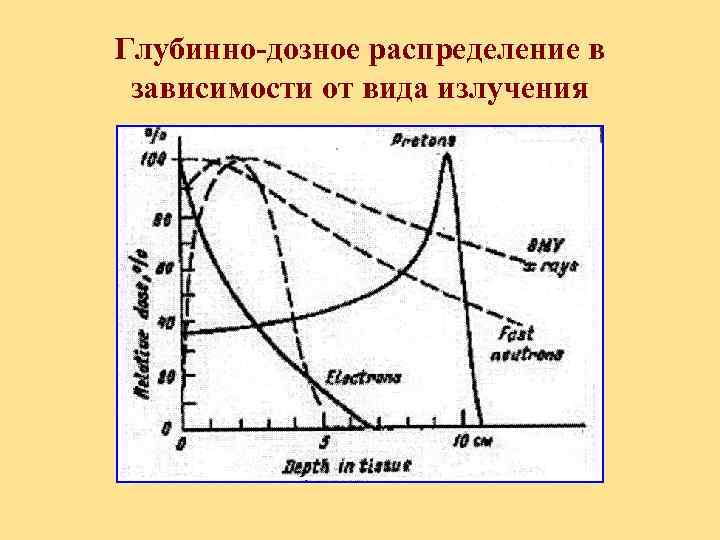
Глубинно-дозное распределение в зависимости от вида излучения

Дистанционная лучевая терапия (Co 60 ) • Простота • Надежность • Низкая стоимость
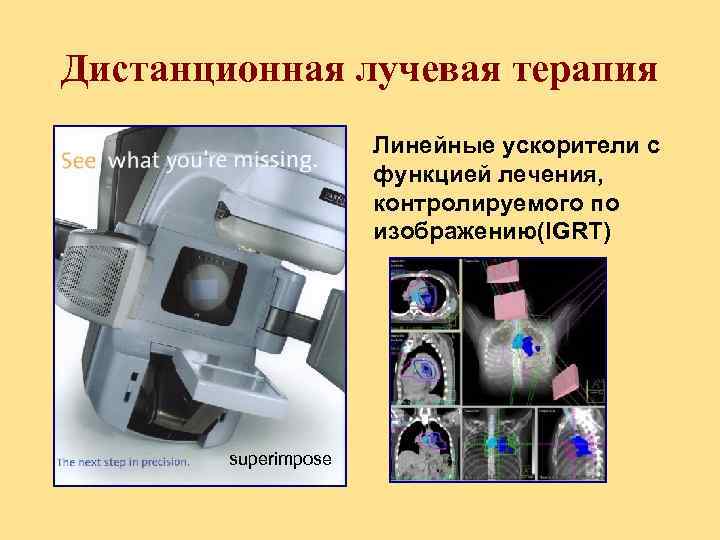
Дистанционная лучевая терапия Линейные ускорители с функцией лечения, контролируемого по изображению(IGRT) superimpose

Image Guided Radiation Therapy (IGRT)
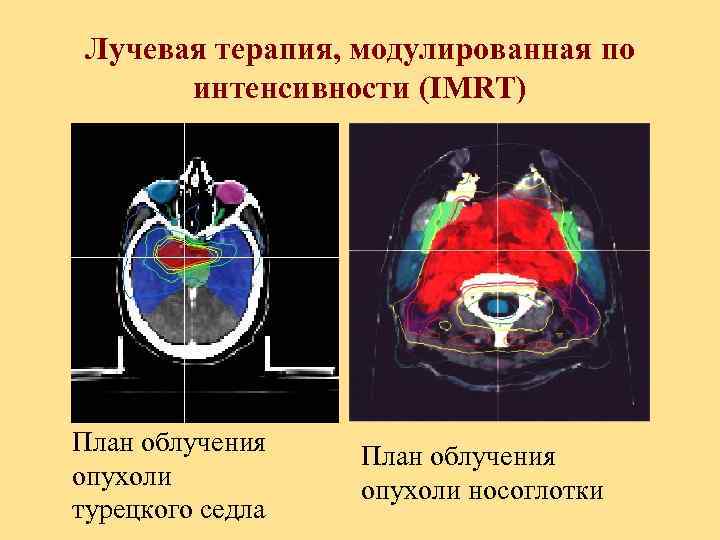
Лучевая терапия, модулированная по интенсивности (IMRT) План облучения опухоли турецкого седла План облучения опухоли носоглотки

Многолепестковый коллиматор Состоит из двух наборов лепестков (20 -40 пар) толщиной 1 -10 мм. Современные коллматоры имеют до 120 пар лепестков.


Адронная лучевая терапия Высокотехнологичный метод ЛТ, основанный на благоприятном для биологических тканей дозном распределении энергии пучка протонов или тяжелых ионов (пик Брегга)
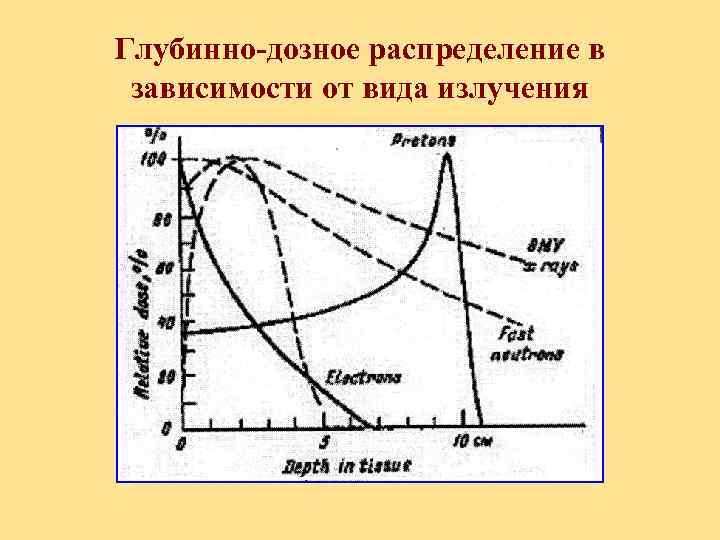
Глубинно-дозное распределение в зависимости от вида излучения

Центр протонной терапии Munchen, Germany 2006
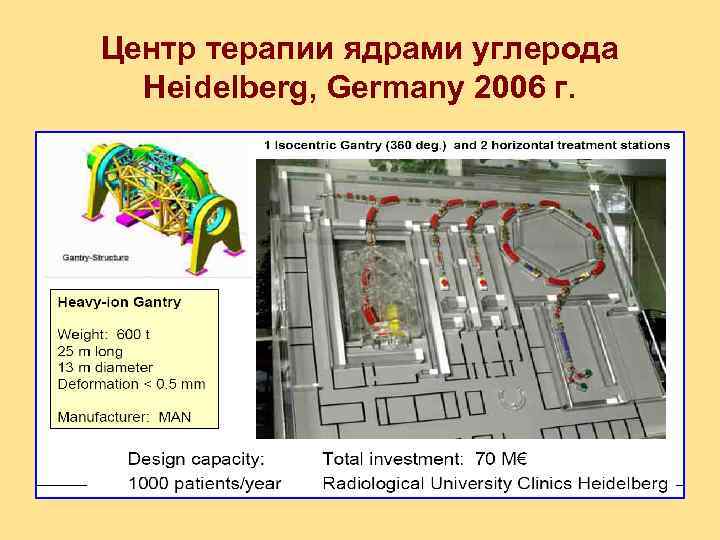
Центр терапии ядрами углерода Heidelberg, Germany 2006 г.

Каналы транспортировки пучков и гантри
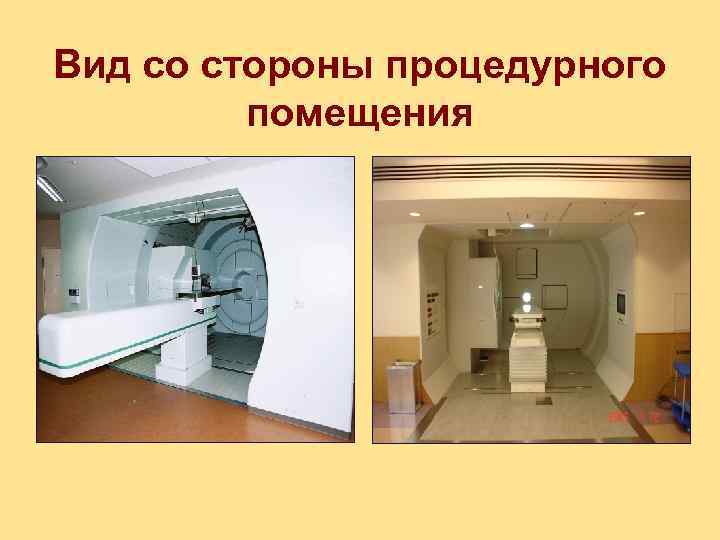
Вид со стороны процедурного помещения

Кибернайф (Cyberknife)

Современные методики дистанционной лучевой терапии Преимущества Недостатки • Конформное дозное распределение • Щажение критических структур • Возможность компьютерной оптимизации лечения • Высокая стоимость оборудования • Высокая стоимость эксплуатации • Более длительное время лечения • Высокие требования к персоналу
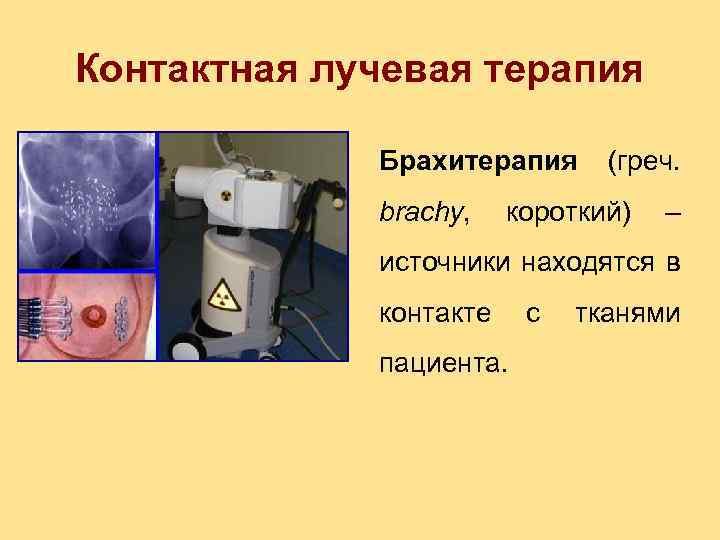
Контактная лучевая терапия Брахитерапия brachy, (греч. короткий) – источники находятся в контакте пациента. с тканями

Расположение источников Внутритканевая лучевая терапия - источники располагаются в опухоли и окружающих ее тканях Внутриполостная лучевая терапия – источники располагаются в естественных полостях тела пациента. Вариант – внутрисосудистая брахитерапия для лечения коронарного рестеноза. Аппликационная брахитерапия – источники находятся в непосредственном контакте с поверхностью (кожа или слизистая)
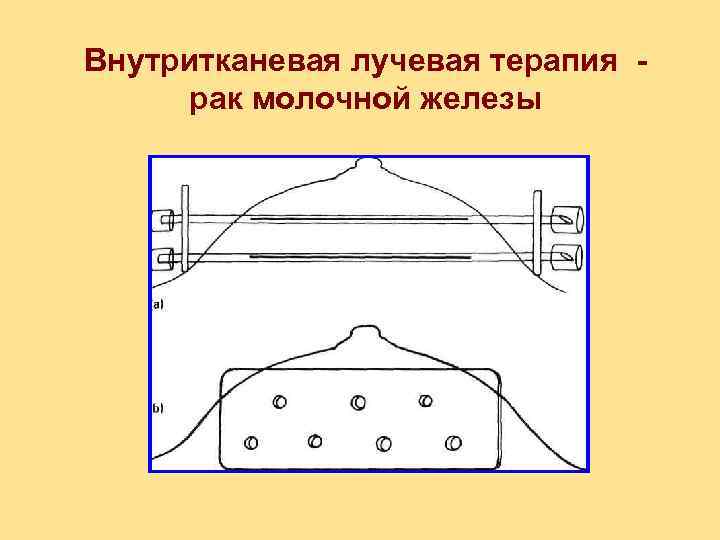
Внутритканевая лучевая терапия рак молочной железы

Внутритканевая лучевая терапия – рак предстательной железы
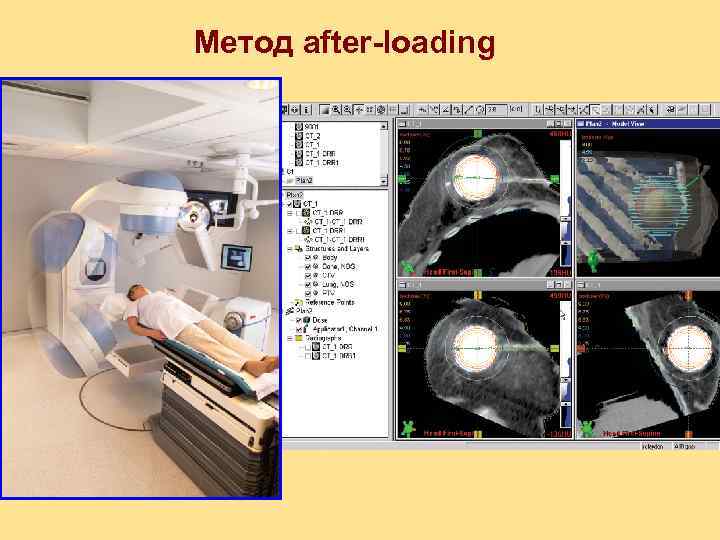
Метод after-loading
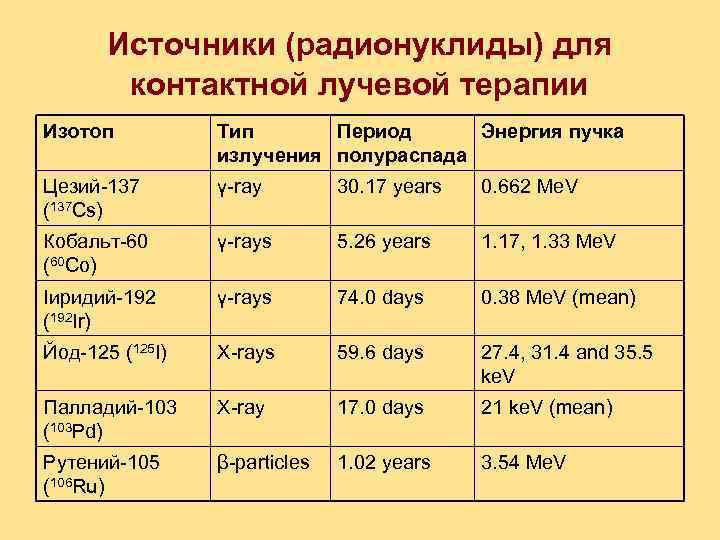
Источники (радионуклиды) для контактной лучевой терапии Изотоп Тип Период Энергия пучка излучения полураспада Цезий-137 (137 Cs) γ-ray 30. 17 years 0. 662 Me. V Кобальт-60 (60 Co) γ-rays 5. 26 years 1. 17, 1. 33 Me. V Iиридий-192 (192 Ir) γ-rays 74. 0 days 0. 38 Me. V (mean) Йод-125 (125 I) X-rays 59. 6 days 27. 4, 31. 4 and 35. 5 ke. V Палладий-103 (103 Pd) X-ray 17. 0 days 21 ke. V (mean) Рутений-105 (106 Ru) β-particles 1. 02 years 3. 54 Me. V

Системная лучевая терапия • Облучение костных метастазов препаратами стронция-89. • Облучение при диссеминированном раке щитовидной железы препаратами йода-131. • Радиоиммунотерапия – моноклональное антитело + радиоактивный изотоп Зевалин (ибритумомаб) – МАТ против СD 20, конъюгированные с Y 90. Бекссар (тозитумомаб) – МАТ против СD 20, конъюгированные с I 131. Альфа-иммунотерапия – в стадии клинических испытаний.
СПАСИБО ЗА ВНИМАНИЕ

Dose rate The dose rate of brachytherapy refers to the level or ‘intensity’ with which the radiation is delivered to the surrounding medium and is expressed in Greys per hour (Gy/h). Low-dose rate(LDR) brachytherapy involves implanting radiation sources that emit radiation at a rate less than 2 Gy/hr. LDR brachytherapy is commonly used for cancers of the oral cavity, oropharynx, sarcomas and prostate cancer. Medium-dose rate (MDR) brachytherapy is characterized by a medium rate of dose delivery ranging between 2 Gy-12 Gy/hr High-dose rate (HDR) brachytherapy is when the rate of dose delivery is more than 12 Gy/h. The most common applications of HDR brachytherapy are in tumours of the cervix, oesophagus, lungs, breast and prostate. Pulsed-dose rate (PDR) brachytherapy involves short pulses of radiation, typically once an hour, to simulate the overall rate and effectiveness of LDR treatment. Typical tumour sites treated by PDR brachytherapy are gynaecological and head and neck cancers.

Duration of dose delivery The placement of radiation sources in the target area can be temporary or permanent. Temporary brachytherapy involves placement of radiation sources for a set duration (usually a number of minutes or hours) before being withdrawn. The specific treatment duration will depend on many different factors, including the required rate of dose delivery and the type, size and location of the cancer. In LDR and PDR brachytherapy, the source typically stays in place up to 24 hours before being removed, while in HDR brachytherapy this time is typically a few minutes. Permanent brachytherapy, also known as seed implantation, involves placing small LDR radioactive seeds or pellets (about the size of a grain of rice) in the tumour or treatment site and leaving them there permanently to gradually decay. Over a period of weeks or months, the level of radiation emitted by the sources will decline to almost zero. The inactive seeds then remain in the treatment site with no lasting effect. Permanent brachytherapy is most commonly used in the treatment of prostate cancer using "seeds" - small radioactive rods implanted directly into the tumour.

Systemic radiation therapy • Photon total body irradiation (low dose) – indolent non. Hogkin lymphoma (initial treatment, recurrence). • Photon total body irradiation (high dose) – non-Hogkin lymphoma and leukaemia preparation for bone marrow transplantation. • Photon subtotal body irradiation (low dose) – non-Hogkin lymphoma (initial treatment, recurrence). • Photon subtotal body irradiation (low dose)– disseminated solid tumors. • Total and subtotal electron skin irradiation in case of advanced tumor.
Роль лучевой терапии русский вариант.ppt