Antipov_Новосибирск_2015.ppt
- Количество слайдов: 45
 Роль кристаллографии в создании новых катодных материалов для литии - и натрии -ионных аккумуляторов Е. В. Антипов Химический факультет, МГУ имени М. В. Ломоносова
Роль кристаллографии в создании новых катодных материалов для литии - и натрии -ионных аккумуляторов Е. В. Антипов Химический факультет, МГУ имени М. В. Ломоносова


 Цель Создание новых технологий для генерации, накопления и передачи энергии Использование возобновляемых источников энергии Природное топливо Ветер Солнце Море Развитие гибридных и электромобилей - улучшение экологии Бензиновые Электромобили Накопление и использование электроэнергии с помощью энергии химических реакций 1995: «Advances in battery research are always restricted by chemistry » R. E. Powers (N. Y. Times)
Цель Создание новых технологий для генерации, накопления и передачи энергии Использование возобновляемых источников энергии Природное топливо Ветер Солнце Море Развитие гибридных и электромобилей - улучшение экологии Бензиновые Электромобили Накопление и использование электроэнергии с помощью энергии химических реакций 1995: «Advances in battery research are always restricted by chemistry » R. E. Powers (N. Y. Times)
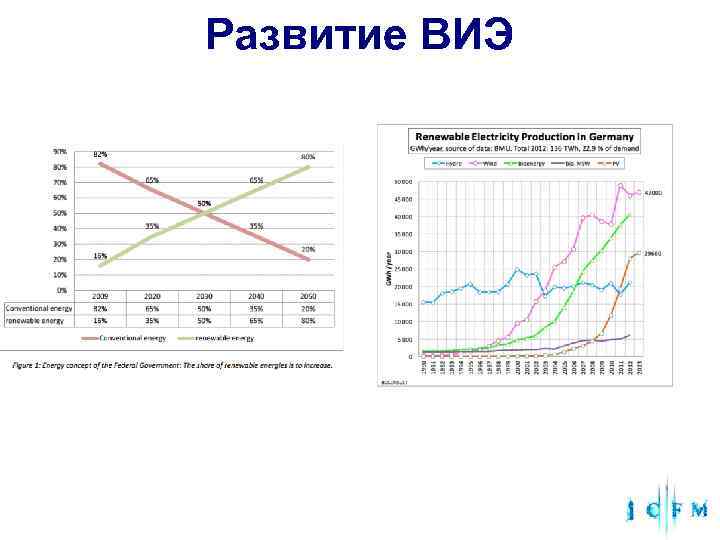 Развитие ВИЭ
Развитие ВИЭ
 Сравнительная характеристика аккумуляторов Энергоемкость (U • I • t) удельная энергия (Вт·ч/кг) объемная энергия (Вт·ч/л) Емкость (A·ч/кг) 26, 8 n Ст (А ч/г) = MW Рабочее напряжение (В) Ecell = - ∆G ⁄ n. F Мощность (Вт) (U • I) Циклируемость (деградация) Рабочий интервал температур Безопасность Стоимость в 20 -е годы и сейчас
Сравнительная характеристика аккумуляторов Энергоемкость (U • I • t) удельная энергия (Вт·ч/кг) объемная энергия (Вт·ч/л) Емкость (A·ч/кг) 26, 8 n Ст (А ч/г) = MW Рабочее напряжение (В) Ecell = - ∆G ⁄ n. F Мощность (Вт) (U • I) Циклируемость (деградация) Рабочий интервал температур Безопасность Стоимость в 20 -е годы и сейчас
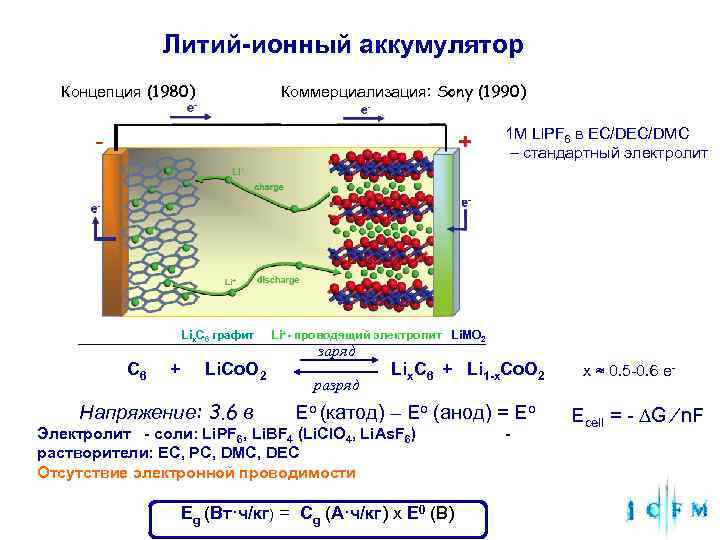 Литий-ионный аккумулятор Концепция (1980) Коммерциализация: Sony (1990) 1 M Li. PF 6 в EC/DMC – стандартный электролит Lix. C 6 графит Li+- проводящий электролит Li. MO 2 заряд С 6 + Li. Co. O 2 Lix. C 6 + Li 1 -x. Co. O 2 x ≈ 0. 5 -0. 6 e- разряд Напряжение: 3. 6 в Eo (катод) – Eo (анод) = Eo Ecell = - ∆G ⁄ n. F Электролит - cоли: Li. PF 6, Li. BF 4 (Li. Cl. O 4, Li. As. F 6) - растворители: EC, PC, DMC, DEC Отсутствие электронной проводимости Eg (Вт·ч/кг) = Cg (A·ч/кг) x E 0 (В)
Литий-ионный аккумулятор Концепция (1980) Коммерциализация: Sony (1990) 1 M Li. PF 6 в EC/DMC – стандартный электролит Lix. C 6 графит Li+- проводящий электролит Li. MO 2 заряд С 6 + Li. Co. O 2 Lix. C 6 + Li 1 -x. Co. O 2 x ≈ 0. 5 -0. 6 e- разряд Напряжение: 3. 6 в Eo (катод) – Eo (анод) = Eo Ecell = - ∆G ⁄ n. F Электролит - cоли: Li. PF 6, Li. BF 4 (Li. Cl. O 4, Li. As. F 6) - растворители: EC, PC, DMC, DEC Отсутствие электронной проводимости Eg (Вт·ч/кг) = Cg (A·ч/кг) x E 0 (В)
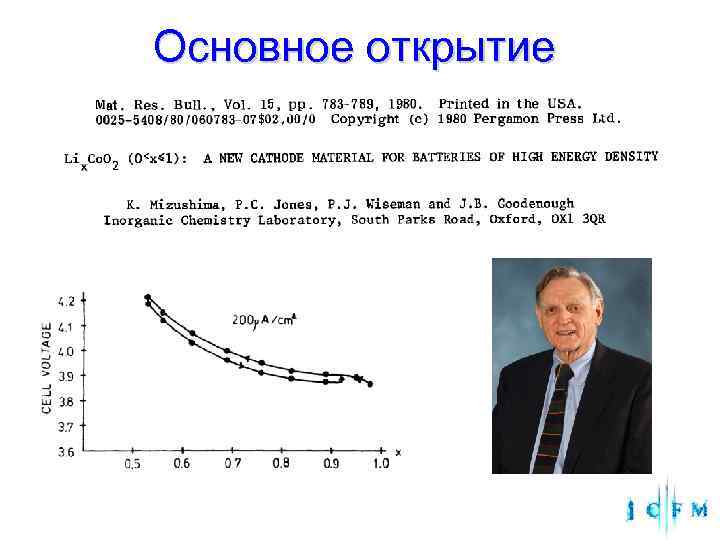 Основное открытие
Основное открытие
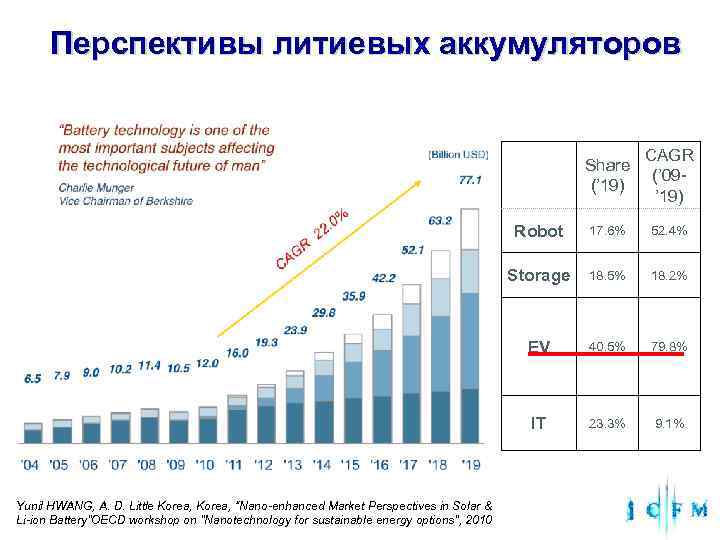 Перспективы литиевых аккумуляторов CAGR Share (’ 09 - (’ 19) ’ 19) Robot 17. 6% 52. 4% Storage 18. 5% 18. 2% EV 40. 5% 79. 8% IT 23. 3% 9. 1% Yunil HWANG, A. D. Little Korea, “Nano-enhanced Market Perspectives in Solar & Li-ion Battery”OECD workshop on "Nanotechnology for sustainable energy options", 2010
Перспективы литиевых аккумуляторов CAGR Share (’ 09 - (’ 19) ’ 19) Robot 17. 6% 52. 4% Storage 18. 5% 18. 2% EV 40. 5% 79. 8% IT 23. 3% 9. 1% Yunil HWANG, A. D. Little Korea, “Nano-enhanced Market Perspectives in Solar & Li-ion Battery”OECD workshop on "Nanotechnology for sustainable energy options", 2010
 Motor wheel
Motor wheel
 Nissan leaf Общий вес 1500 kg Вес аккумулятора 300 kg Запасаемая энергия 24 к. Втч Мощность 120 л. с. Пробег 70 – 220 (150) км Макс. скорость 150 км/ч Время зарядки 7 часов (220 V) 30 мин (440 В) Катодный материал – Li. Mn 2 O 4 Eg = 80 Втч/кг
Nissan leaf Общий вес 1500 kg Вес аккумулятора 300 kg Запасаемая энергия 24 к. Втч Мощность 120 л. с. Пробег 70 – 220 (150) км Макс. скорость 150 км/ч Время зарядки 7 часов (220 V) 30 мин (440 В) Катодный материал – Li. Mn 2 O 4 Eg = 80 Втч/кг
 Проблема безопасности Daily Mail, 20. 01. 2013
Проблема безопасности Daily Mail, 20. 01. 2013
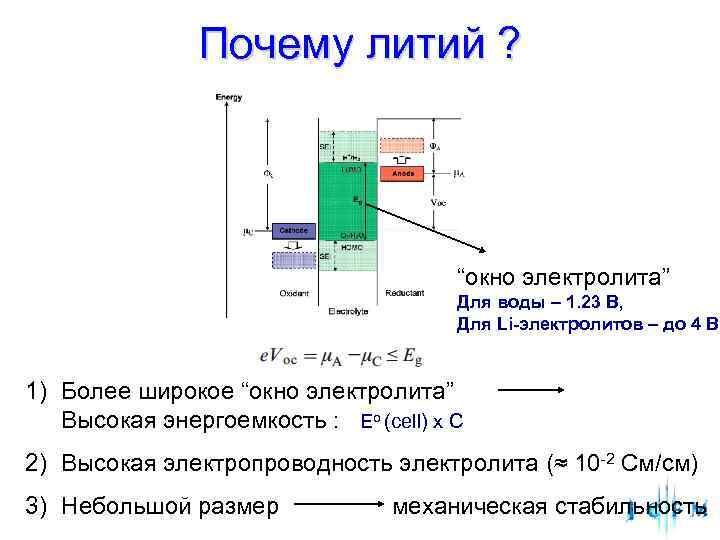 Почему литий ? “окно электролита” Для воды – 1. 23 В, Для Li-электролитов – до 4 В 1) Более широкое “окно электролита” Высокая энергоемкость : Eo (cell) х С 2) Высокая электропроводность электролита (≈ 10 -2 См/см) 3) Небольшой размер механическая стабильность
Почему литий ? “окно электролита” Для воды – 1. 23 В, Для Li-электролитов – до 4 В 1) Более широкое “окно электролита” Высокая энергоемкость : Eo (cell) х С 2) Высокая электропроводность электролита (≈ 10 -2 См/см) 3) Небольшой размер механическая стабильность
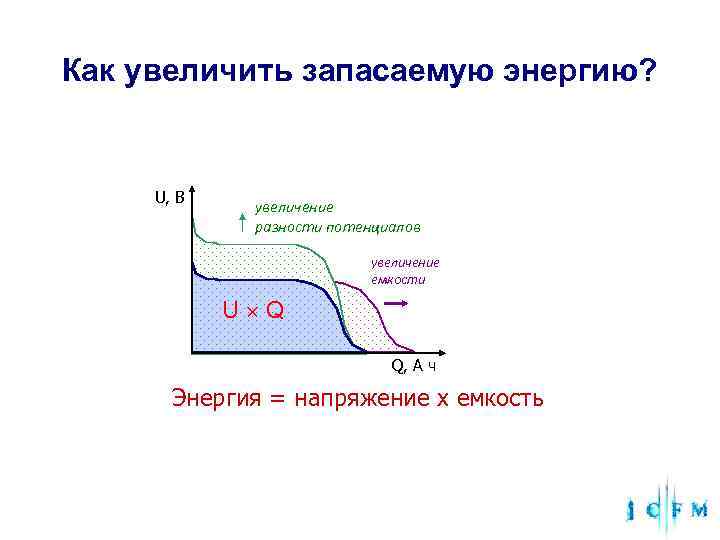 Как увеличить запасаемую энергию? U, В увеличение разности потенциалов увеличение емкости U Q Q, А ч Энергия = напряжение x емкость
Как увеличить запасаемую энергию? U, В увеличение разности потенциалов увеличение емкости U Q Q, А ч Энергия = напряжение x емкость
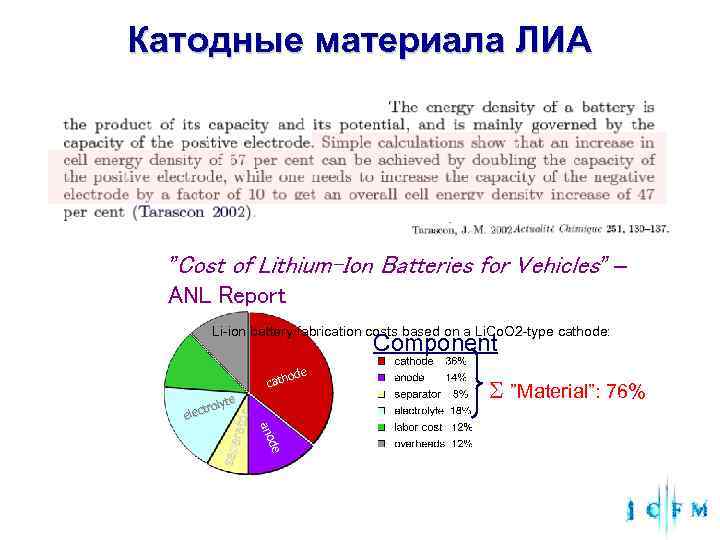 Катодные материала ЛИА ”Cost of Lithium-Ion Batteries for Vehicles” – ANL Report Li-ion battery fabrication costs based on a Li. Co. O 2 -type cathode: Component ode cath te ”Material”: 76% roly e lect rato ano a o sepa de d
Катодные материала ЛИА ”Cost of Lithium-Ion Batteries for Vehicles” – ANL Report Li-ion battery fabrication costs based on a Li. Co. O 2 -type cathode: Component ode cath te ”Material”: 76% roly e lect rato ano a o sepa de d
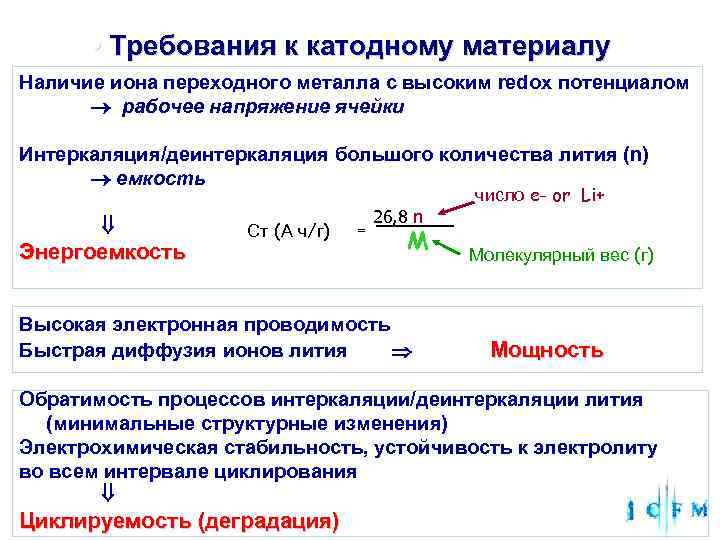 • Требования к катодному материалу Наличие иона переходного металла с высоким redox потенциалом рабочее напряжение ячейки Интеркаляция/деинтеркаляция большого количества лития (n) емкость число e- or Li+ 26, 8 n Ст (А ч/г) M = Энергоемкость Молекулярный вес (г) Высокая электронная проводимость Быстрая диффузия ионов лития Мощность Обратимость процессов интеркаляции/деинтеркаляции лития (минимальные структурные изменения) Электрохимическая стабильность, устойчивость к электролиту во всем интервале циклирования Циклируемость (деградация)
• Требования к катодному материалу Наличие иона переходного металла с высоким redox потенциалом рабочее напряжение ячейки Интеркаляция/деинтеркаляция большого количества лития (n) емкость число e- or Li+ 26, 8 n Ст (А ч/г) M = Энергоемкость Молекулярный вес (г) Высокая электронная проводимость Быстрая диффузия ионов лития Мощность Обратимость процессов интеркаляции/деинтеркаляции лития (минимальные структурные изменения) Электрохимическая стабильность, устойчивость к электролиту во всем интервале циклирования Циклируемость (деградация)
 Кристаллохимические свойства катиона лития: Ионный радиус и координационное окружение: 0. 74 Å (октаэдр) - 0. 59 Å (тетраэдр)
Кристаллохимические свойства катиона лития: Ионный радиус и координационное окружение: 0. 74 Å (октаэдр) - 0. 59 Å (тетраэдр)
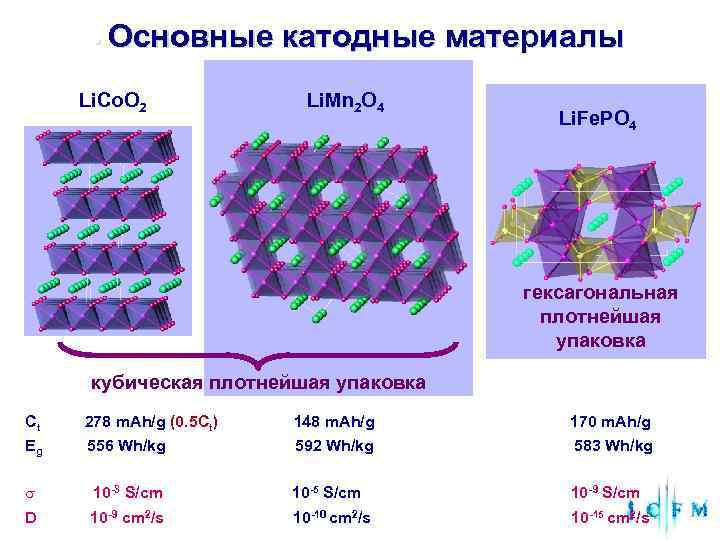 • Основные катодные материалы Li. Со. O 2 Li. Mn 2 O 4 Li. Fe. PO 4 гексагональная плотнейшая упаковка кубическая плотнейшая упаковка Сt 278 m. Ah/g (0. 5 Ct) 148 m. Ah/g 170 m. Ah/g Еg 556 Wh/kg 592 Wh/kg 583 Wh/kg s 10 -3 S/cm 10 -5 S/cm 10 -9 S/cm D 10 -9 сm 2/s 10 -10 сm 2/s 10 -15 сm 2/s
• Основные катодные материалы Li. Со. O 2 Li. Mn 2 O 4 Li. Fe. PO 4 гексагональная плотнейшая упаковка кубическая плотнейшая упаковка Сt 278 m. Ah/g (0. 5 Ct) 148 m. Ah/g 170 m. Ah/g Еg 556 Wh/kg 592 Wh/kg 583 Wh/kg s 10 -3 S/cm 10 -5 S/cm 10 -9 S/cm D 10 -9 сm 2/s 10 -10 сm 2/s 10 -15 сm 2/s
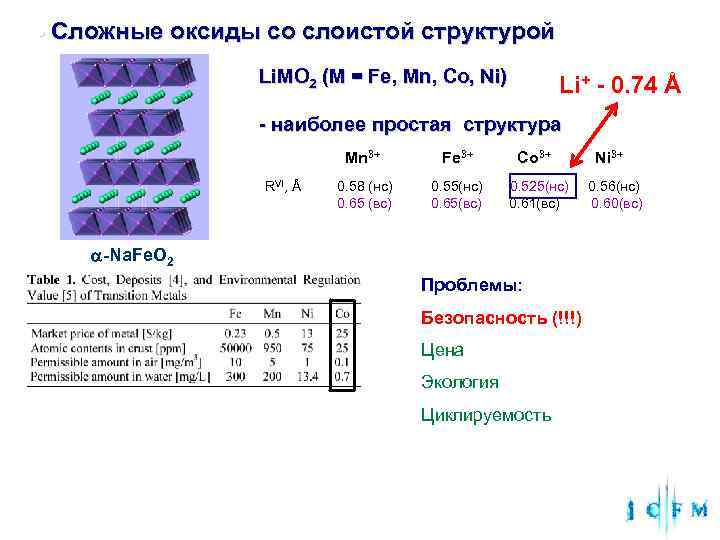 • Сложные оксиды со слоистой структурой Li. MO 2 (M = Fe, Mn, Co, Ni) Li+ - 0. 74 Å - наиболее простая структура Mn 3+ Fe 3+ Co 3+ Ni 3+ RVI, Å 0. 58 (нс) 0. 55(нс) 0. 525(нс) 0. 56(нс) 0. 65 (вс) 0. 65(вс) 0. 61(вс) 0. 60(вс) -Na. Fe. O 2 Проблемы: Безопасность (!!!) Цена Экология Циклируемость
• Сложные оксиды со слоистой структурой Li. MO 2 (M = Fe, Mn, Co, Ni) Li+ - 0. 74 Å - наиболее простая структура Mn 3+ Fe 3+ Co 3+ Ni 3+ RVI, Å 0. 58 (нс) 0. 55(нс) 0. 525(нс) 0. 56(нс) 0. 65 (вс) 0. 65(вс) 0. 61(вс) 0. 60(вс) -Na. Fe. O 2 Проблемы: Безопасность (!!!) Цена Экология Циклируемость
 Смешанные слоистые оксиды: Li. MO 2 (M = Co, Ni, Mn, Al и др. ) Цель: Увеличить емкость и рабочее напряжение Увеличить скорость диффузии Увеличить деградационную стойкость
Смешанные слоистые оксиды: Li. MO 2 (M = Co, Ni, Mn, Al и др. ) Цель: Увеличить емкость и рабочее напряжение Увеличить скорость диффузии Увеличить деградационную стойкость
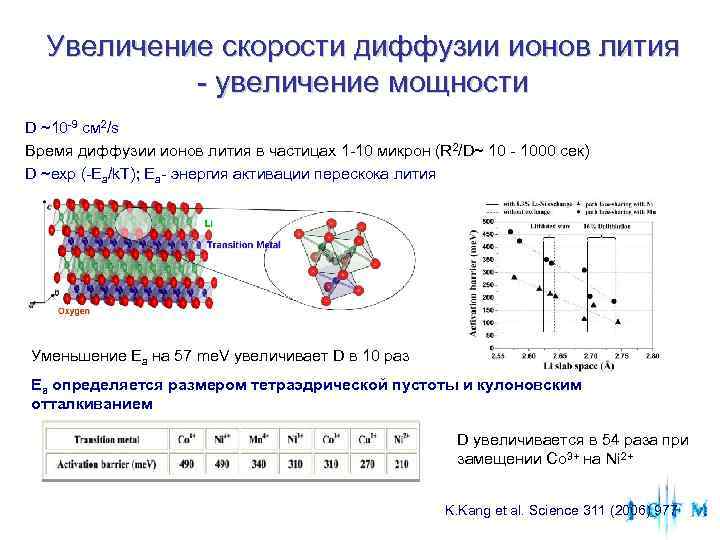 Увеличение скорости диффузии ионов лития - увеличение мощности D ~10 -9 см 2/s Время диффузии ионов лития в частицах 1 -10 микрон (R 2/D~ 10 - 1000 сек) D ~exp (-Ea/k. T); Ea- энергия активации перескока лития Уменьшение Ea на 57 me. V увеличивает D в 10 раз Ea определяется размером тетраэдрической пустоты и кулоновским отталкиванием D увеличивается в 54 раза при замещении Co 3+ на Ni 2+ K. Kang et al. Science 311 (2006) 977
Увеличение скорости диффузии ионов лития - увеличение мощности D ~10 -9 см 2/s Время диффузии ионов лития в частицах 1 -10 микрон (R 2/D~ 10 - 1000 сек) D ~exp (-Ea/k. T); Ea- энергия активации перескока лития Уменьшение Ea на 57 me. V увеличивает D в 10 раз Ea определяется размером тетраэдрической пустоты и кулоновским отталкиванием D увеличивается в 54 раза при замещении Co 3+ на Ni 2+ K. Kang et al. Science 311 (2006) 977
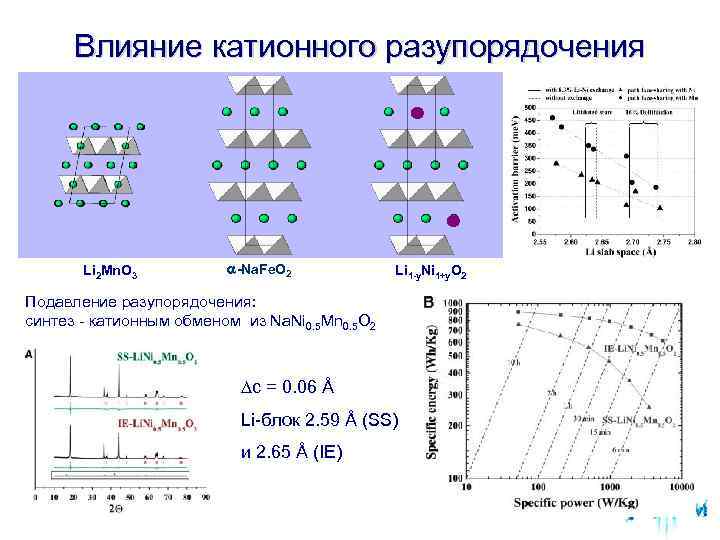 Влияние катионного разупорядочения Li 2 Mn. O 3 -Na. Fe. O 2 Li 1 -y. Ni 1+y. O 2 Подавление разупорядочения: синтез - катионным обменом из Na. Ni 0. 5 Mn 0. 5 O 2 ∆c = 0. 06 Å Li-блок 2. 59 Å (SS) и 2. 65 Å (IE)
Влияние катионного разупорядочения Li 2 Mn. O 3 -Na. Fe. O 2 Li 1 -y. Ni 1+y. O 2 Подавление разупорядочения: синтез - катионным обменом из Na. Ni 0. 5 Mn 0. 5 O 2 ∆c = 0. 06 Å Li-блок 2. 59 Å (SS) и 2. 65 Å (IE)
 Li. Fe. PO 4 со структурой оливина с. T = 170 м. A·ч/г; Е ~ 3. 5 В Достоинства - термическая и циклическая устойчивость Li. Fe. PO 4 «Fe. PO 4 + Li+ + e- с - экологически безопасный - дешевый (минерал - трифилит) b a Недостатки • электронная проводимость ~ 10 -9 С/cм • D~10 -15 см 2/с • низкая плотность • среднее значение рабочего напряжения
Li. Fe. PO 4 со структурой оливина с. T = 170 м. A·ч/г; Е ~ 3. 5 В Достоинства - термическая и циклическая устойчивость Li. Fe. PO 4 «Fe. PO 4 + Li+ + e- с - экологически безопасный - дешевый (минерал - трифилит) b a Недостатки • электронная проводимость ~ 10 -9 С/cм • D~10 -15 см 2/с • низкая плотность • среднее значение рабочего напряжения
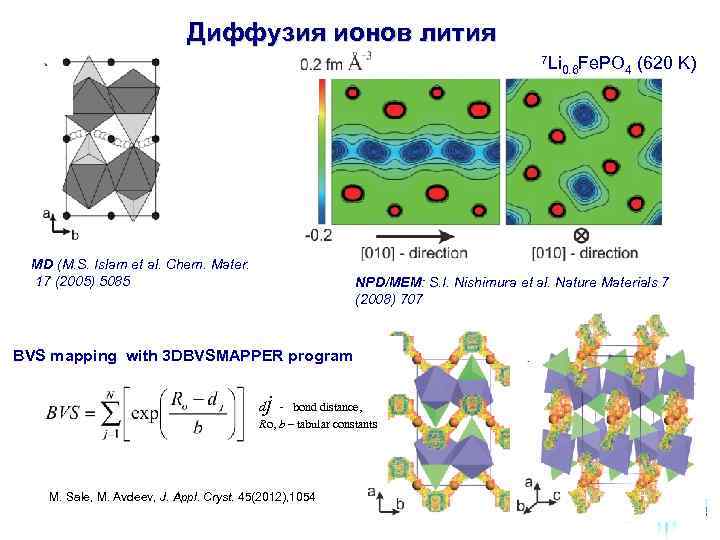 Диффузия ионов лития 7 Li 0. 6 Fe. PO 4 (620 K) MD (M. S. Islam et al. Chem. Mater. 17 (2005) 5085 NPD/MEM: S. I. Nishimura et al. Nature Materials 7 (2008) 707 BVS mapping with 3 DBVSMAPPER program 1, 2 j d - bond distance, Ro, b – tabular constants M. Sale, M. Avdeev, J. Appl. Cryst. 45(2012), 1054
Диффузия ионов лития 7 Li 0. 6 Fe. PO 4 (620 K) MD (M. S. Islam et al. Chem. Mater. 17 (2005) 5085 NPD/MEM: S. I. Nishimura et al. Nature Materials 7 (2008) 707 BVS mapping with 3 DBVSMAPPER program 1, 2 j d - bond distance, Ro, b – tabular constants M. Sale, M. Avdeev, J. Appl. Cryst. 45(2012), 1054
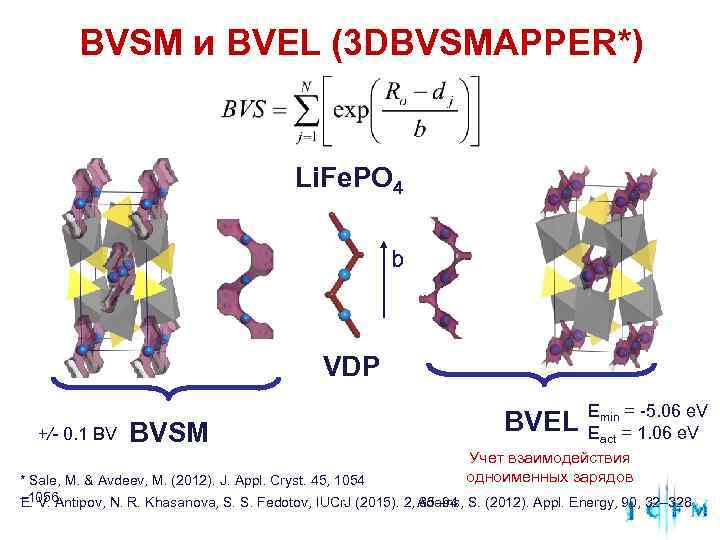 BVSM и BVEL (3 DBVSMAPPER*) Li. Fe. PO 4 b VDP Emin = -5. 06 e. V +/- 0. 1 BV BVSM BVEL Eact = 1. 06 e. V Учет взаимодействия * Sale, M. & Avdeev, M. (2012). J. Appl. Cryst. 45, 1054 одноименных зарядов – 1056 E. V. Antipov, N. R. Khasanova, S. S. Fedotov, IUCr. J (2015). 2, Adams, S. (2012). Appl. Energy, 90, 32– 328 85– 94
BVSM и BVEL (3 DBVSMAPPER*) Li. Fe. PO 4 b VDP Emin = -5. 06 e. V +/- 0. 1 BV BVSM BVEL Eact = 1. 06 e. V Учет взаимодействия * Sale, M. & Avdeev, M. (2012). J. Appl. Cryst. 45, 1054 одноименных зарядов – 1056 E. V. Antipov, N. R. Khasanova, S. S. Fedotov, IUCr. J (2015). 2, Adams, S. (2012). Appl. Energy, 90, 32– 328 85– 94
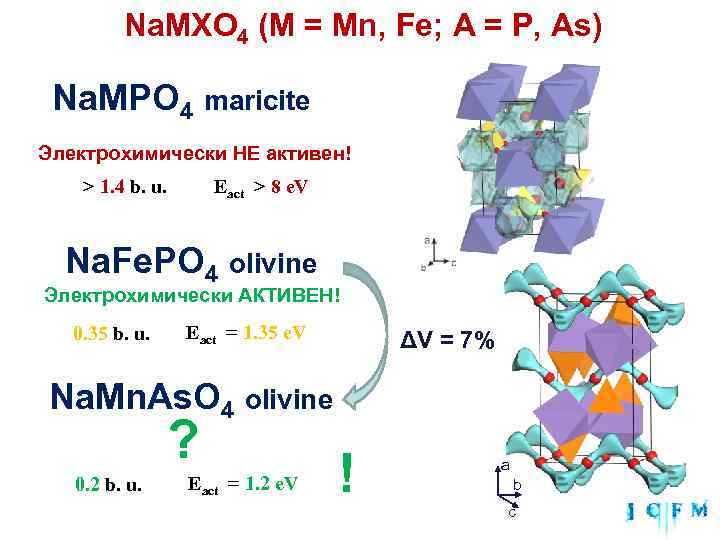 Na. MXO 4 (M = Mn, Fe; A = P, As) Na. MPO 4 maricite Электрохимически НЕ активен! > 1. 4 b. u. Eact > 8 e. V Na. Fe. PO 4 olivine Электрохимически АКТИВЕН! 0. 35 b. u. Eact = 1. 35 e. V ΔV = 7% Na. Mn. As. O 4 olivine ? 0. 2 b. u. Eact = 1. 2 e. V ! a b c
Na. MXO 4 (M = Mn, Fe; A = P, As) Na. MPO 4 maricite Электрохимически НЕ активен! > 1. 4 b. u. Eact > 8 e. V Na. Fe. PO 4 olivine Электрохимически АКТИВЕН! 0. 35 b. u. Eact = 1. 35 e. V ΔV = 7% Na. Mn. As. O 4 olivine ? 0. 2 b. u. Eact = 1. 2 e. V ! a b c
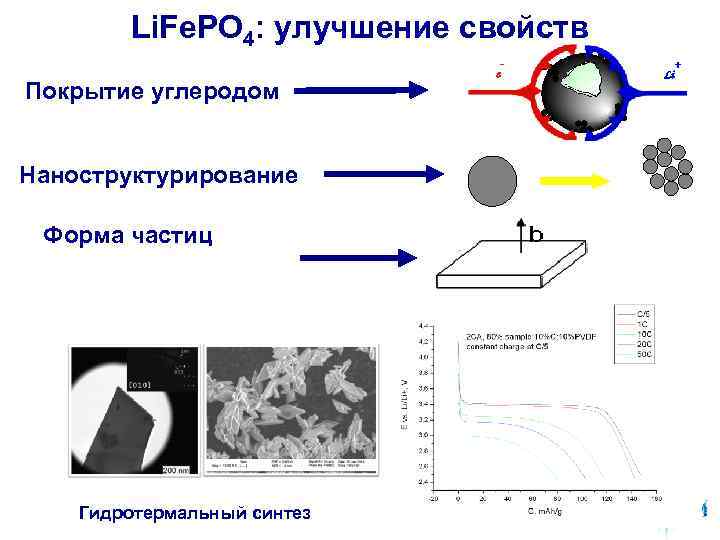 Li. Fe. PO 4: улучшение свойств - + e Li Покрытие углеродом Наноструктурирование Форма частиц Гидротермальный синтез
Li. Fe. PO 4: улучшение свойств - + e Li Покрытие углеродом Наноструктурирование Форма частиц Гидротермальный синтез
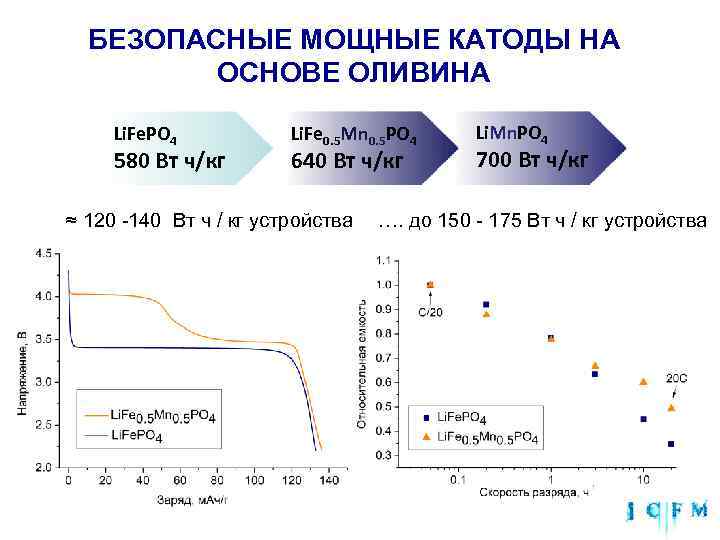 БЕЗОПАСНЫЕ МОЩНЫЕ КАТОДЫ НА ОСНОВЕ ОЛИВИНА Li. Fe. PO 4 Li. Fe 0. 5 Mn 0. 5 PO 4 Li. Mn. PO 4 580 Вт ч/кг 640 Вт ч/кг 700 Вт ч/кг ≈ 120 -140 Вт ч / кг устройства …. до 150 - 175 Вт ч / кг устройства
БЕЗОПАСНЫЕ МОЩНЫЕ КАТОДЫ НА ОСНОВЕ ОЛИВИНА Li. Fe. PO 4 Li. Fe 0. 5 Mn 0. 5 PO 4 Li. Mn. PO 4 580 Вт ч/кг 640 Вт ч/кг 700 Вт ч/кг ≈ 120 -140 Вт ч / кг устройства …. до 150 - 175 Вт ч / кг устройства
 In situ XRPD
In situ XRPD
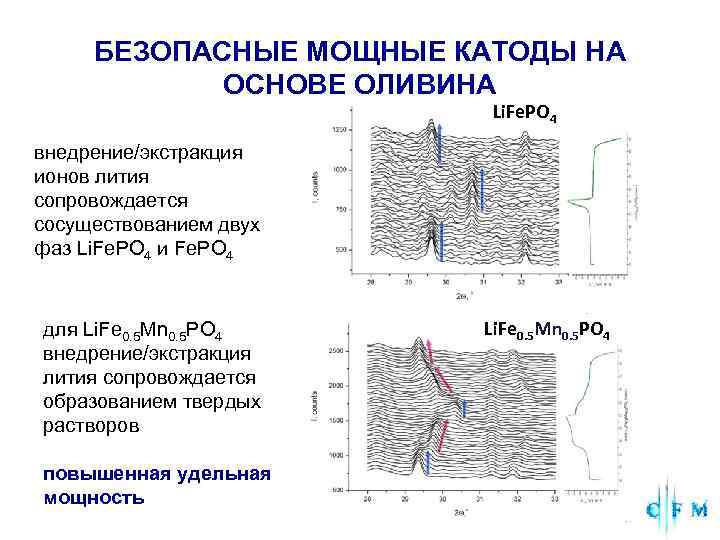 БЕЗОПАСНЫЕ МОЩНЫЕ КАТОДЫ НА ОСНОВЕ ОЛИВИНА Li. Fe. PO 4 внедрение/экстракция ионов лития сопровождается сосуществованием двух фаз Li. Fe. PO 4 и Fe. PO 4 для Li. Fe 0. 5 Mn 0. 5 PO 4 внедрение/экстракция лития сопровождается образованием твердых растворов повышенная удельная мощность
БЕЗОПАСНЫЕ МОЩНЫЕ КАТОДЫ НА ОСНОВЕ ОЛИВИНА Li. Fe. PO 4 внедрение/экстракция ионов лития сопровождается сосуществованием двух фаз Li. Fe. PO 4 и Fe. PO 4 для Li. Fe 0. 5 Mn 0. 5 PO 4 внедрение/экстракция лития сопровождается образованием твердых растворов повышенная удельная мощность
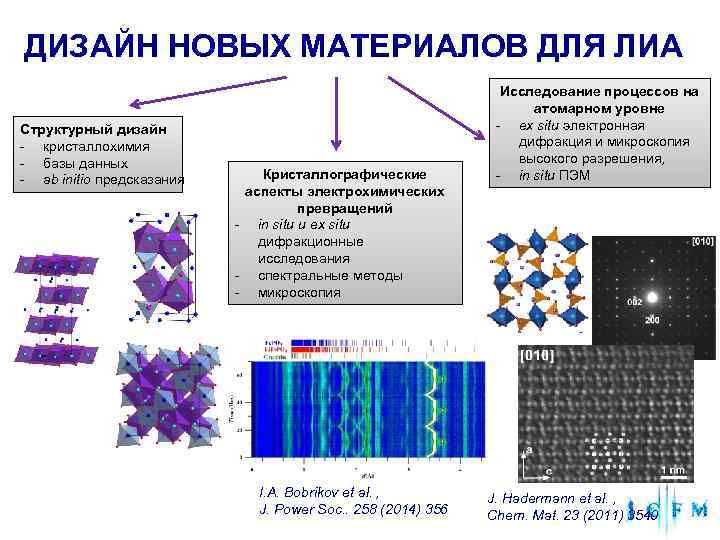 ДИЗАЙН НОВЫХ МАТЕРИАЛОВ ДЛЯ ЛИА Исследование процессов на атомарном уровне Структурный дизайн - ex situ электронная - кристаллохимия дифракция и микроскопия - базы данных высокого разрешения, - ab initio предсказания Кристаллографические - in situ ПЭМ аспекты электрохимических превращений - in situ и ex situ дифракционные исследования - спектральные методы - микроскопия I. A. Bobrikov et al. , J. Hadermann et al. , J. Power Soc. . 258 (2014) 356 Chem. Mat. 23 (2011) 3540
ДИЗАЙН НОВЫХ МАТЕРИАЛОВ ДЛЯ ЛИА Исследование процессов на атомарном уровне Структурный дизайн - ex situ электронная - кристаллохимия дифракция и микроскопия - базы данных высокого разрешения, - ab initio предсказания Кристаллографические - in situ ПЭМ аспекты электрохимических превращений - in situ и ex situ дифракционные исследования - спектральные методы - микроскопия I. A. Bobrikov et al. , J. Hadermann et al. , J. Power Soc. . 258 (2014) 356 Chem. Mat. 23 (2011) 3540
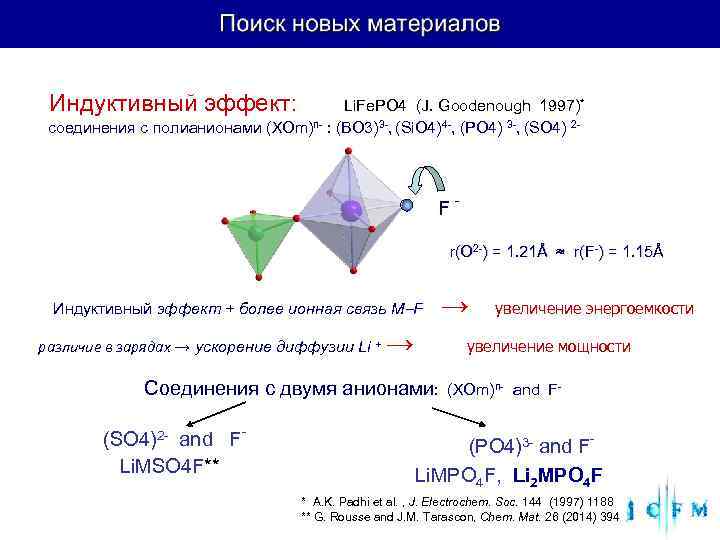 Индуктивный эффект: Li. Fe. PO 4 (J. Goodenough 1997)* соединения с полианионами (XOm)n- : (BO 3)3 -, (Si. O 4)4 -, (PO 4) 3 -, (SO 4) 2 - F- r(O 2 -) = 1. 21Å ≈ r(F-) = 1. 15Å Индуктивный эффект + более ионная связь M F → увеличение энергоемкости различие в зарядах → ускорение диффузии Li + → увеличение мощности Соединения с двумя анионами: (XOm)n- and F- - (SO 4)2 - and F (PO 4)3 - and F- Li. MSO 4 F** Li. MPO 4 F, Li 2 MPO 4 F * A. K. Padhi et al. , J. Electrochem. Soc. 144 (1997) 1188 ** G. Rousse and J. M. Tarascon, Chem. Mat. 26 (2014) 394
Индуктивный эффект: Li. Fe. PO 4 (J. Goodenough 1997)* соединения с полианионами (XOm)n- : (BO 3)3 -, (Si. O 4)4 -, (PO 4) 3 -, (SO 4) 2 - F- r(O 2 -) = 1. 21Å ≈ r(F-) = 1. 15Å Индуктивный эффект + более ионная связь M F → увеличение энергоемкости различие в зарядах → ускорение диффузии Li + → увеличение мощности Соединения с двумя анионами: (XOm)n- and F- - (SO 4)2 - and F (PO 4)3 - and F- Li. MSO 4 F** Li. MPO 4 F, Li 2 MPO 4 F * A. K. Padhi et al. , J. Electrochem. Soc. 144 (1997) 1188 ** G. Rousse and J. M. Tarascon, Chem. Mat. 26 (2014) 394
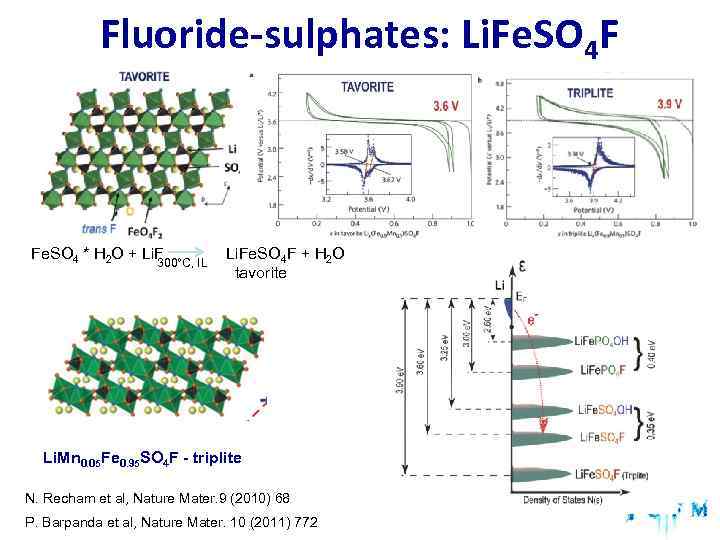 Fluoride-sulphates: Li. Fe. SO 4 F Fe. SO 4 * H 2 O + Li. F Li. Fe. SO 4 F + H 2 O 300°C, IL tavorite Li. Mn 0. 05 Fe 0. 95 SO 4 F - triplite N. Recham et al, Nature Mater. 9 (2010) 68 P. Barpanda et al, Nature Mater. 10 (2011) 772
Fluoride-sulphates: Li. Fe. SO 4 F Fe. SO 4 * H 2 O + Li. F Li. Fe. SO 4 F + H 2 O 300°C, IL tavorite Li. Mn 0. 05 Fe 0. 95 SO 4 F - triplite N. Recham et al, Nature Mater. 9 (2010) 68 P. Barpanda et al, Nature Mater. 10 (2011) 772
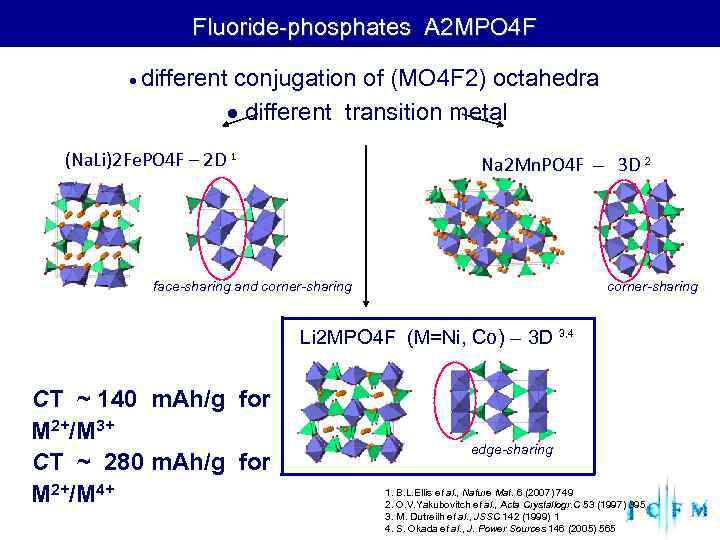 Fluoride-phosphates A 2 MPO 4 F different conjugation of (MO 4 F 2) octahedra different transition metal (Na. Li)2 Fe. PO 4 F – 2 D 1 Na 2 Mn. PO 4 F – 3 D 2 face-sharing and corner-sharing Li 2 MPO 4 F (M=Ni, Co) – 3 D 3, 4 CT ~ 140 m. Ah/g for M 2+/M 3+ edge-sharing CT ~ 280 m. Ah/g for M 2+/M 4+ 1. B. L. Ellis et al. , Nature Mat. 6 (2007) 749 2. O. V. Yakubovitch et al. , Acta Crystallogr. C 53 (1997) 395 3. M. Dutreilh et al. , JSSC 142 (1999) 1 4. S. Okada et al. , J. Power Sources 146 (2005) 565
Fluoride-phosphates A 2 MPO 4 F different conjugation of (MO 4 F 2) octahedra different transition metal (Na. Li)2 Fe. PO 4 F – 2 D 1 Na 2 Mn. PO 4 F – 3 D 2 face-sharing and corner-sharing Li 2 MPO 4 F (M=Ni, Co) – 3 D 3, 4 CT ~ 140 m. Ah/g for M 2+/M 3+ edge-sharing CT ~ 280 m. Ah/g for M 2+/M 4+ 1. B. L. Ellis et al. , Nature Mat. 6 (2007) 749 2. O. V. Yakubovitch et al. , Acta Crystallogr. C 53 (1997) 395 3. M. Dutreilh et al. , JSSC 142 (1999) 1 4. S. Okada et al. , J. Power Sources 146 (2005) 565
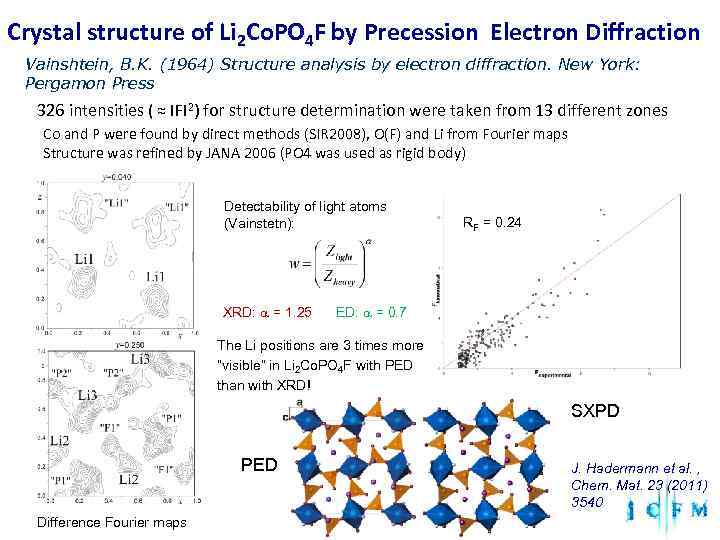 Crystal structure of Li 2 Co. PO 4 F by Precession Electron Diffraction Vainshtein, B. K. (1964) Structure analysis by electron diffraction. New York: Pergamon Press 326 intensities ( ≈ ΙFΙ 2) for structure determination were taken from 13 different zones Co and P were found by direct methods (SIR 2008), O(F) and Li from Fourier maps Structure was refined by JANA 2006 (PO 4 was used as rigid body) Detectability of light atoms (Vainstetn): RF = 0. 24 XRD: a = 1. 25 ED: a = 0. 7 The Li positions are 3 times more “visible” in Li 2 Co. PO 4 F with PED than with XRD! SXPD PED J. Hadermann et al. , Chem. Mat. 23 (2011) 3540 Difference Fourier maps
Crystal structure of Li 2 Co. PO 4 F by Precession Electron Diffraction Vainshtein, B. K. (1964) Structure analysis by electron diffraction. New York: Pergamon Press 326 intensities ( ≈ ΙFΙ 2) for structure determination were taken from 13 different zones Co and P were found by direct methods (SIR 2008), O(F) and Li from Fourier maps Structure was refined by JANA 2006 (PO 4 was used as rigid body) Detectability of light atoms (Vainstetn): RF = 0. 24 XRD: a = 1. 25 ED: a = 0. 7 The Li positions are 3 times more “visible” in Li 2 Co. PO 4 F with PED than with XRD! SXPD PED J. Hadermann et al. , Chem. Mat. 23 (2011) 3540 Difference Fourier maps
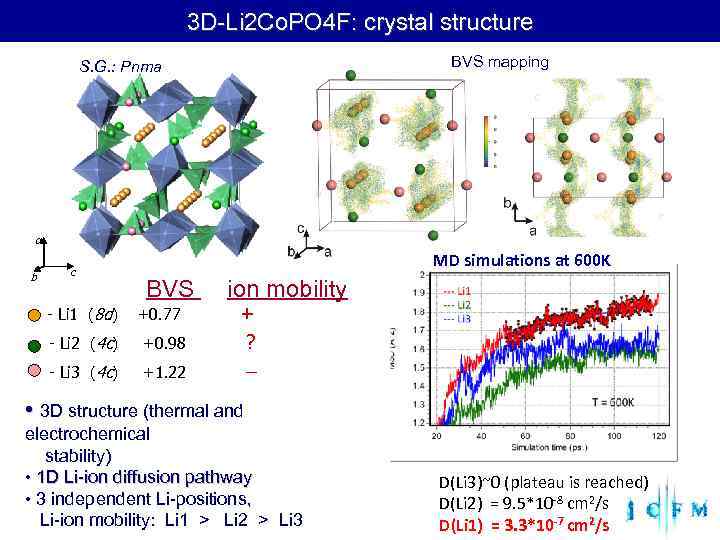 3 D-Li 2 Co. PO 4 F: crystal structure S. G. : Pnma BVS mapping a MD simulations at 600 K b c BVS ion mobility - Li 1 (8 d) +0. 77 + - Li 2 (4 c) +0. 98 ? - Li 3 (4 c) +1. 22 • 3 D structure (thermal and electrochemical stability) • 1 D Li-ion diffusion pathway D(Li 3)~0 (plateau is reached) • 3 independent Li-positions, D(Li 2) = 9. 5*10 -8 cm 2/s Li-ion mobility: Li 1 > Li 2 > Li 3 D(Li 1) = 3. 3*10 -7 cm 2/s
3 D-Li 2 Co. PO 4 F: crystal structure S. G. : Pnma BVS mapping a MD simulations at 600 K b c BVS ion mobility - Li 1 (8 d) +0. 77 + - Li 2 (4 c) +0. 98 ? - Li 3 (4 c) +1. 22 • 3 D structure (thermal and electrochemical stability) • 1 D Li-ion diffusion pathway D(Li 3)~0 (plateau is reached) • 3 independent Li-positions, D(Li 2) = 9. 5*10 -8 cm 2/s Li-ion mobility: Li 1 > Li 2 > Li 3 D(Li 1) = 3. 3*10 -7 cm 2/s
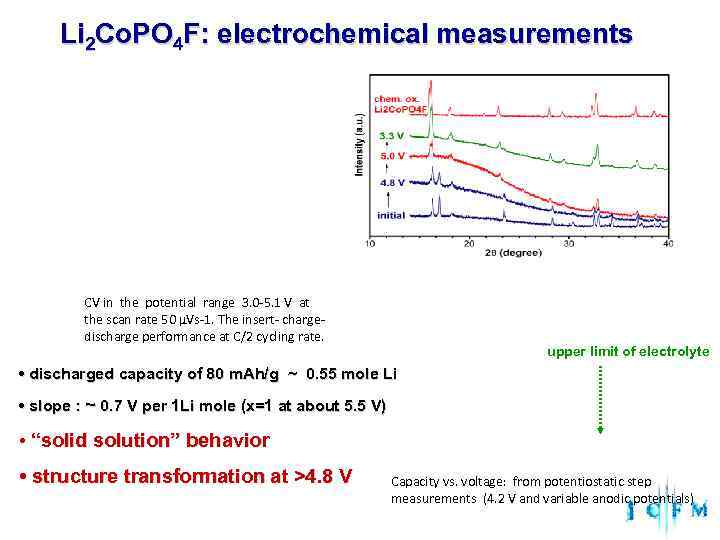 Li 2 Co. PO 4 F: electrochemical measurements CV in the potential range 3. 0 -5. 1 V at the scan rate 50 µVs-1. The insert- charge- discharge performance at C/2 cycling rate. upper limit of electrolyte • discharged capacity of 80 m. Ah/g ~ 0. 55 mole Li • slope : ~ 0. 7 V per 1 Li mole (x=1 at about 5. 5 V) • “solid solution” behavior • structure transformation at >4. 8 V Capacity vs. voltage: from potentiostatic step measurements (4. 2 V and variable anodic potentials)
Li 2 Co. PO 4 F: electrochemical measurements CV in the potential range 3. 0 -5. 1 V at the scan rate 50 µVs-1. The insert- charge- discharge performance at C/2 cycling rate. upper limit of electrolyte • discharged capacity of 80 m. Ah/g ~ 0. 55 mole Li • slope : ~ 0. 7 V per 1 Li mole (x=1 at about 5. 5 V) • “solid solution” behavior • structure transformation at >4. 8 V Capacity vs. voltage: from potentiostatic step measurements (4. 2 V and variable anodic potentials)
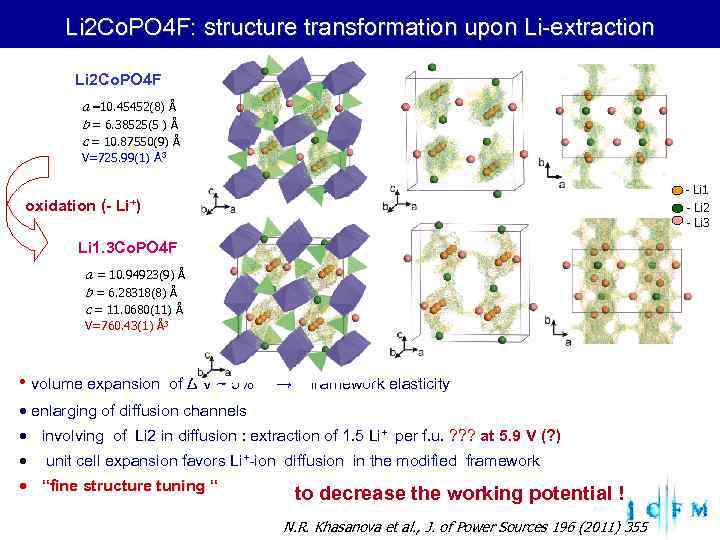 Li 2 Co. PO 4 F: structure transformation upon Li-extraction Li 2 Co. PO 4 F a =10. 45452(8) Å b = 6. 38525(5 ) Å c = 10. 87550(9) Å V=725. 99(1) Å3 - Li 1 oxidation (- Li+) - Li 2 - Li 3 Li 1. 3 Co. PO 4 F a = 10. 94923(9) Å b = 6. 28318(8) Å c = 11. 0680(11) Å V=760. 43(1) Å3 • volume expansion of Δ V ~ 5% → framework elasticity enlarging of diffusion channels involving of Li 2 in diffusion : extraction of 1. 5 Li+ per f. u. ? ? ? at 5. 9 V (? ) unit cell expansion favors Li+-ion diffusion in the modified framework “fine structure tuning “ to decrease the working potential ! N. R. Khasanova et al. , J. of Power Sources 196 (2011) 355
Li 2 Co. PO 4 F: structure transformation upon Li-extraction Li 2 Co. PO 4 F a =10. 45452(8) Å b = 6. 38525(5 ) Å c = 10. 87550(9) Å V=725. 99(1) Å3 - Li 1 oxidation (- Li+) - Li 2 - Li 3 Li 1. 3 Co. PO 4 F a = 10. 94923(9) Å b = 6. 28318(8) Å c = 11. 0680(11) Å V=760. 43(1) Å3 • volume expansion of Δ V ~ 5% → framework elasticity enlarging of diffusion channels involving of Li 2 in diffusion : extraction of 1. 5 Li+ per f. u. ? ? ? at 5. 9 V (? ) unit cell expansion favors Li+-ion diffusion in the modified framework “fine structure tuning “ to decrease the working potential ! N. R. Khasanova et al. , J. of Power Sources 196 (2011) 355
 Li 2(Co 1 -x. Mx)PO 4 F with M=Fe, Mn Mn 2+ Fe 2+ Co 2+ Ni 2+ r, Å 0. 83 0. 78 0. 74 0. 69 E* (M 2+/M 3+), V 4. 1 3. 45 4. 8 >5. 2 * for olivine-type materials narrow range of solid solutions: Li 2(Co 1 -x. Fex)PO 4 F x 0. 3 Li 2(Co 1 -x. Mnx)PO 4 F x 0. 1 Li+ Na+ “framework elasticity”: 0. 76 Å 1. 02 Å N. R. Khasanova et al. , Beilshtein J. Nanotech. 4 (2013) 860
Li 2(Co 1 -x. Mx)PO 4 F with M=Fe, Mn Mn 2+ Fe 2+ Co 2+ Ni 2+ r, Å 0. 83 0. 78 0. 74 0. 69 E* (M 2+/M 3+), V 4. 1 3. 45 4. 8 >5. 2 * for olivine-type materials narrow range of solid solutions: Li 2(Co 1 -x. Fex)PO 4 F x 0. 3 Li 2(Co 1 -x. Mnx)PO 4 F x 0. 1 Li+ Na+ “framework elasticity”: 0. 76 Å 1. 02 Å N. R. Khasanova et al. , Beilshtein J. Nanotech. 4 (2013) 860
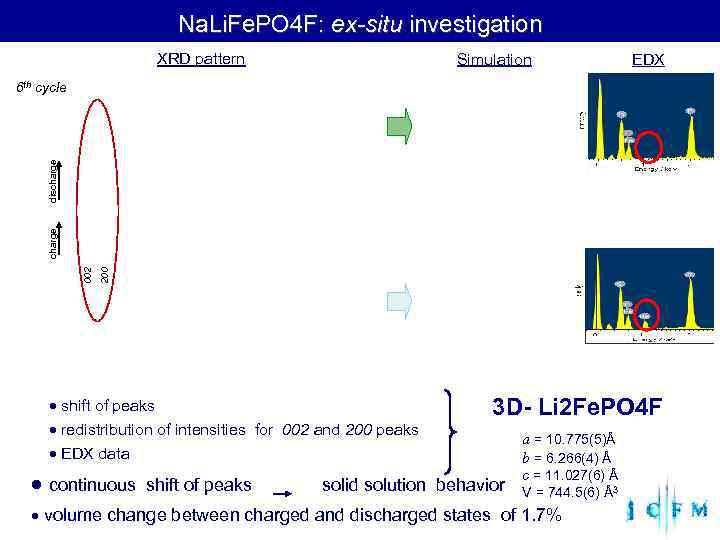 Na. Li. Fe. PO 4 F: ex-situ investigation XRD pattern Simulation EDX 6 th cycle discharge 002 200 shift of peaks 3 D- Li 2 Fe. PO 4 F redistribution of intensities for 002 and 200 peaks a = 10. 775(5)Å EDX data b = 6. 266(4) Å continuous shift of peaks solid solution behavior c = 11. 027(6) Å V = 744. 5(6) Å3 volume change between charged and discharged states of 1. 7%
Na. Li. Fe. PO 4 F: ex-situ investigation XRD pattern Simulation EDX 6 th cycle discharge 002 200 shift of peaks 3 D- Li 2 Fe. PO 4 F redistribution of intensities for 002 and 200 peaks a = 10. 775(5)Å EDX data b = 6. 266(4) Å continuous shift of peaks solid solution behavior c = 11. 027(6) Å V = 744. 5(6) Å3 volume change between charged and discharged states of 1. 7%
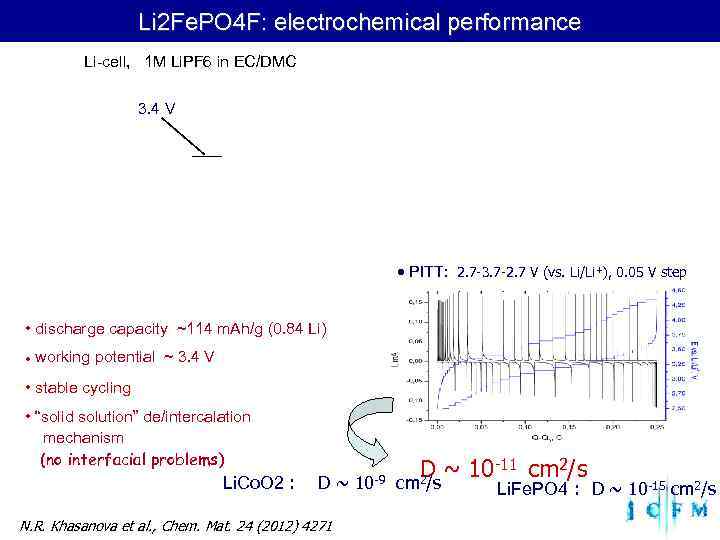 Li 2 Fe. PO 4 F: electrochemical performance Li-cell, 1 M Li. PF 6 in EC/DMC 3. 4 V PITT: 2. 7 -3. 7 -2. 7 V (vs. Li/Li+), 0. 05 V step • discharge capacity ~114 m. Ah/g (0. 84 Li) working potential ~ 3. 4 V • stable cycling • “solid solution” de/intercalation mechanism (no interfacial problems) Li. Co. O 2 : D~ 10 -9 D ~ 10 -11 cm 2/s cm 2/s Li. Fe. PO 4 : D ~ 10 -15 cm 2/s N. R. Khasanova et al. , Chem. Mat. 24 (2012) 4271
Li 2 Fe. PO 4 F: electrochemical performance Li-cell, 1 M Li. PF 6 in EC/DMC 3. 4 V PITT: 2. 7 -3. 7 -2. 7 V (vs. Li/Li+), 0. 05 V step • discharge capacity ~114 m. Ah/g (0. 84 Li) working potential ~ 3. 4 V • stable cycling • “solid solution” de/intercalation mechanism (no interfacial problems) Li. Co. O 2 : D~ 10 -9 D ~ 10 -11 cm 2/s cm 2/s Li. Fe. PO 4 : D ~ 10 -15 cm 2/s N. R. Khasanova et al. , Chem. Mat. 24 (2012) 4271
 КАТОДЫ ДЛЯ ЛИА С ВЫСОКОЙ УДЕЛЬНОЙ ЭНЕРГИИ улучшение энергоемкости: 2 Li на 1 переходный металл - Li 2 MPO 4 F слоистая 3 х-мерный каркас Решетка / Средний потенциал Теоретическая удельная диффузия Li+ отн. Li+/Li 0 , В энергия, Вт ч /кг Состав (в расчете на 1 / 2 иона Li+) Li. Fe. PO 4 3 D / 1 D 3. 45 580 Li 2 Fe. PO 4 F (каркасный) 3 D / 1 -2 D 3. 4 500 / >1000 Li 2 Mn. PO 4 F 3 D / 2 D 3. 9 570 / >1000 Li 2 Co. PO 4 F 3 D / 1 -2 D 5. 1 730 / >1500
КАТОДЫ ДЛЯ ЛИА С ВЫСОКОЙ УДЕЛЬНОЙ ЭНЕРГИИ улучшение энергоемкости: 2 Li на 1 переходный металл - Li 2 MPO 4 F слоистая 3 х-мерный каркас Решетка / Средний потенциал Теоретическая удельная диффузия Li+ отн. Li+/Li 0 , В энергия, Вт ч /кг Состав (в расчете на 1 / 2 иона Li+) Li. Fe. PO 4 3 D / 1 D 3. 45 580 Li 2 Fe. PO 4 F (каркасный) 3 D / 1 -2 D 3. 4 500 / >1000 Li 2 Mn. PO 4 F 3 D / 2 D 3. 9 570 / >1000 Li 2 Co. PO 4 F 3 D / 1 -2 D 5. 1 730 / >1500
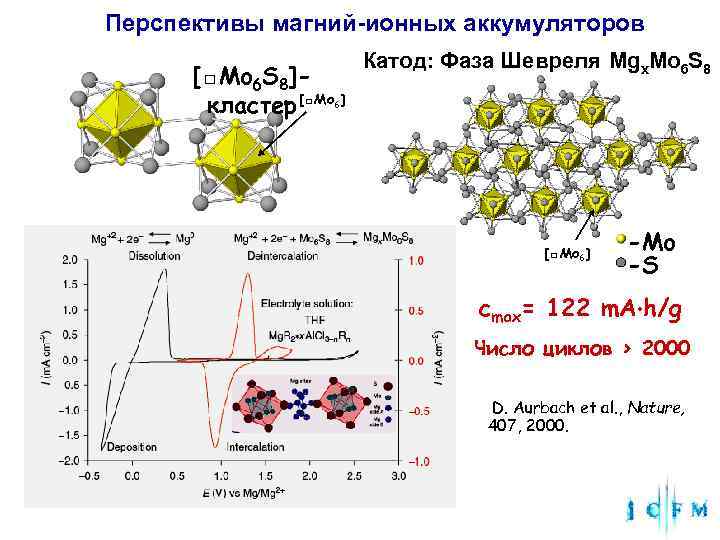 Перспективы магний-ионных аккумуляторов Катод: Фаза Шевреля Mgx. Mo 6 S 8 [□Mo 6 S 8]- кластер [□Mo ] 6 [□Mo 6] -Mo -S cmax= 122 m. A h/g Число циклов > 2000 D. Aurbach et al. , Nature, 407, 2000.
Перспективы магний-ионных аккумуляторов Катод: Фаза Шевреля Mgx. Mo 6 S 8 [□Mo 6 S 8]- кластер [□Mo ] 6 [□Mo 6] -Mo -S cmax= 122 m. A h/g Число циклов > 2000 D. Aurbach et al. , Nature, 407, 2000.
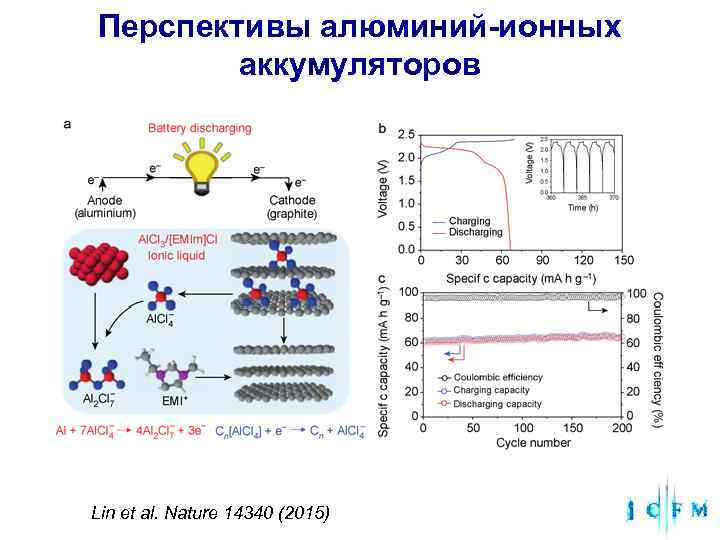 Перспективы алюминий-ионных аккумуляторов Lin et al. Nature 14340 (2015)
Перспективы алюминий-ионных аккумуляторов Lin et al. Nature 14340 (2015)
 Возможные направления развития? 1) Новые типы электродных материалов: Фторфосфаты Фторсульфаты Силикаты Бораты и др. 2) Новые электролиты 3) Нанокомпозиты 4) Магниевые аккумуляторы
Возможные направления развития? 1) Новые типы электродных материалов: Фторфосфаты Фторсульфаты Силикаты Бораты и др. 2) Новые электролиты 3) Нанокомпозиты 4) Магниевые аккумуляторы


