РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ-2013.pptx
- Количество слайдов: 90
РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ Кафедра патофизиологии Сиб. ГМУ доктор мед. наук, врач иммунологаллерголог Е. Г. Чурина

ПЛАН ЛЕКЦИИ ЧТО ТАКОЕ ИММУНИТЕТ? ВИДЫ ИММУНИТЕТА ХАРАКТЕРИСТИКА ВРОЖДЕННОГО И ПРИОБРЕТЕННОГО ИММУНИТЕТА ВИДЫ И СВОЙСТВА АНТИГЕНОВ СТРУКТУРА ИММУННОЙ СИСТЕМЫ МЕХАНИЗМ ФОРМИРОВАНИЯ ИММУННОГО ОТВЕТА, ХАРАКТЕРИСТИКА ЕГО СТАДИЙ РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА НАРУШЕНИЯ ИММУНИТЕТА, ИХ ВИДЫ ХАРАКТЕРИСТИКА ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ

Исторические факты Рождение иммунологии как науки связано с именем Л. Пастера (фр. ). В 1880 г. в ходе проведения исследований по созданию и испытанию вакцин Пастер впервые ввел термин «иммунитет» (от лат. Immunitas – освобождение). Феодальное право обозначало этим термином наличие привилегий, например, освобождение от налогов. В правовом аспекте этот термин сохранился и до наших дней – дипломатический иммунитет. Слово «иммунитет» с медицинским значением ( «освобождение от болезни» ) впервые зафиксировано в 1869 г. в словаре Литтре.

В концепции современной иммунологии ИММУНИТЕТ – это способность организма поддерживать постоянство своего макромолекулярного состава путем удаления генетически чужеродных молекул, что обеспечивает устойчивость к инфекционным агентам и резистентность к развитию опухолей (А. А. Ярилин, 2010)

Виды иммунитета Врожденный или естественный иммунитет Адаптивный или приобретенный иммунитет

I. Врожденный иммунитет В основе его лежат воспаление и фагоцитоз, является «первой линией защиты» Ранее считалось, что фагоцитоз неспецифичен, сейчас доказано, что дендритные клетки и макрофаги с помощью специфических PRRs, в числе которых TLRs-, NOD- и другие рецепторы распознают образы патогенностимолекулярные паттерны (PAMP)-молекулы присущие только микроорганизмам и отсутствующие у многоклеточных и таким образом отличают микробы от клеток своего организма

Разнообразие TOLL-like-рецепторов HSP 60, HSP 70, GP 96 Фибронектин Фибрин/фибриноген Дефенсины Эластаза Пептидогликан Липопротеины Зимозан Некоторые формы ЛПС TLR 7/8 Одноцепочечная РНК Уропатогенные бактерии Мурамилдипептид NOD 1 NOD 2 TLR 9 Олигодезоксинуклеотид Cp. G (тип А, В, С) TLR 11 TLR 3 ? TLR 10 TLR 1 м. РНК хозяина Двуцепочечная РНК Зимозан Диацилированны е липопептиды Пептидогликан Липотейхоевая кислота TLR 6 TLR 5 TLR 2 Триацилированные липопептиды TLR 4 Липотейхоевая кислота ф л а г е л л и н

Нобелевская премия-2011 в номинации «Физиология и медицина» Ральф Ма рвин Шта йнман (14 января 1943 — 30 сентября 2011) — американский иммунолог и цитолог канадского происхождения, лауреат нобелевской премии по Жюль Альфо нс Хо ффман (род. физиологии и медицине за 2011 1941) — французский год «за открытие дендритных иммунолог и цитолог, лауреат клеток и изучение их значения нобелевской премии по для приобретённого физиологии и медицине за 2011 иммунитета» . Является третьим в год (совместно с Брюсом истории премии лауреатом, Бётлером и Ральфом награждённым посмертно. Штейнманом) «за исследование активации врождённого иммунитета» . Брюс Бётлер (род. 29 декабря 1957, Чикаго) — американский врач и учёный медик, лауреат нобелевской премии по физиологии и медицине за 2011 год

Дендритные клетки - основа врожденного иммунитета Все ключевые иммунные реакции в организме всегда начинаются с дендритных клеток, именно они обеспечивают запуск адаптивного иммунитета и способны активировать наивные Тлимфоциты

Основная функция клеток врожденного иммунитета
Интересно, что презентационн ый потенциал дендритной клетки на два порядка превосходит таковой макрофага!

Однако макрофагам и дендритным клеткам свойственны и другие важные функции: эффекторная и регуляторная Таким образом, функционирование клеток врожденного иммунитета основано на распознавании чужеродных молекул, присущих возбудителям инфекций и уничтожение их носителей с помощью комплекса реакций, из которых ключевым является фагоцитоз и представлении АГ Т-лимфоцитам

В реакциях врожденного иммунитета участвуют и иные клетки. Кроме того, особенности системы врожденного иммунитета обусловлены наследственными анатомо физиологическими особенностями организма (см. учебник стр. 327 328) Факторы естественной резистентности включаются в защиту сразу после преодоления возбудителем кожных или слизистых оболочек и внедрения его во внутреннюю среду организма. В течение первых 3 4 х часов после внедрения микроба, они являются практически единственными защитниками организма.

II. Адаптивный иммунитет Формируется в течение всей жизни индивида Основан на индивидуальном распознавании антигенов – макромолекул, обычно чужеродных, но не всегда связанных с патогенами Лимфоциты распознают антигены (их 1018 ) и способствуют их деструкции

Адаптивный иммунитет высоко избирателен и высоко специфичен, что может способствовать аутоиммунным повреждениям Для запуска адаптивного иммунитета абсолютно необходима предварительная активация врожденного Имеет главные преимущества перед врожденным иммунитетом – формирование иммунологической памяти и способность к иммунологической толерантности – отсутствие иммунного ответа при наличии в организме антигена
Лимфоциты – материальные носители адаптивного иммунитета Главное преимущество лимфоцитов состоит в том, что они способны запоминать антигены и при повторном их поступлении реализовывать оперативный и эффективный вторичный иммунный ответ

Все лимфоциты имеют разные рецепторы Число клонов наивных Т лимфоцитов составляет 107 108 Каждый лимфоцит обладает своим рецептором уникальной специфичности, способным распознавать молекулы, принадлежащие только определенному виду и штамму микроорганизмов.

Факторы врожденного и приобретенного иммунитета Врожденный иммунитет (естественная резистентность) Приобретенный (адаптивный) иммунитет и формы иммунного реагирования Механические и физиологические факторы защиты: кожа и слизистые оболочки (сальные и потовые железы, мерцательный эпителий слизистых оболочек, слизь, слюна, слёзы, кислое p. H желудка, пищеварительные ферменты), температура тела, гормональный баланс, чихание, выделение токсических продуктов с мочой и калом. Формы иммунного реагирования: Клеточные и гуморальные факторы защиты: фагоциты (фагоцитоз), естественные киллеры (NK), Tγδ- , B 1(CD 5+)-лимфоциты, нормальная макрофлора тела, лизоцим, секреты кожи и слизистых оболочек, комплемент, фибронектин, цитокины (в т. ч. интерфероны – ИФН), белки острой фазы, естественные антитела, антимикробные пептиды Клеточные и гуморальные* факторы защиты (иммунореагенты): 1. Антителообразование 2. Киллерная функция лимфоцитов 3. Аллергия, ГНТ и ГЗТ 4. Иммунологическая память 5. Иммунологическая толерантность CD 4+- T-хелперы (Tн 1, Tн 2, Tн 3), Treg, CD 8+ цитотоксические T-лимфоциты (ЦТЛ), В-лимфоциты, активированные фагоциты, антитела (иммуноглобулины) *По основным иммунореагентам различают гуморальный иммунный ответ (антителообразование) и клеточный иммунный ответ, иммунореагентами которого являются фагоциты, Th 17 и цитотоксические Т-лимфоциты
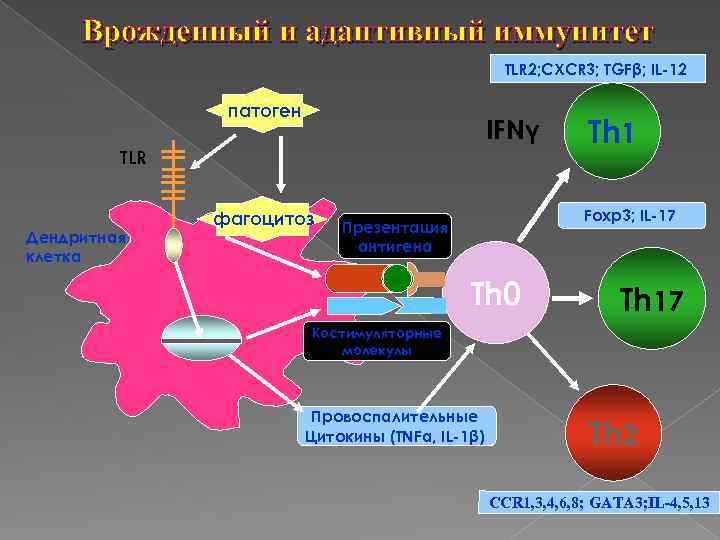
Врожденный и адаптивный иммунитет TLR 2; CXCR 3; TGFβ; IL-12 патоген IFNγ TLR Дендритная клетка фагоцитоз Тh 1 Foxp 3; IL-17 Презентация антигена Th 0 Тh 17 Костимуляторные молекулы Провоспалительные Цитокины (TNFα, IL-1β) Тh 2 ИЛ-4 ССR 1, 3, 4, 6, 8; GATA 3; IL-4, 5, 13

АНТИГЕНЫ Антигены (АГ) – это генетически чужеродные вещества, вызывающие иммунный ответ. Характеристика АГ (см. учебник стр. 329)

Иммунная система Это система, обеспечивающая иммунитет, эволюционно она формировалась для защиты макроорганизма от любых объектов, чужеродных в антигенном отношении
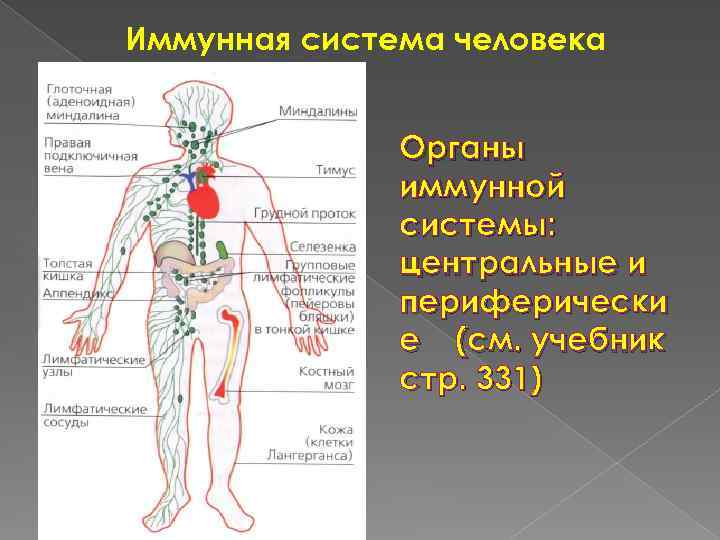
Иммунная система человека Органы иммунной системы: центральные и периферически е (см. учебник стр. 331)

Функции иммунной системы 1. Защита от «чужого» 2. Удаление «модифицированного своего» (опухолевые, инфицированные, стареющие и поврежденные клетки) 3. Регуляция роста и развития клеток и тканей 4. Сохранение «чужого в своем» или новая акцептивная функция! В чем она заключается?

Адаптивный иммунитет нужен не для борьбы, а для сожительства Акцептивная функция иммунитета (Климович В. Б. , Ж. Эвол. Биох. Физиол. 2002; Margaret Mc. Fall Ngai, Nature 2007) Климович Владимир Борисович ЦНИРРИ, Санкт-Петербург Margaret Mc. Fall-Ngai UW -Madison School of Medicine and Public Health
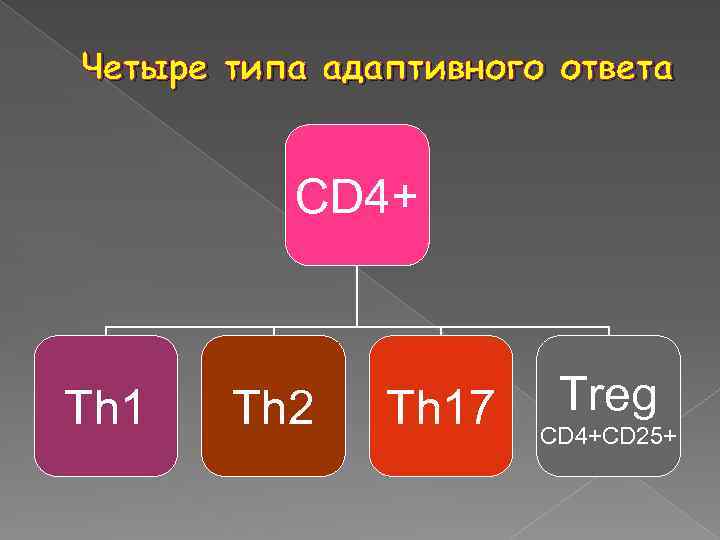
Четыре типа адаптивного ответа CD 4+ Th 1 Th 2 Th 17 Treg CD 4+CD 25+
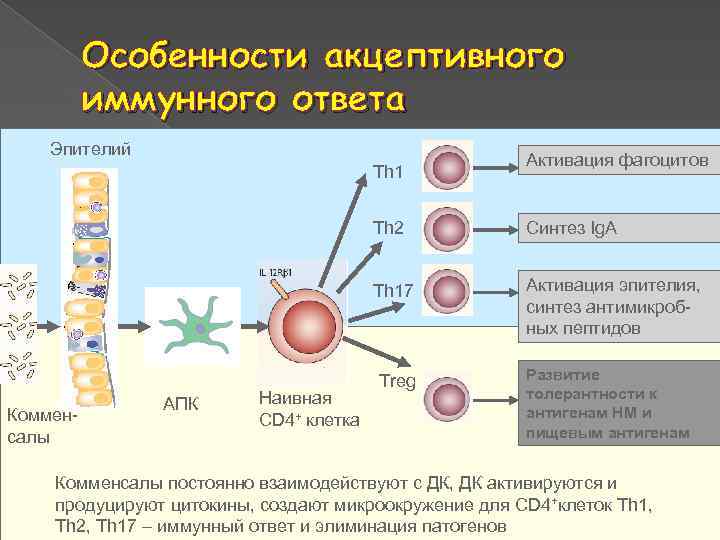
Особенности акцептивного иммунного ответа Эпителий Th 1 Активация фагоцитов Th 2 Th 17 Комменсалы АПК Наивная CD 4+ клетка Синтез Ig. A Активация эпителия, синтез антимикробных пептидов Treg Развитие толерантности к антигенам НМ и пищевым антигенам Комменсалы постоянно взаимодействуют с ДК, ДК активируются и продуцируют цитокины, создают микроокружение для CD 4+клеток Th 1, Th 2, Th 17 – иммунный ответ и элиминация патогенов
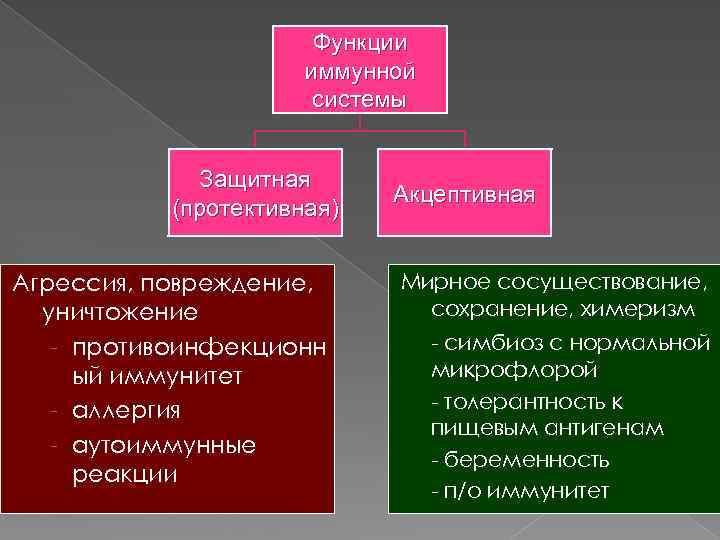
Функции иммунной системы Защитная (протективная) Агрессия, повреждение, уничтожение противоинфекционн ый иммунитет аллергия аутоиммунные реакции Акцептивная Мирное сосуществование, сохранение, химеризм симбиоз с нормальной микрофлорой толерантность к пищевым антигенам беременность п/о иммунитет

Клетки иммунной системы (см. учебник стр. 332 -333) Антигенпредставляющие клетки: макрофаги, дендритные клетки, В лф Регуляторные клетки: Т хелперы и Тreg Эффекторные клетки: плазматические клетки, цитотоксические Т лф (К клетки), ТГЗТ лф, NKT , γδT клетки, натуральные киллеры (NK клетки), моноциты/макрофаги, тучные клетки, гранулоциты – нейтрофильные, эозинофильные и базофильные Клетки памяти: Т и В клетки памяти
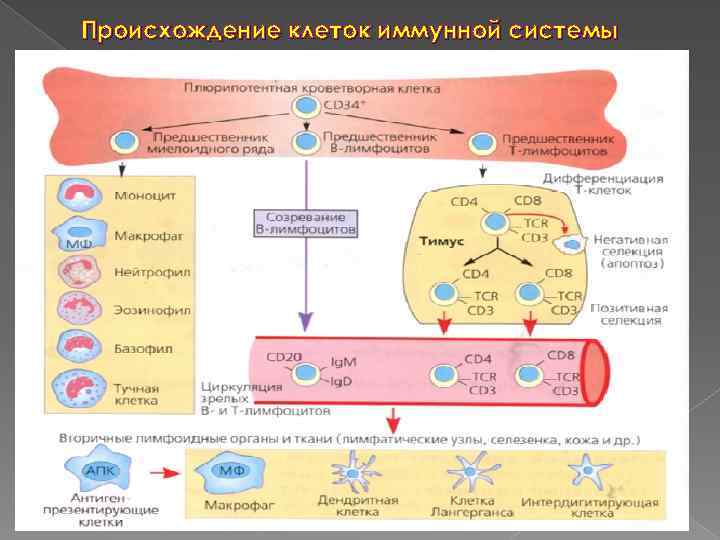
Происхождение клеток иммунной системы

Молекулы иммунной системы 1. CD молекулы (cluster of differentiation – кластеры дифференцировки) – CD 3, 4, 8, 16 2. Антигенпредставляющие, антигенраспознающие и антигенсвязывающие молекулы – иммуноглобулины, TCR, BCR, HLA 3. Адгезивные молекулы – интегрины, селектины 4. Иммунорегуляторные цитокины – IL, IFN, RF 5. Медиаторы воспаления – комплемент, ПГ, ЛТ Структуру и функции молекул иммунной системы изучить самостоятельно на стр. учебника 333 339!

Иммунный ответ это процесс взаимодействия клеток иммунной системы, который индуцируется антигеном и приводит к образованию антител или эффекторных клеток, уничтожающих данный антиген по механизму формирования различают 2 типа иммунного ответа: клеточный (Т клеточный или CTL , Th 17 зависимый); гуморальный (Th 2 , Th 9 , Tf. H зависимый или В клеточный)

Клеточный иммунный ответ Осуществляется Т лимфоцитами Регулируется Th 1/Th 17 Направлен на защиту преимущественно от внутриклеточных патогенов Его характер зависит от доминирующего направления дифференцировки Т клеток В результате образуются эффекторные Т хелперы (CD 4+) и/или CTL (CD 8+) и соответствующие им Т клетки памяти

Основные этапы 1. Презентация ДК антигена CD 4 или CD 8 Т лф, приводящая к их активации 2. IL 2 зависимая пролиферация Th 1 или CD 8 лимфоцитов и их дифференцировка 3. Взаимная активация АПК и Т лимфоцитов, выделение цитокинов 4. Активация цитолиза клеток мишеней и/или цитолиз в фагосомах АПК

Клеточный иммунный ответ
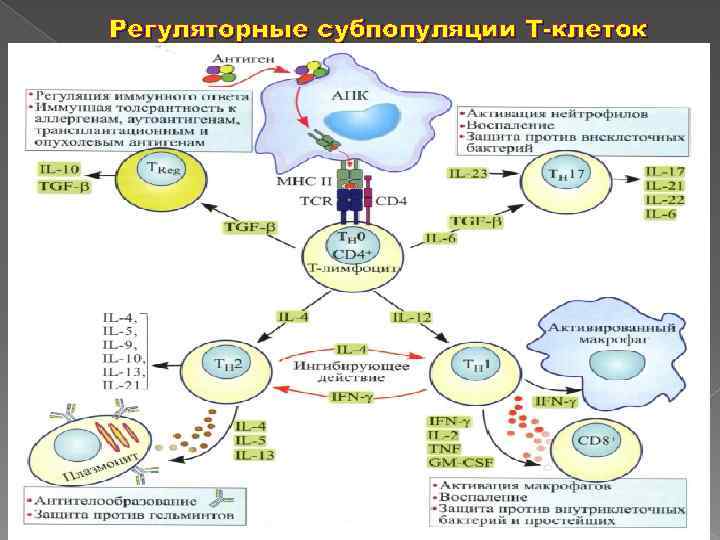
Регуляторные субпопуляции Т-клеток

От каких факторов зависит выбор иммунной системой пути иммунного ответа? Этот вопрос обсудить на практических занятиях.

Гуморальный иммунный ответ Осуществляется В лимфоцитами Регулируется в основном Th 2, но возможно Tf. H (фолликулярные Т хелперы), Th 9 Направлен на защиту преимущественно от внеклеточных патогенов Цель – образование антител, специфичных к антигенам возбудителя В результате образуются плазматические клетки и В клетки памяти

Основные этапы 1. Стимуляция В клетки антигеном с участием Т хелперов 2. Активация и пролиферация В клеток (пролиферативная экспансия клона) 3. Дифференцировка В клеток в плазматические клетки и В клетки памяти

Гуморальный иммунный ответ

Стадии иммунного ответа – самостоятельно, см. учебник стр. 339 -347 1. Эндоцитоз антигена, его обработка и презентация лимфоцитам; 2. Распознавание антигена лимфоцитами; 3. Активация лимфоцитов; 4. Клональная экспансия или пролиферация лимфоцитов; 5. Созревание эффекторных клеток и клеток памяти. 6. Деструкция антигена.

Регуляция иммунного ответа «…иммунный ответ требует надежного контроля и регуляции, которые с одной стороны, должны обеспечить его эффективность, а с другой – ограничить его в безопасных для организма рамках» . А. А. Ярилин

Регуляция иммунного ответа Внутрисистемная Печеночная Генетический контроль иммунного ответа Эндокринная и нервная регуляция иммунного ответа (см. учебник стр. 347 349)

Цитокиновая регуляция иммунного ответа Цитокины являются своеобразным «рабочим инструментом» иммунной системы и функционируют в тесной взаимосвязи между собой Секретируются многими клетками организма и обладают такими важными свойствами как взаимозаменяемость и индуцибельность (активация продукции только при воздействии АГ)

Классификация цитокинов По функциям: провоспалительные: IL 1, 6, 12, 17, 18, TNFα, CSF противовоспалительные с иммуносупрессорной активностью: IL 4, 5, IL 10, 13, TGFβ По «профилю» иммунокомпетентных клеток:

ДИФФЕРЕНЦИРОВКА Т-ХЕЛПЕРНЫХ КЛОНОВ IL-21 Fox. P 3 Тх0 Treg CD 4+CD 25+ TSLP Тfh IL-12 IL-4 IL-18 TSLP IL-23 IL-33 IL-1α/β T-bet GATA-3 C-maf IL-27 IL-35 IL-10 TGFb RORγt Тх1 Тх2 Tx 17 Tx 10 ? Тх9 IFN-γ IL-2 TNF IL-4 IL-5 IL-13 IL-17 IL-10 IL-21 TGFb IL-9 IL-22 Клеточный Гуморальный Воспаление. Регуляция иммунитет. Аутоиммунитета Аллергия

Регуляторные Т-клетки (Treg) с супрессорной активностью Являются гетерогенной популяцией по фенотипу, цитокиновому профилю, механизму действия, клеткам мишеням, функциям в организме – «универсальные регуляторы» Анергичны – вызывают иммунологическую толерантность Основная функция Treg клеток состоит в предотвращении проявлений активности аутореактивных Т клеток и поддержании состояния периферической иммунологической толерантности к собственным антигенам – предотвращают развитие аутоиммунных заболеваний

Участвуют в противоинфекционном, противоаллергическом, противоопухолевом и трансплантационном иммунитете Контролируют продолжительность и интенсивность иммунного ответа Регулируют иммунологические механизмы вынашивания плода Преимущественно имеют фенотип CD 4+CD 25+Foxp 3+ и в больших количествах продуцируют супрессорные цитокины IL-10, TGFβ, IL-35
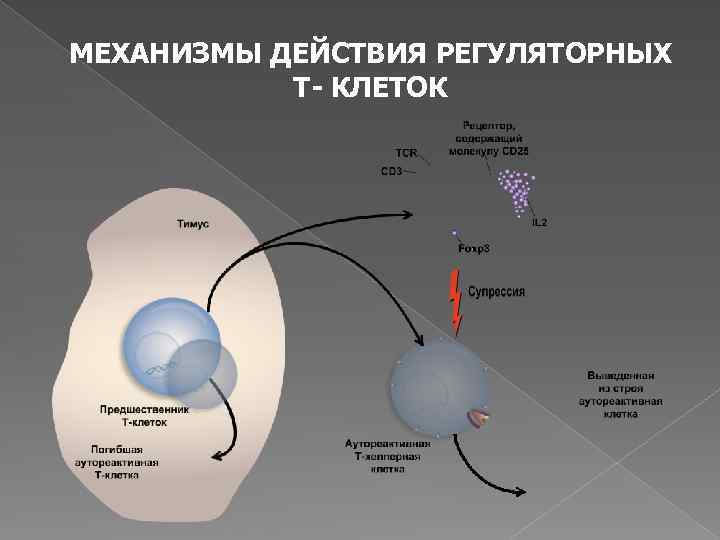
МЕХАНИЗМЫ ДЕЙСТВИЯ РЕГУЛЯТОРНЫХ Т- КЛЕТОК
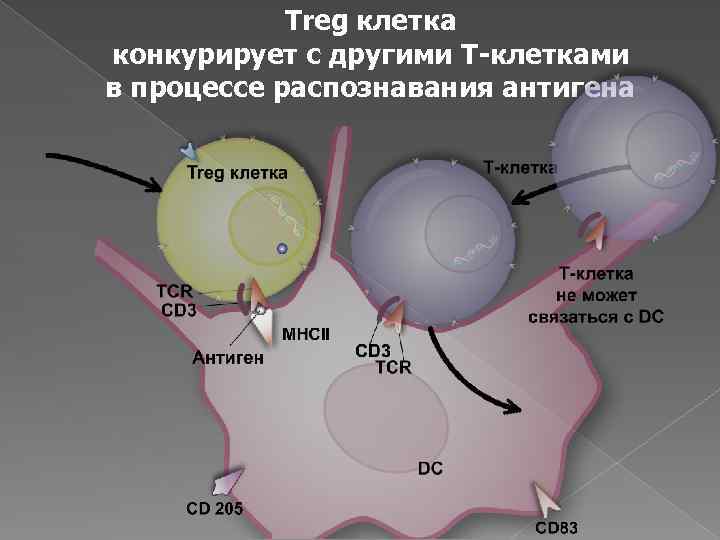
Treg клетка конкурирует с другими T-клетками в процессе распознавания антигена

Treg клетка подавляет активность других клеток путем межклеточных взаимодействий

Патологические эффекты Treg Дефицит количества и функциональной активности: первичный иммунодефицит (IPEX синдром), аллергия, аутоиммунная патология, не вынашивание беременности, отторжение трансплантата Увеличение количества и функциональной активности: вторичные иммунодефициты, хронические инфекции, злокачественные новообразования

Иммунопатология Иммунодефициты • Аутоиммунные заболевания • Аллергические заболевания • Лимфопролиферат ивные заболевания – опухоли иммунной системы •
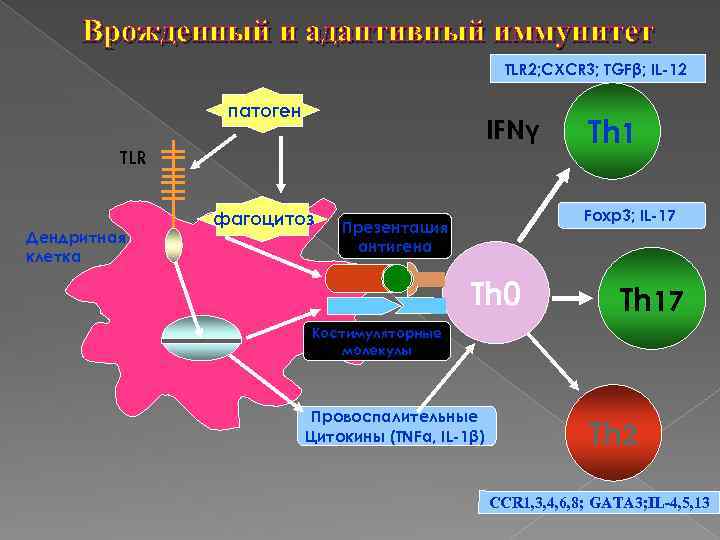
Врожденный и адаптивный иммунитет TLR 2; CXCR 3; TGFβ; IL-12 патоген IFNγ TLR Дендритная клетка фагоцитоз Тh 1 Foxp 3; IL-17 Презентация антигена Th 0 Тh 17 Костимуляторные молекулы Провоспалительные Цитокины (TNFα, IL-1β) Тh 2 ИЛ-4 ССR 1, 3, 4, 6, 8; GATA 3; IL-4, 5, 13

ИММУНОДЕФИЦИТЫ ПЕРВИЧНЫЕ ВТОРИЧНЫЕ q Повышенная чувствительность к инфекциям q Аутоиммунные заболевания q Опухоли q Аллергия

ПРИЗНАКИ НАЛИЧИЯ ИММУНОДЕФИЦИТА: НАСТОРАЖИВАЮЩИЕ АСПЕКТЫ ¨ Частые заболевания верхних дыхательных путей: дошкольники: 9 раз в год (удваивается при посещении д/с) школьники: 5 -6 взрослые: 3 -4 ¨ Повторные кожные гнойные процессы. ¨ Упорная молочница у детей старше 1 г. ¨ Атипичные возбудители (пневмоциста и др. ) ¨ Повторные поносы.

НАСТОРАЖИВАЮЩИЕ АСПЕКТЫ ¨Позднее отпадение пуповины (более 2 недель). ¨ Частый жидкий стул, кровавые поносы. ¨ Геморрагический синдром у ребенка первых месяцев жизни. ¨ БЦЖит, вакцинальная инфекция. ¨ “Отсутствие” лимфоузлов, гипотрофия миндалин.

Первичные иммунодефициты- генетически детерминированные или врожденные синдромы, характеризующиеся нарушением количества и/или функциональной активности иммунокомпетентных клеток, неспецифических факторов защиты и приводящие к увеличению частоты инфекций, аутоиммунных, аллергических и опухолевых заболеваний

Первичные иммунодефициты (ПИД) Дефициты системы фагоцитов (нейтопения, синдром «ленивых лейкоцитов» , дефицит молекул адгезии и др. ) Дефициты системы комплемента (аутосомно доминантный дефицит С 1 ингибитора – наследственный ангионевротический отек) Дефициты антител (болезнь Брутона, ОВИН, селективный дефицит Ig. A и др. )

АГАММАГЛОБУЛИНЕМИЯ С ДЕФИЦИТОМ В-КЛЕТОК Ø Ø Х-СЦЕПЛЕННАЯ АГАММАГЛОБУЛИНЕМИЯ С ДЕФИЦИТОМ В-КЛЕТОК (болезнь Брутона) – мутация в гене btk – дефицит В-клеточной тирозинкиназы АУТОСОМНО-РЕЦЕССИВНЫЕ ФОРМЫ АГАММАГЛОБУЛИНЕМИИ – мутации в генах µH, λ 5, Vpre. B, Igα, BLNK, LRRC 8 ОБЩАЯ ВАРИАБЕЛЬНАЯ ИММУННАЯ НЕДОСТАТОЧНОСТЬ (ОВИН) АУТОСОМНО-РЕЦЕССИВНЫЕ ФОРМЫ – мутации в генах BAFF-R, Blimp-1, ICOS Ø (индуктор-костимулятор Т-клеток) Ø АУТОСОМНО-ДОМИНАНТНОЕ ИЛИ АУТОСОМНО-РЕЦЕССИВНОЕ НАСЛЕДОВАНИЕ – мутация в гене TACI (трансмембранный активатор, кальций-модулирующий циклофилин-лиганд кооператор)

Т-клеточные ПИД : синдром Ди-Джорджи (синдром делеции 22 хромосомы) порок развития первого и второго жаберных карманов – порок развития лицевых структур порок развития третьего-четвертого глоточных карманов – агенезия или дисгенезии паращитовидных желез и тимуса порок развития пятого кармана – широкий спектр врожденных пороков сердца с частым вовлечением дуги аорты Классическая триада: гипоплазия тимуса и/или паращитовидных желез врожденный порок сердца
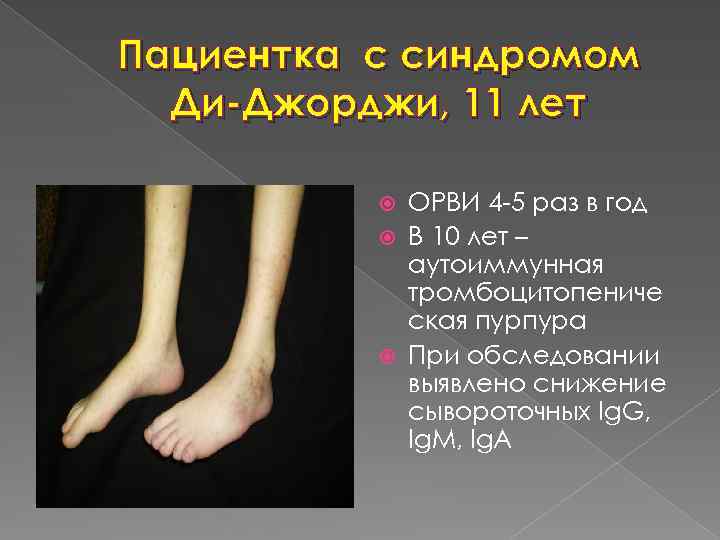
Пациентка с синдромом Ди-Джорджи, 11 лет ОРВИ 4 5 раз в год В 10 лет – аутоиммунная тромбоцитопениче ская пурпура При обследовании выявлено снижение сывороточных Ig. G, Ig. M, Ig. A

Синдром Ди-Джорджи

Комбинированные ПИД – тяжелая комбинированная иммунологическая недостаточность (ТКИН) Лимфоцитопения Агаммаглобулинемия Отсутствие специфических АТ Снижение пролиферативной активности лимфоцитов Часто гематологические нарушения (тромбоцитопения, анемия, нейтропения)

Т-лимфоцитопения, агранулоцитоз, сепсис, грибковый дерматит и мукозит, БЦЖ-ит локальный

ТКИН – клинические примеры: БЦЖит

СИНДРОМ ВИСКОТТА-ОЛДРИЧА КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ Ø Ø ГЕМОРРАГИЧЕСКИЙ СИНДРОМ: ГЕМОРРАГИЧЕСКАЯ СЫПЬ, НОСОВЫЕ, КИШЕЧНЫЕ, ПОЧЕЧНЫЕ КРОВОТЕЧЕНИЯ, КРОВОИЗЛИЯНИЯ ПОСЛЕ ТРАВМ ЭКЗЕМА Ø БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ РАЗЛИЧНОЙ ЛОКАЛИЗАЦИИ Ø ВИРУСНЫЕ ИНФЕКЦИИ (CMV, HHV) Ø Ø Ø ОППОРТУНИСТИЧЕСКИЕ ИНФЕКЦИИ АУТОИММУННЫЕ РАССТРОЙСТВА (ВАСКУЛИТ, ГЕМОЛИТИЧЕСКАЯ АНЕМИЯ, НЕЙТРОПЕНИЯ, ТРОМБОЦИТОПЕНИЯ, ГЛОМЕРУЛОНЕФРИТ) ПОВЫШЕННАЯ СКЛОННОСТЬ К РАЗВИТИЮ ОПУХОЛЕЙ

СИНДРОМ ВИСКОТТА-ОЛДРИЧА: ЭКЗЕМА

СИНДРОМ ВИСКОТТА-ОЛДРИЧА: ГЕМОРРАГИЧЕСКИЙ СИНДРОМ
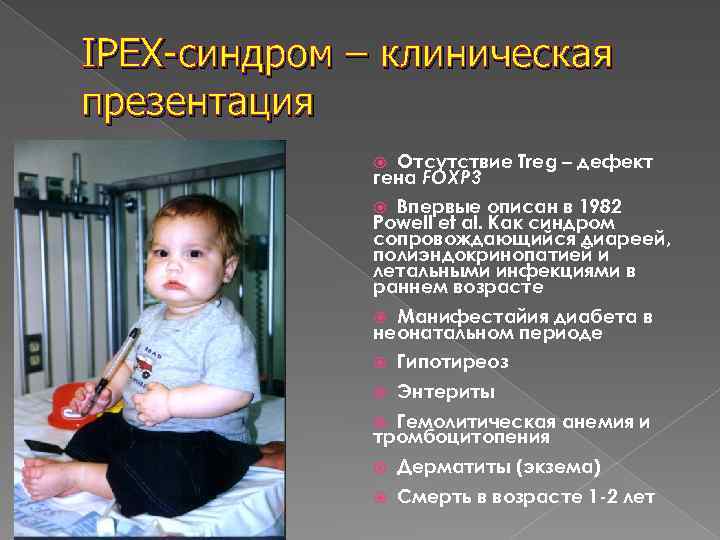
IPEX-синдром – клиническая презентация Отсутствие Treg – дефект гена FOXP 3 Впервые описан в 1982 Powell et al. Как синдром сопровождающийся диареей, полиэндокринопатией и летальными инфекциями в раннем возрасте Манифестайия диабета в неонатальном периоде Гипотиреоз Энтериты Гемолитическая анемия и тромбоцитопения Дерматиты (экзема) Смерть в возрасте 1 -2 лет

Вторичный иммунодефицит (ВИД) это нарушения иммунной защиты организма вследствие действия ненаследственных индукторных (т. е. способствующих развитию ВИД) факторов единая и общепринятая классификация ВИД не разработана и в МКБ 10 не представлена, так как различные варианты ВИД не являются самостоятельными нозологически ми формами, а лишь сопутствуют течению заболеваний

ВИД Спонтанный (этиологический фактор не установлен) Приобретенный (СПИД ) – причина ВИЧ, не путать ВИЧ инфицирование и СПИД – это клиническая манифестация! Индуцированный – вызван воздействием конкретных болезнетворных факторов (например, ионизирующим излучением)

ВИД Физиологический (младенцы, пожилые, беременные, кратковременный стресс) Патологический(хронические рецидивирующие вирусные, бактериальные и грибковые инфекции, неблагоприятные климатические условия, дефицит природных факторов, например, микроэлементов, или, напротив, их повышенное содержание, повышенный естественный фон радиации и др. )

ВИД Инфекционный синдром (критерий – наличие хронических рецидивирующих или повторяющихся острых инфекционных заболеваний); Аллергический синдром (критерий – наличие иммунопатологии, обусловленной реализацией иммунопатологических реакций «реагинового» типа); Аутоиммунный синдром (критерий – иммунопатология, обусловленная дисбалансом периферической толерантности к антигенам организма); Иммунопролиферативный синдром (критерий – наличие лимфопролиферативных процессов)

ПАТОГЕНЕЗ ВТОРИЧНЫХ ИММУНОДЕФИЦИТОВ Патогенез ВИД во многом определяется вызвавшими его причинами. Например, при туберкулезной инфекции главным патогенетическим фактором ВИД является увеличение количества регуляторных Тклеток и их функциональной активности (Е. Г. Чурина и соавт. , 2012). ПГ факторы ВИД разобрать на практических занятиях.

Herpes zoster
Грибковое поражение ногтей
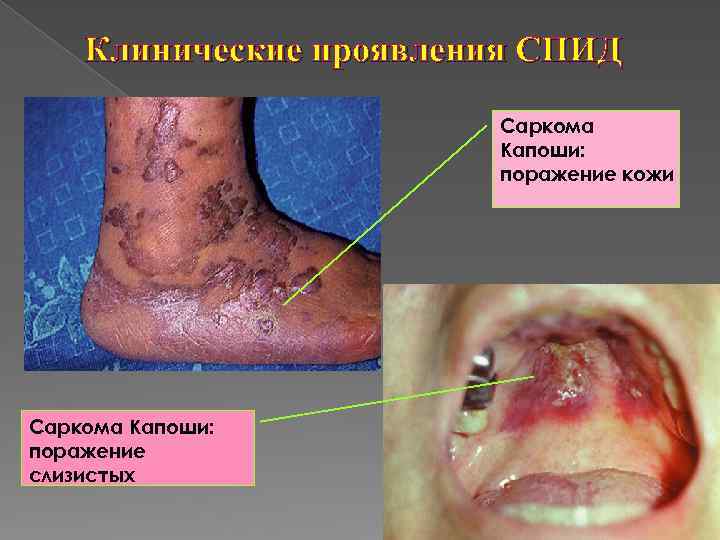
Клинические проявления СПИД Саркома Капоши: поражение кожи Саркома Капоши: поражение слизистых

Аутоиммунные заболевания (АИЗ) заболевания, основой патогенеза которых служит развитие самоподдерживающегося иммунного ответа (гуморального и/или Тклеточного) на собственные антигены организма, что приводит к повреждению клеток, содержащих аутоантиген (А. А. Ярилин, 2010 с дополн. )
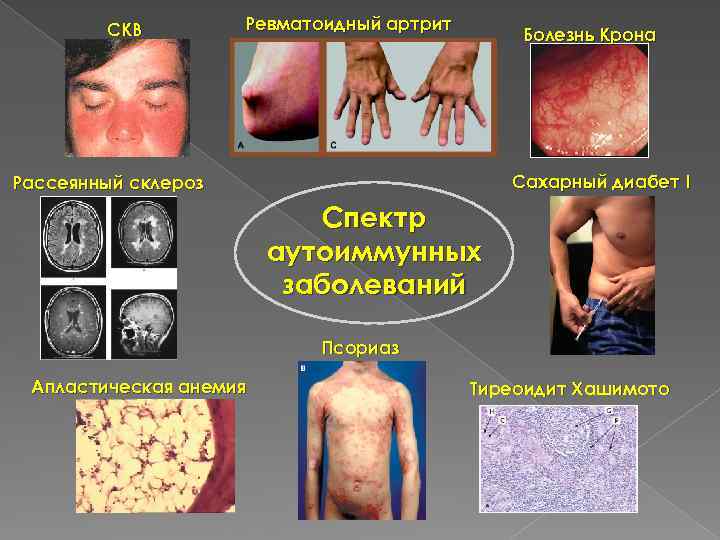
СКВ Ревматоидный артрит Болезнь Крона Сахарный диабет I Рассеянный склероз Спектр аутоиммунных заболеваний Псориаз Апластическая анемия Тиреоидит Хашимото

АУТОИММУНИТЕТ - способность иммунной системы распознавать и специфически реагировать на собственные антигены Физиологические аутоиммунные процессы (не сопровождаются повреждением) • резидуальные клоны аутореактивных Т лимфоцитов • CD 5+ B 1 лимфоциты, естественные Ig. M аутоантитета Периферическая толерантность Центральная иммунологическая толерантность Патологические аутоиммунные процессы (вызывают повреждение, иммунное воспаление) Аутоиммунные заболевания • Th 1 зависимые • Th 2 зависимые

Причины развития АИЗ ГЭФ – нарушение толерантности к аутоантигенам Предрасполагающие факторы: 1. Генетические 2. Первичные иммунодефициты (нарушение формирования иммунологической толерантности) 3. Патология вилочковой железы (тимома, дисплазия тимуса: нарушение внутритимусной селекции клонов Т лифоцитов) 4. Половой диморфизм (соотношение больных АИЗ ♀: ♂ = 3: 1 10: 1) Андрогены – иммуносупрессорная активность Эстрогены – иммуностимулирующая активность

Причины развития АИЗ Инициирующие (способствующие) факторы: 1. Инфекция Бактериальная (модификация АГ собственных тканей, перекрёстные реакции): β гемолитический стрептококк А и субсарколема миокарда ( ревматизм); β гемолитический стрептококк А 12 и эндотелий почечных клубочков (нефрит); АГ E. coli 014, 086 и эпителий толстой кишки (неспецифический язвенный колит); АГ Klebsiela и HLA B 27 (анкилозирующий спондилоартрит) Вирусная ( «неоантигены» , трансактивация генов) – аутоиммунный сахарный диабет 1 типа 2. Нарушение аутораспознавания Неадекватная экспрессия белков MHC II класса 3. Нарушение функции иммунорегуляторных клеток, цитокинов Преобладание активации Th 1: ревматоидный артрит Th 2: сист. красная волчанка 4. Снижение количества и функциональной активности Treg

5. Поликлональная активация иммунной системы (вакцинация, немотивированное назначение иммуностимулирующих препаратов!) 6. Дефект апоптоза 7. Поступление в кровоток антигенов тканей, в норме изолированных от иммунной системы (мозг, хрусталик, щитовидная железа, тестикулы), например, при травме глаза часто развивается АИЗ второго глаза – симпатическая офтальмия

Патогенез аутоиммунных заболеваний (см. учебник стр. 397 -402) на примере рассеянного склероза

Патогенез АИЗ на примере РС 1) Ключевое событие в патогенезе рассеянного склероза – срыв аутотолерантности к АГ миелина и активация аутореактивных Тh 0, распознающих эпитопы этих АГ. Мех-м: молекулярная мимикрия АГ вируса под АГ миелина перекрестная имм. реакция. 2) Нед-ть Treg, нед ть противовоспалительных цитокинов 3) Активация миелинреактивных Th 1 и их цитокинов, которые привлекают АПК в очаг воспаления 4) Аутоиммунное воспаление прогрессирует, демиелинизация, повреждение аксонов, неврологическая симптоматика.

Антигенная мимикрия при АИЗ Антигены EBV и антигены основного белка миелина при рассеянном склерозе

Ревматоидный артрит
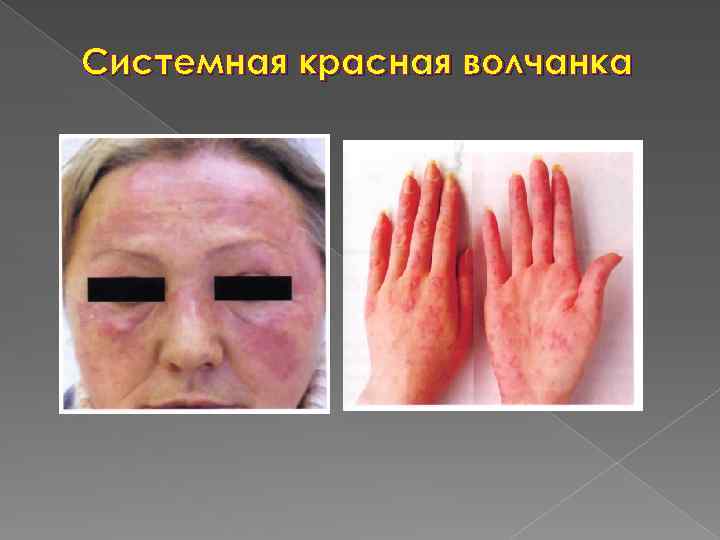
Системная красная волчанка

Псориаз

Благодарности Автор выражает благодарность и искреннюю признательность коллегам проф. В. Б. Климовичу, проф. Е. П. Киселевой, проф. А. П. Продеусу, д. м. н. А. Д. Кулагину, проф. А. С. Симбирцеву, проф. А. А. Ярилину за предоставление и обсуждение материалов, использованных при подготовке лекции Для подготовки лекции использованы материалы из кн. А. В. Караулова, С. А. Быкова, А. С. Быкова «Иммунология, микробиология и иммунопатология кожи» , М. : изд во БИНОМ, 2012. – 328 стр.
РОЛЬ ИММУННОЙ СИСТЕМЫ В ПАТОЛОГИИ-2013.pptx