болезнь паркинсона и глутамат 19.10.2016.pptx
- Количество слайдов: 29
 Роль и место антиглутаматных препаратов в комплексной терапии паркинсонизма К. м. н Александрова Е. А. Кафедра неврологии, психиатрии и наркологии ФПКВ Ниж. ГМА Нижний Новгород 2016
Роль и место антиглутаматных препаратов в комплексной терапии паркинсонизма К. м. н Александрова Е. А. Кафедра неврологии, психиатрии и наркологии ФПКВ Ниж. ГМА Нижний Новгород 2016
 Болезнь Паркинсона Хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением в них белка αсинуклеина и образованием особых внутриклеточных включений (телец Леви), которое проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психотических, вегетативных, сенсорных и др. ) 60 -и кратное увеличение 20 -и кратное увеличение Левин О. С. , Федорова Н. В. /Болезнь Паркинсона. – 3 -е изд. – М. : МЕДпресс информ, 2012. – 352 с.
Болезнь Паркинсона Хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением в них белка αсинуклеина и образованием особых внутриклеточных включений (телец Леви), которое проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психотических, вегетативных, сенсорных и др. ) 60 -и кратное увеличение 20 -и кратное увеличение Левин О. С. , Федорова Н. В. /Болезнь Паркинсона. – 3 -е изд. – М. : МЕДпресс информ, 2012. – 352 с.
 Кардинальные симптомы болезни Паркинсона СИМПТОМ ОПРЕДЕЛЕНИЕ Тремор Ритмичные возвратные движения, часто появляющиеся в руках, но могущие появляться также в стопах или челюсти Постуральная неустойчивость Нарушение баланса, что часто приводит к падениям и склоненной позе Брадикинезия (гипокинезия) Замедление и утрата спонтанных и автоматических движений Мышечная ригидность Сопротивление движению, возникающее изза нарушения баланса между активными и противоположными мышцами с. Примечание: Наличие 2 -го и 3 -го из этих симптомов является диагностическим критерием
Кардинальные симптомы болезни Паркинсона СИМПТОМ ОПРЕДЕЛЕНИЕ Тремор Ритмичные возвратные движения, часто появляющиеся в руках, но могущие появляться также в стопах или челюсти Постуральная неустойчивость Нарушение баланса, что часто приводит к падениям и склоненной позе Брадикинезия (гипокинезия) Замедление и утрата спонтанных и автоматических движений Мышечная ригидность Сопротивление движению, возникающее изза нарушения баланса между активными и противоположными мышцами с. Примечание: Наличие 2 -го и 3 -го из этих симптомов является диагностическим критерием
 Здоровый контроль и болезнь Паркинсона 123 I-FP-CIT SPECT images of healthy volunteer and patient with early hemi-PD. David J. Brooks J Nucl Med 2010; 51: 596 -609 (c) Copyright 2014 SNMMI; all rights reserved
Здоровый контроль и болезнь Паркинсона 123 I-FP-CIT SPECT images of healthy volunteer and patient with early hemi-PD. David J. Brooks J Nucl Med 2010; 51: 596 -609 (c) Copyright 2014 SNMMI; all rights reserved
 Образование аномально складчатой формы альфа-синуклеина в эпителии обонятельных луковиц или мейснеровском сплетении кишечника. Браак, 2007 Иллариошкин С. Н. , 2011
Образование аномально складчатой формы альфа-синуклеина в эпителии обонятельных луковиц или мейснеровском сплетении кишечника. Браак, 2007 Иллариошкин С. Н. , 2011
 Патогенез болезни Паркинсона
Патогенез болезни Паркинсона
 Избирательное поражение нейронов черной субстанции при паркинсонизме Избыточное накопление белка альфа-синуклеина при генетической предрасположенности или при нарушении внутриклеточной системы клиренса белка. Гиперактивация глутаматергических структур субталамического ядра (осуществляет релейную передачу кортико-нигральных глутаматергических влиянний) Повышение уровня глутамата Активация NMDA- рецепторов Митохондриальная дисфункция (Снижение уровня АТФ. Уменьшение образования глутатиона) Избыток активных форм кислорода (феномен окислительного стресса). Накопление внутриклеточного кальция и стимуляция протеаз Воспалительные реакции, Нарушение синтеза белка, Дисфункция нейрона, генетически детерминированный апоптоз и смерть нейронов в черной субстанции
Избирательное поражение нейронов черной субстанции при паркинсонизме Избыточное накопление белка альфа-синуклеина при генетической предрасположенности или при нарушении внутриклеточной системы клиренса белка. Гиперактивация глутаматергических структур субталамического ядра (осуществляет релейную передачу кортико-нигральных глутаматергических влиянний) Повышение уровня глутамата Активация NMDA- рецепторов Митохондриальная дисфункция (Снижение уровня АТФ. Уменьшение образования глутатиона) Избыток активных форм кислорода (феномен окислительного стресса). Накопление внутриклеточного кальция и стимуляция протеаз Воспалительные реакции, Нарушение синтеза белка, Дисфункция нейрона, генетически детерминированный апоптоз и смерть нейронов в черной субстанции
 Imaging approaches to Parkinson disease. 11 C-PK 11195 PET scans of healthy subject and PD patient. David J. Brooks J Nucl Med 2010; 51: 596 -609 11 C-PK 11195 PET scans of healthy subject and PD patient. Mild microglial activation is seen in thalamus of healthy control, whereas significantly raised activation is evident in midbrain and striata of PD patient. (Courtesy of Alex Gerhard. ) (c) Copyright 2014 SNMMI; all rights reserved
Imaging approaches to Parkinson disease. 11 C-PK 11195 PET scans of healthy subject and PD patient. David J. Brooks J Nucl Med 2010; 51: 596 -609 11 C-PK 11195 PET scans of healthy subject and PD patient. Mild microglial activation is seen in thalamus of healthy control, whereas significantly raised activation is evident in midbrain and striata of PD patient. (Courtesy of Alex Gerhard. ) (c) Copyright 2014 SNMMI; all rights reserved
 Глутамат? Нейромедиаторная роль глутаминовой кислоты заключается в способности вызывать деполяризацию мембраны нейрона и, следовательно, увеличение проводимости ионов Са 2+. Позитивная медиаторная роль глутамата- обучение и память Медиаторная функция находится в тесной связи с обменом Са 2+, что дает возможность говорить о глутаматно-кальциевом каскаде. Действие глутамата проявляется через взаимодействие со специфическим нейрорецептором, имеющим белковую структуру и относящимся по своей природе к клеточным гликопротеидам.
Глутамат? Нейромедиаторная роль глутаминовой кислоты заключается в способности вызывать деполяризацию мембраны нейрона и, следовательно, увеличение проводимости ионов Са 2+. Позитивная медиаторная роль глутамата- обучение и память Медиаторная функция находится в тесной связи с обменом Са 2+, что дает возможность говорить о глутаматно-кальциевом каскаде. Действие глутамата проявляется через взаимодействие со специфическим нейрорецептором, имеющим белковую структуру и относящимся по своей природе к клеточным гликопротеидам.
 NMDA-рецептор q NMDA-рецепторы состоят из пяти субъединиц, которые являются гликопротеид-липидными комплексами q NMDA-рецептор представляет собой целый рецепторно-ионофорный комплекс, включающий в себя: 1) сайт специфического связывания медиатора (Lглутаминовой кислоты); 2) регуляторный, или коактивирующий, сайт специфического связывания глицина; 3) аллостерические модуляторные сайты, расположенные на мембране (полиаминовый) и в ионном канале (сайты связывания фенциклидина, двухвалентных катионов и потенциал-зависимый Mgсвязывающий участок). q Ионы Mg 2+ селективно блокируют активность рецепторов при высокой гиперполяризации или деполяризации. При полном отсутствии глицина рецептор не активируется L-глутаматом.
NMDA-рецептор q NMDA-рецепторы состоят из пяти субъединиц, которые являются гликопротеид-липидными комплексами q NMDA-рецептор представляет собой целый рецепторно-ионофорный комплекс, включающий в себя: 1) сайт специфического связывания медиатора (Lглутаминовой кислоты); 2) регуляторный, или коактивирующий, сайт специфического связывания глицина; 3) аллостерические модуляторные сайты, расположенные на мембране (полиаминовый) и в ионном канале (сайты связывания фенциклидина, двухвалентных катионов и потенциал-зависимый Mgсвязывающий участок). q Ионы Mg 2+ селективно блокируют активность рецепторов при высокой гиперполяризации или деполяризации. При полном отсутствии глицина рецептор не активируется L-глутаматом.
 Глутамат и эксайтотоксичность Нарушение биохимических процессов, наблюдаемое при ряде повреждений ЦНС, таких как БП, запускает глутаматно-кальциевый каскад, приводит к разнообразным изменениям клеточного метаболизма, обусловленным в первую очередь активацией мембранной проницаемости, перемещением Са 2+ внутрь клетки
Глутамат и эксайтотоксичность Нарушение биохимических процессов, наблюдаемое при ряде повреждений ЦНС, таких как БП, запускает глутаматно-кальциевый каскад, приводит к разнообразным изменениям клеточного метаболизма, обусловленным в первую очередь активацией мембранной проницаемости, перемещением Са 2+ внутрь клетки
 Эксайтотоксичность и паркинсонизм Эксайтотоксичность глутамата опосредуется NMDA-рецепторами, названными по специфическому антагонисту N-метил-D-аспартату. При взаимодействии глутамата с этими рецепторами открываются ионные каналы нейронной мембраны и осуществляется вход глутамата в нейрон. Экстенсивное связывание глутамата NMDA-рецепторами приводит к усилению тока Са 2+ в нейрон через каналы NMDA-рецепторов. Механизм эксайтотоксичности глутамата при болезни Паркинсона (БП) связан с массивным входом Са 2+ в ДА-нейроны черной субстанции. Крыжановский Г. Н. , Карабань И. Н. , Магаева С. В. , Кучеряну В. Г. , Карабань Н. В. Болезнь Паркинсона (этиология, патогенез, клиника, диагностика, лечение, профилактика). — 2002. — 315 с. 7. Левин О. С. , Федорова Н. В. Болезнь Паркинсона. — М. : Медпрессинформ, 2012. — 315 с. 8. Литвиненко И. В. Болезнь Паркинсона. — М. : Миклош, 2006. — 216 с.
Эксайтотоксичность и паркинсонизм Эксайтотоксичность глутамата опосредуется NMDA-рецепторами, названными по специфическому антагонисту N-метил-D-аспартату. При взаимодействии глутамата с этими рецепторами открываются ионные каналы нейронной мембраны и осуществляется вход глутамата в нейрон. Экстенсивное связывание глутамата NMDA-рецепторами приводит к усилению тока Са 2+ в нейрон через каналы NMDA-рецепторов. Механизм эксайтотоксичности глутамата при болезни Паркинсона (БП) связан с массивным входом Са 2+ в ДА-нейроны черной субстанции. Крыжановский Г. Н. , Карабань И. Н. , Магаева С. В. , Кучеряну В. Г. , Карабань Н. В. Болезнь Паркинсона (этиология, патогенез, клиника, диагностика, лечение, профилактика). — 2002. — 315 с. 7. Левин О. С. , Федорова Н. В. Болезнь Паркинсона. — М. : Медпрессинформ, 2012. — 315 с. 8. Литвиненко И. В. Болезнь Паркинсона. — М. : Миклош, 2006. — 216 с.
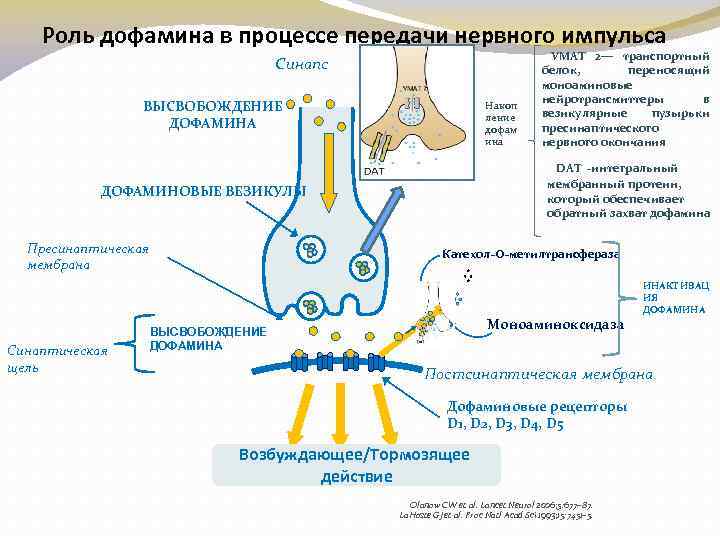 Роль дофамина в процессе передачи нервного импульса Синапс ВЫСВОБОЖДЕНИЕ ДОФАМИНА Накоп ление дофам ина DAT -интегральный мембранный протеин, который обеспечивает обратный захват дофамина ДОФАМИНОВЫЕ ВЕЗИКУЛЫ Пресинаптическая мембрана VMAT 2— транспортный белок, переносящий моноаминовые нейротрансмиттеры в везикулярные пузырьки пресинаптического нервного окончания Катехол-О-метилтрансфераза ИНАКТИВАЦ ИЯ ДОФАМИНА Синаптическая щель Моноаминоксидаза ВЫСВОБОЖДЕНИЕ ДОФАМИНА Постсинаптическая мембрана Дофаминовые рецепторы D 1, D 2, D 3, D 4, D 5 Возбуждающее/Тормозящее действие Olanow CW et al. Lancet Neurol 2006; 5: 677– 87. La. Hoste GJ et al. Proc Natl Acad Sci 1993; 15: 7451– 5.
Роль дофамина в процессе передачи нервного импульса Синапс ВЫСВОБОЖДЕНИЕ ДОФАМИНА Накоп ление дофам ина DAT -интегральный мембранный протеин, который обеспечивает обратный захват дофамина ДОФАМИНОВЫЕ ВЕЗИКУЛЫ Пресинаптическая мембрана VMAT 2— транспортный белок, переносящий моноаминовые нейротрансмиттеры в везикулярные пузырьки пресинаптического нервного окончания Катехол-О-метилтрансфераза ИНАКТИВАЦ ИЯ ДОФАМИНА Синаптическая щель Моноаминоксидаза ВЫСВОБОЖДЕНИЕ ДОФАМИНА Постсинаптическая мембрана Дофаминовые рецепторы D 1, D 2, D 3, D 4, D 5 Возбуждающее/Тормозящее действие Olanow CW et al. Lancet Neurol 2006; 5: 677– 87. La. Hoste GJ et al. Proc Natl Acad Sci 1993; 15: 7451– 5.
 Основные препараты для лечения болезни Паркинсона Холинолитики (тригексифенидил) Препараты леводопы (наком, мадопар, сталево) Агонисты дофаминовых рецепторов( ропинирол, прамипексол, пирибедил, ротиготин) Препараты амантадина( мидантан, ПК-Мерц) Ингибиторы МАО типа В ( селегилин, Азилект Ингибиторы катехол-О-метилтрасферазы (КОМТ) (толкапон, энтакапон) Полусинтетические алкалоиды (апоморфин)
Основные препараты для лечения болезни Паркинсона Холинолитики (тригексифенидил) Препараты леводопы (наком, мадопар, сталево) Агонисты дофаминовых рецепторов( ропинирол, прамипексол, пирибедил, ротиготин) Препараты амантадина( мидантан, ПК-Мерц) Ингибиторы МАО типа В ( селегилин, Азилект Ингибиторы катехол-О-метилтрасферазы (КОМТ) (толкапон, энтакапон) Полусинтетические алкалоиды (апоморфин)
 Антагонисты глутамата и паркинсонизм Доказан нейропротекторный эффект блокаторов (антагонистов) глутаматных рецепторов на моделях паркинсонизма [Deep P. , Dagher A. , Sadikot A. Stimulation of dopa decarboxylase activity in striatum of healthy human brain secondary to NMDA receptor antagonism with low dose of amantadine // Synapse. — 1999. — V. 34. — Р. 313 -318. Vitti R. J. , Rajput A. N. , Ahiskog J. E. Amantadine treatment is an independent predictor of improved survival in Parkinson’s dise-ase // Neurology. — 1996. — V. 46. — Р. 1551 -1556. В неврологической клинике в качестве блокаторов или антагонистов глутамата широко применяют производные аминоамантадина (амантадин, мидантан, неомидантан, ПК-Мерц) — препараты, селективно «распознающие» фенциклидиновый NMDA-сайт.
Антагонисты глутамата и паркинсонизм Доказан нейропротекторный эффект блокаторов (антагонистов) глутаматных рецепторов на моделях паркинсонизма [Deep P. , Dagher A. , Sadikot A. Stimulation of dopa decarboxylase activity in striatum of healthy human brain secondary to NMDA receptor antagonism with low dose of amantadine // Synapse. — 1999. — V. 34. — Р. 313 -318. Vitti R. J. , Rajput A. N. , Ahiskog J. E. Amantadine treatment is an independent predictor of improved survival in Parkinson’s dise-ase // Neurology. — 1996. — V. 46. — Р. 1551 -1556. В неврологической клинике в качестве блокаторов или антагонистов глутамата широко применяют производные аминоамантадина (амантадин, мидантан, неомидантан, ПК-Мерц) — препараты, селективно «распознающие» фенциклидиновый NMDA-сайт.
 Механизм действия амантадина сульфата (ПК-Мерц) Действие комбинированной терапии при тяжелой стадии (ПК-Мерц и леводопа) -усиливает и удлиняет эффект леводопы -уменьшает выраженность лекарственных дискинезий
Механизм действия амантадина сульфата (ПК-Мерц) Действие комбинированной терапии при тяжелой стадии (ПК-Мерц и леводопа) -усиливает и удлиняет эффект леводопы -уменьшает выраженность лекарственных дискинезий
 Амантадины и болезнь Паркинсона Амантадин синтезирован в США как противовирусный препарат под названием «симметрел» и использовался при массовой профилактике гриппа, вызываемого вирусом А 2. Впервые результаты исследования амантадина для лечения паркинсонизма описали в 1969 году Schwab и Poshanzer. Находившаяся под их наблюдением женщина, страдавшая паркинсонизмом, в течение 5 недель принимала для предупреждения гриппа амантадин (2 раза в день по 100 мг). Одновременно она отметила значительное уменьшение скованности, тремора и акинезии. После отмены препарата эти симптомы усилились вновь. Действие амантадина изучали в течение 6 месяцев на 160 больных паркинсонизмом с помощью плацебоконтролируемого исследования и обосновали клинические показания к применению препарата на всех стадиях течения БП.
Амантадины и болезнь Паркинсона Амантадин синтезирован в США как противовирусный препарат под названием «симметрел» и использовался при массовой профилактике гриппа, вызываемого вирусом А 2. Впервые результаты исследования амантадина для лечения паркинсонизма описали в 1969 году Schwab и Poshanzer. Находившаяся под их наблюдением женщина, страдавшая паркинсонизмом, в течение 5 недель принимала для предупреждения гриппа амантадин (2 раза в день по 100 мг). Одновременно она отметила значительное уменьшение скованности, тремора и акинезии. После отмены препарата эти симптомы усилились вновь. Действие амантадина изучали в течение 6 месяцев на 160 больных паркинсонизмом с помощью плацебоконтролируемого исследования и обосновали клинические показания к применению препарата на всех стадиях течения БП.
 Амантадины и болезнь Паркинсона Было показано, что амантадин стимулирует выброс ДА из пресинаптических окончаний, уменьшает обратный захват ДА в синапсе, тормозит глутаматергические влияния лобной коры на полосатое тело и обладает отчетливым холиноблокирующим эффектом. Как антагонист глутаматных рецепторов амантадин способен реализовать свое действие на уровне эксайтотоксического каскада Последующее длительное наблюдение более 800 пациентов, получавших различное лечение в период с 1968 по 1990 год, с проведением регрессионного анализа показало, что продолжительность жизни больных с БП, получавших лечение амантадином (250 человек), снижается минимально по сравнению со здоровой группой и выше, чем у пациентов, получавших другие виды лечения без амантадина (586 человек).
Амантадины и болезнь Паркинсона Было показано, что амантадин стимулирует выброс ДА из пресинаптических окончаний, уменьшает обратный захват ДА в синапсе, тормозит глутаматергические влияния лобной коры на полосатое тело и обладает отчетливым холиноблокирующим эффектом. Как антагонист глутаматных рецепторов амантадин способен реализовать свое действие на уровне эксайтотоксического каскада Последующее длительное наблюдение более 800 пациентов, получавших различное лечение в период с 1968 по 1990 год, с проведением регрессионного анализа показало, что продолжительность жизни больных с БП, получавших лечение амантадином (250 человек), снижается минимально по сравнению со здоровой группой и выше, чем у пациентов, получавших другие виды лечения без амантадина (586 человек).
 Выживаемость % Применение амантадина являлось достоверным (Р < 0, 01) независимым предиктором более длительного выживания пациентов Данные ретроспективного исследован при болезни Паркинсона годы Продолжительность жизни в здоровой популяции Продолжительность жизни при лечении амантадином (n 250) Продолжительность жизни без применения амантадина (n 586)
Выживаемость % Применение амантадина являлось достоверным (Р < 0, 01) независимым предиктором более длительного выживания пациентов Данные ретроспективного исследован при болезни Паркинсона годы Продолжительность жизни в здоровой популяции Продолжительность жизни при лечении амантадином (n 250) Продолжительность жизни без применения амантадина (n 586)
 Эффективность применения ПКМерц 2 недели 4 недели Оценка эффективности терапии по шкале Webster в баллах
Эффективность применения ПКМерц 2 недели 4 недели Оценка эффективности терапии по шкале Webster в баллах
 Механизм действия амантадинов • антагонист NMDA-рецепторов глутамата • холинолитическое действие • увеличение синтеза дофамина в пресинаптических терминалях • увеличение высвобождения дофамина в синаптическую щель • торможение обратного захвата дофамина в пресинаптическую терминаль блокируя моноаминоксидазу и повышая уровень бетаэндорфина/бета-липотропина, • стимуляция ДА-рецепторов нейропротекторный эффект Обладают серотонинергическим и норадренергическим действием. Имеют мягкое антихолинергическое и амфетаминоподобное действие Nutt J. G. , Chung K. A. , Holford N. H. Dyskinesia and the antiparkinsonian response always temporally coincide: a retrospective study // Neurology. — 2010. — V. 74 (15). — Р. 1191 -1197.
Механизм действия амантадинов • антагонист NMDA-рецепторов глутамата • холинолитическое действие • увеличение синтеза дофамина в пресинаптических терминалях • увеличение высвобождения дофамина в синаптическую щель • торможение обратного захвата дофамина в пресинаптическую терминаль блокируя моноаминоксидазу и повышая уровень бетаэндорфина/бета-липотропина, • стимуляция ДА-рецепторов нейропротекторный эффект Обладают серотонинергическим и норадренергическим действием. Имеют мягкое антихолинергическое и амфетаминоподобное действие Nutt J. G. , Chung K. A. , Holford N. H. Dyskinesia and the antiparkinsonian response always temporally coincide: a retrospective study // Neurology. — 2010. — V. 74 (15). — Р. 1191 -1197.
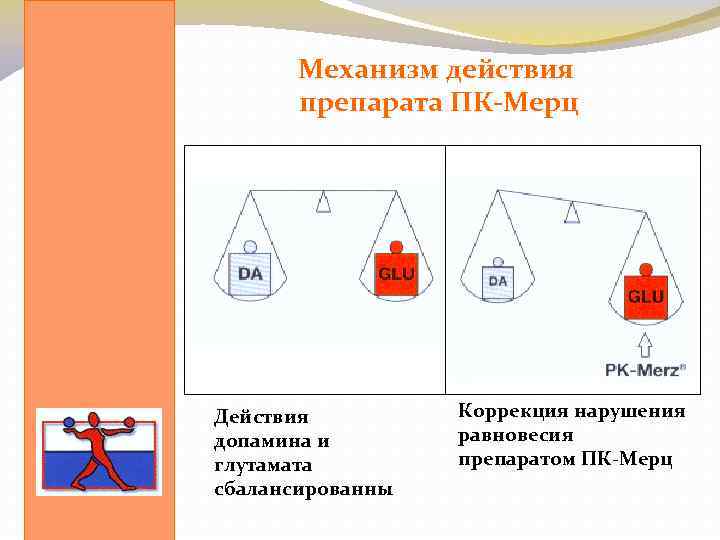 Механизм действия препарата ПК-Мерц Действия допамина и глутамата сбалансированны Коррекция нарушения равновесия препаратом ПК-Мерц
Механизм действия препарата ПК-Мерц Действия допамина и глутамата сбалансированны Коррекция нарушения равновесия препаратом ПК-Мерц
 Соли амантадина и фарамакокинетика v. Для лечения БП применяют две различные соли амантадина: сульфат (пероральная и инфузионная формы) и гидрохлорид (только пероральная форма). Максимальная суточная доза ПК-Мерца составляет 600 мг. v. Внутривенный сульфат амантадина эффективен в случаях акинетического криза и выраженных лекарственных осложнений от леводопа-терапии, что является дополнительным показанием к его применению. v. Пероральный сульфат амантадина медленнее растворяется и всасывается, действуя более продолжительное время с меньшей концентрацией препарата в крови, тогда как гидрохлорид амантадина полностью всасывается через 10 минут и имеет в 1, 5 раза большую концентрацию препарата в крови. v. Этими фармакокинетическими и токсикологическими различиями обусловлена существенная разница в частоте возникновения побочных эффектов и дозе, при которой у пациентов могут возникнуть нежелательные побочные явления Голубев В. Л. Терапия поздних стадий болезни Паркинсона // Пожилой пациент. — 2010. — № 1 (2). — С. 3 -8. Левин О. С. , Федорова Н. В. Болезнь Паркинсона. — М. : Медпрессинформ, 2012. — 315 с. Crosby N. J. , Deane K. H. O. , Clarke E. C. Amantadine for dyskinesia in Parkinson’s disease (Cochrane review) // Cochrane Library, Issue 2, Oxford Update Software, 2003.
Соли амантадина и фарамакокинетика v. Для лечения БП применяют две различные соли амантадина: сульфат (пероральная и инфузионная формы) и гидрохлорид (только пероральная форма). Максимальная суточная доза ПК-Мерца составляет 600 мг. v. Внутривенный сульфат амантадина эффективен в случаях акинетического криза и выраженных лекарственных осложнений от леводопа-терапии, что является дополнительным показанием к его применению. v. Пероральный сульфат амантадина медленнее растворяется и всасывается, действуя более продолжительное время с меньшей концентрацией препарата в крови, тогда как гидрохлорид амантадина полностью всасывается через 10 минут и имеет в 1, 5 раза большую концентрацию препарата в крови. v. Этими фармакокинетическими и токсикологическими различиями обусловлена существенная разница в частоте возникновения побочных эффектов и дозе, при которой у пациентов могут возникнуть нежелательные побочные явления Голубев В. Л. Терапия поздних стадий болезни Паркинсона // Пожилой пациент. — 2010. — № 1 (2). — С. 3 -8. Левин О. С. , Федорова Н. В. Болезнь Паркинсона. — М. : Медпрессинформ, 2012. — 315 с. Crosby N. J. , Deane K. H. O. , Clarke E. C. Amantadine for dyskinesia in Parkinson’s disease (Cochrane review) // Cochrane Library, Issue 2, Oxford Update Software, 2003.
 ПК-МЕРЦ
ПК-МЕРЦ
 Показания к применению ПК-Мерц • Болезнь Паркинсона (мышечная ригидность, тремор, гипо- или акинезия) • Синдром паркинсонизма • Акинетический криз, острая декомпенсация • Экстрапирамидные расстройства, вызванные приемом нейролептиков или другими препаратами • Нарушение вигильности (инициативности) в посткоматозном периоде • Невралгия при опоясывающем герпесе
Показания к применению ПК-Мерц • Болезнь Паркинсона (мышечная ригидность, тремор, гипо- или акинезия) • Синдром паркинсонизма • Акинетический криз, острая декомпенсация • Экстрапирамидные расстройства, вызванные приемом нейролептиков или другими препаратами • Нарушение вигильности (инициативности) в посткоматозном периоде • Невралгия при опоясывающем герпесе
 ПК-Мерц С осторожностью • гиперплазия предстательной железы, • закрытоугольная глаукома, • почечная недостаточность различной степени тяжести (существует риск кумуляции препарата), • ажитация, • делирий, • угнетение центральной нервной системы, • экзогенный психоз (в том числе в анамнезе), • совместный прием с мемантином,
ПК-Мерц С осторожностью • гиперплазия предстательной железы, • закрытоугольная глаукома, • почечная недостаточность различной степени тяжести (существует риск кумуляции препарата), • ажитация, • делирий, • угнетение центральной нервной системы, • экзогенный психоз (в том числе в анамнезе), • совместный прием с мемантином,
 Схема применения ПК-Мерц Таблетки, покрытые оболочкой
Схема применения ПК-Мерц Таблетки, покрытые оболочкой
 Схема применения ПК-Мерц Инфузионный раствор Начальная терапия стационарных больных 1 -2 инфузии в день в течение 5 -7 дней В случае неэффективности оральной терапии 1 -2 инфузии в день в течение 7 -14 дней При акинетических кризах 2 -3 инфузии в день в течение 7 -14 дней
Схема применения ПК-Мерц Инфузионный раствор Начальная терапия стационарных больных 1 -2 инфузии в день в течение 5 -7 дней В случае неэффективности оральной терапии 1 -2 инфузии в день в течение 7 -14 дней При акинетических кризах 2 -3 инфузии в день в течение 7 -14 дней
 Первая обязанность врача заключается в том, чтобы не вредить своими руками, не мешать естественному целебному действию природы Спасибо за внимание E-mail: dalex 1970@mail. ru
Первая обязанность врача заключается в том, чтобы не вредить своими руками, не мешать естественному целебному действию природы Спасибо за внимание E-mail: dalex 1970@mail. ru


