replication_eu2.pptx
- Количество слайдов: 33
 РЕПЛИКАЦИЯ. ЭУКАРИОТы 2
РЕПЛИКАЦИЯ. ЭУКАРИОТы 2

 cdc-гены, сеll division control Реакции обратимого фосфорования: • киназы, активируемые циклинами: 2 субъединицы – CDK – каталитическая субъединица циклин – активирующая субъединица • циклины • фосфатазы • протеолиз • убиквитинилирование (poly. Ub и mono. Ub) –протеолиз и изменение белок-белковых взаимодействий, соответственно
cdc-гены, сеll division control Реакции обратимого фосфорования: • киназы, активируемые циклинами: 2 субъединицы – CDK – каталитическая субъединица циклин – активирующая субъединица • циклины • фосфатазы • протеолиз • убиквитинилирование (poly. Ub и mono. Ub) –протеолиз и изменение белок-белковых взаимодействий, соответственно
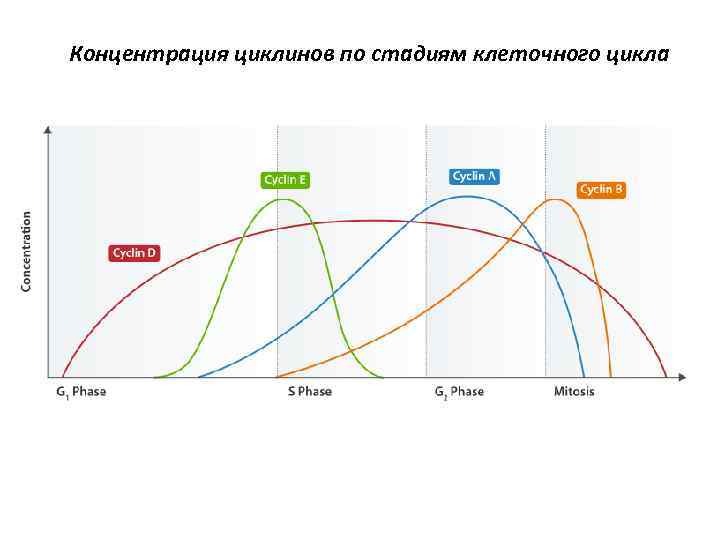 Концентрация циклинов по стадиям клеточного цикла
Концентрация циклинов по стадиям клеточного цикла
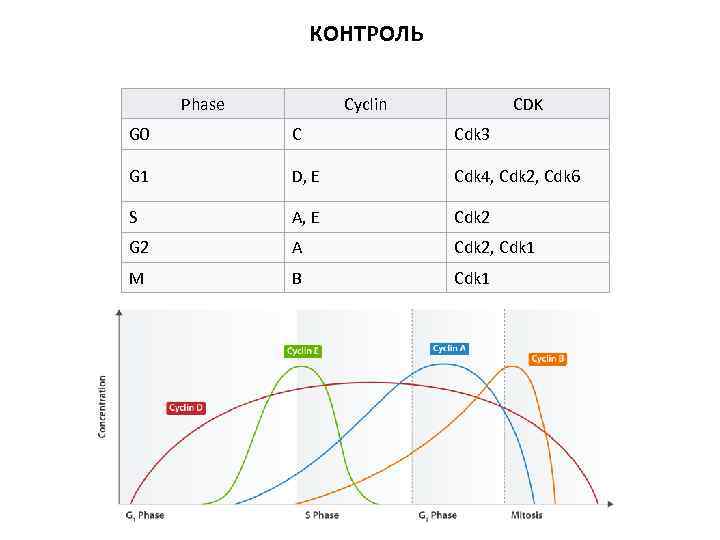 КОНТРОЛЬ Phase Cyclin CDK G 0 C Cdk 3 G 1 D, E Cdk 4, Cdk 2, Cdk 6 S A, E Cdk 2 G 2 A Cdk 2, Cdk 1 M B Cdk 1
КОНТРОЛЬ Phase Cyclin CDK G 0 C Cdk 3 G 1 D, E Cdk 4, Cdk 2, Cdk 6 S A, E Cdk 2 G 2 A Cdk 2, Cdk 1 M B Cdk 1
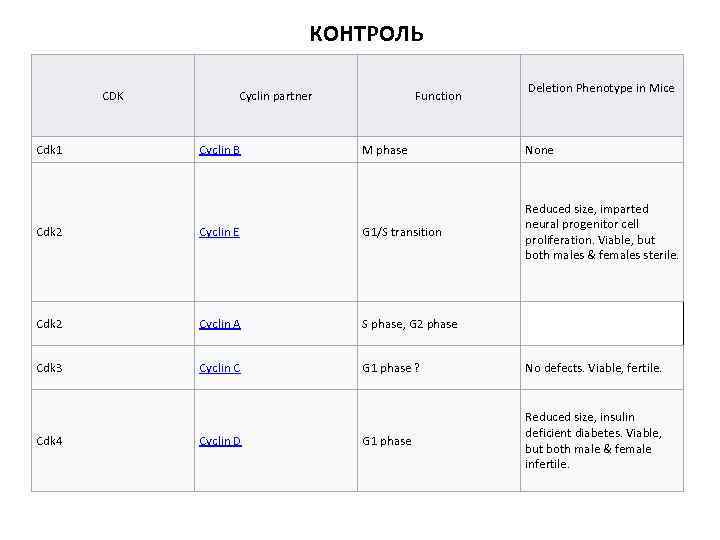 КОНТРОЛЬ CDK Cdk 1 Cyclin partner Cyclin B Function Deletion Phenotype in Mice M phase None Reduced size, imparted neural progenitor cell proliferation. Viable, but both males & females sterile. Cdk 2 Cyclin E G 1/S transition Cdk 2 Cyclin A S phase, G 2 phase Cdk 3 Cyclin C G 1 phase ? No defects. Viable, fertile. G 1 phase Reduced size, insulin deficient diabetes. Viable, but both male & female infertile. Cdk 4 Cyclin D
КОНТРОЛЬ CDK Cdk 1 Cyclin partner Cyclin B Function Deletion Phenotype in Mice M phase None Reduced size, imparted neural progenitor cell proliferation. Viable, but both males & females sterile. Cdk 2 Cyclin E G 1/S transition Cdk 2 Cyclin A S phase, G 2 phase Cdk 3 Cyclin C G 1 phase ? No defects. Viable, fertile. G 1 phase Reduced size, insulin deficient diabetes. Viable, but both male & female infertile. Cdk 4 Cyclin D
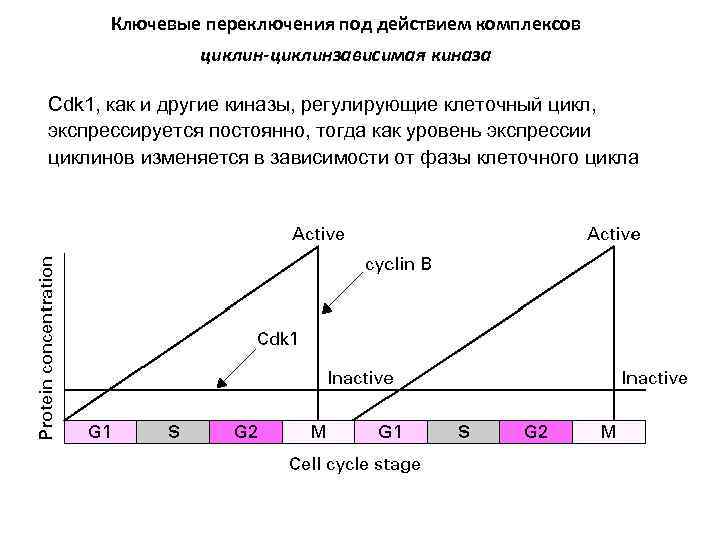 Ключевые переключения под действием комплексов циклин-циклинзависимая киназа Cdk 1, как и другие киназы, регулирующие клеточный цикл, экспрессируется постоянно, тогда как уровень экспрессии циклинов изменяется в зависимости от фазы клеточного цикла
Ключевые переключения под действием комплексов циклин-циклинзависимая киназа Cdk 1, как и другие киназы, регулирующие клеточный цикл, экспрессируется постоянно, тогда как уровень экспрессии циклинов изменяется в зависимости от фазы клеточного цикла
 Ключевые переключения под действием комплексов циклин-циклинзависимая киназа Фосфорилирование целевых белков “включает или выключает” процесс G 1 a - R (restriction point) - G 1 b – Cyc. D/Cdc 4, Cyc. D/Cdc 6 G 1/S-checkpoint – Cyc. E/Cdc 2 (Cyc. E/Cdk 1) S-фаза (включая внутренний checkpoint) – Cyc. A/Cdk 2 G 2 - и M-фазы – Cyc. B 3/Cdk 1, Cyc. B 3/Cdk 2 G 2/M-checkpoint – Cyc. A/Cdk 1 М-фаза – Cyc. B/Cdk 1
Ключевые переключения под действием комплексов циклин-циклинзависимая киназа Фосфорилирование целевых белков “включает или выключает” процесс G 1 a - R (restriction point) - G 1 b – Cyc. D/Cdc 4, Cyc. D/Cdc 6 G 1/S-checkpoint – Cyc. E/Cdc 2 (Cyc. E/Cdk 1) S-фаза (включая внутренний checkpoint) – Cyc. A/Cdk 2 G 2 - и M-фазы – Cyc. B 3/Cdk 1, Cyc. B 3/Cdk 2 G 2/M-checkpoint – Cyc. A/Cdk 1 М-фаза – Cyc. B/Cdk 1
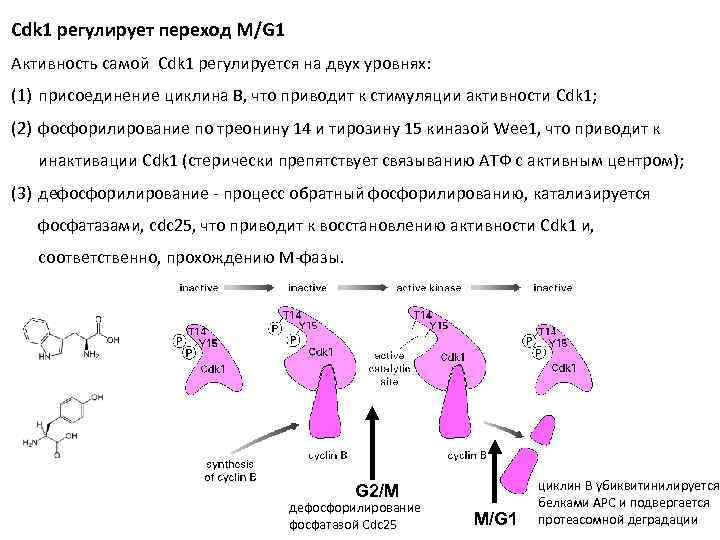 Cdk 1 регулирует переход M/G 1 Активность самой Cdk 1 регулируется на двух уровнях: (1) присоединение циклина B, что приводит к стимуляции активности Cdk 1; (2) фосфорилирование по треонину 14 и тирозину 15 киназой Wee 1, что приводит к инактивации Cdk 1 (стерически препятствует связыванию АТФ с активным центром); (3) дефосфорилирование - процесс обратный фосфорилированию, катализируется фосфатазами, cdc 25, что приводит к восстановлению активности Cdk 1 и, соответственно, прохождению М-фазы. G 2/M дефосфорилирование фосфатазой Cdc 25 M/G 1 циклин В убиквитинилируется белками APC и подвергается протеасомной деградации
Cdk 1 регулирует переход M/G 1 Активность самой Cdk 1 регулируется на двух уровнях: (1) присоединение циклина B, что приводит к стимуляции активности Cdk 1; (2) фосфорилирование по треонину 14 и тирозину 15 киназой Wee 1, что приводит к инактивации Cdk 1 (стерически препятствует связыванию АТФ с активным центром); (3) дефосфорилирование - процесс обратный фосфорилированию, катализируется фосфатазами, cdc 25, что приводит к восстановлению активности Cdk 1 и, соответственно, прохождению М-фазы. G 2/M дефосфорилирование фосфатазой Cdc 25 M/G 1 циклин В убиквитинилируется белками APC и подвергается протеасомной деградации
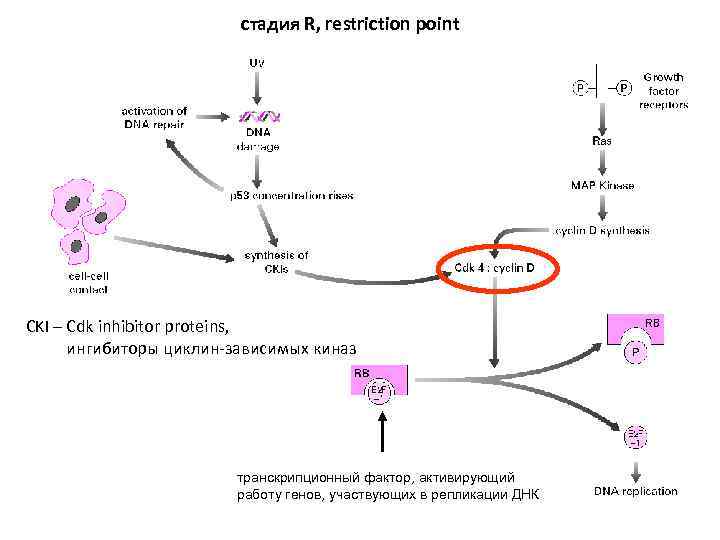 стадия R, restriction point CKI – Cdk inhibitor proteins, ингибиторы циклин-зависимых киназ транскрипционный фактор, активирующий работу генов, участвующих в репликации ДНК
стадия R, restriction point CKI – Cdk inhibitor proteins, ингибиторы циклин-зависимых киназ транскрипционный фактор, активирующий работу генов, участвующих в репликации ДНК
 контроль начала S-фазы Cdk 2 - циклин E Сdk 4 Cdk 6 циклин D Cdk 4 активирует работу транскрипционного фактора E 2 F-1, включающего гены, работа которых необходима для репликации ДНК Cdk 4 инактивирует белок Rb, который является ингибитором E 2 F-1 Cdk 2, 4 и 6 являются сенсорами различных сигналов. Частью сенсорной системы являются ингибиторы Cdk (CKI).
контроль начала S-фазы Cdk 2 - циклин E Сdk 4 Cdk 6 циклин D Cdk 4 активирует работу транскрипционного фактора E 2 F-1, включающего гены, работа которых необходима для репликации ДНК Cdk 4 инактивирует белок Rb, который является ингибитором E 2 F-1 Cdk 2, 4 и 6 являются сенсорами различных сигналов. Частью сенсорной системы являются ингибиторы Cdk (CKI).
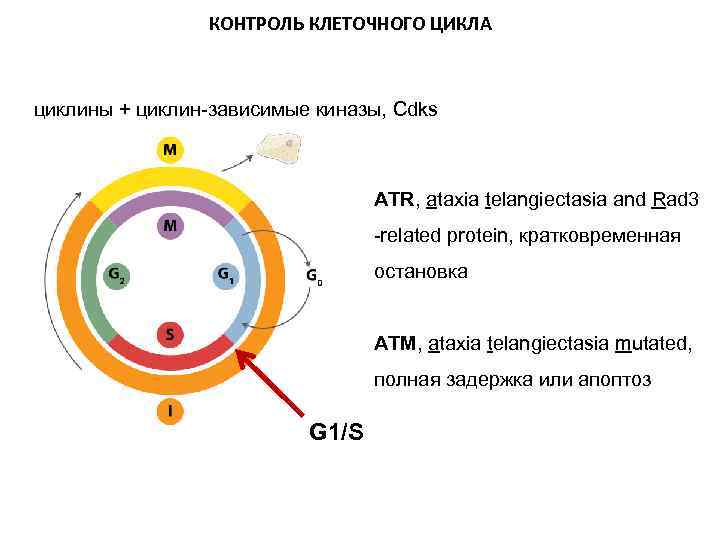 КОНТРОЛЬ КЛЕТОЧНОГО ЦИКЛА циклины + циклин-зависимые киназы, Cdks ATR, ataxia telangiectasia and Rad 3 -related protein, кратковременная остановка ATM, ataxia telangiectasia mutated, полная задержка или апоптоз G 1/S
КОНТРОЛЬ КЛЕТОЧНОГО ЦИКЛА циклины + циклин-зависимые киназы, Cdks ATR, ataxia telangiectasia and Rad 3 -related protein, кратковременная остановка ATM, ataxia telangiectasia mutated, полная задержка или апоптоз G 1/S
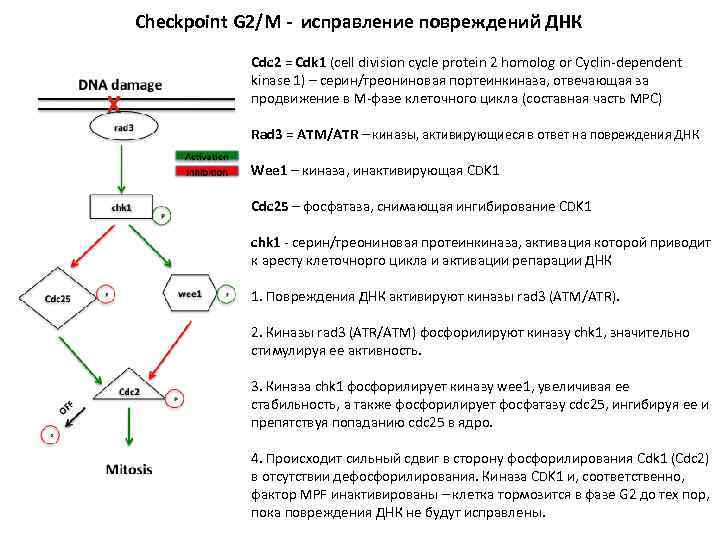 Checkpoint G 2/M - исправление повреждений ДНК Cdc 2 = Cdk 1 (cell division cycle protein 2 homolog or Cyclin-dependent kinase 1) – серин/треониновая портеинкиназа, отвечающая за продвижение в М-фазе клеточного цикла (составная часть MPC) Rad 3 = ATM/ATR – киназы, активирующиеся в ответ на повреждения ДНК Wee 1 – киназа, инактивирующая CDK 1 Cdc 25 – фосфатаза, снимающая ингибирование CDK 1 сhk 1 - серин/треониновая протеинкиназа, активация которой приводит к аресту клеточнорго цикла и активации репарации ДНК 1. Повреждения ДНК активируют киназы rad 3 (ATM/ATR). 2. Киназы rad 3 (ATR/ATM) фосфорилируют киназу chk 1, значительно стимулируя ее активность. 3. Киназа chk 1 фосфорилирует киназу wee 1, увеличивая ее стабильность, а также фосфорилирует фосфатазу cdc 25, ингибируя ее и препятствуя попаданию cdc 25 в ядро. 4. Происходит сильный сдвиг в сторону фосфорилирования Cdk 1 (Cdc 2) в отсутствии дефосфорилирования. Киназа CDK 1 и, соответственно, фактор MPF инактивированы – клетка тормозится в фазе G 2 до тех пор, пока повреждения ДНК не будут исправлены.
Checkpoint G 2/M - исправление повреждений ДНК Cdc 2 = Cdk 1 (cell division cycle protein 2 homolog or Cyclin-dependent kinase 1) – серин/треониновая портеинкиназа, отвечающая за продвижение в М-фазе клеточного цикла (составная часть MPC) Rad 3 = ATM/ATR – киназы, активирующиеся в ответ на повреждения ДНК Wee 1 – киназа, инактивирующая CDK 1 Cdc 25 – фосфатаза, снимающая ингибирование CDK 1 сhk 1 - серин/треониновая протеинкиназа, активация которой приводит к аресту клеточнорго цикла и активации репарации ДНК 1. Повреждения ДНК активируют киназы rad 3 (ATM/ATR). 2. Киназы rad 3 (ATR/ATM) фосфорилируют киназу chk 1, значительно стимулируя ее активность. 3. Киназа chk 1 фосфорилирует киназу wee 1, увеличивая ее стабильность, а также фосфорилирует фосфатазу cdc 25, ингибируя ее и препятствуя попаданию cdc 25 в ядро. 4. Происходит сильный сдвиг в сторону фосфорилирования Cdk 1 (Cdc 2) в отсутствии дефосфорилирования. Киназа CDK 1 и, соответственно, фактор MPF инактивированы – клетка тормозится в фазе G 2 до тех пор, пока повреждения ДНК не будут исправлены.
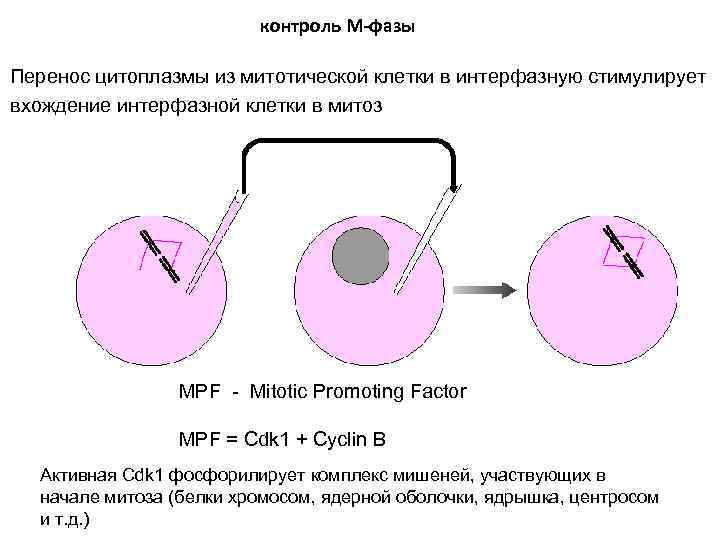 контроль М-фазы Перенос цитоплазмы из митотической клетки в интерфазную стимулирует вхождение интерфазной клетки в митоз MPF - Mitotic Promoting Factor MPF = Cdk 1 + Cyclin B Активная Cdk 1 фосфорилирует комплекс мишеней, участвующих в начале митоза (белки хромосом, ядерной оболочки, ядрышка, центросом и т. д. )
контроль М-фазы Перенос цитоплазмы из митотической клетки в интерфазную стимулирует вхождение интерфазной клетки в митоз MPF - Mitotic Promoting Factor MPF = Cdk 1 + Cyclin B Активная Cdk 1 фосфорилирует комплекс мишеней, участвующих в начале митоза (белки хромосом, ядерной оболочки, ядрышка, центросом и т. д. )
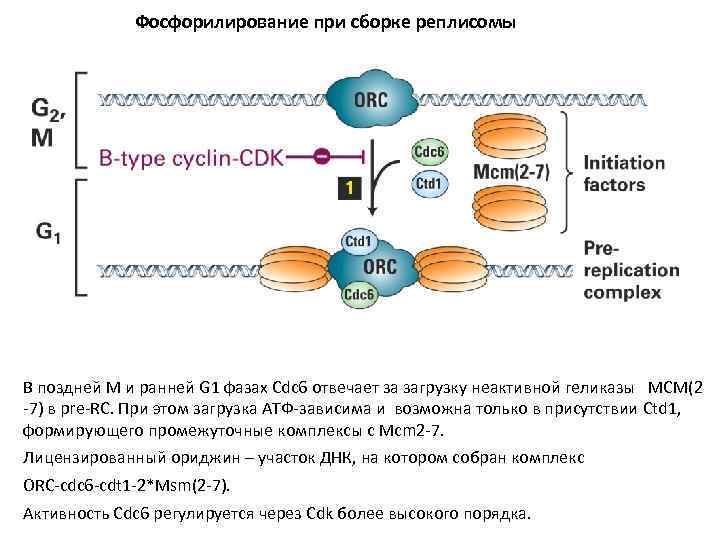 Фосфорилирование при сборке реплисомы В поздней М и ранней G 1 фазах Cdc 6 отвечает за загрузку неактивной геликазы MCM(2 -7) в pre-RC. При этом загрузка АТФ-зависима и возможна только в присутствии Ctd 1, формирующего промежуточные комплексы с Mсm 2 -7. Лицензированный ориджин – участок ДНК, на котором собран комплекс ORC-cdc 6 -cdt 1 -2*Msm(2 -7). Активность Cdc 6 регулируется через Cdk более высокого порядка.
Фосфорилирование при сборке реплисомы В поздней М и ранней G 1 фазах Cdc 6 отвечает за загрузку неактивной геликазы MCM(2 -7) в pre-RC. При этом загрузка АТФ-зависима и возможна только в присутствии Ctd 1, формирующего промежуточные комплексы с Mсm 2 -7. Лицензированный ориджин – участок ДНК, на котором собран комплекс ORC-cdc 6 -cdt 1 -2*Msm(2 -7). Активность Cdc 6 регулируется через Cdk более высокого порядка.
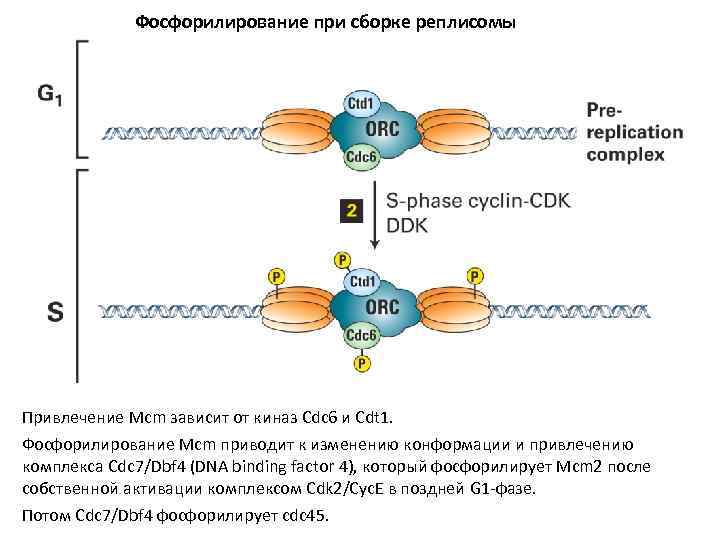 Фосфорилирование при сборке реплисомы Привлечение Mcm зависит от киназ Cdc 6 и Cdt 1. Фосфорилирование Mcm приводит к изменению конформации и привлечению комплекса Cdc 7/Dbf 4 (DNA binding factor 4), который фосфорилирует Mcm 2 после собственной активации комплексом Сdk 2/Сус. Е в поздней G 1 -фазе. Потом Cdc 7/Dbf 4 фосфорилирует cdc 45.
Фосфорилирование при сборке реплисомы Привлечение Mcm зависит от киназ Cdc 6 и Cdt 1. Фосфорилирование Mcm приводит к изменению конформации и привлечению комплекса Cdc 7/Dbf 4 (DNA binding factor 4), который фосфорилирует Mcm 2 после собственной активации комплексом Сdk 2/Сус. Е в поздней G 1 -фазе. Потом Cdc 7/Dbf 4 фосфорилирует cdc 45.
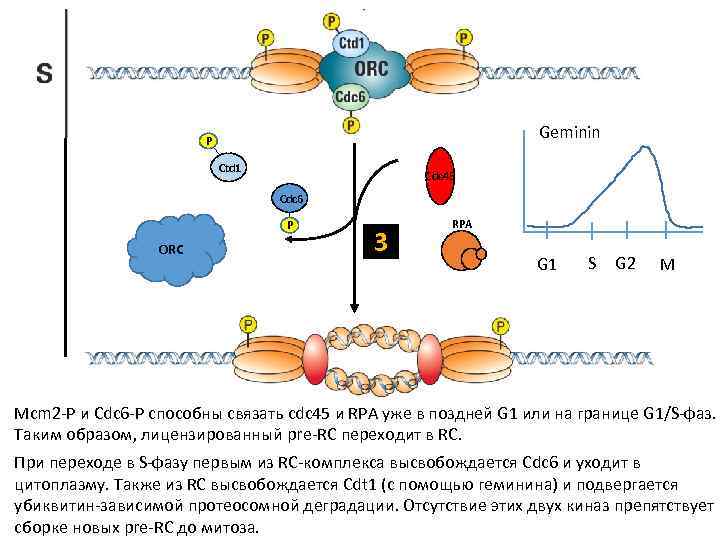 Geminin P Ctd 1 Cdc 45 Cdc 6 P ORC 3 RPA G 1 S G 2 M Mcm 2 -P и Cdc 6 -P способны связать cdc 45 и RPA уже в поздней G 1 или на границе G 1/S-фаз. Таким образом, лицензированный pre-RC переходит в RC. При переходе в S-фазу первым из RC-комплекса высвобождается Cdc 6 и уходит в цитоплазму. Также из RC высвобождается Cdt 1 (с помощью геминина) и подвергается убиквитин-зависимой протеосомной деградации. Отсутствие этих двух киназ препятствует сборке новых pre-RC до митоза.
Geminin P Ctd 1 Cdc 45 Cdc 6 P ORC 3 RPA G 1 S G 2 M Mcm 2 -P и Cdc 6 -P способны связать cdc 45 и RPA уже в поздней G 1 или на границе G 1/S-фаз. Таким образом, лицензированный pre-RC переходит в RC. При переходе в S-фазу первым из RC-комплекса высвобождается Cdc 6 и уходит в цитоплазму. Также из RC высвобождается Cdt 1 (с помощью геминина) и подвергается убиквитин-зависимой протеосомной деградации. Отсутствие этих двух киназ препятствует сборке новых pre-RC до митоза.
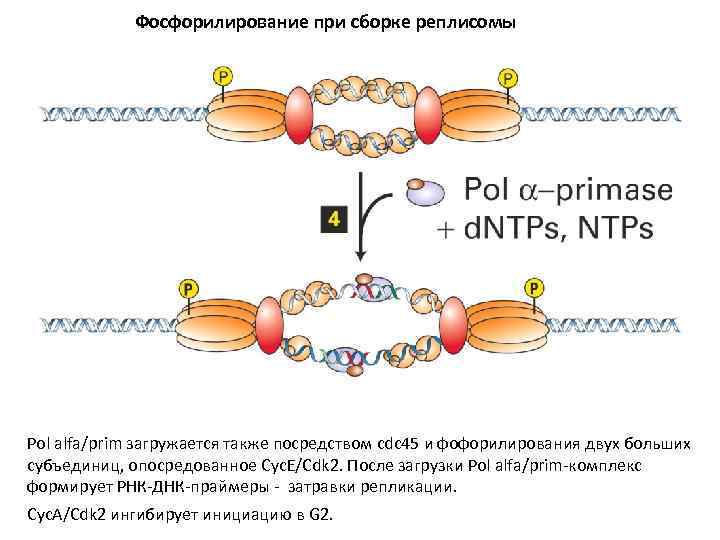 Фосфорилирование при сборке реплисомы Pol alfa/prim загружается также посредством cdc 45 и фофорилирования двух больших субъединиц, опосредованное Cyc. E/Cdk 2. После загрузки Pol alfa/prim-комплекс формирует РНК-ДНК-праймеры - затравки репликации. Cyc. А/Cdk 2 ингибирует инициацию в G 2.
Фосфорилирование при сборке реплисомы Pol alfa/prim загружается также посредством cdc 45 и фофорилирования двух больших субъединиц, опосредованное Cyc. E/Cdk 2. После загрузки Pol alfa/prim-комплекс формирует РНК-ДНК-праймеры - затравки репликации. Cyc. А/Cdk 2 ингибирует инициацию в G 2.
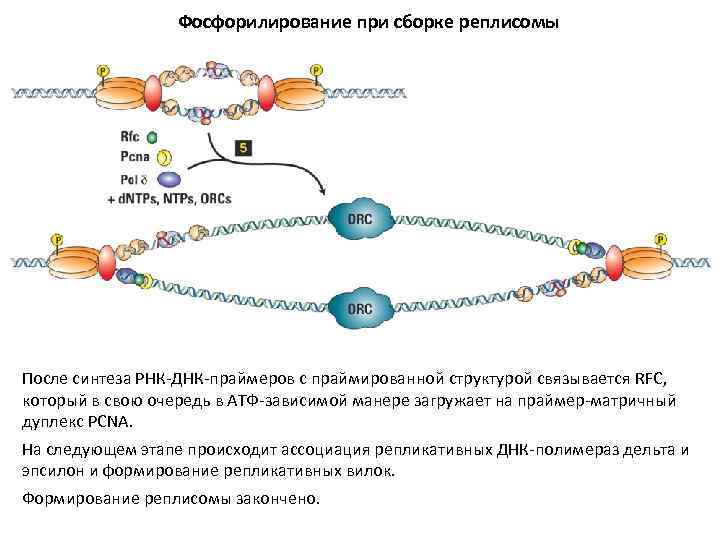 Фосфорилирование при сборке реплисомы После синтеза РНК-ДНК-праймеров с праймированной структурой связывается RFC, который в свою очередь в АТФ-зависимой манере загружает на праймер-матричный дуплекс PCNA. На следующем этапе происходит ассоциация репликативных ДНК-полимераз дельта и эпсилон и формирование репликативных вилок. Формирование реплисомы закончено.
Фосфорилирование при сборке реплисомы После синтеза РНК-ДНК-праймеров с праймированной структурой связывается RFC, который в свою очередь в АТФ-зависимой манере загружает на праймер-матричный дуплекс PCNA. На следующем этапе происходит ассоциация репликативных ДНК-полимераз дельта и эпсилон и формирование репликативных вилок. Формирование реплисомы закончено.
 Репликация ДНК у высших эукариот После того, как синтез ДНК закончен, ori вновь. АТФ-зависимо заполняются комплексом ORC на протяжении частично G 2 и М-G 1 -фаз. Таким образом, обеспечивается выбор ori для следующего раунда репликации. Повторная сборка pre-RC-комплексов в этих местах в рамках текущего цикла невозможна. Почему? На этих стадиях клеточного цикла не хватает факторов cdc 6, ctd 1. Загрузка геликазы MCM 2 -7 на ori невозможна, ori "не лицензирован". Еще один путь запрета повторной сборки репликативных комплексов – убиквитинилирование отдельной субъединицы Orc 1, при которой невозможно формирование продуктивного комплекса ORC в ori, а также полиубиквитинилирование Orc 1, ведущее к его протеолитической деградации на указанных стадиях клеточного цикла.
Репликация ДНК у высших эукариот После того, как синтез ДНК закончен, ori вновь. АТФ-зависимо заполняются комплексом ORC на протяжении частично G 2 и М-G 1 -фаз. Таким образом, обеспечивается выбор ori для следующего раунда репликации. Повторная сборка pre-RC-комплексов в этих местах в рамках текущего цикла невозможна. Почему? На этих стадиях клеточного цикла не хватает факторов cdc 6, ctd 1. Загрузка геликазы MCM 2 -7 на ori невозможна, ori "не лицензирован". Еще один путь запрета повторной сборки репликативных комплексов – убиквитинилирование отдельной субъединицы Orc 1, при которой невозможно формирование продуктивного комплекса ORC в ori, а также полиубиквитинилирование Orc 1, ведущее к его протеолитической деградации на указанных стадиях клеточного цикла.
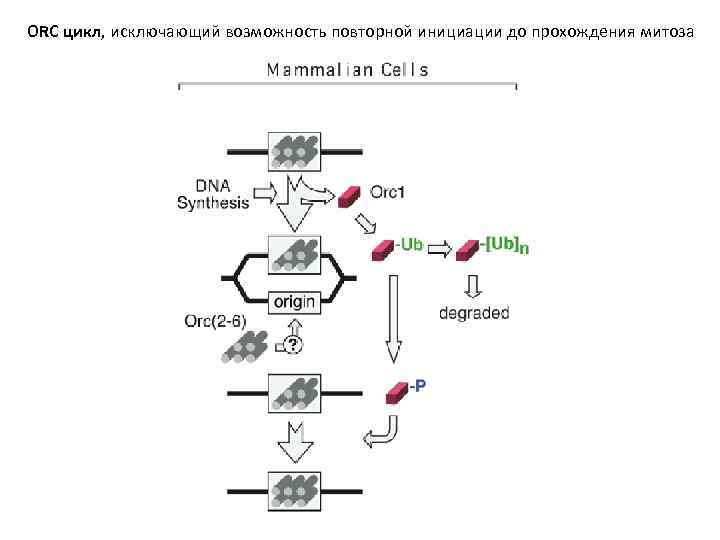 ORC цикл, исключающий возможность повторной инициации до прохождения митоза
ORC цикл, исключающий возможность повторной инициации до прохождения митоза
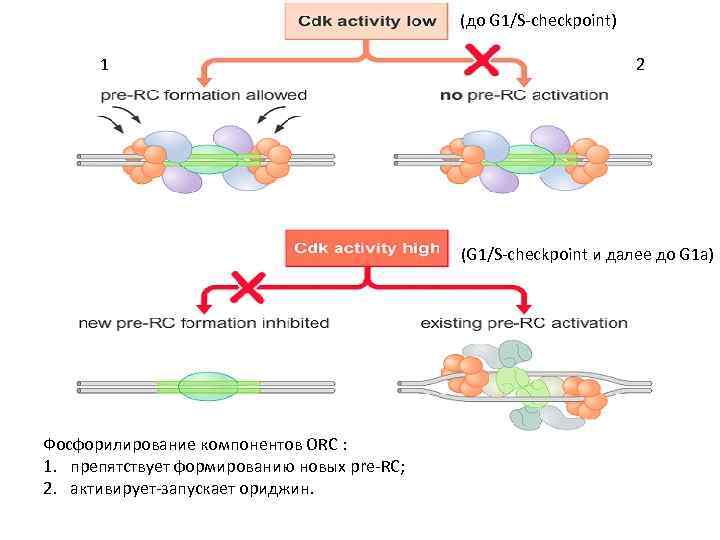 (до G 1/S-checkpoint) 1 2 (G 1/S-checkpoint и далее до G 1 a) Фосфорилирование компонентов ORC : 1. препятствует формированию новых pre-RC; 2. активирует-запускает ориджин.
(до G 1/S-checkpoint) 1 2 (G 1/S-checkpoint и далее до G 1 a) Фосфорилирование компонентов ORC : 1. препятствует формированию новых pre-RC; 2. активирует-запускает ориджин.
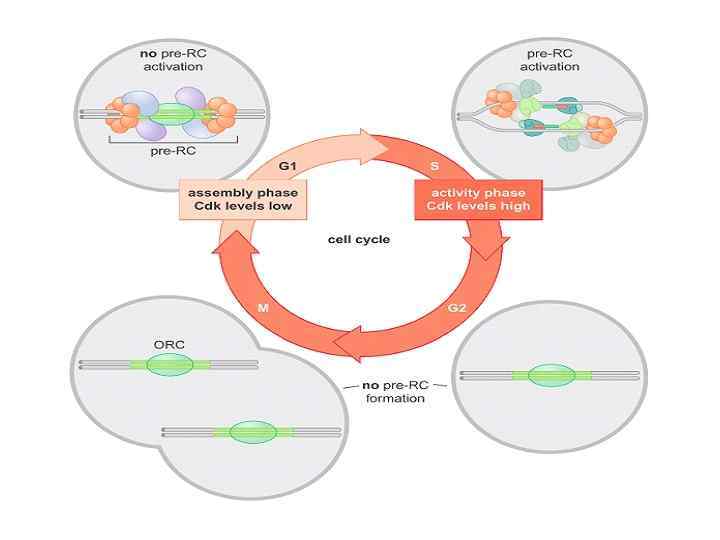
 Начало клеточного цикла – restriction point (R) – - решается вопрос о дальнейшем продвижении по G 1 -фазе (достаточно ли питания, есть ли внешний сигнал - факторы роста) G 1 b-фаза - транскрипция, трансляция необходимых макромолекул - окончательное лицензирование ориджинов репликации G 1/S-checkpoint – индукция инициации синтеза ДНК - решается вопрос о готовности к синтезу ДНК S-фаза – DNA damage/replication stall checkpoint - синтез ДНК, удвоение хромосом G 2 -фаза – конденсация хроматина, подготовка к митозу G 2/M-checkpoint – решается вопрос о готовности к делению (полностью ли реплицирована ДНК, отсутствуют ли повреждения ДНК) M-фаза (митоз) – разделение хромосом, цитокинез, деление клетки (практически полное отсутствие матричного биосинтеза) M-checkpoint – проверяется крепление хромосом на веретене деления
Начало клеточного цикла – restriction point (R) – - решается вопрос о дальнейшем продвижении по G 1 -фазе (достаточно ли питания, есть ли внешний сигнал - факторы роста) G 1 b-фаза - транскрипция, трансляция необходимых макромолекул - окончательное лицензирование ориджинов репликации G 1/S-checkpoint – индукция инициации синтеза ДНК - решается вопрос о готовности к синтезу ДНК S-фаза – DNA damage/replication stall checkpoint - синтез ДНК, удвоение хромосом G 2 -фаза – конденсация хроматина, подготовка к митозу G 2/M-checkpoint – решается вопрос о готовности к делению (полностью ли реплицирована ДНК, отсутствуют ли повреждения ДНК) M-фаза (митоз) – разделение хромосом, цитокинез, деление клетки (практически полное отсутствие матричного биосинтеза) M-checkpoint – проверяется крепление хромосом на веретене деления
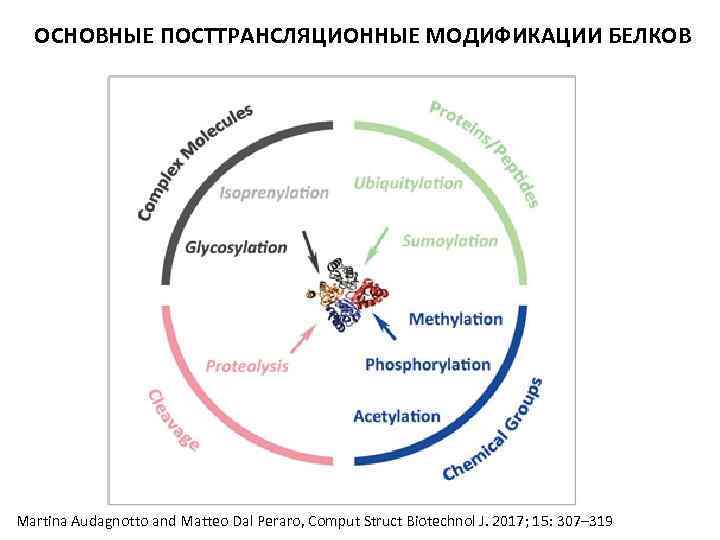 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Martina Audagnotto and Matteo Dal Peraro, Comput Struct Biotechnol J. 2017; 15: 307– 319
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Martina Audagnotto and Matteo Dal Peraro, Comput Struct Biotechnol J. 2017; 15: 307– 319
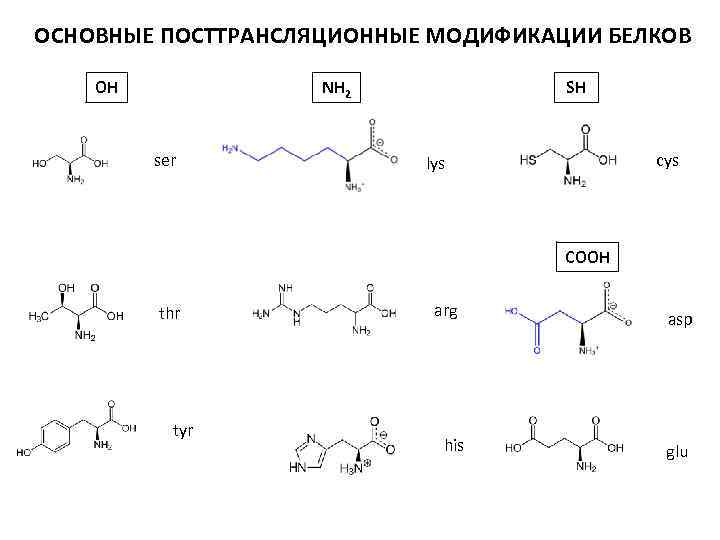 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ OH NH 2 ser SH cys lys COOH thr tyr arg his asp glu
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ OH NH 2 ser SH cys lys COOH thr tyr arg his asp glu
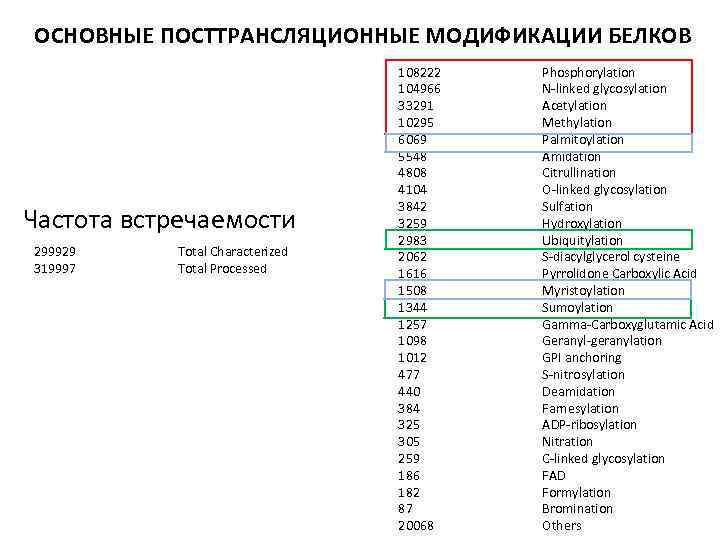 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Частота встречаемости 299929 319997 Total Characterized Total Processed 108222 104966 33291 10295 6069 5548 4808 4104 3842 3259 2983 2062 1616 1508 1344 1257 1098 1012 477 440 384 325 305 259 186 182 87 20068 Phosphorylation N-linked glycosylation Acetylation Methylation Palmitoylation Amidation Citrullination O-linked glycosylation Sulfation Hydroxylation Ubiquitylation S-diacylglycerol cysteine Pyrrolidone Carboxylic Acid Myristoylation Sumoylation Gamma-Carboxyglutamic Acid Geranyl-geranylation GPI anchoring S-nitrosylation Deamidation Farnesylation ADP-ribosylation Nitration C-linked glycosylation FAD Formylation Bromination Others
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Частота встречаемости 299929 319997 Total Characterized Total Processed 108222 104966 33291 10295 6069 5548 4808 4104 3842 3259 2983 2062 1616 1508 1344 1257 1098 1012 477 440 384 325 305 259 186 182 87 20068 Phosphorylation N-linked glycosylation Acetylation Methylation Palmitoylation Amidation Citrullination O-linked glycosylation Sulfation Hydroxylation Ubiquitylation S-diacylglycerol cysteine Pyrrolidone Carboxylic Acid Myristoylation Sumoylation Gamma-Carboxyglutamic Acid Geranyl-geranylation GPI anchoring S-nitrosylation Deamidation Farnesylation ADP-ribosylation Nitration C-linked glycosylation FAD Formylation Bromination Others
 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ • небольшие химические группы: фосфорилирование, гликозилирование, S-нитрозилирование, метилирование, N-ацетилирование; • липиды: пальмитилирование - присоединение 16 -звенной ацильной цепи к остаткам цистеина через тиоэфирную связь, myristoylation является ковалентным и необратимым присоединением 14 звенной жирной кислоты к N-концевым остаткам Gly эукариотических или вирусных белков; • небольшие белки: убиквитинилирование, сумоилирование.
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ • небольшие химические группы: фосфорилирование, гликозилирование, S-нитрозилирование, метилирование, N-ацетилирование; • липиды: пальмитилирование - присоединение 16 -звенной ацильной цепи к остаткам цистеина через тиоэфирную связь, myristoylation является ковалентным и необратимым присоединением 14 звенной жирной кислоты к N-концевым остаткам Gly эукариотических или вирусных белков; • небольшие белки: убиквитинилирование, сумоилирование.
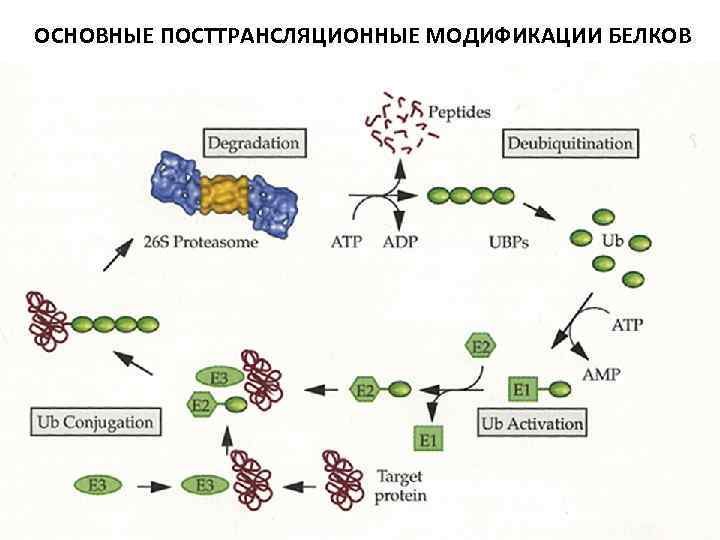
 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Убиквитин 76 ао, 8. 5 к. Да Функции: • связывание протеасомой и деградация белков; • изменение клеточной локализации; • контроль функций других белков; • контроль клеточных процессов; Процессы: • деление клеточного цикла; • транскрипция и репликация; • биогенез органелл, в том числе рибосом; • дифференцировка и созревание клеток; • передача клеточного сигнала, ответ на стресс; • моделирование рецепторов на клеточной поверхности; • морфогенез нервной системы; • дегенерация нервных и мышечных волокон; • продукция антигенов; • иммунный ответ; • генерация иммунного ответа при вирусной инфекции; • апоптоз.
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ Убиквитин 76 ао, 8. 5 к. Да Функции: • связывание протеасомой и деградация белков; • изменение клеточной локализации; • контроль функций других белков; • контроль клеточных процессов; Процессы: • деление клеточного цикла; • транскрипция и репликация; • биогенез органелл, в том числе рибосом; • дифференцировка и созревание клеток; • передача клеточного сигнала, ответ на стресс; • моделирование рецепторов на клеточной поверхности; • морфогенез нервной системы; • дегенерация нервных и мышечных волокон; • продукция антигенов; • иммунный ответ; • генерация иммунного ответа при вирусной инфекции; • апоптоз.
 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ
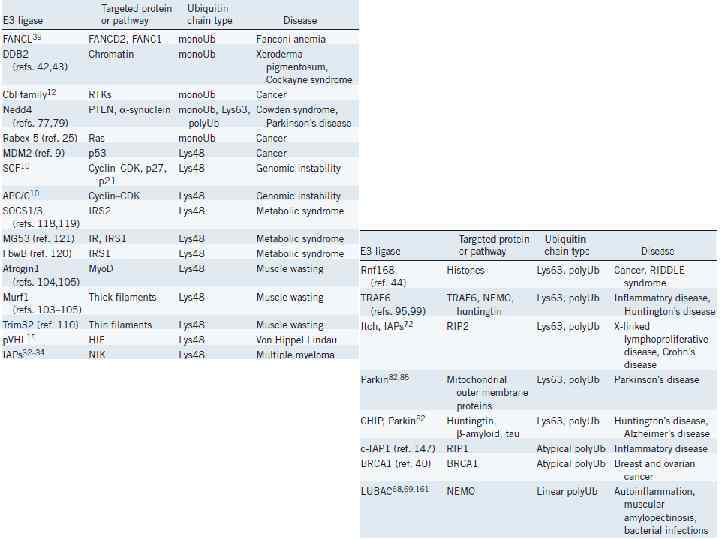
 ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ SUMO Small Ubiquitin-like Modifier ~100 ао, 12 к. Да Функции: • транспорт белков (цитоплазма-ядро); • регуляция транскрипции; • апоптоз; • стабильность белков; • прогресс клеточного цикла; • ответ на стресс; • НЕ используется для деградации белков; Заболевания: • наследственные кардиомиопатии; • болезнь Альцгемера; • болезнь Паркинсона; • болезнь Хантингтона; • рак; • спиноцеребральная атахия 1; • амиотропный латеральный склероз; 1996
ОСНОВНЫЕ ПОСТТРАНСЛЯЦИОННЫЕ МОДИФИКАЦИИ БЕЛКОВ SUMO Small Ubiquitin-like Modifier ~100 ао, 12 к. Да Функции: • транспорт белков (цитоплазма-ядро); • регуляция транскрипции; • апоптоз; • стабильность белков; • прогресс клеточного цикла; • ответ на стресс; • НЕ используется для деградации белков; Заболевания: • наследственные кардиомиопатии; • болезнь Альцгемера; • болезнь Паркинсона; • болезнь Хантингтона; • рак; • спиноцеребральная атахия 1; • амиотропный латеральный склероз; 1996



