генная терапия 2003.ppt
- Количество слайдов: 27
 «Ремонт генів» : генна терапія ОЛЕКСАНДРІВНА ВИКОНАЛА: МАГІСТР ІІ РОКУ НАВЧАННЯ КАФЕДРИ ВІРУСОЛОГІЇ ННЦ «ІНСТИТУТ БІОЛОГІЇ» КНУ ІМ. Т. Г. ШЕВЧЕНКА ЧАЙКА ДАР'Я
«Ремонт генів» : генна терапія ОЛЕКСАНДРІВНА ВИКОНАЛА: МАГІСТР ІІ РОКУ НАВЧАННЯ КАФЕДРИ ВІРУСОЛОГІЇ ННЦ «ІНСТИТУТ БІОЛОГІЇ» КНУ ІМ. Т. Г. ШЕВЧЕНКА ЧАЙКА ДАР'Я
 Генна терапія – сукупність генно-інженерних (біотехнологічних) та медичних методів, що направлені на внесення змін у генетичний апарат соматичних клітин людини з метою лікування спадкових та набутих захворювань. “Ремонт генів” має фундаментальну перевагу в порівнянні з іншими методами лікування, оскільки дає можливість корегувати дефекти на первинному молекулярному рівні. Йдеться про генну терапію соматичних клітин, оскільки робота з статевими клітинами та клітинами плода заборонена як з етичних міркувань, так і законодавчо. Спадкова генотерапія є трансгенною і змінює всі клітини організму. У людини вона не використовується. Неспадкова (соматична) генна терапія корегує тільки соматичні клітини, уражені внаслідок генетичного дефекту. Неспадкова генотерапія може допомогти індивідууму, але вона не покращить стан майбутніх поколінь, тому що мутантний ген не змінений у гаметах.
Генна терапія – сукупність генно-інженерних (біотехнологічних) та медичних методів, що направлені на внесення змін у генетичний апарат соматичних клітин людини з метою лікування спадкових та набутих захворювань. “Ремонт генів” має фундаментальну перевагу в порівнянні з іншими методами лікування, оскільки дає можливість корегувати дефекти на первинному молекулярному рівні. Йдеться про генну терапію соматичних клітин, оскільки робота з статевими клітинами та клітинами плода заборонена як з етичних міркувань, так і законодавчо. Спадкова генотерапія є трансгенною і змінює всі клітини організму. У людини вона не використовується. Неспадкова (соматична) генна терапія корегує тільки соматичні клітини, уражені внаслідок генетичного дефекту. Неспадкова генотерапія може допомогти індивідууму, але вона не покращить стан майбутніх поколінь, тому що мутантний ген не змінений у гаметах.
 Проблеми, які потребують вирішення для застосування підходів генної терапії При розробці генотерапії також вирішуються такі питання: Ø які клітини необхідно використовувати? Ø як отримати доступ до клітин, що повинні піддаватись корекції; Ø яку частину клітин необхідно вилікувати, щоб зменшити або зупинити прогресування хвороби? Ø чи не викличе надлишкова експресія введеного гена побічних ефектів 4) чи є безпечним потрапляння реконструйо¬ваного гена в інші тканини? Ø чи будуть модифіковані клітини функціонувати (підтримуватись) безмежно довгий час, чи необхідно буде проводити повторні введення? Ø чи будуть атаковані нові клітини імунною системою?
Проблеми, які потребують вирішення для застосування підходів генної терапії При розробці генотерапії також вирішуються такі питання: Ø які клітини необхідно використовувати? Ø як отримати доступ до клітин, що повинні піддаватись корекції; Ø яку частину клітин необхідно вилікувати, щоб зменшити або зупинити прогресування хвороби? Ø чи не викличе надлишкова експресія введеного гена побічних ефектів 4) чи є безпечним потрапляння реконструйо¬ваного гена в інші тканини? Ø чи будуть модифіковані клітини функціонувати (підтримуватись) безмежно довгий час, чи необхідно буде проводити повторні введення? Ø чи будуть атаковані нові клітини імунною системою?
 Види генної терапії Замісна терапія – використовується для лікування генетичних дефектів, обумовлених втратою функції гена. Суть полягає у введенні у клітини копії нормального “терапевтичного” гена та створення умов його замісної експресії, щоб замінити функцію дефектного гена. Інгібіторна терапія – лікування генетичних захворювань, обумовлених надмірною активацією гена. Стратегія скерована на вбудовування гена, продукт якого блокує експресію патологічного гена і тим самим гальмує розвиток хвороби. Елімінація певних клітин – знищення трансформованих. Стратегія може включати: конкретної популяції клітин, зокрема Øутворення в клітині токсичного продукту; Øекспресію ензиму, що перетворює нетоксичний лікарський препарат в токсичний продукт; Øспецифічне мічення клітин для їх елімінації імунною системою. Значні успіхи досягнуті в посиленні експресії цитохрому Р-450 в трансформованих (ракових) клітинах. Перетворення нетоксичних сполук за дії цього ензиму на високотоксичні вбиває саме ракові клітини.
Види генної терапії Замісна терапія – використовується для лікування генетичних дефектів, обумовлених втратою функції гена. Суть полягає у введенні у клітини копії нормального “терапевтичного” гена та створення умов його замісної експресії, щоб замінити функцію дефектного гена. Інгібіторна терапія – лікування генетичних захворювань, обумовлених надмірною активацією гена. Стратегія скерована на вбудовування гена, продукт якого блокує експресію патологічного гена і тим самим гальмує розвиток хвороби. Елімінація певних клітин – знищення трансформованих. Стратегія може включати: конкретної популяції клітин, зокрема Øутворення в клітині токсичного продукту; Øекспресію ензиму, що перетворює нетоксичний лікарський препарат в токсичний продукт; Øспецифічне мічення клітин для їх елімінації імунною системою. Значні успіхи досягнуті в посиленні експресії цитохрому Р-450 в трансформованих (ракових) клітинах. Перетворення нетоксичних сполук за дії цього ензиму на високотоксичні вбиває саме ракові клітини.
 Генна терапія ex vivo, тобто зовнішня, включення “терапевтичного” гена в геном клітин здійснюється поза організмом. Клітини крові, кісткового мозку або інших тканин отримують від пацієнта, трансформують (вбудовують необхідний “терапевтичний” ген) поза організмом, здійснюють відбір та нарощування “виправлених” клітин і потім повертають модифіковані клітини в організм пацієнту шляхом інфузії або трансплантації. Використання власних (аутологічних) клітин пацієнта гарантує, що після інфузії чи трансплантації у нього не буде розвиватись імунна відповідь. Особливо перспективним напрямом у генній терапії ex vivo виявилась генно-інженерна модифікація поліпотентних стовбурових клітин кісткового мозку з їх наступною інфузією або трансплантацією пацієнту. Терапевтичний ефект трансплантації кісткового мозку пов’язаний з наявністю в ньому ембріональних стовбурових клітин, які здатні проліферувати і диференціюватись в різні типи клітин крові, зокрема такі як В- та Тлімфоцити (В- та Т-клітини), макрофаги, еритроцити, тромбоцити та остеобласти. Наприклад, у випадку якщо генна мутація порушує функції макрофагів, трансплантація кісткового мозку забезпечує реципієнту постійний запас компетентних макрофагів, які утворюються з поліпотентних стовбурових клітин.
Генна терапія ex vivo, тобто зовнішня, включення “терапевтичного” гена в геном клітин здійснюється поза організмом. Клітини крові, кісткового мозку або інших тканин отримують від пацієнта, трансформують (вбудовують необхідний “терапевтичний” ген) поза організмом, здійснюють відбір та нарощування “виправлених” клітин і потім повертають модифіковані клітини в організм пацієнту шляхом інфузії або трансплантації. Використання власних (аутологічних) клітин пацієнта гарантує, що після інфузії чи трансплантації у нього не буде розвиватись імунна відповідь. Особливо перспективним напрямом у генній терапії ex vivo виявилась генно-інженерна модифікація поліпотентних стовбурових клітин кісткового мозку з їх наступною інфузією або трансплантацією пацієнту. Терапевтичний ефект трансплантації кісткового мозку пов’язаний з наявністю в ньому ембріональних стовбурових клітин, які здатні проліферувати і диференціюватись в різні типи клітин крові, зокрема такі як В- та Тлімфоцити (В- та Т-клітини), макрофаги, еритроцити, тромбоцити та остеобласти. Наприклад, у випадку якщо генна мутація порушує функції макрофагів, трансплантація кісткового мозку забезпечує реципієнту постійний запас компетентних макрофагів, які утворюються з поліпотентних стовбурових клітин.
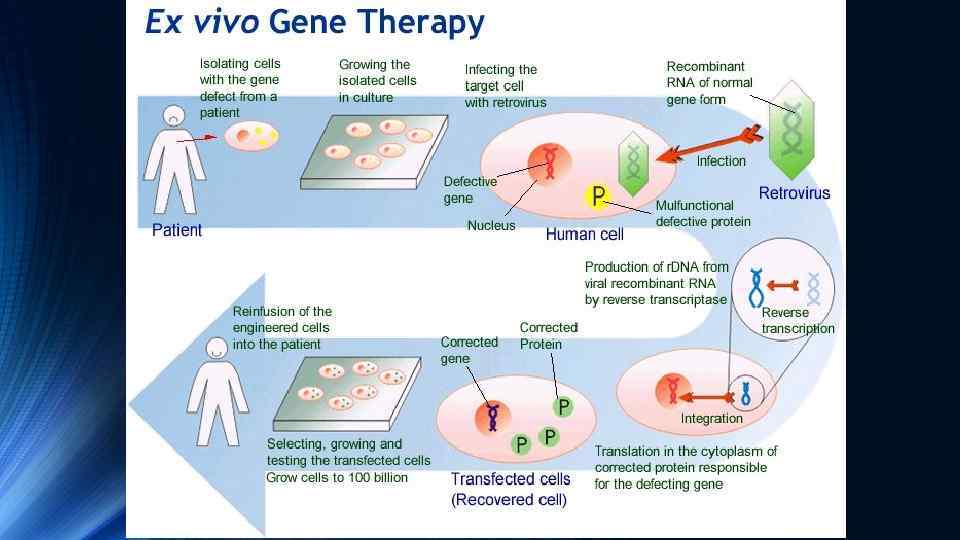
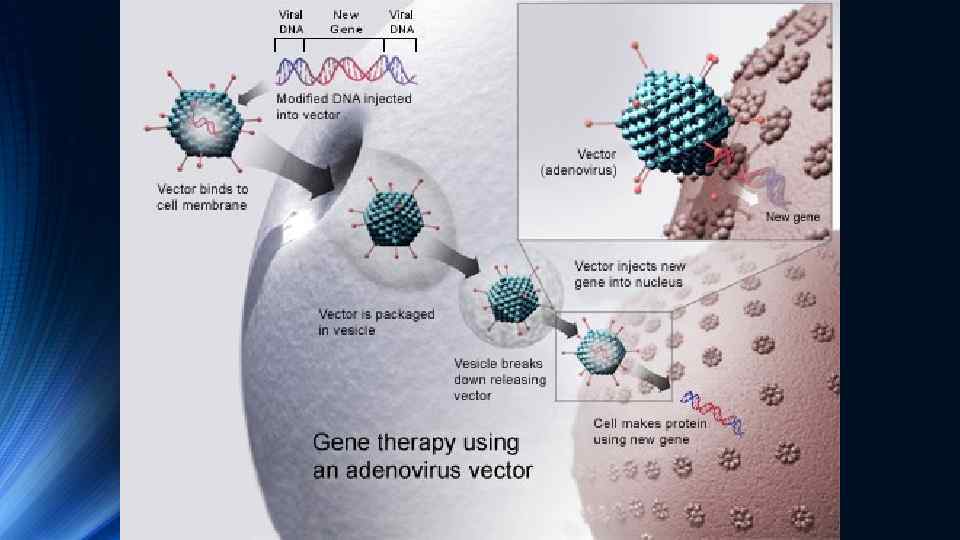
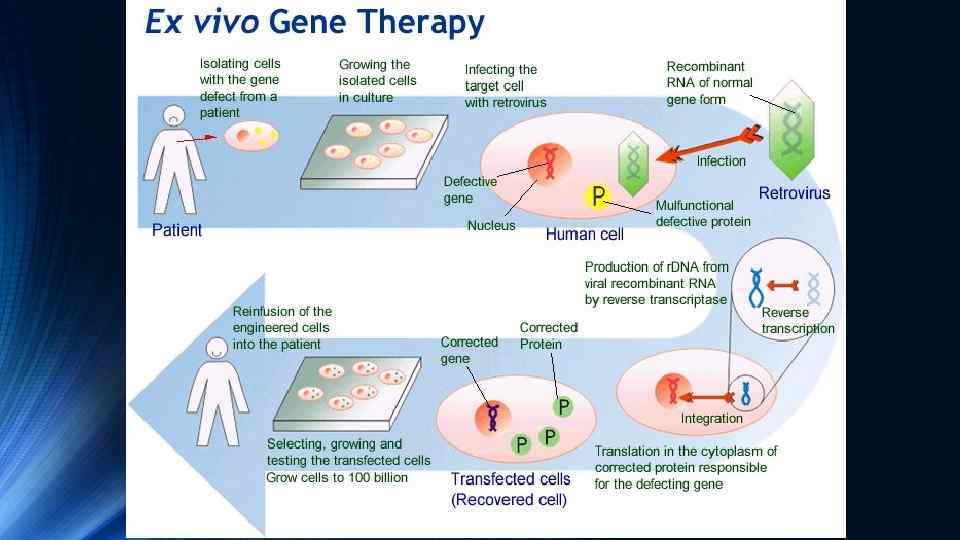
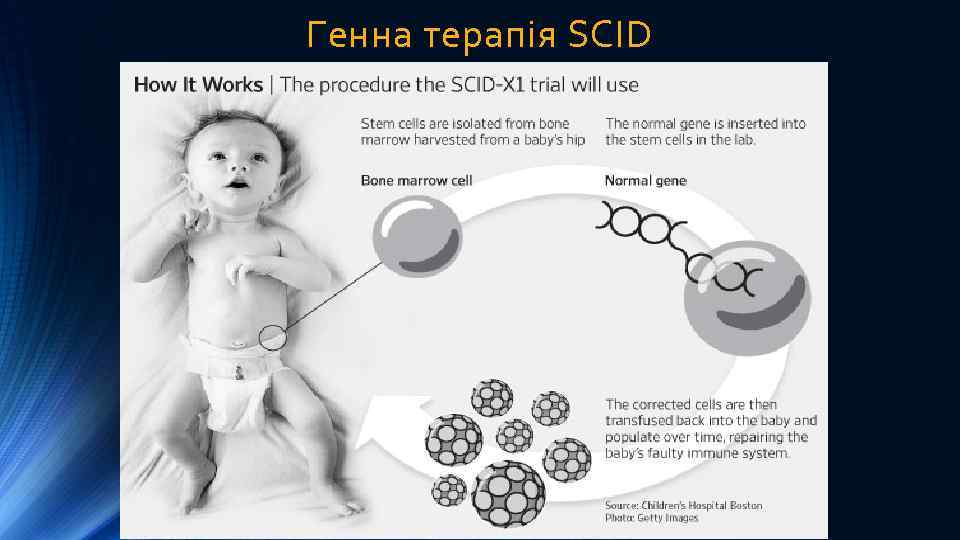
 Приклади успішного застосування генної терапії ex vivo Значних успіхів було досягнуто у лікуванні генетичного дефекту ензиму аденозиндезамінази (АДА), який викликає порушення метаболізму пуринів та призводить до підвищення в крові рівня аденозину та дезокси-аденозину. Їх токсична дія веде до загибелі В- та Т-лімфоцитів та розвитку важкого комбінованого імунодефіциту (SCID – severe combined immunodeficiency). Оскільки В- та Т-лімфоцити утворюються зі стовбурових клітин, то перенесення в стовбурові клітини “нормального” гена АДА з наступним введенням їх пацієнту, сприяє зниженню в його крові рівня аденозину та дезоксиаденозину, що попереджує руйнування В- та Т-лімфоцитів В 1990 р. було здійснено перше успішне застосування генної терапії для лікування SCID у двох дівчаток. Ця робота продемонструвала безпечність генної терапії ex vivo з використанням стовбурових клітин кісткового мозку. В теперішній час для лікування SCID у новонароджених переважно використовують стовбурові клітини пуповинної (хордової) крові. З пуповинної крові отримують стовбурові (CD 34) клітини, трансдукують в них к. ДНК ензиму АДА і такі генетично модифіковані клітини вводять новонародженим з дефіцитом АДА та симптомами SCID. Показана висока ефективність такого лікування саме у новонароджених.
Приклади успішного застосування генної терапії ex vivo Значних успіхів було досягнуто у лікуванні генетичного дефекту ензиму аденозиндезамінази (АДА), який викликає порушення метаболізму пуринів та призводить до підвищення в крові рівня аденозину та дезокси-аденозину. Їх токсична дія веде до загибелі В- та Т-лімфоцитів та розвитку важкого комбінованого імунодефіциту (SCID – severe combined immunodeficiency). Оскільки В- та Т-лімфоцити утворюються зі стовбурових клітин, то перенесення в стовбурові клітини “нормального” гена АДА з наступним введенням їх пацієнту, сприяє зниженню в його крові рівня аденозину та дезоксиаденозину, що попереджує руйнування В- та Т-лімфоцитів В 1990 р. було здійснено перше успішне застосування генної терапії для лікування SCID у двох дівчаток. Ця робота продемонструвала безпечність генної терапії ex vivo з використанням стовбурових клітин кісткового мозку. В теперішній час для лікування SCID у новонароджених переважно використовують стовбурові клітини пуповинної (хордової) крові. З пуповинної крові отримують стовбурові (CD 34) клітини, трансдукують в них к. ДНК ензиму АДА і такі генетично модифіковані клітини вводять новонародженим з дефіцитом АДА та симптомами SCID. Показана висока ефективність такого лікування саме у новонароджених.
 Генна терапія SCID
Генна терапія SCID
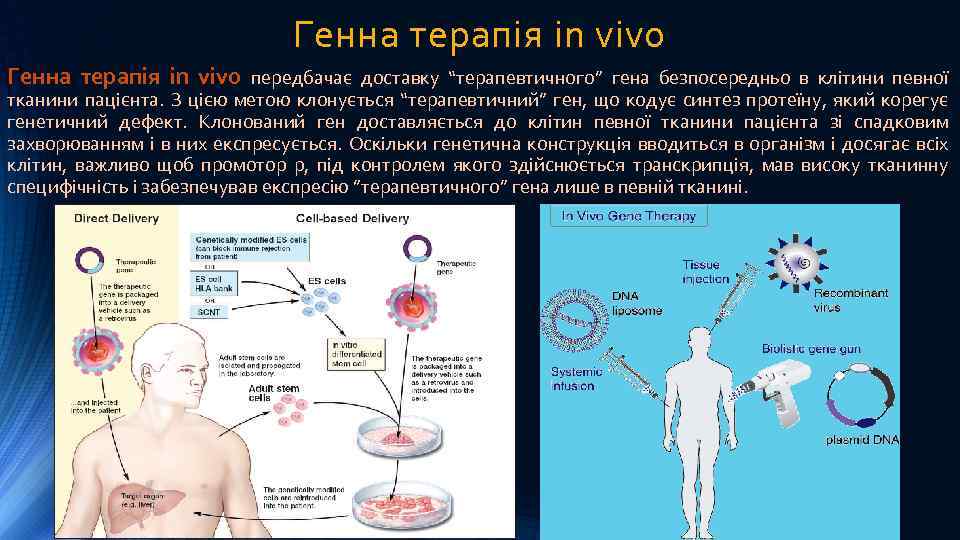 Генна терапія in vivo передбачає доставку “терапевтичного” гена безпосередньо в клітини певної тканини пацієнта. З цією метою клонується “терапевтичний” ген, що кодує синтез протеїну, який корегує генетичний дефект. Клонований ген доставляється до клітин певної тканини пацієнта зі спадковим захворюванням і в них експресується. Оскільки генетична конструкція вводиться в організм і досягає всіх клітин, важливо щоб промотор p, під контролем якого здійснюється транскрипція, мав високу тканинну специфічність і забезпечував експресію ”терапевтичного” гена лише в певній тканині.
Генна терапія in vivo передбачає доставку “терапевтичного” гена безпосередньо в клітини певної тканини пацієнта. З цією метою клонується “терапевтичний” ген, що кодує синтез протеїну, який корегує генетичний дефект. Клонований ген доставляється до клітин певної тканини пацієнта зі спадковим захворюванням і в них експресується. Оскільки генетична конструкція вводиться в організм і досягає всіх клітин, важливо щоб промотор p, під контролем якого здійснюється транскрипція, мав високу тканинну специфічність і забезпечував експресію ”терапевтичного” гена лише в певній тканині.
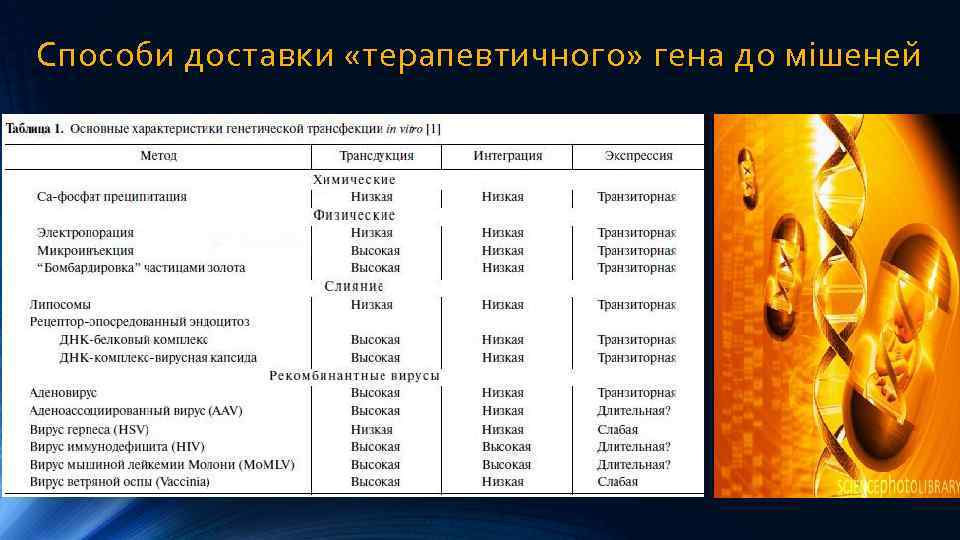
 Способи доставки «терапевтичного» гена до мішеней Надзвичайно важливою проблемою генної терапії є вибір способу доставки терапевтичного гена до тканини-мішені. Ідеальна система доставки “терапевтичного” гена повинна забезпечувати: Øвисоку ефективність цільового поглинання “терапевтичного” гена клітинами-мішенями; Ø мінімальне його внутрішньоклітинне руйнування під час транспорту в ядро; Øвисокий рівень експресії, який забезпечить лікувальний ефект; Ø відсутність перебудов і мутацій; Øвідсутність імуногенності продукту експресії.
Способи доставки «терапевтичного» гена до мішеней Надзвичайно важливою проблемою генної терапії є вибір способу доставки терапевтичного гена до тканини-мішені. Ідеальна система доставки “терапевтичного” гена повинна забезпечувати: Øвисоку ефективність цільового поглинання “терапевтичного” гена клітинами-мішенями; Ø мінімальне його внутрішньоклітинне руйнування під час транспорту в ядро; Øвисокий рівень експресії, який забезпечить лікувальний ефект; Ø відсутність перебудов і мутацій; Øвідсутність імуногенності продукту експресії.
 Способи доставки «терапевтичного» гена до мішеней
Способи доставки «терапевтичного» гена до мішеней
 Вибір системи доставки «терапевтичних» генів Надзвичайно важливою проблемою генної терапії є вибір способу доставки терапевтичного гена до тканини-мішені. Ідеальна система доставки “терапевтичного” гена повинна забезпечувати: Øвисоку ефективність цільового поглинання “терапевтичного” гена клітинами-мішенями; Ø мінімальне його внутрішньоклітинне руйнування під час транспорту в ядро; Øвисокий рівень експресії, який забезпечить лікувальний ефект; Ø відсутність перебудов і мутацій; Øвідсутність імуногенності продукту експресії.
Вибір системи доставки «терапевтичних» генів Надзвичайно важливою проблемою генної терапії є вибір способу доставки терапевтичного гена до тканини-мішені. Ідеальна система доставки “терапевтичного” гена повинна забезпечувати: Øвисоку ефективність цільового поглинання “терапевтичного” гена клітинами-мішенями; Ø мінімальне його внутрішньоклітинне руйнування під час транспорту в ядро; Øвисокий рівень експресії, який забезпечить лікувальний ефект; Ø відсутність перебудов і мутацій; Øвідсутність імуногенності продукту експресії.
 Невірусні системи доставки терапевтичних генів в клітини у генній терапії Невірусні системи доставки включають фізичні та хімічні методи. До фізичних методів належать: Øмікроін’єкції, Øін’єкція струменем, Ø електропорація, Øзаморожування-відтаювання, Øбіобалістика (бомбардування клітин краплями рідини або суспензією часточок золота з адсорбованою плазмідою). Хімічні методи ґрунтуються на використанні солей деяких катіонів (наприклад кальцію), ДЕАЕ-декстрану, полілізину, ліпосом, тощо.
Невірусні системи доставки терапевтичних генів в клітини у генній терапії Невірусні системи доставки включають фізичні та хімічні методи. До фізичних методів належать: Øмікроін’єкції, Øін’єкція струменем, Ø електропорація, Øзаморожування-відтаювання, Øбіобалістика (бомбардування клітин краплями рідини або суспензією часточок золота з адсорбованою плазмідою). Хімічні методи ґрунтуються на використанні солей деяких катіонів (наприклад кальцію), ДЕАЕ-декстрану, полілізину, ліпосом, тощо.
 Невірусні системи доставки терапевтичних генів в клітини у генній терапії. Фізичні методи ØПряме введення ДНК-конструкції в клітини-мішені шляхом ін’єкції є самим простим методом доставки трансгена (гена, що переноситься) в клітини in vivo, за якого ДНК вводиться безпосередньо в тканину шляхом ін’єкції. Область застосування даного методу обмежується такими тканинами як шкіра, тимус, поперечно-смугасті м’язи, деякі солідні (ті, що ростуть щільним вузлом) пухлини. Крім того, для здійснення прямого введення потрібні великі кількості ДНК. Ефективність такого способу трансфекції зазвичай низька (складає менше 1%), але достатня наприклад для генетичної імунізації; ØІснують методи прямого внесення генів у тканини через кровоносні судини, що проходять крізь орган, який необхідно трансфікувати (зокрема при лікуванні хвороб печінки), методи прямої ін’єкції у ниркову паренхіму та у тканину сечовивідних шляхів; Ø Аерозольне введення генетичного матеріалу в клітини дихальних шляхів використовується при лікуванні захворювань легень; ØБіолістична трансфекція грунтується на обстрілюванні (бомбардуванні) органів і тканин мікрочастками важких металів (золото, вольфрам діаметром 1 -3 мкм) покритих плазмідною ДНК. Введені таким чином “терапевтичні” гени експресуються в клітинах-мішенях, а їхні продукти потрапляють у кров. В якості засобів використовуються схожі на стрілецьку зброю біолістична “генна” гармата, біолістична рушниця, гелієвий пістолет. Мікрочастинки проходять через клітинні шари і переносять генетичну конструкцію безпосередньо у ядра клітин. Глибина проникнення мікрочасток, як правило, невелика – до 1 мм, тому метод використовується переважно для трансфекції шкіри або прилеглої хрящової тканини. Особливі умови обстрілу дозволяють мікрочастинкам проникати на глибину до 4 -5 мм і переносити генні конструкти у волокна поперечно-смугастих м’язів.
Невірусні системи доставки терапевтичних генів в клітини у генній терапії. Фізичні методи ØПряме введення ДНК-конструкції в клітини-мішені шляхом ін’єкції є самим простим методом доставки трансгена (гена, що переноситься) в клітини in vivo, за якого ДНК вводиться безпосередньо в тканину шляхом ін’єкції. Область застосування даного методу обмежується такими тканинами як шкіра, тимус, поперечно-смугасті м’язи, деякі солідні (ті, що ростуть щільним вузлом) пухлини. Крім того, для здійснення прямого введення потрібні великі кількості ДНК. Ефективність такого способу трансфекції зазвичай низька (складає менше 1%), але достатня наприклад для генетичної імунізації; ØІснують методи прямого внесення генів у тканини через кровоносні судини, що проходять крізь орган, який необхідно трансфікувати (зокрема при лікуванні хвороб печінки), методи прямої ін’єкції у ниркову паренхіму та у тканину сечовивідних шляхів; Ø Аерозольне введення генетичного матеріалу в клітини дихальних шляхів використовується при лікуванні захворювань легень; ØБіолістична трансфекція грунтується на обстрілюванні (бомбардуванні) органів і тканин мікрочастками важких металів (золото, вольфрам діаметром 1 -3 мкм) покритих плазмідною ДНК. Введені таким чином “терапевтичні” гени експресуються в клітинах-мішенях, а їхні продукти потрапляють у кров. В якості засобів використовуються схожі на стрілецьку зброю біолістична “генна” гармата, біолістична рушниця, гелієвий пістолет. Мікрочастинки проходять через клітинні шари і переносять генетичну конструкцію безпосередньо у ядра клітин. Глибина проникнення мікрочасток, як правило, невелика – до 1 мм, тому метод використовується переважно для трансфекції шкіри або прилеглої хрящової тканини. Особливі умови обстрілу дозволяють мікрочастинкам проникати на глибину до 4 -5 мм і переносити генні конструкти у волокна поперечно-смугастих м’язів.
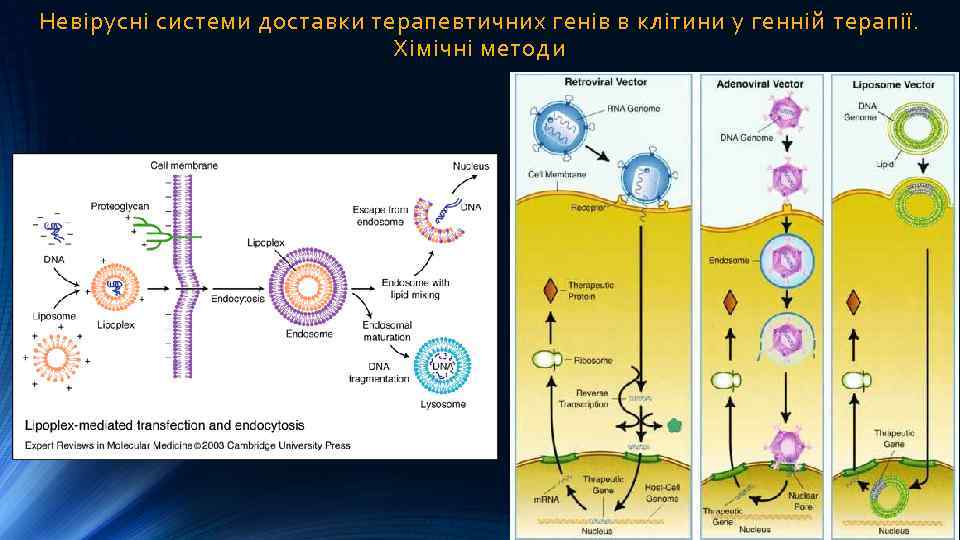
 Невірусні системи доставки терапевтичних генів в клітини у генній терапії. Хімічні методи Ø Доставка генетичної конструкції в ліпосомах. Зокрема в катіонних ліпосомах з позитивним зарядом, негативно заряджена молекула ДНК утворює ДНК-ліпідний комплекс – ліпоплекс. Переваги застосування таких комплексів порівняно з вірусними векторами полягають у здатності нести більший об’єм інформації, неможливості виникнення рекомбінацій та появи інфекційних властивостей. Конструкти мають нижчу вірогідність ініціації імунної відповіді або реакції запалення, вони простіші та дешевші у виготовленні. В 2003 р. були створені надзвичайно малі – мілімікронні ліпосоми покриті полімером поліетиленгліколем, які здатні переносити терапевтичну ДНК в нейрони головного мозку і через пори в ядро. До цього перенесення генів в нейрони головного мозку було неможливим із-за того, що вірусні вектори не в стані проходити гематоенцефалічний бар’єр. На основі створеної технології розроблено методи генної терапії хвороби Паркінсона. Ø Для доставки до клітин великих генетичних конструкцій (>10 т. п. н. ) за участю ендосомного клітинного транспорту утворюють кон’югати ДНК з іншими молекулами. Такий підхід забезпечує цілеспрямовану доставку генних конструктів лише у клітини, що містять відповідні рецептори. Ø Полімерні молекули, що несуть надлишковий катіонний заряд, можуть суттєво підвищувати ефективність трансфекції. Певну активність мають навіть невеликі молекули (протамін, диметилсульфоксид, похідні імідазолу, граміцидин, ліпополіамін). Більшу активність проявляють синтетичні полімери (поліетиленімін, полілізин, ліпополілізин або його кон’югати з трансферином, галактозою, манозою), а також природні катіонні протеїни (гістони).
Невірусні системи доставки терапевтичних генів в клітини у генній терапії. Хімічні методи Ø Доставка генетичної конструкції в ліпосомах. Зокрема в катіонних ліпосомах з позитивним зарядом, негативно заряджена молекула ДНК утворює ДНК-ліпідний комплекс – ліпоплекс. Переваги застосування таких комплексів порівняно з вірусними векторами полягають у здатності нести більший об’єм інформації, неможливості виникнення рекомбінацій та появи інфекційних властивостей. Конструкти мають нижчу вірогідність ініціації імунної відповіді або реакції запалення, вони простіші та дешевші у виготовленні. В 2003 р. були створені надзвичайно малі – мілімікронні ліпосоми покриті полімером поліетиленгліколем, які здатні переносити терапевтичну ДНК в нейрони головного мозку і через пори в ядро. До цього перенесення генів в нейрони головного мозку було неможливим із-за того, що вірусні вектори не в стані проходити гематоенцефалічний бар’єр. На основі створеної технології розроблено методи генної терапії хвороби Паркінсона. Ø Для доставки до клітин великих генетичних конструкцій (>10 т. п. н. ) за участю ендосомного клітинного транспорту утворюють кон’югати ДНК з іншими молекулами. Такий підхід забезпечує цілеспрямовану доставку генних конструктів лише у клітини, що містять відповідні рецептори. Ø Полімерні молекули, що несуть надлишковий катіонний заряд, можуть суттєво підвищувати ефективність трансфекції. Певну активність мають навіть невеликі молекули (протамін, диметилсульфоксид, похідні імідазолу, граміцидин, ліпополіамін). Більшу активність проявляють синтетичні полімери (поліетиленімін, полілізин, ліпополілізин або його кон’югати з трансферином, галактозою, манозою), а також природні катіонні протеїни (гістони).
 Невірусні системи доставки терапевтичних генів в клітини у генній терапії. Хімічні методи
Невірусні системи доставки терапевтичних генів в клітини у генній терапії. Хімічні методи
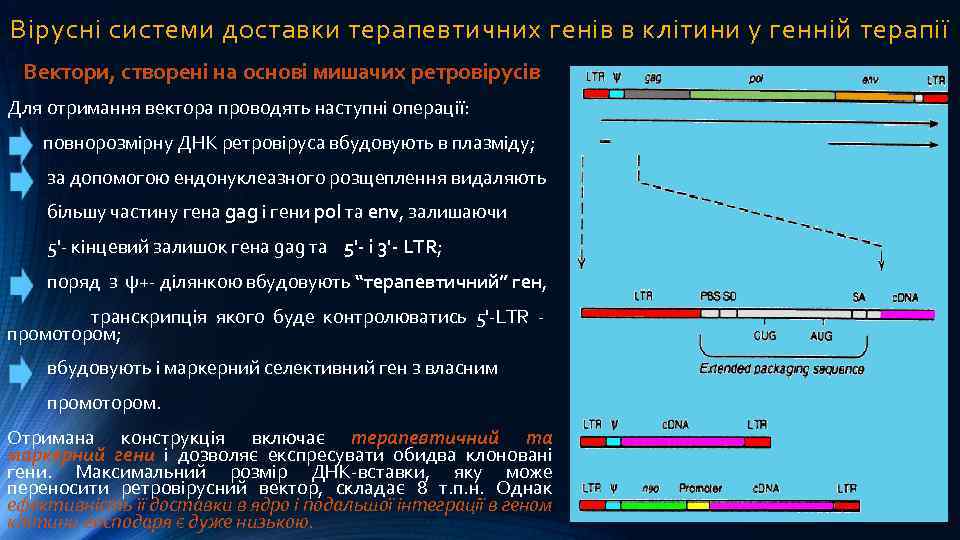 Вірусні системи доставки терапевтичних генів в клітини у генній терапії Вектори, створені на основі мишачих ретровірусів Для отримання вектора проводять наступні операції: повнорозмірну ДНК ретровіруса вбудовують в плазміду; за допомогою ендонуклеазного розщеплення видаляють більшу частину гена gag і гени pol та env, залишаючи 5'- кінцевий залишок гена gag та 5'- і 3'- LTR; поряд з ψ+- ділянкою вбудовують “терапевтичний” ген, транскрипція якого буде контролюватись 5'-LTR промотором; вбудовують і маркерний селективний ген з власним промотором. Отримана конструкція включає терапевтичний та маркерний гени і дозволяє експресувати обидва клоновані гени. Максимальний розмір ДНК-вставки, яку може переносити ретровірусний вектор, складає 8 т. п. н. Однак ефективність її доставки в ядро і подальшої інтеграції в геном клітини-господаря є дуже низькою.
Вірусні системи доставки терапевтичних генів в клітини у генній терапії Вектори, створені на основі мишачих ретровірусів Для отримання вектора проводять наступні операції: повнорозмірну ДНК ретровіруса вбудовують в плазміду; за допомогою ендонуклеазного розщеплення видаляють більшу частину гена gag і гени pol та env, залишаючи 5'- кінцевий залишок гена gag та 5'- і 3'- LTR; поряд з ψ+- ділянкою вбудовують “терапевтичний” ген, транскрипція якого буде контролюватись 5'-LTR промотором; вбудовують і маркерний селективний ген з власним промотором. Отримана конструкція включає терапевтичний та маркерний гени і дозволяє експресувати обидва клоновані гени. Максимальний розмір ДНК-вставки, яку може переносити ретровірусний вектор, складає 8 т. п. н. Однак ефективність її доставки в ядро і подальшої інтеграції в геном клітини-господаря є дуже низькою.
 Способи реалізації підходів генної терапії. Стратегії на основі протеїнів включають: 1. Введення “суїцидальних” генів. Клітини трансфекують суїцидальним геном з метою їх негативної селекції (видалення). Суїцидальний ген здійснює експресію ензиму, який перетворить певний нетоксичний лікарський засіб на його токсичну форму. Токсичний продукт вбиває трансформовану клітину. Певні успіхи досягнуті у використанні тимідилаткінази вірусу простого герпесу. Цей ген вибірково фосфорилює синтетичний нуклеозидний аналог генцикловір, який потім ефективно пригнічує синтез ДНК та обумовлює загибель пухлинних клітин; 2. Домінант-негативні протеїни. Вводиться ген (або викликається мутація в гені), що експресує мутантну одну із субодиниць олігомерного протеїну. Такий домінант-негативний протеїн, взаємодіючи з нормальними субодиницями протеїну утворює функціонально неактивний комплекс; 3. Химерні рецептори ВІЛ. CD 4 – модифіковані Т-лімфоцити інгібують реплікацію вірусів у Тклітинах та макрофагах in vitro, а також опосередковують загибель ВІЛ-інфікованих Т-клітин. 4. Внутрішньоклітинні одноланцюгові антитіла (SFv). Такі антитіла приєднуються до вірусних протеїнів в клітині та блокують їх дію, зокрема це анті-Rev SFv та анті-gr 120 SFv.
Способи реалізації підходів генної терапії. Стратегії на основі протеїнів включають: 1. Введення “суїцидальних” генів. Клітини трансфекують суїцидальним геном з метою їх негативної селекції (видалення). Суїцидальний ген здійснює експресію ензиму, який перетворить певний нетоксичний лікарський засіб на його токсичну форму. Токсичний продукт вбиває трансформовану клітину. Певні успіхи досягнуті у використанні тимідилаткінази вірусу простого герпесу. Цей ген вибірково фосфорилює синтетичний нуклеозидний аналог генцикловір, який потім ефективно пригнічує синтез ДНК та обумовлює загибель пухлинних клітин; 2. Домінант-негативні протеїни. Вводиться ген (або викликається мутація в гені), що експресує мутантну одну із субодиниць олігомерного протеїну. Такий домінант-негативний протеїн, взаємодіючи з нормальними субодиницями протеїну утворює функціонально неактивний комплекс; 3. Химерні рецептори ВІЛ. CD 4 – модифіковані Т-лімфоцити інгібують реплікацію вірусів у Тклітинах та макрофагах in vitro, а також опосередковують загибель ВІЛ-інфікованих Т-клітин. 4. Внутрішньоклітинні одноланцюгові антитіла (SFv). Такі антитіла приєднуються до вірусних протеїнів в клітині та блокують їх дію, зокрема це анті-Rev SFv та анті-gr 120 SFv.
 Способи реалізації підходів генної терапії. Стратегії на основі РНК включають: 1. РНК-капкани – блокування зворотної транскрипції. Молекули малих РНК містять незамінні цис-взаємодіючі елементи, які зв’язують транс-взаємодіючі протеїни. Тому транс-взаємодіючі протеїни не звязуються з їх справжніми мішенями-послідовностями. При значному рівні експресії їх може бути цілком достатньо для цис-взаємодіючих послідовностей віруса, які є абсолютно необхідними для реплікації віруса; 2. Особливий спосіб дії мають генні конструкції, призначені для пригнічення функціонування генів. Зазвичай їх дію спрямовують на вимкнення функції матричної РНК (м. РНК), що кодує протеїн, синтез якого планується загальмувати. Синтезуються штучні антисмислові, одноланцюгові РНК, що володіють комплементарними нуклеотидними послідовностями до м. РНК-мішеней. В парі з м. РНК -мішенями вони утворюють дволанцюгові структури РНК, які або блокують трансляцію, або стають мішенню для деградації в клітині.
Способи реалізації підходів генної терапії. Стратегії на основі РНК включають: 1. РНК-капкани – блокування зворотної транскрипції. Молекули малих РНК містять незамінні цис-взаємодіючі елементи, які зв’язують транс-взаємодіючі протеїни. Тому транс-взаємодіючі протеїни не звязуються з їх справжніми мішенями-послідовностями. При значному рівні експресії їх може бути цілком достатньо для цис-взаємодіючих послідовностей віруса, які є абсолютно необхідними для реплікації віруса; 2. Особливий спосіб дії мають генні конструкції, призначені для пригнічення функціонування генів. Зазвичай їх дію спрямовують на вимкнення функції матричної РНК (м. РНК), що кодує протеїн, синтез якого планується загальмувати. Синтезуються штучні антисмислові, одноланцюгові РНК, що володіють комплементарними нуклеотидними послідовностями до м. РНК-мішеней. В парі з м. РНК -мішенями вони утворюють дволанцюгові структури РНК, які або блокують трансляцію, або стають мішенню для деградації в клітині.
 Способи реалізації підходів генної терапії. Стратегії на основі РНК (продовження) 3. Рибозими. Молекули малих РНК носять назву “каталітичні РНК”. Вони розщеплюють РНК-мішені по специфічних послідовностях. Зв'язуюча ділянка молекули рибозиму впізнає специфічний сайт розщеплення. Рибозими можуть розпізнавати критичні сайти-мішені, такі як gag, tat та U 5. Результати клінічних випробувань лікування ВІЛ-інфекції методом генної терапії на 74 добровольцях були опубліковані в 2009 р. В стовбурові клітини ВІЛ-інфікованих вбудовували ген, що кодує синтез “каталітичної РНК” (рибозиму – OZ). Передбачалось, що оснащені рибозимом стовбурові клітини дадуть початок новому поколінню гемопоетичних клітин, які будуть невразливі до ВІЛ-інфекції. “Каталітична РНК” цих клітин буде розщеплювати РНК ВІЛ-вірусу. Протягом 100 тижнів у пацієнтів знижувалось вірусне навантаження та зростало число CD 4 -лімфоцитів – клітин, основних мішеней вірусу імунодефіциту. Однак з часом число генетично модифікованих клітин у крові пацієнтів зменшувалось (до 7%). Генна терапія не викликала у хворих побічних ефектів. 4. РНК-інтерференція (РНКі). Малі інтерферуючі РНК (міРНК – si. RNA) є дволанцюговими РНК послідовностями, що містять приблизно 22 пари основ у довжину, зв’язуються з клітинними РНК по специфічних послідовностях та розщеплюють їх по центрах комплементарних ділянок. Процес протікає в ряд стадій, що включають – залучення факторів РНК-інтерференції, утворення РНК-індукованого сайленсингового комплексу (RNA-induced silencing complex (RISC), розгортання міРНК та активацію RISC. Короткі шпилькові РНК (кш-РНК – sh. RNA) здатні індукувати сайленсінг генів. Протеїн – рибонуклеаза типу ІІІ, що носить назву Dicer розрізає петлю шпильки sh. RNA з утворенням внутрішньоклітинної sіРНК.
Способи реалізації підходів генної терапії. Стратегії на основі РНК (продовження) 3. Рибозими. Молекули малих РНК носять назву “каталітичні РНК”. Вони розщеплюють РНК-мішені по специфічних послідовностях. Зв'язуюча ділянка молекули рибозиму впізнає специфічний сайт розщеплення. Рибозими можуть розпізнавати критичні сайти-мішені, такі як gag, tat та U 5. Результати клінічних випробувань лікування ВІЛ-інфекції методом генної терапії на 74 добровольцях були опубліковані в 2009 р. В стовбурові клітини ВІЛ-інфікованих вбудовували ген, що кодує синтез “каталітичної РНК” (рибозиму – OZ). Передбачалось, що оснащені рибозимом стовбурові клітини дадуть початок новому поколінню гемопоетичних клітин, які будуть невразливі до ВІЛ-інфекції. “Каталітична РНК” цих клітин буде розщеплювати РНК ВІЛ-вірусу. Протягом 100 тижнів у пацієнтів знижувалось вірусне навантаження та зростало число CD 4 -лімфоцитів – клітин, основних мішеней вірусу імунодефіциту. Однак з часом число генетично модифікованих клітин у крові пацієнтів зменшувалось (до 7%). Генна терапія не викликала у хворих побічних ефектів. 4. РНК-інтерференція (РНКі). Малі інтерферуючі РНК (міРНК – si. RNA) є дволанцюговими РНК послідовностями, що містять приблизно 22 пари основ у довжину, зв’язуються з клітинними РНК по специфічних послідовностях та розщеплюють їх по центрах комплементарних ділянок. Процес протікає в ряд стадій, що включають – залучення факторів РНК-інтерференції, утворення РНК-індукованого сайленсингового комплексу (RNA-induced silencing complex (RISC), розгортання міРНК та активацію RISC. Короткі шпилькові РНК (кш-РНК – sh. RNA) здатні індукувати сайленсінг генів. Протеїн – рибонуклеаза типу ІІІ, що носить назву Dicer розрізає петлю шпильки sh. RNA з утворенням внутрішньоклітинної sіРНК.
 Застосування генної терапії в медицині. Результати Ø Найвагоміші результати ГТ досягнуті в тих випадках, коли захворювання обумовлене дефектом одного гена. За таких умов значно зростає вірогідність того, що терапевтичний ген прицільно вбудується у те місце на хромосомі, де розташований дефектний ген. Внаслідок цього при подальшій гомологічній рекомбінації введений ген замістить дефектний. Застосування викладених підходів дозволило досягти значних успіхів у лікуванні ряду моногенних захворювань, зокрема гемофілії, міодистрофії Дюшена, муковісцидозу, синдрому вродженого імунодефіциту, пухлинних захворювань і деяких інших. В літературі наводяться дані про розробку експериментальних підходів, проведення доклінічних та клінічних випробувань методів генної терапії у лікуванні майже 30 моногенних хвороб людини; Ø Значний відсоток серед протоколів генної терапії займають неспадкові захворювання. ГТ таких захворювань базується на припущенні, що введений в організм “терапевтичний” ген призводить до синтезу протеїну, який буде мати терапевтичний ефект. Інша можлива схема базується на зміні властивостей трансфіковапних клітин, а саме клітини стають чутливими до дії лікарських препаратів. Запропонований підхід успішно використовується у лікуванні хвороб серцево-судинної системи, зокрема: у лікуванні тромбозів (запобігання тромбоутворенню), для відновлення судинної системи серцевого м’язу після інфаркту міокарда – продукти введених генів індукують процес судиноутворення (гени ангіогенезу), лікування атеросклерозу, артритів та значної кількості інших захворювань. Незважаючи на дуже широкий спектр неспадкових захворювань, лікуванням яких займається генна терапія, все ж до 80% усіх сучасних розробок генної терапії припадають на пухлинні захворювання.
Застосування генної терапії в медицині. Результати Ø Найвагоміші результати ГТ досягнуті в тих випадках, коли захворювання обумовлене дефектом одного гена. За таких умов значно зростає вірогідність того, що терапевтичний ген прицільно вбудується у те місце на хромосомі, де розташований дефектний ген. Внаслідок цього при подальшій гомологічній рекомбінації введений ген замістить дефектний. Застосування викладених підходів дозволило досягти значних успіхів у лікуванні ряду моногенних захворювань, зокрема гемофілії, міодистрофії Дюшена, муковісцидозу, синдрому вродженого імунодефіциту, пухлинних захворювань і деяких інших. В літературі наводяться дані про розробку експериментальних підходів, проведення доклінічних та клінічних випробувань методів генної терапії у лікуванні майже 30 моногенних хвороб людини; Ø Значний відсоток серед протоколів генної терапії займають неспадкові захворювання. ГТ таких захворювань базується на припущенні, що введений в організм “терапевтичний” ген призводить до синтезу протеїну, який буде мати терапевтичний ефект. Інша можлива схема базується на зміні властивостей трансфіковапних клітин, а саме клітини стають чутливими до дії лікарських препаратів. Запропонований підхід успішно використовується у лікуванні хвороб серцево-судинної системи, зокрема: у лікуванні тромбозів (запобігання тромбоутворенню), для відновлення судинної системи серцевого м’язу після інфаркту міокарда – продукти введених генів індукують процес судиноутворення (гени ангіогенезу), лікування атеросклерозу, артритів та значної кількості інших захворювань. Незважаючи на дуже широкий спектр неспадкових захворювань, лікуванням яких займається генна терапія, все ж до 80% усіх сучасних розробок генної терапії припадають на пухлинні захворювання.
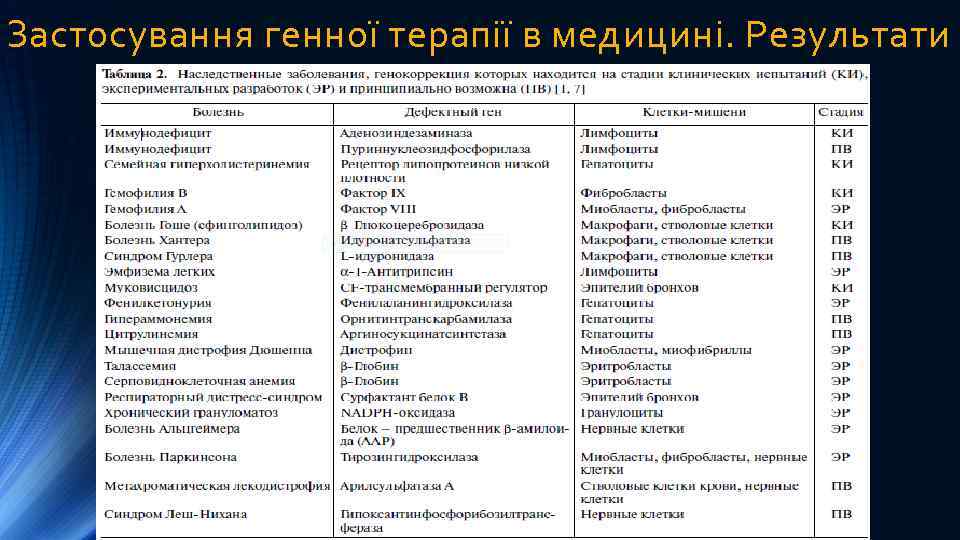 Застосування генної терапії в медицині. Результати
Застосування генної терапії в медицині. Результати
 Застосування генної терапії в медицині. Результати
Застосування генної терапії в медицині. Результати
 Вивчення методики генної терапії в Україні В Україні дослідження в галузі генної терапії проводяться під керівництвом Кордюма В. А. – член-кор. НАН України, академіка АМН України, завідувача відділу регуляторних механізмів клітини Інституту молекулярної біології і генетики НАН України. Зокрема розробляється генна терапія гіперхолестеринемії. Виділено ген апо-1 (апопротеїну-1) ліпопротеїнів високої щільності (ЛПВЩ), створена невірусна молекулярна конструкція його транспорту в клітини печінки та підібрані умови ефективної експресії апопротеїну. Спільно з науковцями Ізраілю розробляються підходи генної терапії інсулінозалежного цукрового діабету. Виділено ген інсуліну, створено невірусну молекулярну конструкцію його транспорту в клітини-мішені та підібрано умови ефективної експресії інсуліну.
Вивчення методики генної терапії в Україні В Україні дослідження в галузі генної терапії проводяться під керівництвом Кордюма В. А. – член-кор. НАН України, академіка АМН України, завідувача відділу регуляторних механізмів клітини Інституту молекулярної біології і генетики НАН України. Зокрема розробляється генна терапія гіперхолестеринемії. Виділено ген апо-1 (апопротеїну-1) ліпопротеїнів високої щільності (ЛПВЩ), створена невірусна молекулярна конструкція його транспорту в клітини печінки та підібрані умови ефективної експресії апопротеїну. Спільно з науковцями Ізраілю розробляються підходи генної терапії інсулінозалежного цукрового діабету. Виділено ген інсуліну, створено невірусну молекулярну конструкцію його транспорту в клітини-мішені та підібрано умови ефективної експресії інсуліну.
 Дякую за увагу!
Дякую за увагу!


