Муравлёв.pptx
- Количество слайдов: 35

Рекомбинантные вектора на основе аденоассоциированного вируса в генной терапии нейродегенеративных заболеваний. Mouravlev A. , Ph. D, Research Fellow, Centre for Brain Research, Faculty of Medical and Health Sciences, The University of Auckland, New Zealand

Генная терапия - общие сведения. • В узком смысле слова генная терапия (или генотерапия) - это использование ДНК в качестве терапевтического средства для лечения различных заболеваний человека. • Однако, в настоящее время под генной терапией в более широком смысле понимают любые манипуляции по переносу чужеродной (экзогенной) генетической информации в клетки живого организма in vivo.

• На концептуальном уровне генная терапия зародилась в начале 70 -х годов прошлого века. • 1990 год - в США был осуществлён первый эксперимент на человеке. • К настоящему времени проведено более 2 -х тысяч клинических испытаний с использованием различных методов генной терапии. • Тем не менее, подавляющее количество научных работ в этой области все ещё находится на стадии экспериментальных разработок на животных моделях различных заболеваний. • Кроме того, методы генной терапии являются в настоящее время незаменимым инструментом функционального анализа генома млекопитающих in vivo.

Типы генной терапии. • Фетальная генотерапия - чужеродная ДНК внедряется непосредственно в половые клетки. Изменяется в целом генотип развивающегося организма, а приобретённые генетические изменения могут наследоваться последующих поколениях. • Соматическая генотерапия (или трансгеноз) - перенос ДНК в соматические клетки взрослого организма. Экспрессия экзогенной ДНК ограничивается популяцией клеток или тканями и не может быть передана по наследству.

Типы генной терапии. • Невирусная генотерапия - трансдукция клеток очищенными нуклеиновыми кислотами (не только ДНК, но и РНК) осуществляется различными физическими методами, такими как электропорация, генная пушка, сонопорация, магнетофекция, а также с использованием липоплексов, комплексов ДНК с неорганическими наночастицами и др. • Вирусная генотерапия - перенос чужеродной ДНК осуществляется в составе векторов, сконструированных на основе различных вирусов человека, таких как ретро-, адено-, ленти-, герпес-вирусы, вирус осповакцины, а также аденоассоциированный вирус (англ. Adenoassociated Virus, AAV).
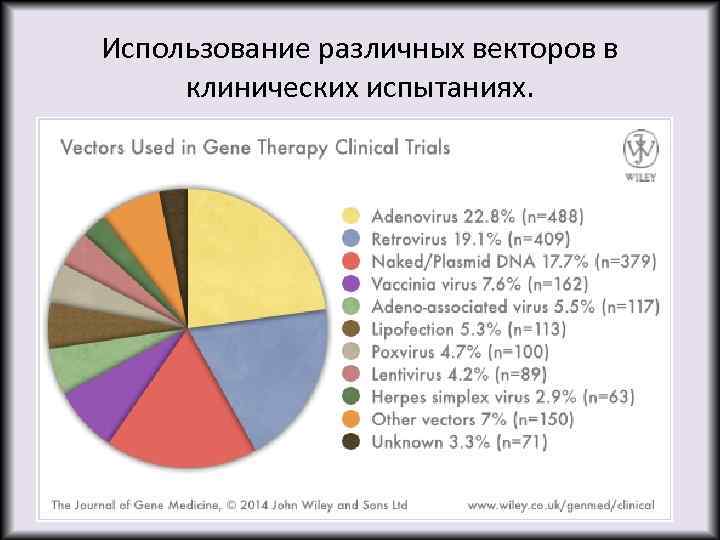
Использование различных векторов в клинических испытаниях.

Аденоассоциированный вирус. Основные преимущества векторов r. AAV. • • Не выявлено каких-либо патологий, вызываемых этим вирусом у человека, несмотря на то, что до 40% людей является его носителем. Способен трансдуцировать как дифференцированные клетки, так и быстро делящиеся (раковые). Не вызывает заметного иммунного ответа как на свои белки, так и на инфицированные им клетки человека. Обеспечивает стабильную длительную экспрессию терапевтического гена. Не вызывает мутаций или перестроек в хозяйской ДНК. Наличие 11 -ти серотипов расширяет спектр потенциальных клеток мишеней. Показано, что вектора на основе AAV могут быть использованы для лечения очень широкого круга заболеваний, таких как различные типы рака, нейродегенеративные заболевания, артриты, мышечная дистрофия, муковисцидоз, гемофилия Б и многие другие.

Аденоассоциированный вирус. • Аденоассоциированный вирус (AAV) - маленький (20 нм) вирус человека и некоторых высших приматов семейства парвовирусов. • Геном представляет собой одноцепочечную линейную ДНК (в равном соотношении плюс- и минус- цепи) длиной около 4, 7 тыс. оснований. • Белковый капсид икосаэдрической формы, не имеющий липидной оболочки. • Не имеет собственных ферментов репликации и, таким образом, в своем жизненном цикле зависит от присутствия вируса-помощника, роль которого чаще всего выполняет аденовирус. • Дикий тип вируса способен интегрировать свой геном в специфическую область 19 ой хромосомы человека.
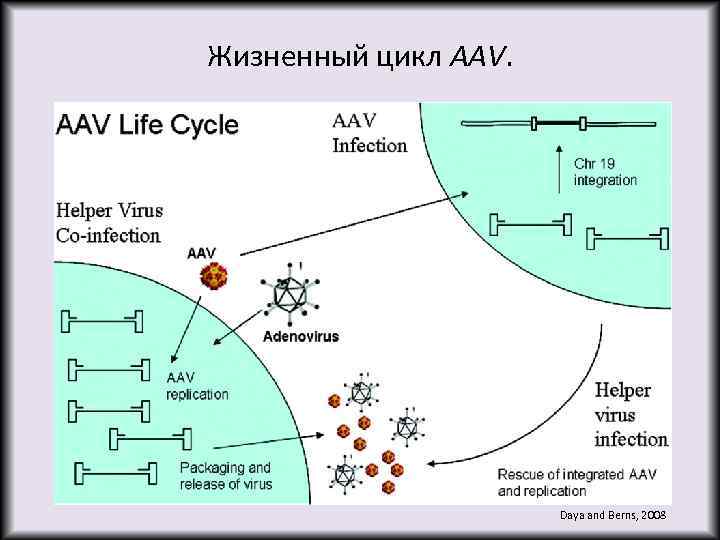
Жизненный цикл AAV. Daya and Berns, 2008
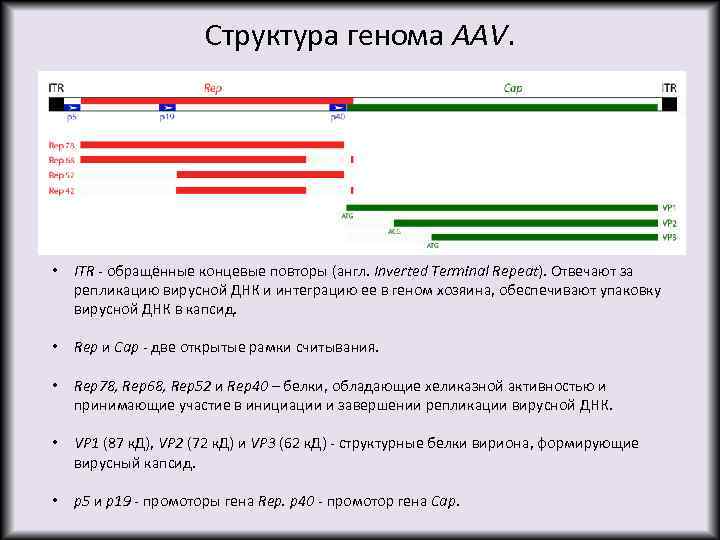
Структура генома AAV. • ITR - обращённые концевые повторы (англ. Inverted Terminal Repeat). Отвечают за репликацию вирусной ДНК и интеграцию ее в геном хозяина, обеспечивают упаковку вирусной ДНК в капсид. • Rep и Cap - две открытые рамки считывания. • Rep 78, Rep 68, Rep 52 и Rep 40 – белки, обладающие хеликазной активностью и принимающие участие в инициации и завершении репликации вирусной ДНК. • VP 1 (87 к. Д), VP 2 (72 к. Д) и VP 3 (62 к. Д) - структурные белки вириона, формирующие вирусный капсид. • p 5 и p 19 - промоторы гена Rep. p 40 - промотор гена Cap.

Рекомбинантный вектор r. AAV. • А - Трансдуцирующая кассета. • Б - Упаковочная плазмида. • В - Аденовирусная плазмида. E 1 A, B, VA, E 2 AE 4 - гены Ad 5, участвуещие в репликации генома AAV.

Экспрессирующий модуль. Необходимые компонентты: • Трансген - носитель чужеродной генетической информации. • Промотор - транскрипция трансгена. • Сигнал полиаденилирования. • Дополнительные регуляторные элементы, повышающие эффективность и специфичность экспрессии трансгена

Трансген. • Полноразмерные к. ДНК. • к. ДНК, включающие отдельные интроны. • Открытые рамки считывания (ORF). • sh. RNA. • mi. RNA (микро РНК).

Промоторы. Выбор промотора определяется задачами эксперимента, типом трансгена и типом клеток мишеней. Универсальные: • CMV - ранний энхансер и промотор цитомегаловируса человека. • CAG - синтетический промотор, сконструированный на основе CMV, а также элементов генов бета-актина курицы и бета-глобина кролика. Специфичные: • GFAP – Glial Fibrillary Acidic Protein (Астроциты). • TH – Tyrosine Hydroxylase (Substantia Nigra Pars Compacta). Эти промоторы могут быть использованы также в случае микро РНК. sh. RNA - РНК полимеразы III • U 1, U 6, H 1.

Сигналы полиаденилирования. • BGH - бычий гормон роста (англ. Bovine Growth Hormone) • TK - тимидинкиназа вируса герпеса • SV 40 - поздний антиген вируса SV 40 • Sp. A - короткие синтетические сигналы (англ. short poly. A).

Дополнительные элементы. • WPRE - посттранскрипционный регуляторный элемент вируса гепатита лесного сурка (англ. Woodchuck Hepatitis Virus Posttranscriptional Regulatory Element) - повышает стабильность м. РНК и, соответственно, уровень экспрессии белка. • REs - регуляторные элементы отклика (англ. Response Elements), отвечающие на присутствие, например, антибиотиков (тетрациклин), гормонов. • Lox - рекомбиназа CRE.
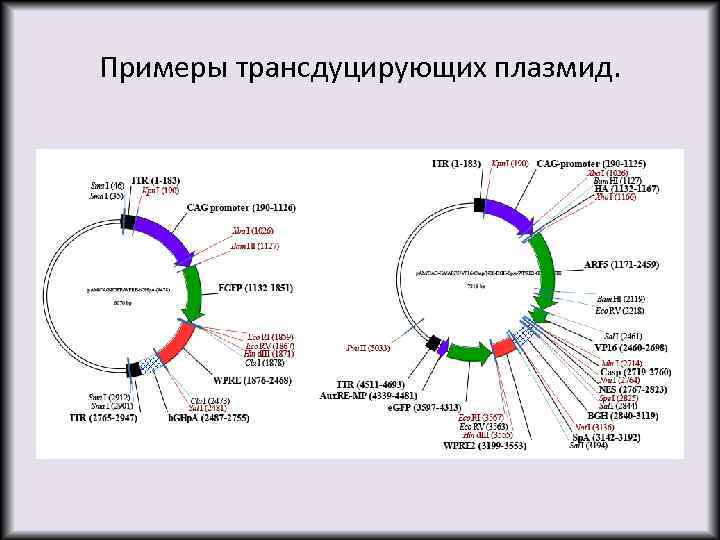
Примеры трансдуцирующих плазмид.

Упаковочная плазмида. • Внутренняя часть генома AAV, включающая rep и cap гены с соответствующими промоторами, но без обращённых концевых повторов, в коммерческом векторе p. Bluescript SK. • Rep - серотип AAV 2 (человек) • Cap - серотипы AAV 1 -11 (человек); rh 20, rh 39, rh 43 (высшие приматы); cy 5 (макака).

Аденовирусная плазмида-помощник. • Содержит минимальное количество генов аденовируса, необходимых для репликации ДНК AAV. • Получают путем последовательного удаления из ДНК аденовируса, клонированного в какой-либо бактериальный вектор, всех предположительно не участвующих в данном процессе фрагментов с последующим тестированием полученной конструкции в системе упаковки вектора AAV. Xiao et al. , 1998

Продукция рекомбинантных векторов AAV. • Конструирование трансдуцирующей кассеты (лаборатория PC 1). • Упаковка полученной кассеты в вирусную частицу (лаборатория PC 2). • Очистка вирусных частиц (вектора) из клеточного лизата (лаборатория PC 2). • Анализ вектора in vitro и in vivo (лаборатория PC 2).

Конструирование трансдуцирующей кассеты. • Трансдуцирующая кассета собирается на основе какого-либо плазмидного вектора таким образом, чтобы её экспрессирующий модуль располагалась между двумя обращёнными концевыми повторами (ITR). • При этом важно учитывать, что бы длина трансдуцирующей кассеты не превышала размеров геномной ДНК AAV, т. е. 4, 8 тыс. нуклеотидов.
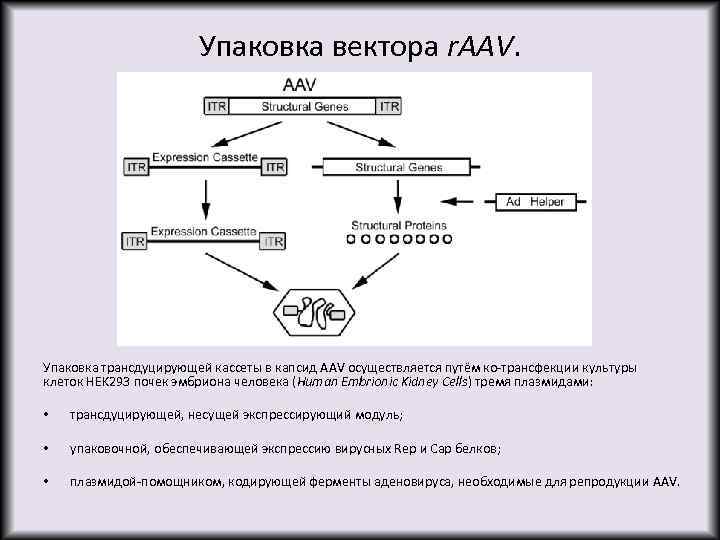
Упаковка вектора r. AAV. Упаковка трансдуцирующей кассеты в капсид AAV осуществляется путём ко-трансфекции культуры клеток HEK 293 почек эмбриона человека (Human Embrionic Kidney Cells) тремя плазмидами: • трансдуцирующей, несущей экспрессирующий модуль; • упаковочной, обеспечивающей экспрессию вирусных Rep и Cap белков; • плазмидой-помощником, кодирующей ферменты аденовируса, необходимые для репродукции AAV.

Очистка рекомбинантного вектора r. AAV. • Универсальный метод очистки векторов AAV ультрацентрифугирование клеточных лизатов в градиенте плотности йодиксанола. • В случае серотипа AAV 2, вирион которого содержит на поверхности рецептор гепарина - аффинная хроматография на гепариновом сорбенте. http: //biotechtrends. blogspot. co. nz/2010_12_01_archive. html
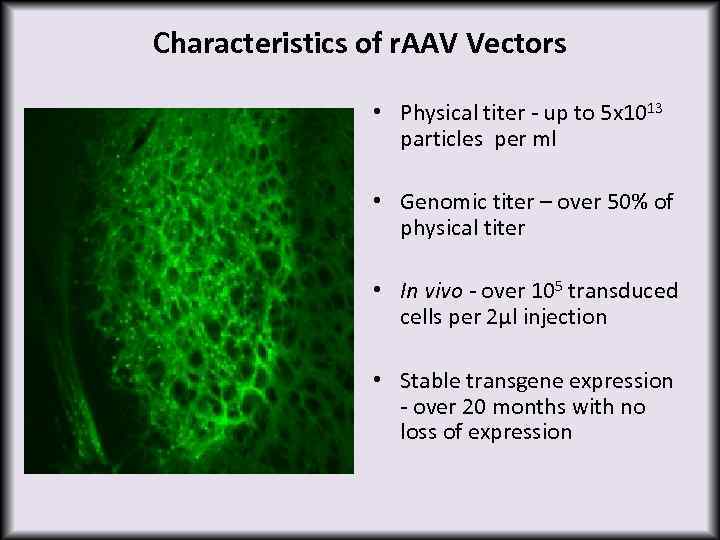
Characteristics of r. AAV Vectors • Physical titer - up to 5 x 1013 particles per ml • Genomic titer – over 50% of physical titer • In vivo - over 105 transduced cells per 2µl injection • Stable transgene expression - over 20 months with no loss of expression
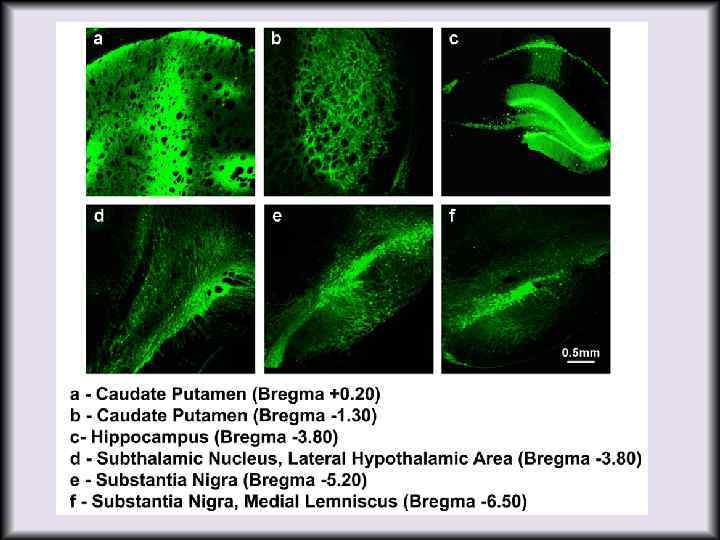

Нейро-дегенеративные заболевания - болезни Паркинсона, Альцге ймера, Хантингтона. • Нейродегенеративные заболевания - большая и разнородная группа болезней, характеризующихся прогрессирующей потерей нейронов в определённых областях головного мозга, которые могут иметь как наследственный, так и приобретённый характер. • Заболевания характеризуются медленным и длительным скрытым развитием, проявляются в пожилом возрасте. • В связи с постоянным увеличением продолжительности жизни человека нейродегенеративные заболевания приобретают все большее значения в общей системе здравоохранения. • С точки зрения генной терапии наибольший интерес представляют болезнь Паркинсона (БП), болезнь Альцгеймера (БА), болезнь Хантигтона (БХ).
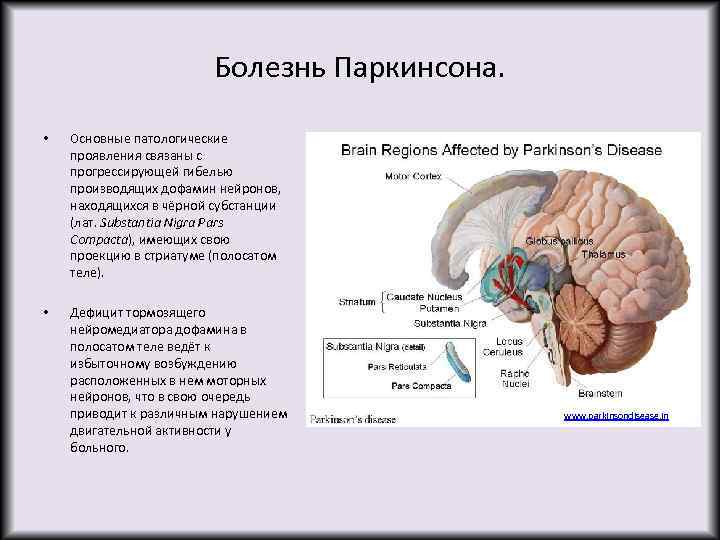
Болезнь Паркинсона. • Основные патологические проявления связаны с прогрессирующей гибелью производящих дофамин нейронов, находящихся в чёрной субстанции (лат. Substantia Nigra Pars Compacta), имеющих свою проекцию в стриатуме (полосатом теле). • Дефицит тормозящего нейромедиатора дофамина в полосатом теле ведёт к избыточному возбуждению расположенных в нем моторных нейронов, что в свою очередь приводит к различным нарушением двигательной активности у больного. www. parkinsondisease. in

Генная терапия болезни Паркинсона. • Tерапия может быть направлена как на замедление или остановку процесса деградации дофаминовых нейронов в чёрной субстанции, так и на компенсацию дефицита дофамина путём экзогенной экспрессии ключевых ферментов его биосинтеза непосредственно в клетках стриатума. • В первом случае терапия может состоят в трансдукции клеток чёрной субстанции генами, кодирующими различные нейропротекторы, включая нейротрофные факторы и ингибиторы апоптоза. • Во втором случае наиболее перспективными терапевтическими генами являются тирозингидроксилаза (англ. Tyrosine Hydroxylase, TH) и декарбоксилаза ароматических L-аминокислот (англ. Aromatic Lamino acid decarboxylase, AADC).

Генная терапия болезни Паркинсона. • Ввиду наличия сложных связей между различными отделами головного мозга, генная терапия болезни Паркинсона может включать в себя воздействие на другие его части. Например, успешные эксперименты на пациентах были осуществлены с помощью введения гена глутаматдекарбоксилазы (англ. Glutamate decarboxylase, GAD) в субталамическое ядро, что приводило к снижению его активность и, таким образом, снимало избыточное возбуждение двигательных нейронов.

Болезнь Альцгеймера. Основа патологии - прогрессирующая потеря нейронов и синаптических связей в коре головного мозга и определённых субкортикальных областях. Три основных гипотезы причин развития заболевания. • Холинергическая - снижение уровня ацетилхолина в нейронах. • Амилоидная - внеклеточные отложения бета-амилоида. • Тау-гипотеза - нарушение правильного свёртывания тау-белка и последующее отложение в клетках его агрегатов.

Генная терапия болезни Альцгеймера. • Поиск возможных подходов , причем в основном в рамках холинергической и Тау- гипотез.

Болезнь Хантигтона. • Связана с изменения количества так называемых тринуклеотидных повторов (ЦАГ), кодирующих глутамин, в белке хантигтин. • Когда протяжённость полиглутамоинового трака в этом белке превышает 36 аминокислот, мутантный белок становится токсичным для клеток. • В основном процесс наблюдается в нейронах стриатума и приводит к их гибели, что, в свою очередь, вызывает прогрессирующий гиперкинез и психические расстройства.

Генная терапия болезни Хантингтона. • Использование различных нейропротекторных и нейрорегенеративных генов. • Селективное отключение мутантного гена хантигтина с помощью малых интерферирующих РНК. • Трансдукция генами, улучшающими общий клеточный метаболизм и восстанавливающими транскрипционный баланс в клетках подвергшихся токсическому воздействию мутантного хантигтина.

Acknowledgements

Муравлёв.pptx