РЕГУЛЯЦИЯ И ПАТОЛОГ белк ОБМЕНА.ppt
- Количество слайдов: 44

РЕГУЛЯЦИЯ И ПАТОЛОГИЯ БЕЛКОВОГО ОБМЕНА

РЕГУЛЯЦИЯ СИНТЕЗА БЕЛКА • Жакоб и Моно разработали теорию регуляции синтеза белка и описали модель оперона. Сущность теории – «выключение» или «включение» генов. • У бактерий доказана индукция и репрессия ферментов. По теории Жакоба-Моно в биосинтезе белка у бактерий участвует 3 типа генов: • структурные гены, • ген-регулятор, • ген-оператор.

• Структурные гены определяют первичную структуру синтезируемого белка. • Ген-оператор – пусковой механизм для функционирования структурных генов. • Оперон - группа структурных генов, координируемая одним оператором. • Операторный локус (ген-оператор) – участок последовательности ДНК длиной 27 пар оснований. Он находится между промотором, к которому перед началом транскрипции присоединяется ДНК-зависимая РНК-полимераза, и началом структурного гена. • Ген-регулятор контролирует деятельность оперона через белок-репрессор.

Белок-репрессор • образуется под влиянием гена-регулятора, • действует на оператор, • имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс, препятствуя посадке РНК –полимеразы на локус промотора и предотвращая транскрипцию структурных генов. • Таким образом ген-регулятор через белок-репрессор прекращает деятельность структурных генов. • Репрессор – негативный регулятор. • На клетку приходится 20 -40 молекул репрессора.

Регуляция экспрессии генов • Многие механизмы, контролирующие экспрессию генов принимают участие в ответе организма на воздействия гормонов и лекарств. Существует 2 типа регуляции экспрессии генов: • позитивная, • негативная.

Индукция синтеза белка • Белок-репрессор способен связываться с низкомолекулярными веществами – индукторами (эффекторами). • Индуктор, соединяясь с белком-репрессором, изменяет его третичную структуру, при этом белок-репрессор теряет способность связываться с геном-оператором (происходит синтез белка). • При этом белок-репрессор становится неактивен.
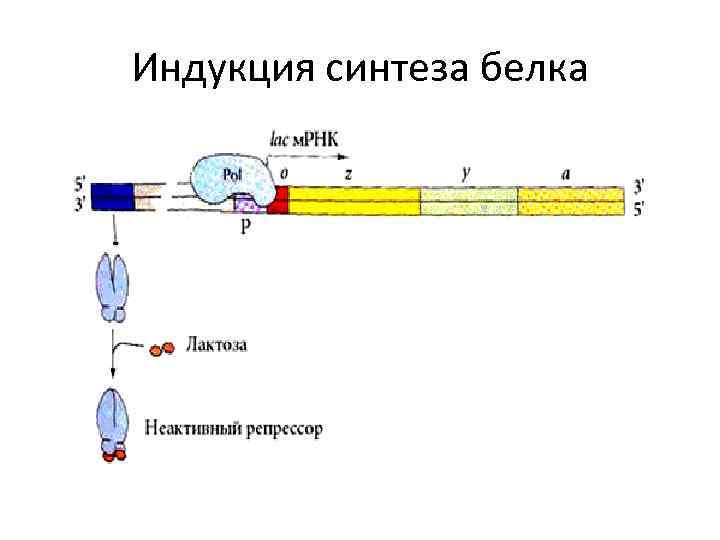
Индукция синтеза белка
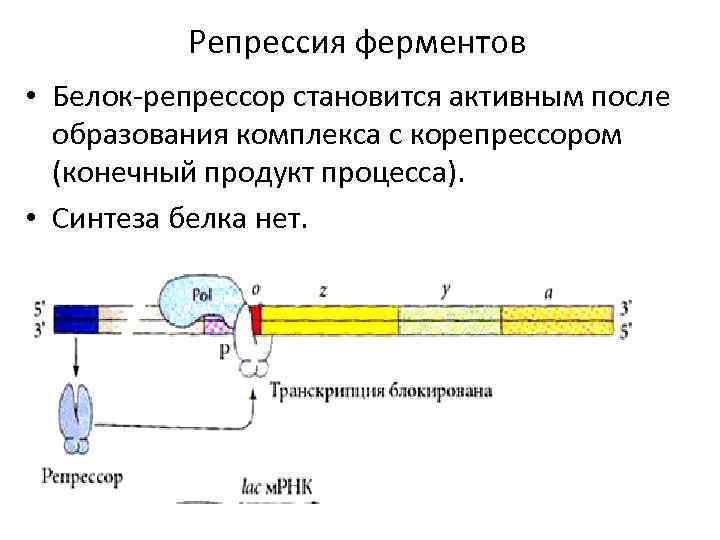
Репрессия ферментов • Белок-репрессор становится активным после образования комплекса с корепрессором (конечный продукт процесса). • Синтеза белка нет.

Нейроэндокринная регуляция белкового обмена. Гормоны-анаболики: • СТГ, • инсулин, • андрогены, • эстрогены (на органы репродукции), • тироксин в малых дозах в детстве. Гормоны-катаболики: • кортикостероиды, • тироксин в больших дозах.

Соматотропный гормон • способствует росту мышц, костей, • повышает проницаемость клеточных мембран для АМК, • усиливает все этапы синтеза белка, • задерживает азот в организма, • обеспечивает энергетическую сторону синтеза белка, • переводит жиры в углеводы, • приводит к положительному азотистому балансу.

Инсулин • оказывает белоксберегающий эффект, так как тормозит глюконеогенез, • усиливает все этапы синтеза белка, • повышает сродство клеточных мембран к АМК.
Эстрогены • в матке и молочных железах усиливают все этапы синтеза белка. Андрогены способствуют синтезу белка в мышечной и костной тканях, • усиливают все этапы синтеза белка, • активируют РНК-полимеразы, • ускоряют транспорт нуклеотидов. •
Тироксин в малых дозах в раннем детстве • приводит к положительному азотистому балансу, • способствует ускорению роста, • влияет на дифференцировку клеток, • повышает активность ферментов, • усиливает трансляцию, транскрипцию, • усиливает синтез белка за счёт обеспечения процесса энергией.

Тироксин во взрослом организме в больших дозах • усиливает распад белка, • усиливает действие протеиназ, АМК стают энергетическим материалом.
Глюкокортикоиды • • катаболики во всех тканях кроме печени, активируют глюконеогенез, препятствуют синтезу заменимых АМК, тормозят транспорт АМК в ткани, усиливают распад АМК, активируют синтез мочевины, оказывают иммунодепрессорное действие.

Врождённая патология белкового обмена • связана с генетическими дефектами синтеза, • Известно около 2000 наследственных болезней. • Каждый человек – носитель 4 -8 генов, которые могут вызвать развитие болезни при определённых условиях. • Эти гены унаследованы от родителей или результат мутаций.

10% всех случаев умственной отсталости у детей за счёт инфекции у беременных Особо опасны: • коревая краснуха, • цитомегаловирусная инфекция, Курение, алкоголь, наркотики приводят к дефектам у детей.

Болезни, обусловленные выпадением синтеза молекул белка (из -за неправильного строения и функции гена) • Ферментопатии (гликогенозы, липоидозы, патология обмена фенилаланина, тирозина, метионина, цистеина, галактоземия). • Неферментативные протеинопатии (гемоглобинозы).

Предположение о наличии врождённого нарушения метаболизма возникает, если у обследуемого • • • нарушение развития, рвота, гипогликемия, особый запах или окраска пелёнок, гепатоспленомегалия, желтуха, задержка умственного развития, припадки, спастические сокращения мышц, метаболический ацидоз, почечные колики, рахит, не поддающийся лечению.

Лабораторная диагностика врождённых нарушений метаболизма • О недостаточности фермента судят косвенно по повышению концентрации исходного вещества. • Прямое определение активности ферментов проводят в специализированных центрах.

Пренатальная диагностика возможна путём исследования клеток амниотической жидкости, полученных на ранних стадиях беременности и культивируемых in vitro.

Из заболеваний, связанных с врождёнными нарушениями метаболизма чаще встречаются • • • фенилкетонурия, цистинурия, болезнь Хартнапа, иминоглицинурия, гистидинемия.
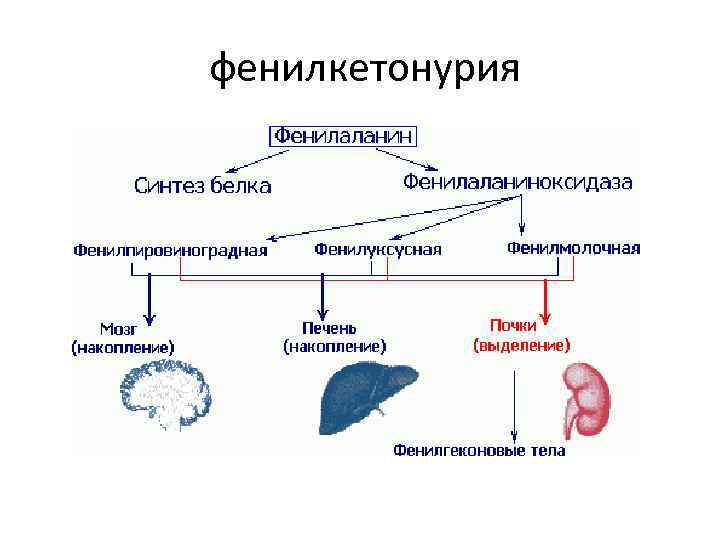
фенилкетонурия

Гистидинемия связана с недостаточностью гистидина, наследуется по аутосомно-рецессивному типу. В крови повышена концентрация гистидина, В моче увеличено содержание гистидина и его побочного метаболита – имидазол. ПВК. Имидазол. ПВК подобно фенил. ПВК реагирует с хлорным железом, образуя сине-зелёный пигмент. • У больных наблюдается умственная отсталость, дефекты речи. • •

Болезнь Хартнапа • Нарушается транспорт нейтральных АМК в почках и пищеварительном тракте. • Болезнь связана с уменьшением всасывания триптофана и увеличением его экскреции с мочой. В норме триптофан превращается в никотинамид. Проявления болезни Хартнапа: • сыпь, • атаксия, • спутанность сознания, • аминоацидурия.

Глицинурия • обусловлена дефицитом ферментов, обеспечивающих превращение глицина, что ведёт к усиленной продукции оксалата, образованию кристаллов в почках и мочевыводящих путях, хронической почечной недостаточности.

Роль ферментов обмена пуриновых нуклеотидов в функционировании Т- и Влимфоцитов и в патогенезе иммунодефицитов АДА • олигомерный фермент, • активен в Т-лимфоцитах, незрелых тимоцитах. При лейкозах возрастает активность АДА в клетках. Для лечения лейкозов применяют ингибиторы АДА.

Наследственный дефект АДА • у детей до 2 лет наблюдается тяжёлый иммунодефицит, связанный с нарушением созревания и пролиферации Т- и В-лимфоцитов, лимфопенией. Наследственный дефект нуклеозидфосфорилазы уменьшает количество и изменяет функции Т-лимфоцитов, что приводит к нарушению Т-опосредованного (клеточного) иммунитета.

Аминоацидурии -один из первых симптомов нарушения метаболизма АМК • Преренальные аминоацидурии обусловлены высокой концентрацией АМК в плазме. АМК поступают в проксимальные канальцы в количествах, превосходящих реабсорбционную способность канальцевого эпителия. • Ренальные аминоацидурии связаны с повреждением почечных канальцев. Содержание АМК в плазме крови снижено в результате потери их с мочой.

Болезни, обусловленные синтезом молекул белка с неправильной структурой • гемоглобинозы, гликогенозы, липоидозы, • болезнь Вильсона-Коновалова (аномальный церулоплазмин), • при синтезе Г-6 -ФДГ с неправильной структурой, если сохраняется менее 10% активности фермента, то наблюдается гемолиз.

Ферментопатии как следствие незрелости клеточных систем (болезни новорожденных) • гемолитическая анемия новорожденных, • синдром мальабсорбции, • гипераммониемия. У новорожденных функциональная незрелость фенилаланин-, тирозин-, серосодержащих АМК.

Патология усвоения пищевых белков. Причины: • нарушение секреторной и моторной функции желудка и кишечника, • дефицит ферментов, • недостаток соляной кислоты, • патология ЖКТ, • нарушение всасывания.

Последствия недостаточного усвоения пищевых белков • • алиментарная белковая недостаточность, отрицательный азотистый баланс, снижение иммунореактивности, усиление бактериального расщепления белка.

Нарушение тканевого метаболизма белков Нарушение синтеза белков при: • заболеваниях печени, • гипоксии, • ацидозе, • инфекциях.

Нарушить соотношение между синтезом и распадом белка могут • алиментарная недостаточность, • расстройства нейроэндокринной регуляции, • нарушение энергетических процессов, • изменение активности протеаз

Отсутствие лизина в организме характеризуется появлением • • тошноты, головной боли, головокружением, повышенной чувствительностью к шуму. При отсутствии в пище аргинина снижается сперматогенез.

Патология белкового состава плазмы крови • диспротеинемии – нарушения нормального соотношения между фракциями белков крови, • гиперпротеинемии, • гипопротеинемии.

Нарушение межуточного обмена аминокислот Нарушение трансаминирования АМК при недостатке витамина В 6, при угнетении активности трансаминаз, при нарушениях соотношений субстратов. Нарушение дезаминирования АМК при белковом голодании, при гипоксии, при гиповитаминозах. Нарушение декарбоксилирования АМК. Усилено образование биогенных аминов при - гипоксии, - ишемии, - деструкции тканей. • • •

Нарушение конечного этапа белкового обмена Конечные продукты белкового обмена – аммиак и мочевина. • NHз + Глу глутамин. При патологии содержание аммиака повышается в головном мозге и вызывает нейротоксикоз. • Нарушение синтеза мочевины. • Продукционная и ретенционная гиперазотемии.
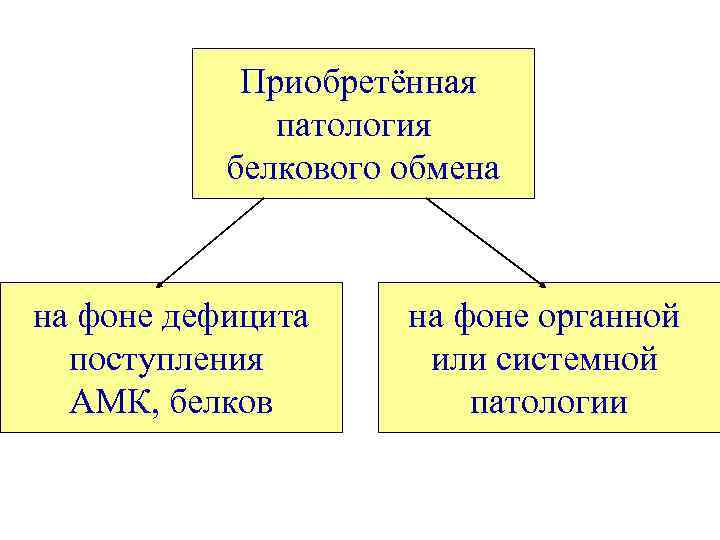
Приобретённая патология белкового обмена на фоне дефицита поступления АМК, белков на фоне органной или системной патологии

Приобретённая патология белкового обмена на фоне дефицита поступления АМК, белков. • • отрицательный азотистый баланс, отёки, гипопротеинемия, медленный рост, истощение, анемии, дерматозы, желудочно-кишечные расстройства.

Квашиоркор – недостаток белка в питании детей. Белковая недостаточность наблюдается при: • голодании, • приёме однообразного белкового питания. Снижается интенсивность • трансаминирования, • дезаминирования, • биосинтеза АМК, мочевины

Вторичные гипопротеинемии обусловлены • недостаточностью белка в питании или нарушением переваривания и всасывания белка после перенесённых заболеваний, • врождёнными дефектами переваривания и всасывания белков, • нарушением синтеза белков в печени, • ускоренным распадом белков (гипертиреоидизм, болезнь Иценко-Кушинга, острые инфекции), • потерями белка (амилоидоз, протеинурия, гнойные процессы с обильным отделяемым, кровопотери, большая раневая поверхность, ожоги, потери через ЖКТ, образование больших экссудатов), • повышенным использованием белков (послеоперационные состояния, неопластические процессы, лейкемия. )

• При патологии печени страдает синтез белка, снижается синтез мочевины. • При патологии почек белок выводится с мочей. • При заболеваниях кишечника и желудка наблюдается недостаточное поступление белков в организм. • Симптоматический дефицит антител возникает при СПИДе, инфекциях.
РЕГУЛЯЦИЯ И ПАТОЛОГ белк ОБМЕНА.ppt