lecture_11_prostor.pptx
- Количество слайдов: 23
 Регуляція ферментативної активності шляхом просторового роз’єднання Дисоціативна регуляція Адсорбційна регуляція
Регуляція ферментативної активності шляхом просторового роз’єднання Дисоціативна регуляція Адсорбційна регуляція
 Дисоціативна регуляція 1. Типи структур, що утворюються при асоціації білкових молекул. 2. Характер розподілу ферментативної активності серед олігомерних форм ферменту. 3. Вплив специфічних лігандів на положення рівноваги між олігомерними формами ферментів. 4. Динамічна мікрокомпартменталізація метаболітів.
Дисоціативна регуляція 1. Типи структур, що утворюються при асоціації білкових молекул. 2. Характер розподілу ферментативної активності серед олігомерних форм ферменту. 3. Вплив специфічних лігандів на положення рівноваги між олігомерними формами ферментів. 4. Динамічна мікрокомпартменталізація метаболітів.
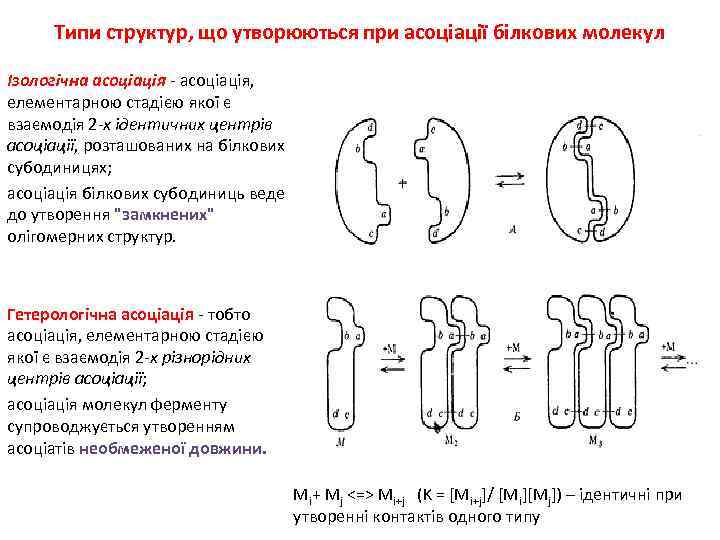 Типи структур, що утворюються при асоціації білкових молекул Ізологічна асоціація - асоціація, елементарною стадією якої є взаємодія 2 -х ідентичних центрів асоціації, розташованих на білкових субодиницях; асоціація білкових субодиниць веде до утворення "замкнених" олігомерних структур. Гетерологічна асоціація - тобто асоціація, елементарною стадією якої є взаємодія 2 -х різнорідних центрів асоціації; асоціація молекул ферменту супроводжується утворенням асоціатів необмеженої довжини. Мi+ Mj <=> Mi+j (K = [Mi+j]/ [Mi][Mj]) – ідентичні при утворенні контактів одного типу
Типи структур, що утворюються при асоціації білкових молекул Ізологічна асоціація - асоціація, елементарною стадією якої є взаємодія 2 -х ідентичних центрів асоціації, розташованих на білкових субодиницях; асоціація білкових субодиниць веде до утворення "замкнених" олігомерних структур. Гетерологічна асоціація - тобто асоціація, елементарною стадією якої є взаємодія 2 -х різнорідних центрів асоціації; асоціація молекул ферменту супроводжується утворенням асоціатів необмеженої довжини. Мi+ Mj <=> Mi+j (K = [Mi+j]/ [Mi][Mj]) – ідентичні при утворенні контактів одного типу
 Ізологічна асоціація NADP-залежна ізоцитратдегідрогеназа система типу мономер <=> димер з молекулярною масою 115 к. Д глікогенфосфорилаза b з скелетних м'язів кроля димер <=> тетрамер, молекулярна маса димеру 194, 8 к. Д
Ізологічна асоціація NADP-залежна ізоцитратдегідрогеназа система типу мономер <=> димер з молекулярною масою 115 к. Д глікогенфосфорилаза b з скелетних м'язів кроля димер <=> тетрамер, молекулярна маса димеру 194, 8 к. Д
 Гетерологічна асоціація глутаматдегідрогеназа з печінки бика Молекула ферменту, що виступає як "мономерна одиниця" - М у рівновазі М <=> M 2 <=> M 3, являє собою гексамер з молекулярною масою 312 к. Д К не ідентичні!!!
Гетерологічна асоціація глутаматдегідрогеназа з печінки бика Молекула ферменту, що виступає як "мономерна одиниця" - М у рівновазі М <=> M 2 <=> M 3, являє собою гексамер з молекулярною масою 312 к. Д К не ідентичні!!!
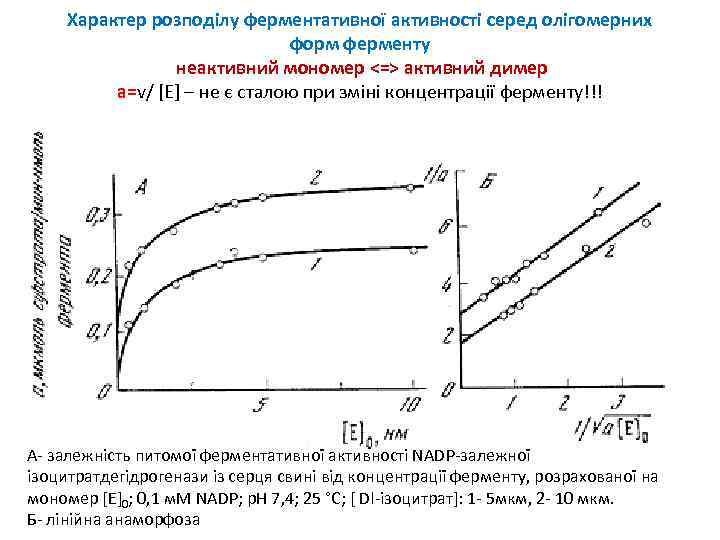 Характер розподілу ферментативної активності серед олігомерних форм ферменту неактивний мономер <=> активний димер а=v/ [E] – не є сталою при зміні концентрації ферменту!!! А- залежність питомої ферментативної активності NADP-залежної ізоцитратдегідрогенази із серця свині від концентрації ферменту, розрахованої на мономер [E]0; 0, 1 м. М NADP; р. Н 7, 4; 25 °С; [ Dl-ізоцитрат]: 1 - 5 мкм, 2 - 10 мкм. Б- лінійна анаморфоза
Характер розподілу ферментативної активності серед олігомерних форм ферменту неактивний мономер <=> активний димер а=v/ [E] – не є сталою при зміні концентрації ферменту!!! А- залежність питомої ферментативної активності NADP-залежної ізоцитратдегідрогенази із серця свині від концентрації ферменту, розрахованої на мономер [E]0; 0, 1 м. М NADP; р. Н 7, 4; 25 °С; [ Dl-ізоцитрат]: 1 - 5 мкм, 2 - 10 мкм. Б- лінійна анаморфоза
 Характер розподілу ферментативної активності серед олігомерних форм ферменту активний димер <=> неактивний тетрамер • Н: глікогенфосфорилаза b з скелетних м'язів кроля
Характер розподілу ферментативної активності серед олігомерних форм ферменту активний димер <=> неактивний тетрамер • Н: глікогенфосфорилаза b з скелетних м'язів кроля
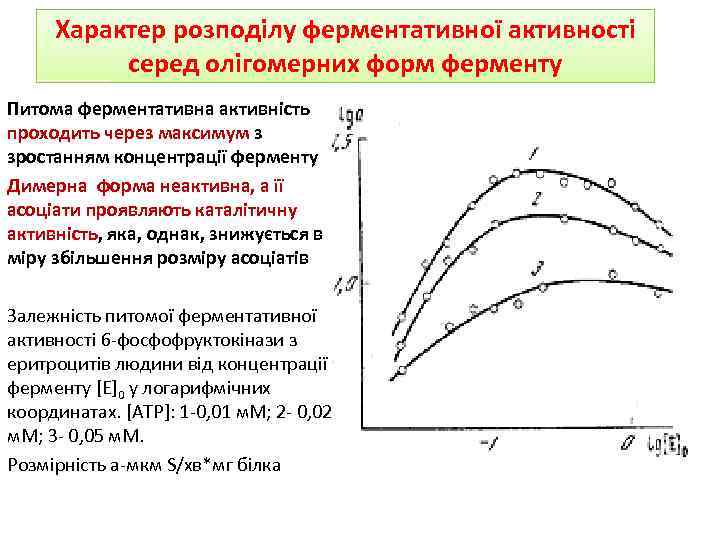 Характер розподілу ферментативної активності серед олігомерних форм ферменту Питома ферментативна активність проходить через максимум з зростанням концентрації ферменту Димерна форма неактивна, а її асоціати проявляють каталітичну активність, яка, однак, знижується в міру збільшення розміру асоціатів Залежність питомої ферментативної активності 6 -фосфофруктокінази з еритроцитів людини від концентрації ферменту [E]0 у логарифмічних координатах. [ATP]: 1 -0, 01 м. М; 2 - 0, 02 м. М; 3 - 0, 05 м. М. Розмірність а-мкм S/хв*мг білка
Характер розподілу ферментативної активності серед олігомерних форм ферменту Питома ферментативна активність проходить через максимум з зростанням концентрації ферменту Димерна форма неактивна, а її асоціати проявляють каталітичну активність, яка, однак, знижується в міру збільшення розміру асоціатів Залежність питомої ферментативної активності 6 -фосфофруктокінази з еритроцитів людини від концентрації ферменту [E]0 у логарифмічних координатах. [ATP]: 1 -0, 01 м. М; 2 - 0, 02 м. М; 3 - 0, 05 м. М. Розмірність а-мкм S/хв*мг білка
 Вплив специфічних лігандів на положення рівноваги між олігомерними формами ферментів • зв'язування специфічних лігандів приводить до конформаційних змін білкової молекули, що стосуються центрів асоціації, відповідальних за білок-білкові взаємодії. Н: асоціація димерів глікогенфосфорилази b у тетрамери під дією АМР • центри зв'язування специфічних лігандів розташовуються в зонах, що беруть участь у білок-білкових взаємодіях, і стерично екрануються при утворенні білкових асоціатів Н: глікогенфосфорилаза b: амінокислотні залишки, що входять у центр запасання глікогену, залучаються в димер -димерні контакти в тетрамері. Тому тетрамер не здатний зв'язувати глікоген. В умовах існуючої рухомої рівноваги димер <=> тетрамер глікоген проявляє дисоціюючу дію.
Вплив специфічних лігандів на положення рівноваги між олігомерними формами ферментів • зв'язування специфічних лігандів приводить до конформаційних змін білкової молекули, що стосуються центрів асоціації, відповідальних за білок-білкові взаємодії. Н: асоціація димерів глікогенфосфорилази b у тетрамери під дією АМР • центри зв'язування специфічних лігандів розташовуються в зонах, що беруть участь у білок-білкових взаємодіях, і стерично екрануються при утворенні білкових асоціатів Н: глікогенфосфорилаза b: амінокислотні залишки, що входять у центр запасання глікогену, залучаються в димер -димерні контакти в тетрамері. Тому тетрамер не здатний зв'язувати глікоген. В умовах існуючої рухомої рівноваги димер <=> тетрамер глікоген проявляє дисоціюючу дію.
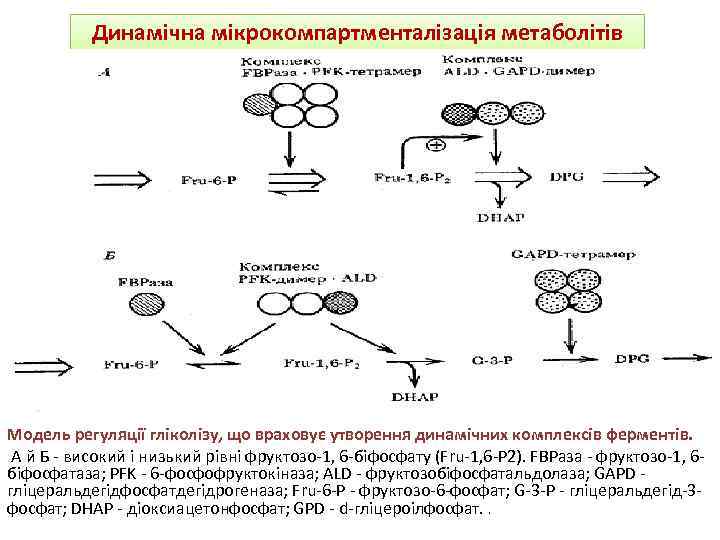 Динамічна мікрокомпартменталізація метаболітів Модель регуляції гліколізу, що враховує утворення динамічних комплексів ферментів. А й Б - високий і низький рівні фруктозо-1, 6 -біфосфату (Fru-1, 6 -P 2). FBPаза - фруктозо-1, 6 біфосфатаза; PFK - 6 -фосфофруктокіназа; ALD - фруктозобіфосфатальдолаза; GAPD гліцеральдегідфосфатдегідрогеназа; Fru-6 -P - фруктозо-6 -фосфат; G-3 -P - гліцеральдегід-3 фосфат; DHAP - діоксиацетонфосфат; GPD - d-гліцероілфосфат. .
Динамічна мікрокомпартменталізація метаболітів Модель регуляції гліколізу, що враховує утворення динамічних комплексів ферментів. А й Б - високий і низький рівні фруктозо-1, 6 -біфосфату (Fru-1, 6 -P 2). FBPаза - фруктозо-1, 6 біфосфатаза; PFK - 6 -фосфофруктокіназа; ALD - фруктозобіфосфатальдолаза; GAPD гліцеральдегідфосфатдегідрогеназа; Fru-6 -P - фруктозо-6 -фосфат; G-3 -P - гліцеральдегід-3 фосфат; DHAP - діоксиацетонфосфат; GPD - d-гліцероілфосфат. .
 Адсорбційний механізм регуляції активності ферментів 1. Фізіологічна важливість оборотного зв'язування ферментів субклітинними структурами. 2. Адсорбційний механізм регуляції. Зміна властивостей ферменту. 3. Фізіологічні наслідки адсорбції ферментів. Компартменталізація метаболітів.
Адсорбційний механізм регуляції активності ферментів 1. Фізіологічна важливість оборотного зв'язування ферментів субклітинними структурами. 2. Адсорбційний механізм регуляції. Зміна властивостей ферменту. 3. Фізіологічні наслідки адсорбції ферментів. Компартменталізація метаболітів.
 Фізіологічна важливість оборотного зв'язування ферментів субклітинними структурами а) оборотна адсорбція ферментів може приводити до зміни їх каталітичних і регуляторних властивостей і, отже, бути чинником, що регулює активність ферментів; б) адсорбція ферментів може забезпечувати компартменталізацію метаболітів у поверхні, на якій адсорбовані ці ферменти; в) адсорбовані ферменти можуть утворювати впорядковані мультиферментні структури (метаболони), завдяки чому з'являється можливість регулювати метаболічний процес як єдине ціле; г) ферменти, адсорбовані на білкових порах мембран, можуть брати участь в активному транспорті метаболітів через мембрану; д) адсорбовані ферменти більш стабільні, чим вільні ферменти й таким чином, адсорбція може служити фактором, що знижує швидкість деградації ферментів у клітині.
Фізіологічна важливість оборотного зв'язування ферментів субклітинними структурами а) оборотна адсорбція ферментів може приводити до зміни їх каталітичних і регуляторних властивостей і, отже, бути чинником, що регулює активність ферментів; б) адсорбція ферментів може забезпечувати компартменталізацію метаболітів у поверхні, на якій адсорбовані ці ферменти; в) адсорбовані ферменти можуть утворювати впорядковані мультиферментні структури (метаболони), завдяки чому з'являється можливість регулювати метаболічний процес як єдине ціле; г) ферменти, адсорбовані на білкових порах мембран, можуть брати участь в активному транспорті метаболітів через мембрану; д) адсорбовані ферменти більш стабільні, чим вільні ферменти й таким чином, адсорбція може служити фактором, що знижує швидкість деградації ферментів у клітині.
 Адсорбційний механізм регуляції Передумови існування • 1) існування оборотної рівноваги між вільною формою ферменту й адсорбованим ферментом; • 2) зміна каталітичних характеристик ферменту при адсорбції; • 3) чутливість рухомої рівноваги між вільною й зв'язаною формами ферменту до присутності клітинних метаболітів
Адсорбційний механізм регуляції Передумови існування • 1) існування оборотної рівноваги між вільною формою ферменту й адсорбованим ферментом; • 2) зміна каталітичних характеристик ферменту при адсорбції; • 3) чутливість рухомої рівноваги між вільною й зв'язаною формами ферменту до присутності клітинних метаболітів
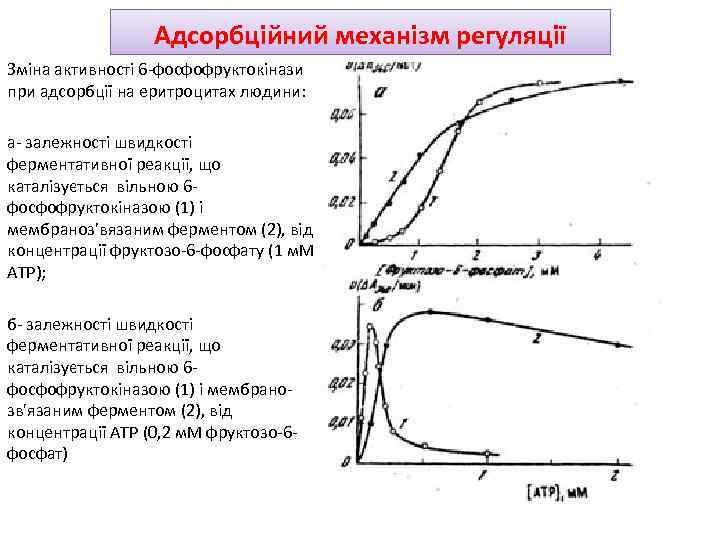 Адсорбційний механізм регуляції Зміна активності 6 -фосфофруктокінази при адсорбції на еритроцитах людини: а- залежності швидкості ферментативної реакції, що каталізується вільною 6 фосфофруктокіназою (1) і мембраноз’вязаним ферментом (2), від концентрації фруктозо-6 -фосфату (1 м. М АТР); б- залежності швидкості ферментативної реакції, що каталізується вільною 6 фосфофруктокіназою (1) і мембранозв'язаним ферментом (2), від концентрації АТР (0, 2 м. М фруктозо-6 фосфат)
Адсорбційний механізм регуляції Зміна активності 6 -фосфофруктокінази при адсорбції на еритроцитах людини: а- залежності швидкості ферментативної реакції, що каталізується вільною 6 фосфофруктокіназою (1) і мембраноз’вязаним ферментом (2), від концентрації фруктозо-6 -фосфату (1 м. М АТР); б- залежності швидкості ферментативної реакції, що каталізується вільною 6 фосфофруктокіназою (1) і мембранозв'язаним ферментом (2), від концентрації АТР (0, 2 м. М фруктозо-6 фосфат)
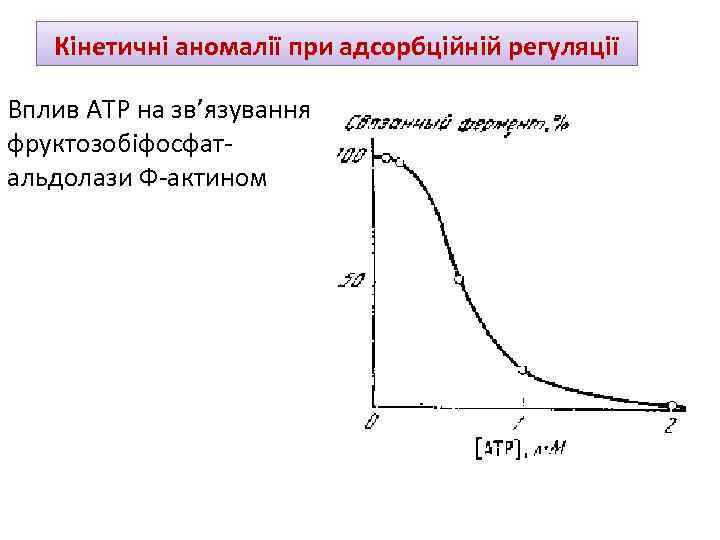 Кінетичні аномалії при адсорбційній регуляції Вплив АТР на зв’язування фруктозобіфосфатальдолази Ф-актином
Кінетичні аномалії при адсорбційній регуляції Вплив АТР на зв’язування фруктозобіфосфатальдолази Ф-актином
 Аллотопія Зміна фізико-хімічних властивостей ферменту під впливом мембранного оточення
Аллотопія Зміна фізико-хімічних властивостей ферменту під впливом мембранного оточення
 Причини зміни каталітичних і регуляторних властивостей ферменту при адсорбції на субклітинних структурах • зміна конформації білкової молекули • стеричне екранування активних або алостеричних центрів • зміна мікрооточення молекули ферменту, що супроводжує перехід ферменту з вільного стану в адсорбований.
Причини зміни каталітичних і регуляторних властивостей ферменту при адсорбції на субклітинних структурах • зміна конформації білкової молекули • стеричне екранування активних або алостеричних центрів • зміна мікрооточення молекули ферменту, що супроводжує перехід ферменту з вільного стану в адсорбований.
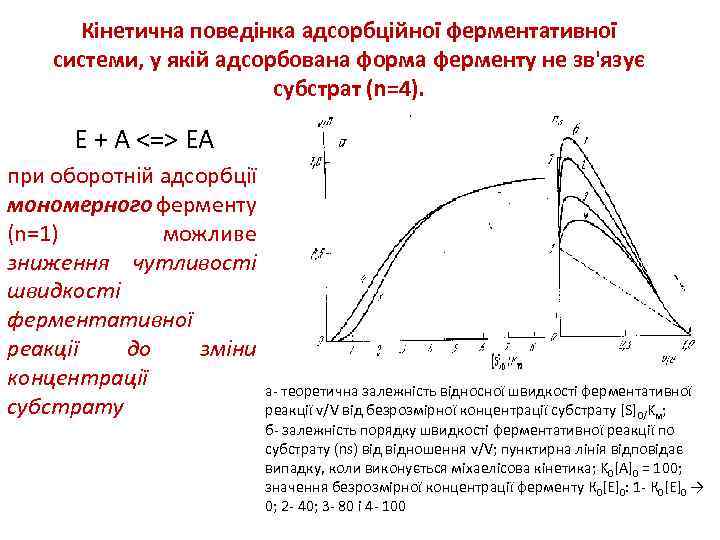 Кінетична поведінка адсорбційної ферментативної системи, у якій адсорбована форма ферменту не зв'язує субстрат (n=4). Е + А <=> ЕА при оборотній адсорбції мономерного ферменту (n=1) можливе зниження чутливості швидкості ферментативної реакції до зміни концентрації субстрату а- теоретична залежність відносної швидкості ферментативної реакції v/V від безрозмірної концентрації субстрату [S]0/Kм; б- залежність порядку швидкості ферментативної реакції по субстрату (ns) відношення v/V; пунктирна лінія відповідає випадку, коли виконується міхаелісова кінетика; K 0[A]0 = 100; значення безрозмірної концентрації ферменту К 0[E]0: 1 - К 0[E]0 → 0; 2 - 40; 3 - 80 і 4 - 100
Кінетична поведінка адсорбційної ферментативної системи, у якій адсорбована форма ферменту не зв'язує субстрат (n=4). Е + А <=> ЕА при оборотній адсорбції мономерного ферменту (n=1) можливе зниження чутливості швидкості ферментативної реакції до зміни концентрації субстрату а- теоретична залежність відносної швидкості ферментативної реакції v/V від безрозмірної концентрації субстрату [S]0/Kм; б- залежність порядку швидкості ферментативної реакції по субстрату (ns) відношення v/V; пунктирна лінія відповідає випадку, коли виконується міхаелісова кінетика; K 0[A]0 = 100; значення безрозмірної концентрації ферменту К 0[E]0: 1 - К 0[E]0 → 0; 2 - 40; 3 - 80 і 4 - 100
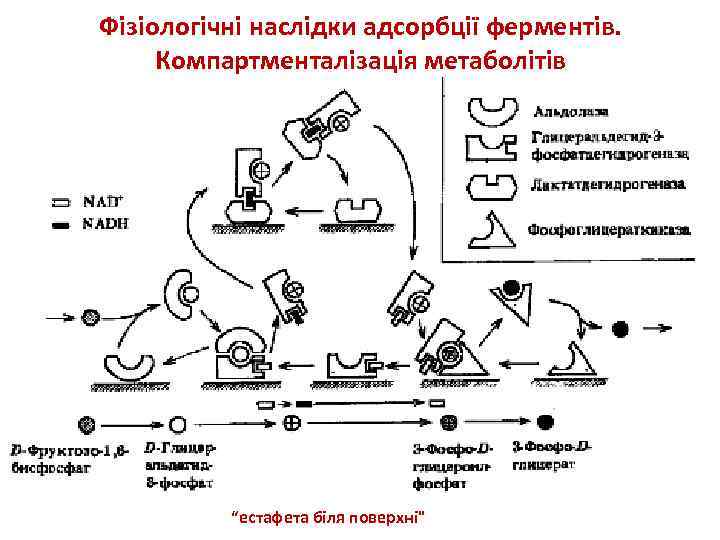 Фізіологічні наслідки адсорбції ферментів. Компартменталізація метаболітів “естафета біля поверхні"
Фізіологічні наслідки адсорбції ферментів. Компартменталізація метаболітів “естафета біля поверхні"
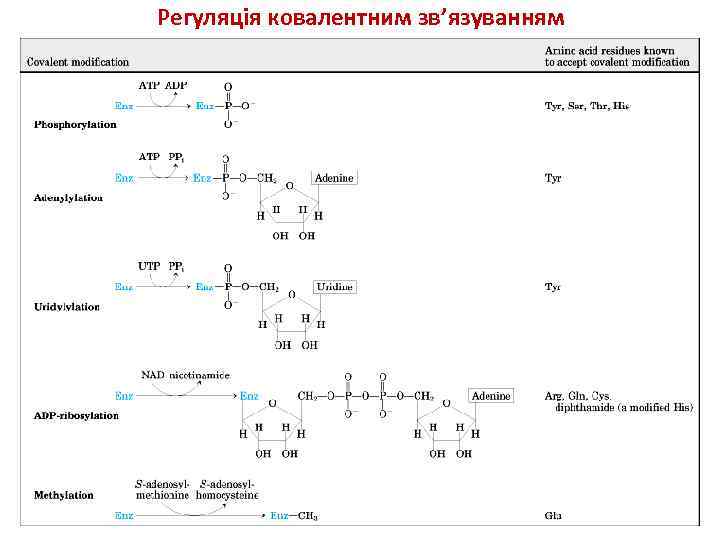 Регуляція ковалентним зв’язуванням
Регуляція ковалентним зв’язуванням
 Мультиферментні комплекси
Мультиферментні комплекси
 Участь у активному транспорті • Периферические мембрано-связанные ферменты могут участвовать в активном транспорте метаболитов через мембрану за счет энергии ферментативной реакции, катализирумой ферментом. Возможно, подобным образом функционирует гексокиназа, адсорбированная на порине, встроенном во внешнюю мембрану митохондрий. Известно, что адсорбированная гексокиназа эффективно использует синтезируемый митохондриями АТР. Не исключено, что транспорт адениновых нуклеотидов через порин сопряжен с действием гексокиназы
Участь у активному транспорті • Периферические мембрано-связанные ферменты могут участвовать в активном транспорте метаболитов через мембрану за счет энергии ферментативной реакции, катализирумой ферментом. Возможно, подобным образом функционирует гексокиназа, адсорбированная на порине, встроенном во внешнюю мембрану митохондрий. Известно, что адсорбированная гексокиназа эффективно использует синтезируемый митохондриями АТР. Не исключено, что транспорт адениновых нуклеотидов через порин сопряжен с действием гексокиназы
 Підсумок • Аллостерический, диссоциативный и адсорбционный механизмы регуляции активности ферментов обеспечивают регуляцию метаболических процессов на уровне ферментов. У Надмолекулярных структур появляется новый, иерархически более высокий регуляторный механизм. Важность изучения структурных уровней, соответствующих биомакромолекулам и надмолекулярным комплексам, состоит в том, что они играют роль стандартных блоков (транспортные, ферментные, сократительные, рецепторные, энергизирующие) в построении более высоких структурных уровней (клетка, орган, ткань, системы органов, организм), выполняющих более сложные функции и регулируемые с участием иерархически более важных регуляторных механизмов. В целом эволюция осуществляется с помощью комбинации одних и тех же универсальных блоков, что приводит к возникновению функциональных блоков более высокого ранга, которые обладают новыми, уникальными функциями.
Підсумок • Аллостерический, диссоциативный и адсорбционный механизмы регуляции активности ферментов обеспечивают регуляцию метаболических процессов на уровне ферментов. У Надмолекулярных структур появляется новый, иерархически более высокий регуляторный механизм. Важность изучения структурных уровней, соответствующих биомакромолекулам и надмолекулярным комплексам, состоит в том, что они играют роль стандартных блоков (транспортные, ферментные, сократительные, рецепторные, энергизирующие) в построении более высоких структурных уровней (клетка, орган, ткань, системы органов, организм), выполняющих более сложные функции и регулируемые с участием иерархически более важных регуляторных механизмов. В целом эволюция осуществляется с помощью комбинации одних и тех же универсальных блоков, что приводит к возникновению функциональных блоков более высокого ранга, которые обладают новыми, уникальными функциями.


