Lecture_9_regul.pptx
- Количество слайдов: 40

Регуляція ферментативної активності Принципи контролю метаболізму Способи регуляції активності ферментів Механізми регуляції ферментативної активності

Принципи контролю метаболізму Просторова регуляція • Компартменталізація • Утворення мультиферментних комплексів • Диференціація Часова регуляція Регуляція швидкості ферментативних реакції: • Контроль синтезу молекул ферменту (транскрипція, трансляція, фолдінг …) • Структурні модифікації (фосфорилювання, обмежений протеоліз, дисоціація-асоціація …)

Рівні регуляції метаболізму • Дотранскрипційний: метилювання хроматину у прокаріот суперспіралізація у еукаріот • Транскрипційний: Ініціація – промотори+регуляторні білки Термінація – аттенуація, антитермінація • Трансляційний : Стабільність м. РНК – rpo. S ініціація трансляції (cold shock) • Посттрансляційний: білок-білкові взаємодії модифікації білків аллостерична регуляція тощо

Способи регуляції активності ферментів Регуляція експресії білків Внутрішньоклітинні механізми регуляції ферментативної активності • Зміна концентрації субстратів чи коферментів без зміни кількості ферменту – компартменталізація • Зміна концентрації ефекторів алостеричних ферментів • Індукція або репресія • Мультиферментні системи Регуляція на рівні цілісного організму • Нервова • Гормональна

Контроль швидкості ферментативної реакції Контроль кількості ферменту Регуляція активності фермента • Визначається співвідношенням швидкості синтезу та розпаду ферменту • Більш повільний процес, проявляється через кілька годин • Результат взаємодії з речовинами, що змінюють конформацію активного центру • Швидкий процес

Механізми регуляції ферментативної активності 1. Алостерична регуляція 2. Дисоціативна регуляція 3. Адсорбційна регуляція 4. Регуляція ковалентним зв’язуванням 5. Регуляція обмеженим протеолізом

Алостеричний механізм регуляції • Алостеричним механізмом регуляції активності ферментів називають регуляторний механізм, у якому контроль активності ферменту реалізується шляхом зміни конформації білкової молекули, індукованої зв'язуванням метаболітарегулятора в особливому (алостеричному) центрі, просторово віддаленому від активного центру. • Зміна конформації молекули ферменту спричиняє зміну каталітичних характеристик активного центру.

Алостеричний механізм регуляції

Алостеричний механізм регуляції • Метаболіт-регулятор, що модифікує активність ферменту подібним чином, називають алостеричним ефектором. • Олігомерна молекула ферменту, що складається з декількох субодиниць, може містити кілька активних центрів і кілька алостеричних центрів для певного ефектора. У такому олігомері можливі взаємодії не тільки між активним і алостеричним центрами, але й між центрами одного типу ( між активними або між алостеричними центрами). • У результаті взаємодії між субодиницями зв'язування субстрату стає кооперативним.

Дисоціативна регуляція • Багато ферментів клітинного метаболізму мають олігомерну структуру, тобто побудовані з окремих субодиниць. • Зв'язки між субодиницями мають найчастіше нековалентний характер, і це визначає можливість дисоціації ферментного олігомеру на окремі субодиниці, як правило, відрізняються по своїх каталітичних властивостях від ферментного олігомеру. • Положення рівноваги між олігомерними формами ферменту контролюється присутністю субстратів, коферментів і алостеричних ефекторів. Такий вплив метаболітів на міцність зв'язків між субодиницями у ферментному олігомері являє собою дисоціативний механізм регуляції активності.

Дисоціативна регуляція

Адсорбційна регуляція • Клітинні метаболіти впливають на здатність ферменту взаємодіяти із субклітинними структурами. Ферменти, адсорбовані структурними білками м'язів і мембранами клітинних органел, мають інше мікрооточення, ніж ферменти в розчині, і характеризуються зміненими каталітичними характеристиками. Контрольована метаболітами адсорбція ферментів на субклітинних структурах (адсорбційний механізм регуляції) розширює регуляторні можливості клітини.

NB !!! • Алостеричний, дисоціативний і адсорбційний механізми регуляції ферментативної активності є подібними в тому відношенні, що в кожному з них вплив метаболіту-регулятора на каталітичні властивості ферменту здійснюється не шляхом прямого впливу на активний центр ферменту, а непрямим шляхом ( через зміну конформаційного, олігомерного або адсорбційного стану ферменту).

NB !!! • Алостеричні, дисоціативні й адсорбційні ферментні системи виявляють кінетичні аномалії ( S-подібні залежності швидкості ферментативної реакції від концентрації субстрату або алостеричного ефектору, лагперіоди або сплески на кінетичних кривих нагромадження продукту ферментативної реакції і т. д. ), важливі з погляду виконання цими системами регуляторних функцій.

Регуляція ковалентним зв’язуванням • Модифікація ферментативної активності може полягати в ковалентній модифікації ферменту. Відомо багато ферментів, які активуються тільки у фосфорильованому стані, або фосфорилирована й дефосфорильована форми мають різні активності. Н. : АТФ-Глутамінсинтетаза-Аденілтрансфераза з Е. coli у присутності АТФ і Мg 2+ приєднує молекулу аденілової кислоти на кожну субодиницю глутамінсинтетази. Немодифікований фермент інгібується гліцином, але майже не інгібується АТФ і ЦТФ. На противагу цьому аденільований фермент сильно інгібується АТФ, ЦТФ, гістидином і триптофаном і тільки злегка гліцином.

Регуляція ковалентним зв’язуванням

Регуляція обмеженим протеолізом • Накопичений кінцевий продукт зв'язується з інгібіторами протеолітичних ферментів, знижуючи їх інгібуючу дію. • Протеолітичні ферменти, звільнені в такий спосіб від інгібування, відщеплюють частину молекули ферменту. • У результаті концентрація кінцевого продукту знижується, потрійний комплекс кінцевий продуктпротеолітичний фермент-інгібітор дисоціює, звільнений інгібітор знову зв'язується із протеолітичним ферментом, і розщеплення ферменту припиняється. Н. : ферменти системи згортання крові,

Регуляція обмеженим протеолізом

Алостеричний механізм регуляції Механізми алостеричних взаємодій. 1. Узгоджений механізм алостеричних взаємодій (“все або нічого”, “модель 2 -х станів”) 2. Послідовний механізм алостеричної взаємодії (“модель індукованих взаємодій”)

NB !!! • Кооперативне зв'язування субстрату ферментом являє собою гомотропний ефект, а вплив активатора або інгібітору – гетеротропний

Узгоджений механізм алостеричних взаємодій Субодиниці можуть перебувати у двох конформаціях - R- (relaxed - "розслабленому")-стані й T (tense, "напруженому")-стані. Конформація R має високу спорідненість до субстрату, Т- низьку Наявність гібридної форми RT виключається!!! Ця модель виходить із важливої ролі симетрії у взаємодії субодиниць в олігомерних білках і тому припускає її збереження при алостеричних переходах. Зміни відбуваються на рівні четвертинної структури !!!

Узгоджений механізм алостеричних взаємодій для збереження симетрії димеру обидві субодиниці повинні перебувати в тому самому конформаційному стані !!! R 0 <=>T 0 L = T 0/ R 0

Гомотропні взаємодії • Додавання субстрату зрушує конформаційну рівновагу у бік утворення R -форми • перехід від Т до R і назад усі субодиниці ферменту здійснюють узгоджено. • у міру додавання субстрату частка молекул ферменту в R-формі прогресивно зростає, і зв'язування субстрату відбувається кооперативно.
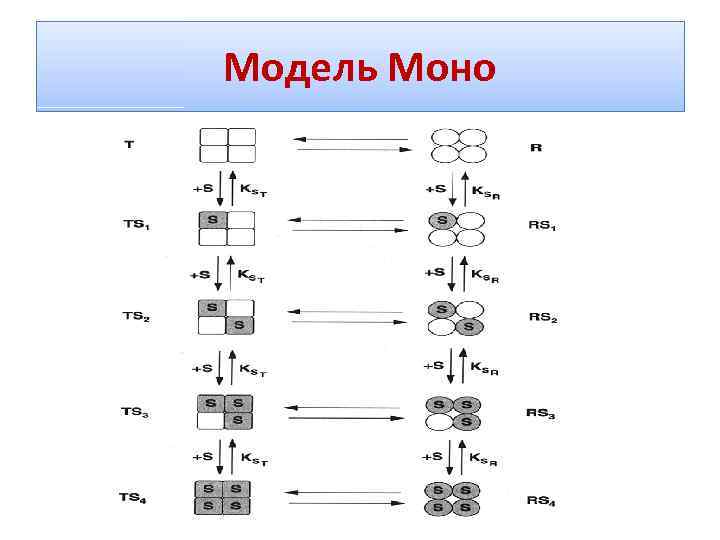
Модель Моно
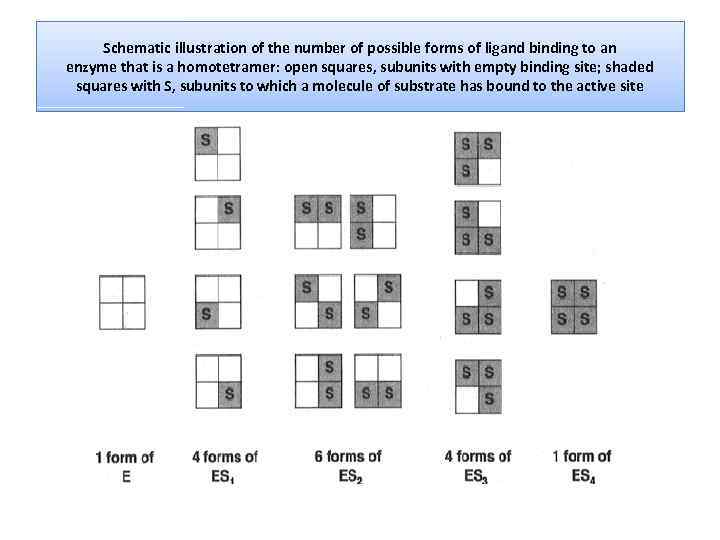
Schematic illustration of the number of possible forms of ligand binding to an enzyme that is a homotetramer: open squares, subunits with empty binding site; shaded squares with S, subunits to which a molecule of substrate has bound to the active site

Гетеротропні ефекти • Гетеротропний регулятор стабілізує одну з форм, збільшуючи її концентрацію !!!

Узгоджений механізм алостеричних взаємодій • Алостеричний інгібітор зв'язується переважно з Т-формою, тоді як алостеричний активатор зв'язується переважно з R-формою • При узгодженому механізмі алостеричних взаємодій гомотропні ефекти завжди позитивні (кооперативні), а гетеротропні можуть бути й позитивними й негативними.

Узгоджений механізм алостеричних взаємодій

Зникнення позитивної кооперативності приєднанні алостеричних ефекторів ізоцитратдегідрогеназа


А якщо відкинути симетрію?

Послідовний механізм алостеричної взаємодії 1. Під час відсутності субстрату весь фермент перебуває в Т-формі. Перехід від Т-Форми до Rформи індукується приєднанням субстрату. 2. Конформаційний перехід від Т до R у різних субодиницях ферменту відбувається не узгоджено, а послідовно. 3. Зв'язування субстрату змінює форму тієї субодиниці, до якої він приєднується. 4. Конформаційні зміни, викликані зв'язуванням субстрату на одній субодиниці, можуть збільшувати або зменшувати спорідненість до субстрату іншої субодиниці тієї ж молекули ферменту.

Послідовний механізм алостеричної взаємодії Зв'язування є кооперативним, якщо в RТ -форми спорідненість до субстрату вища, чим у ТТформи Зміни відбуваються на рівні третинної структури !!!

Модель Кошланда

Модель простого послідовного механізму взаємодії відрізняється від моделі узгодженого механізму У випадку узгодженого механізму гомотропні взаємодії завжди повинні бути позитивними, тоді як у випадку послідовного механізму вони можуть бути або позитивними, або негативними. Це залежить від структурних переходів, викликаних приєднанням першої молекули субстрату.

Негативна гомотропна кооперативність Антикооперативність Н. : тирозил- т. РНКсинтетаза – симетричні субодиниці

Реакційна здатність половини АЦ
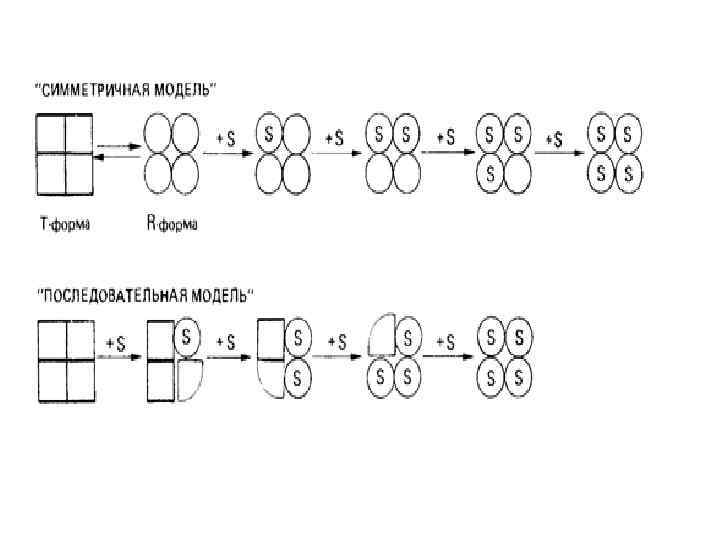

Схема Ейгена

Lecture_9_regul.pptx