регуляции дыхания_2009.ppt
- Количество слайдов: 69
 Регуляция дыхания
Регуляция дыхания
 Цель лекции: Определить основные механизмы регуляции внешнего дыхания в норме и при различных функциональных воздействий. Мотивация: Понять основные координирующие принципы регуляции внешнего дыхания как в норме так и патологии. План лекции: история изучения регуляции дыхания дыхательные центры и его строение центральные механизмы регуляции дыхания периферические механизмы регуляции дыхания дыхание в изменённых условиях окружающей среды функциональная система регуляции дыхания
Цель лекции: Определить основные механизмы регуляции внешнего дыхания в норме и при различных функциональных воздействий. Мотивация: Понять основные координирующие принципы регуляции внешнего дыхания как в норме так и патологии. План лекции: история изучения регуляции дыхания дыхательные центры и его строение центральные механизмы регуляции дыхания периферические механизмы регуляции дыхания дыхание в изменённых условиях окружающей среды функциональная система регуляции дыхания
 Дыхательный центр • Дыхательный центр - совокупность нейронных ансамблей разных этажей центральной нервной системы, обеспечивающих управление внешним дыханием • Автоматический дыхательный центр совокупность нейронов специфических (дыхательных) ядер продолговатого мозга, способных генерировать дыхательный ритм • Функции дыхательного центра: • - моторная или двигательная • - гомеостатическая
Дыхательный центр • Дыхательный центр - совокупность нейронных ансамблей разных этажей центральной нервной системы, обеспечивающих управление внешним дыханием • Автоматический дыхательный центр совокупность нейронов специфических (дыхательных) ядер продолговатого мозга, способных генерировать дыхательный ритм • Функции дыхательного центра: • - моторная или двигательная • - гомеостатическая
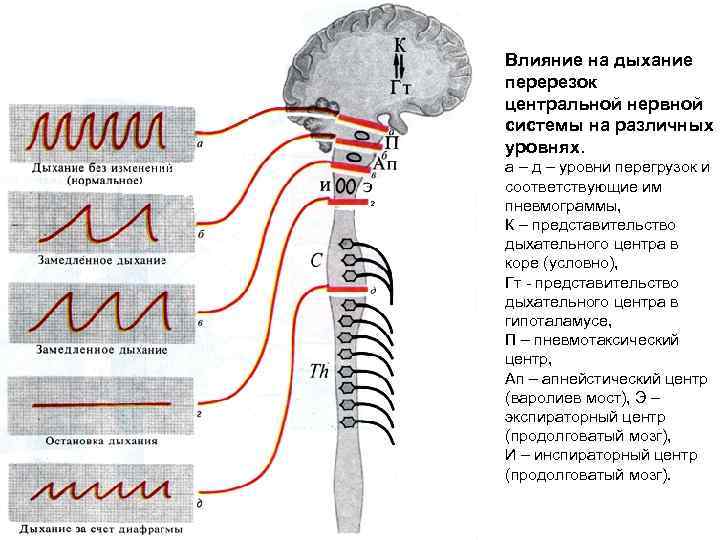 Влияние на дыхание перерезок центральной нервной системы на различных уровнях. а – д – уровни перегрузок и соответствующие им пневмограммы, К – представительство дыхательного центра в коре (условно), Гт представительство дыхательного центра в гипоталамусе, П – пневмотаксический центр, Ап – апнейстический центр (варолиев мост), Э – экспираторный центр (продолговатый мозг), И – инспираторный центр (продолговатый мозг).
Влияние на дыхание перерезок центральной нервной системы на различных уровнях. а – д – уровни перегрузок и соответствующие им пневмограммы, К – представительство дыхательного центра в коре (условно), Гт представительство дыхательного центра в гипоталамусе, П – пневмотаксический центр, Ап – апнейстический центр (варолиев мост), Э – экспираторный центр (продолговатый мозг), И – инспираторный центр (продолговатый мозг).
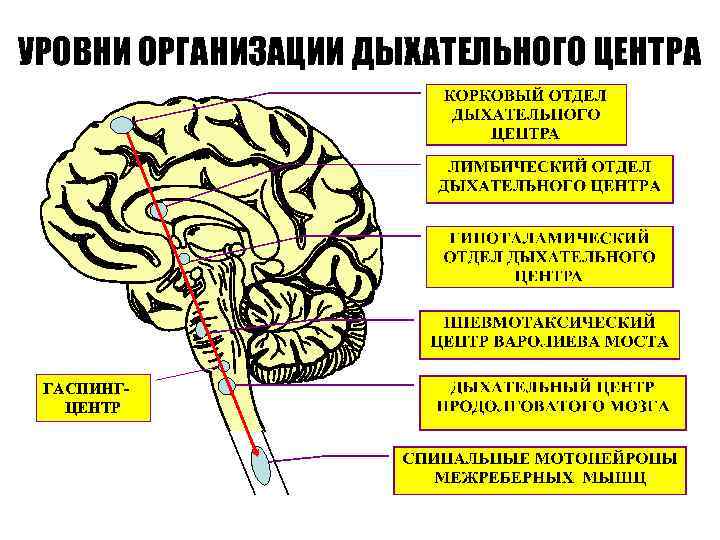 УРОВНИ ОРГАНИЗАЦИИ ДЫХАТЕЛЬНОГО ЦЕНТРА ГАСПИНГЦЕНТР
УРОВНИ ОРГАНИЗАЦИИ ДЫХАТЕЛЬНОГО ЦЕНТРА ГАСПИНГЦЕНТР
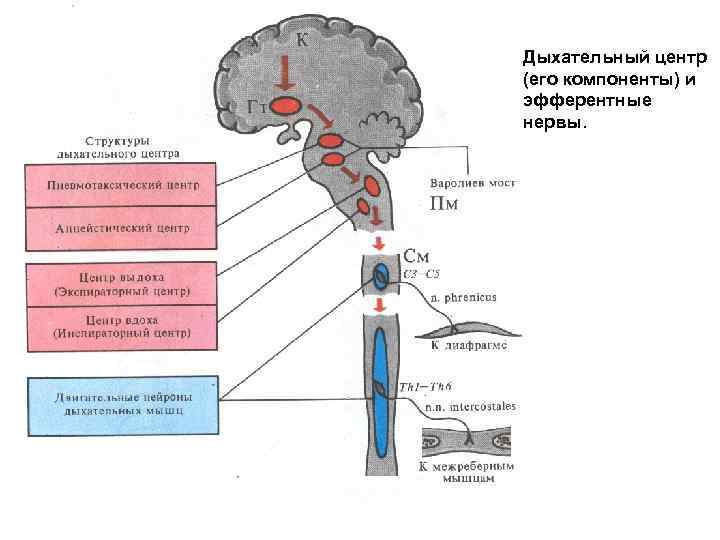 Дыхательный центр (его компоненты) и эфферентные нервы.
Дыхательный центр (его компоненты) и эфферентные нервы.
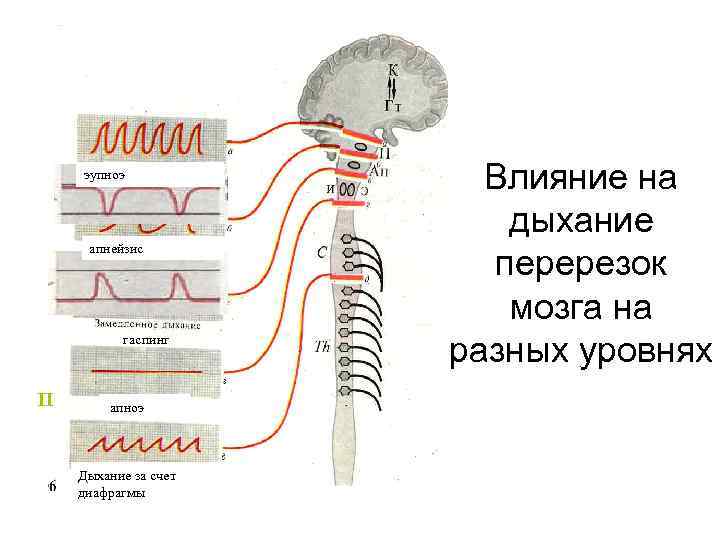 эупноэ апнейзис гаспинг П апноэ Дыхание за счет диафрагмы Влияние на дыхание перерезок мозга на разных уровнях
эупноэ апнейзис гаспинг П апноэ Дыхание за счет диафрагмы Влияние на дыхание перерезок мозга на разных уровнях
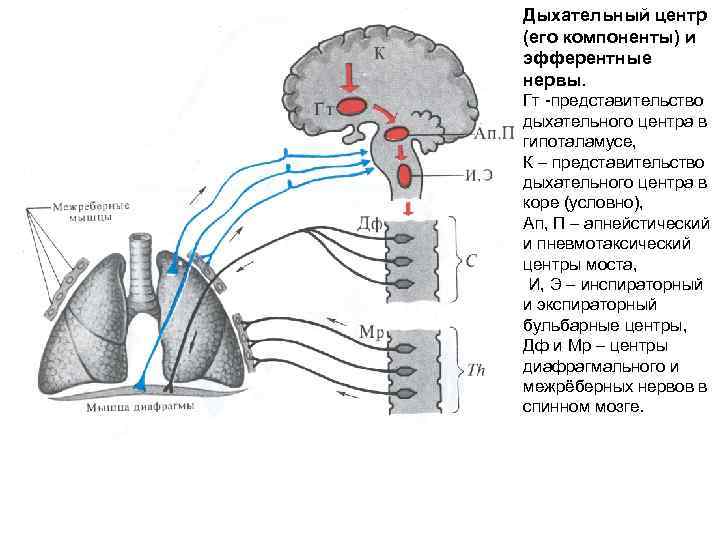 Дыхательный центр (его компоненты) и эфферентные нервы. Гт представительство дыхательного центра в гипоталамусе, К – представительство дыхательного центра в коре (условно), Ап, П – апнейстический и пневмотаксический центры моста, И, Э – инспираторный и экспираторный бульбарные центры, Дф и Мр – центры диафрагмального и межрёберных нервов в спинном мозге.
Дыхательный центр (его компоненты) и эфферентные нервы. Гт представительство дыхательного центра в гипоталамусе, К – представительство дыхательного центра в коре (условно), Ап, П – апнейстический и пневмотаксический центры моста, И, Э – инспираторный и экспираторный бульбарные центры, Дф и Мр – центры диафрагмального и межрёберных нервов в спинном мозге.
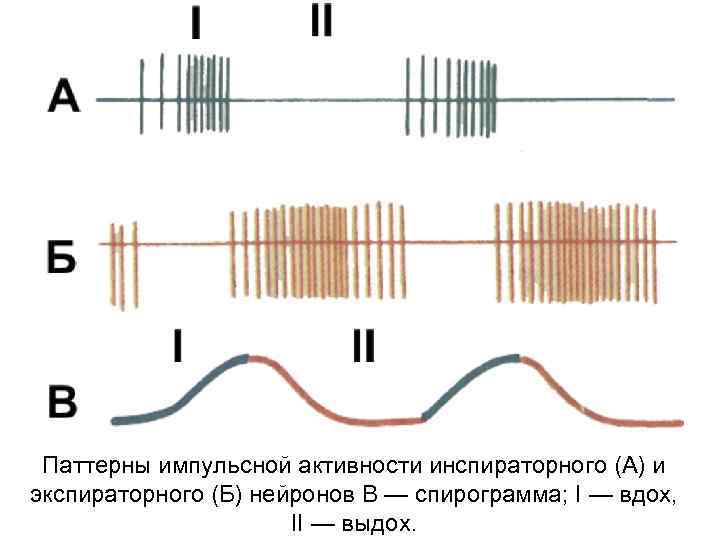 Паттерны импульсной активности инспираторного (А) и экспираторного (Б) нейронов В — спирограмма; I — вдох, II — выдох.
Паттерны импульсной активности инспираторного (А) и экспираторного (Б) нейронов В — спирограмма; I — вдох, II — выдох.
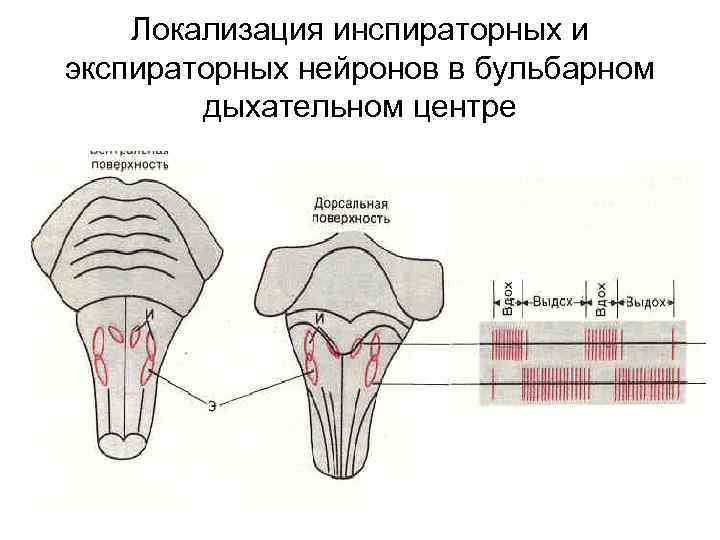 Локализация инспираторных и экспираторных нейронов в бульбарном дыхательном центре
Локализация инспираторных и экспираторных нейронов в бульбарном дыхательном центре
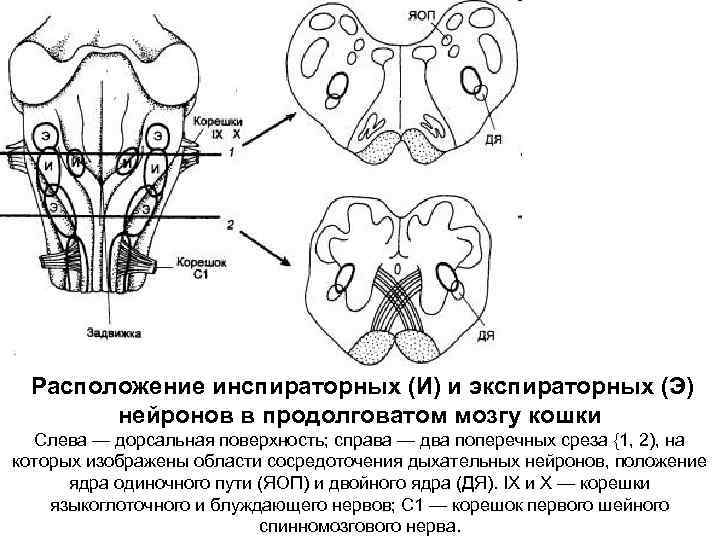 Расположение инспираторных (И) и экспираторных (Э) нейронов в продолговатом мозгу кошки Слева — дорсальная поверхность; справа — два поперечных среза {1, 2), на которых изображены области сосредоточения дыхательных нейронов, положение ядра одиночного пути (ЯОП) и двойного ядра (ДЯ). IX и Х — корешки языкоглоточного и блуждающего нервов; С 1 — корешок первого шейного спинномозгового нерва.
Расположение инспираторных (И) и экспираторных (Э) нейронов в продолговатом мозгу кошки Слева — дорсальная поверхность; справа — два поперечных среза {1, 2), на которых изображены области сосредоточения дыхательных нейронов, положение ядра одиночного пути (ЯОП) и двойного ядра (ДЯ). IX и Х — корешки языкоглоточного и блуждающего нервов; С 1 — корешок первого шейного спинномозгового нерва.
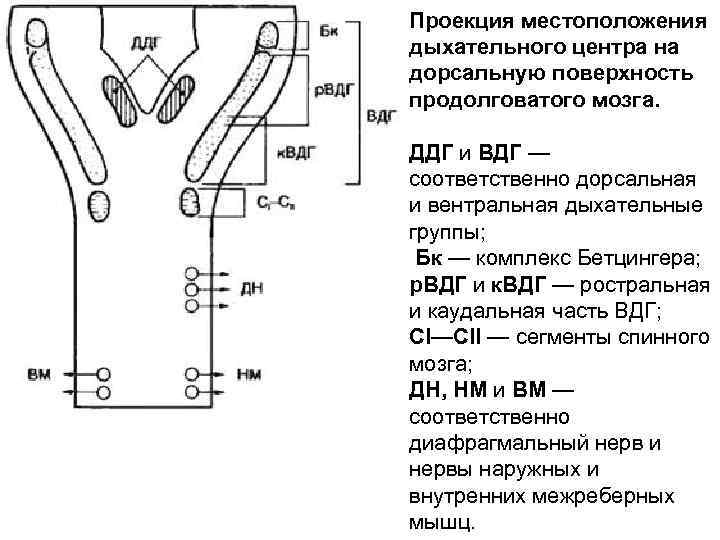 Проекция местоположения дыхательного центра на дорсальную поверхность продолговатого мозга. ДДГ и ВДГ — соответственно дорсальная и вентральная дыхательные группы; Бк — комплекс Бетцингера; р. ВДГ и к. ВДГ — ростральная и каудальная часть ВДГ; СI—СII — сегменты спинного мозга; ДН, НМ и ВМ — соответственно диафрагмальный нерв и нервы наружных и внутренних межреберных мышц.
Проекция местоположения дыхательного центра на дорсальную поверхность продолговатого мозга. ДДГ и ВДГ — соответственно дорсальная и вентральная дыхательные группы; Бк — комплекс Бетцингера; р. ВДГ и к. ВДГ — ростральная и каудальная часть ВДГ; СI—СII — сегменты спинного мозга; ДН, НМ и ВМ — соответственно диафрагмальный нерв и нервы наружных и внутренних межреберных мышц.
 Биоэлектрическая активность основных типом дыхательных нейронов течение трех нейронных фаз дыхательного цикла. 1 — ранние; 2 — полные; 3 — поздние инспираторные; 4 — постинспираторные; 5 – экспираторные; 6 преинспираторные нейроны.
Биоэлектрическая активность основных типом дыхательных нейронов течение трех нейронных фаз дыхательного цикла. 1 — ранние; 2 — полные; 3 — поздние инспираторные; 4 — постинспираторные; 5 – экспираторные; 6 преинспираторные нейроны.
 Соотношение фаз дыхательного цикла и фаз активности нейронов дыхательного центра. Площадь темных фигур соответствует степени биоэлектрической активности диафрагмального нерва и дыхательных мышц в различные фазы активности дыхательного центра.
Соотношение фаз дыхательного цикла и фаз активности нейронов дыхательного центра. Площадь темных фигур соответствует степени биоэлектрической активности диафрагмального нерва и дыхательных мышц в различные фазы активности дыхательного центра.
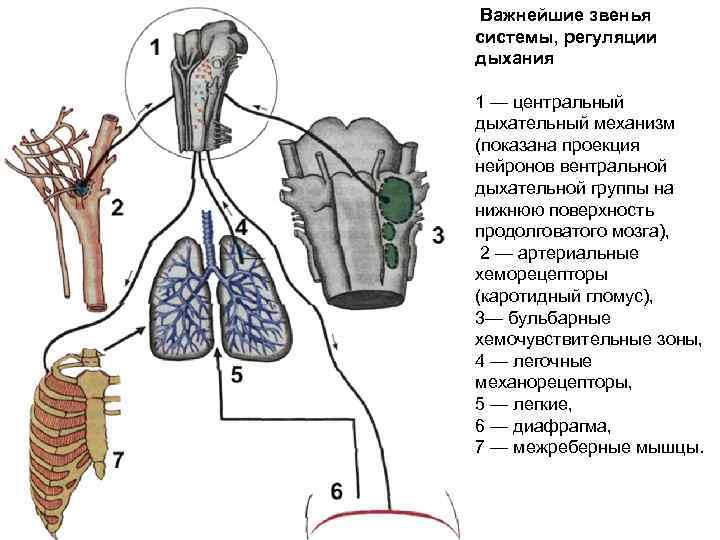 Важнейшие звенья системы, регуляции дыхания 1 — центральный дыхательный механизм (показана проекция нейронов вентральной дыхательной группы на нижнюю поверхность продолговатого мозга), 2 — артериальные хеморецепторы (каротидный гломус), 3— бульбарные хемочувствительные зоны, 4 — легочные механорецепторы, 5 — легкие, 6 — диафрагма, 7 — межреберные мышцы.
Важнейшие звенья системы, регуляции дыхания 1 — центральный дыхательный механизм (показана проекция нейронов вентральной дыхательной группы на нижнюю поверхность продолговатого мозга), 2 — артериальные хеморецепторы (каротидный гломус), 3— бульбарные хемочувствительные зоны, 4 — легочные механорецепторы, 5 — легкие, 6 — диафрагма, 7 — межреберные мышцы.
 Основные рецепторы легких • Ирритантные рецепторы слизистой оболочки дыхательных путей • Рецепторы растяжения гладких мышц дыхательных путей • Юкста капиллярные рецепторы межальвеолярного интерстиция
Основные рецепторы легких • Ирритантные рецепторы слизистой оболочки дыхательных путей • Рецепторы растяжения гладких мышц дыхательных путей • Юкста капиллярные рецепторы межальвеолярного интерстиция
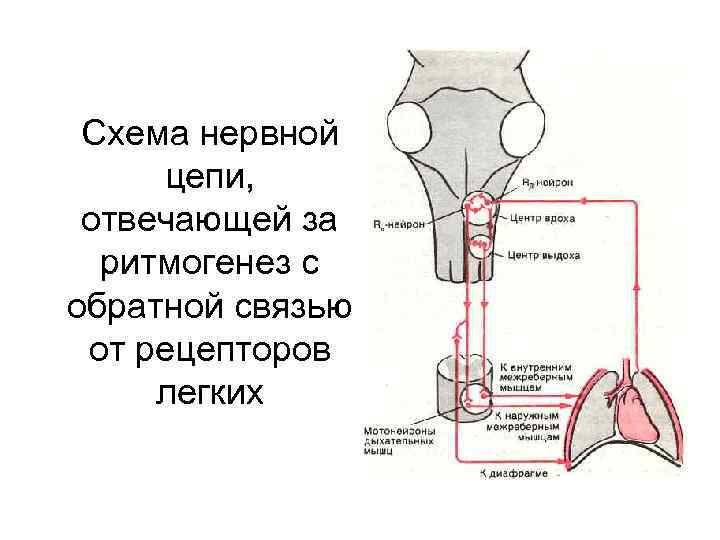 Схема нервной цепи, отвечающей за ритмогенез с обратной связью от рецепторов легких
Схема нервной цепи, отвечающей за ритмогенез с обратной связью от рецепторов легких
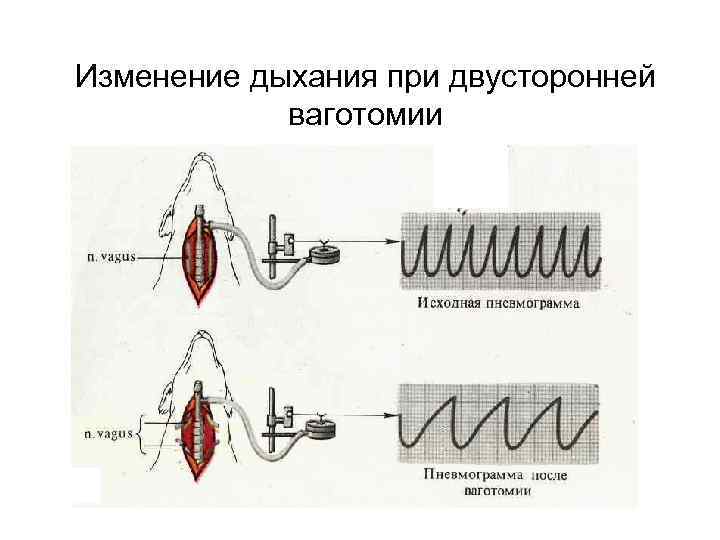 Изменение дыхания при двусторонней ваготомии
Изменение дыхания при двусторонней ваготомии
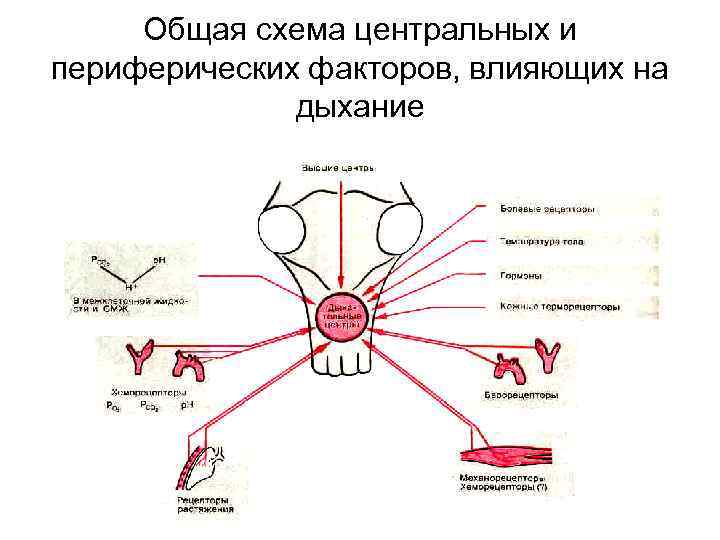 Общая схема центральных и периферических факторов, влияющих на дыхание
Общая схема центральных и периферических факторов, влияющих на дыхание
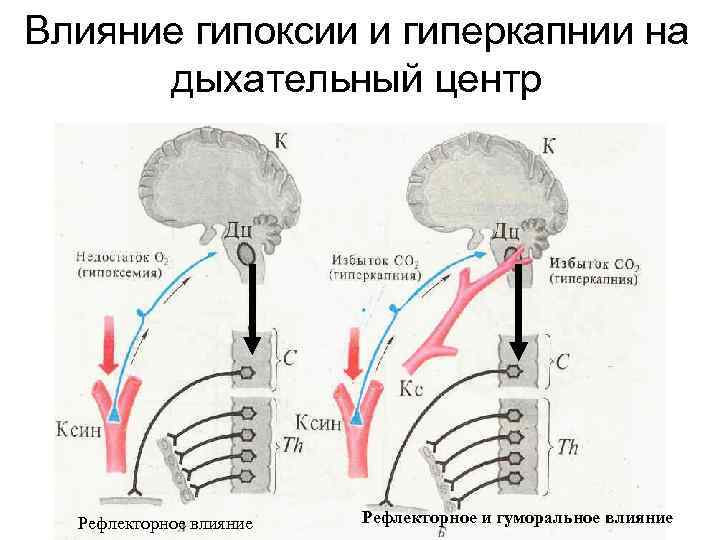 Влияние гипоксии и гиперкапнии на дыхательный центр Рефлекторное влияние Рефлекторное и гуморальное влияние
Влияние гипоксии и гиперкапнии на дыхательный центр Рефлекторное влияние Рефлекторное и гуморальное влияние
 Центральный дыхательный механизм входит в состав ретикулярной формации ствола мозга. Подавляющая масса дыхательных нейронов сосредоточена в двух группах ядер: дорсальной и вентральной. Большая часть нейронов дорсальной группы — инспираторные, бульбоспинальные. Их аксоны направляются в шейные сегменты спинного мозга и образуют синапсы с мотонейронами ядра диафрагмального нерва. Эти нейроны непосредственно управляют сокращением диафрагмы. Ядра вентральной дыхательной группы содержат инспираторные и экспираторные нейроны. Последние связаны преимущественно с мотонейронами межреберных и брюшных мышц, расположенными в грудных и поясничных сегментах спинного мозга, частично с мотонейронами диафрагмы, обеспечивая дыхательную активность указанных мышц. Активность центрального дыхательного механизма, в свою очередь, управляется стимулами, исходящими от хеморецепторов и механорецепторов дыхательной системы. Главная особенность работы этого механизма — линейное нарастание активности инспираторных нейронов на протяжении вдоха и резкий обрыв инспираторной активности, знаменующий окончание вдоха и переход к выдоху. Полагают, что этот обрыв осуществляется благодаря тормозному влиянию со стороны особой группы нейронов, возбуждение которых происходит одновременно с инспираторными и усиливается под влиянием афферентной импульсации от рецепторов растяжения легких. Чем сильнее импульсация от хеморецепторов, тем круче нарастает инспираторная активность и быстрее развивается вдох, но так как при этом резче растягиваются легкие, то вдох быстрее сменяется выдохом. В итоге увеличивается и глубина, и частота дыхания.
Центральный дыхательный механизм входит в состав ретикулярной формации ствола мозга. Подавляющая масса дыхательных нейронов сосредоточена в двух группах ядер: дорсальной и вентральной. Большая часть нейронов дорсальной группы — инспираторные, бульбоспинальные. Их аксоны направляются в шейные сегменты спинного мозга и образуют синапсы с мотонейронами ядра диафрагмального нерва. Эти нейроны непосредственно управляют сокращением диафрагмы. Ядра вентральной дыхательной группы содержат инспираторные и экспираторные нейроны. Последние связаны преимущественно с мотонейронами межреберных и брюшных мышц, расположенными в грудных и поясничных сегментах спинного мозга, частично с мотонейронами диафрагмы, обеспечивая дыхательную активность указанных мышц. Активность центрального дыхательного механизма, в свою очередь, управляется стимулами, исходящими от хеморецепторов и механорецепторов дыхательной системы. Главная особенность работы этого механизма — линейное нарастание активности инспираторных нейронов на протяжении вдоха и резкий обрыв инспираторной активности, знаменующий окончание вдоха и переход к выдоху. Полагают, что этот обрыв осуществляется благодаря тормозному влиянию со стороны особой группы нейронов, возбуждение которых происходит одновременно с инспираторными и усиливается под влиянием афферентной импульсации от рецепторов растяжения легких. Чем сильнее импульсация от хеморецепторов, тем круче нарастает инспираторная активность и быстрее развивается вдох, но так как при этом резче растягиваются легкие, то вдох быстрее сменяется выдохом. В итоге увеличивается и глубина, и частота дыхания.
 Обнаружено, что полному расслаблению инспираторных мышц предшествует плавное снижение их активности, обусловленное, как полагают, включением особой группы нейронов, которые оказывают тормозящее ( «запирающее» ) влияние на инспираторную и экспираторную активность. Эту фазу назвали постинспираторной. По—видимому, постинспираторная фаза обеспечивает интервалы, необходимые для опорожнения легких после очередного вдоха. Таким образом, центральный паттерн дыхания включает три фазы: инспираторную, постинспираторную и экспираторную. Нейроны, связанные с регуляцией дыхания, имеются и в мосту. Здесь выделяют так называемый пневмотаксический центр, который участвует в переключении фаз дыхательного цикла; при разрушении этого центра вдохи становятся затянутыми, необычно глубокими. Центральный дыхательный механизм продолговатого мозга обладает автоматизмом, т. е. постоянной ритмической активностью. Однако это его свойство у высших позвоночных полностью отлично от автоматии, свойственной, например, узлам проводящей системы сердца, возбуждение которых происходит в силу их внутренних свойств. Дыхательные нейроны функционируют нормально лишь при двух условиях. Первым условием является сохранность связей между их различными группами (хотя пока не установлено, какие именно нейроны являются водителями ритма, пейсмекерами, и существуют ли среди них такие пейсмекеры вообще), вторым условием — наличие афферентной стимуляции. В этом плане важнейшую роль играет импульсация, поступающая от хеморецепторов.
Обнаружено, что полному расслаблению инспираторных мышц предшествует плавное снижение их активности, обусловленное, как полагают, включением особой группы нейронов, которые оказывают тормозящее ( «запирающее» ) влияние на инспираторную и экспираторную активность. Эту фазу назвали постинспираторной. По—видимому, постинспираторная фаза обеспечивает интервалы, необходимые для опорожнения легких после очередного вдоха. Таким образом, центральный паттерн дыхания включает три фазы: инспираторную, постинспираторную и экспираторную. Нейроны, связанные с регуляцией дыхания, имеются и в мосту. Здесь выделяют так называемый пневмотаксический центр, который участвует в переключении фаз дыхательного цикла; при разрушении этого центра вдохи становятся затянутыми, необычно глубокими. Центральный дыхательный механизм продолговатого мозга обладает автоматизмом, т. е. постоянной ритмической активностью. Однако это его свойство у высших позвоночных полностью отлично от автоматии, свойственной, например, узлам проводящей системы сердца, возбуждение которых происходит в силу их внутренних свойств. Дыхательные нейроны функционируют нормально лишь при двух условиях. Первым условием является сохранность связей между их различными группами (хотя пока не установлено, какие именно нейроны являются водителями ритма, пейсмекерами, и существуют ли среди них такие пейсмекеры вообще), вторым условием — наличие афферентной стимуляции. В этом плане важнейшую роль играет импульсация, поступающая от хеморецепторов.
 Рефлекторная регуляция дыхания осуществляется благодаря тому, что нейроны дыхательного центра имеют связи с многочислен ными механорецепторами дыхательных путей и альвеол легких и рецепторов сосудистых рефлексогенных зон. В легких человека на ходятся следующие типы механорецепторов: 1) ирритантные, или быстроадаптирующиеся, рецепторы слизистой оболочки дыхательных путей; 2) рецепторы растяжения гладких мышц дыхательных путей; 3) J-рецепторы. Рефлексы со слизистой оболочки полости носа. Раздражение ирритантных рецепторов слизистой оболочки полости носа, например табачным дымом, инертными частицами пыли, газообразными веществами, водой вызывает сужение бронхов, голосовой щели, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Защитный рефлекс проявляется у новорожденных при кратковременном погружении в воду. У них возникает остановка дыхания, препятствующая проникновению воды в верхние дыха тельные пути. Рефлексы с глотки. Механическое раздражение рецепторов сли зистой оболочки задней части полости носа вызывает сильнейшее сокращение диафрагмы, наружных межреберных мышц, а следовательно, вдох, который открывает дыхательный путь через носовые ходы (аспирационный рефлекс). Этот рефлекс выражен у новорожденных. Рефлексы с гортани и трахеи. Многочисленные нервные окон чания расположены между эпителиальными клетками слизистой оболочки гортани и главных бронхов. Эти рецепторы раздражаются вдыхаемыми частицами, раздражающими газами, бронхиальным секретом, инородными телами. Все это вызывает кашлевой рефлекс, проявляющийся в резком выдохе на фоне сужения гортани и сокращение гладких мышц бронхов, которое сохраняется долгое время после рефлекса. Кашлевой рефлекс является основным легочным рефлексом блуж дающего нерва.
Рефлекторная регуляция дыхания осуществляется благодаря тому, что нейроны дыхательного центра имеют связи с многочислен ными механорецепторами дыхательных путей и альвеол легких и рецепторов сосудистых рефлексогенных зон. В легких человека на ходятся следующие типы механорецепторов: 1) ирритантные, или быстроадаптирующиеся, рецепторы слизистой оболочки дыхательных путей; 2) рецепторы растяжения гладких мышц дыхательных путей; 3) J-рецепторы. Рефлексы со слизистой оболочки полости носа. Раздражение ирритантных рецепторов слизистой оболочки полости носа, например табачным дымом, инертными частицами пыли, газообразными веществами, водой вызывает сужение бронхов, голосовой щели, брадикардию, снижение сердечного выброса, сужение просвета сосудов кожи и мышц. Защитный рефлекс проявляется у новорожденных при кратковременном погружении в воду. У них возникает остановка дыхания, препятствующая проникновению воды в верхние дыха тельные пути. Рефлексы с глотки. Механическое раздражение рецепторов сли зистой оболочки задней части полости носа вызывает сильнейшее сокращение диафрагмы, наружных межреберных мышц, а следовательно, вдох, который открывает дыхательный путь через носовые ходы (аспирационный рефлекс). Этот рефлекс выражен у новорожденных. Рефлексы с гортани и трахеи. Многочисленные нервные окон чания расположены между эпителиальными клетками слизистой оболочки гортани и главных бронхов. Эти рецепторы раздражаются вдыхаемыми частицами, раздражающими газами, бронхиальным секретом, инородными телами. Все это вызывает кашлевой рефлекс, проявляющийся в резком выдохе на фоне сужения гортани и сокращение гладких мышц бронхов, которое сохраняется долгое время после рефлекса. Кашлевой рефлекс является основным легочным рефлексом блуж дающего нерва.
 Рефлексы с рецепторов бронхиол. Многочисленные миелинизированные рецепторы находятся в эпителии внутрилегочных бронхов и бронхиол. Раздражение этих рецепторов вызывает гиперпноэ, бронхоконстрикцию, сокращение гортани, гиперсекрецию слизи, но никогда не сопровождается кашлем. Рецепторы наиболее чувстви тельны к трем типам раздражителей: 1) табачному дыму, много численным инертным и раздражающим химическим веществам; 2) повреждению и механическому растяжению дыхательных путей при глубоком дыхании, а также пневмотораксе, ателектазах, действии бронхоконстрикторов; 3) легочной эмболии, легочной капиллярной гипертензии и к легочным анафилактическим феноменам. Рефлексы с J-рецепторов. В альвеолярных перегородках в кон такте с капиллярами находятся особые J рецепторы. Эти рецепторы особенно чувствительны к интерстициальному отеку, легочной венозной гипертензии, микроэмболии, раздражающим газам и ингаляционным наркотическим веществам, фенилдигуаниду (при внут ривенном введении этого вещества). Стимуляция рецепторов вы зывает вначале J апноэ, затем поверхностное тахипноэ, гипотензию и брадикардию. Рефлекс Геринга — Брейера. Раздувание легких у наркотизи рованного животного рефлекторно тормозит вдох и вызывает выдох. Перерезка блуждающих нервов устраняет рефлекс. Нервные окон чания, расположенные в бронхиальных мышцах, играют роль рецепторов растяжения легких. Их относят к медленно адаптирующимся рецепторам растяжения легких, которые иннервируются миелинизированными волокнами блуждающего нерва.
Рефлексы с рецепторов бронхиол. Многочисленные миелинизированные рецепторы находятся в эпителии внутрилегочных бронхов и бронхиол. Раздражение этих рецепторов вызывает гиперпноэ, бронхоконстрикцию, сокращение гортани, гиперсекрецию слизи, но никогда не сопровождается кашлем. Рецепторы наиболее чувстви тельны к трем типам раздражителей: 1) табачному дыму, много численным инертным и раздражающим химическим веществам; 2) повреждению и механическому растяжению дыхательных путей при глубоком дыхании, а также пневмотораксе, ателектазах, действии бронхоконстрикторов; 3) легочной эмболии, легочной капиллярной гипертензии и к легочным анафилактическим феноменам. Рефлексы с J-рецепторов. В альвеолярных перегородках в кон такте с капиллярами находятся особые J рецепторы. Эти рецепторы особенно чувствительны к интерстициальному отеку, легочной венозной гипертензии, микроэмболии, раздражающим газам и ингаляционным наркотическим веществам, фенилдигуаниду (при внут ривенном введении этого вещества). Стимуляция рецепторов вы зывает вначале J апноэ, затем поверхностное тахипноэ, гипотензию и брадикардию. Рефлекс Геринга — Брейера. Раздувание легких у наркотизи рованного животного рефлекторно тормозит вдох и вызывает выдох. Перерезка блуждающих нервов устраняет рефлекс. Нервные окон чания, расположенные в бронхиальных мышцах, играют роль рецепторов растяжения легких. Их относят к медленно адаптирующимся рецепторам растяжения легких, которые иннервируются миелинизированными волокнами блуждающего нерва.
 Рефлекс Геринга — Брейера контролирует глубину и частоту дыхания. У человека он имеет физиологическое значение при ды хательных объемах свыше 1 л (например, при физической нагрузке). У бодрствующего взрослого человека кратковременная двусторонняя блокада блуждающих нервов с помощью местной анестезии не влияет ни на глубину, ни на частоту дыхания. У новорожденных рефлекс Геринга — Брейера четко проявляется только в первые 3— 4 дня после рождения. Проприоцептивный контроль дыхания. Рецепторы суставов груд ной клетки посылают импульсы в кору больших полушарий и являются единственным источником информации о движениях груд ной клетки и дыхательных объемах. Межреберные мышцы, в меньшей степени диафрагма, содержат большое количество мышечных веретен. Активность этих рецепторов проявляется при пассивном растяжении мышц, изометрическом со кращении и изолированном сокращении интрафузальных мышечных волокон. Рецепторы посылают сигналы в соответствующие сегменты спинного мозга. Недостаточное укорочение инспираторных или экс пираторных мышц усиливает импульсацию от мышечных веретен, которые через γ мотонейроны повышают активность α мотонейронов и дозируют таким образом мышечное усилие.
Рефлекс Геринга — Брейера контролирует глубину и частоту дыхания. У человека он имеет физиологическое значение при ды хательных объемах свыше 1 л (например, при физической нагрузке). У бодрствующего взрослого человека кратковременная двусторонняя блокада блуждающих нервов с помощью местной анестезии не влияет ни на глубину, ни на частоту дыхания. У новорожденных рефлекс Геринга — Брейера четко проявляется только в первые 3— 4 дня после рождения. Проприоцептивный контроль дыхания. Рецепторы суставов груд ной клетки посылают импульсы в кору больших полушарий и являются единственным источником информации о движениях груд ной клетки и дыхательных объемах. Межреберные мышцы, в меньшей степени диафрагма, содержат большое количество мышечных веретен. Активность этих рецепторов проявляется при пассивном растяжении мышц, изометрическом со кращении и изолированном сокращении интрафузальных мышечных волокон. Рецепторы посылают сигналы в соответствующие сегменты спинного мозга. Недостаточное укорочение инспираторных или экс пираторных мышц усиливает импульсацию от мышечных веретен, которые через γ мотонейроны повышают активность α мотонейронов и дозируют таким образом мышечное усилие.
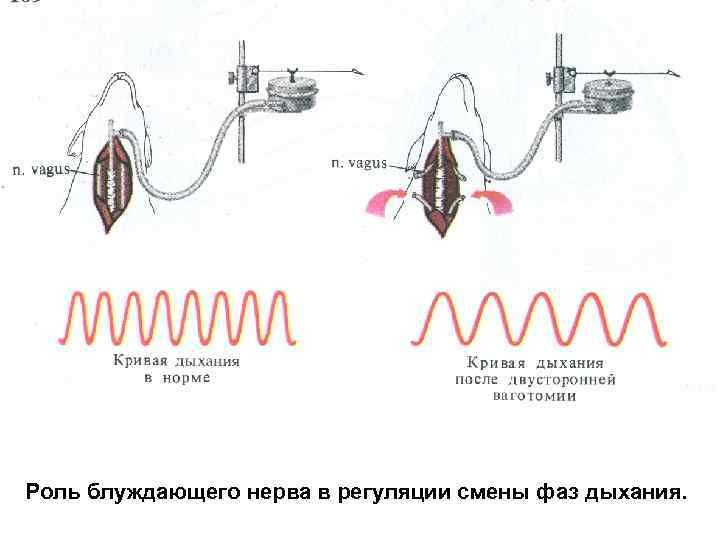 Роль блуждающего нерва в регуляции смены фаз дыхания.
Роль блуждающего нерва в регуляции смены фаз дыхания.
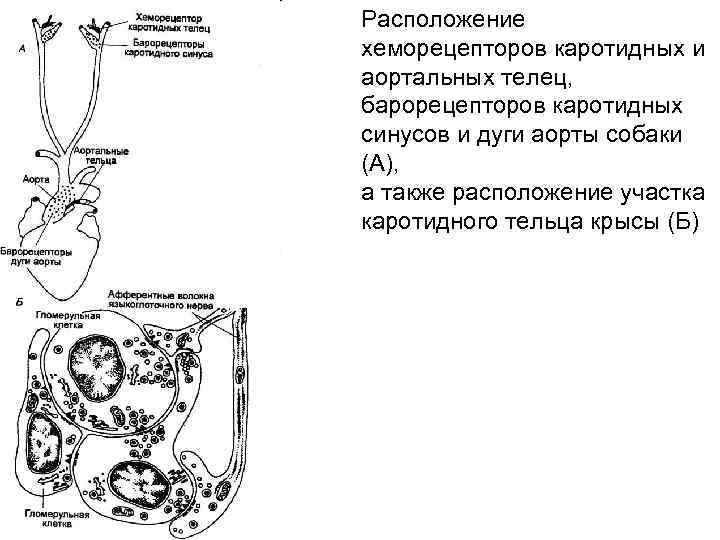 Расположение хеморецепторов каротидных и аортальных телец, барорецепторов каротидных синусов и дуги аорты собаки (А), а также расположение участка каротидного тельца крысы (Б)
Расположение хеморецепторов каротидных и аортальных телец, барорецепторов каротидных синусов и дуги аорты собаки (А), а также расположение участка каротидного тельца крысы (Б)
 Хеморефлексы дыхания. Рo 2 и Рсо 2 в артериальной крови человека и животных поддерживается на достаточно стабильном уровне, несмотря на значительные изменения потребления О 2 и выделение СО 2. Гипоксия и понижение р. Н крови (ацидоз) вызывают усиление вентиляции (гипервентиляция), а гипероксия и повышение р. Н крови (алкалоз) — понижение вентиляции (гиповентиляция) или апноэ. Контроль за нормальным содержанием во внутренней среде организма О 2, СО 2 и р. Н осуществляется периферическими и центральными хеморецепторами. Адекватным раздражителем для периферических хеморецепторов является уменьшение Ро 2 артериальной крови, в меньшей степени увеличение Рco 2 и р. Н, а для центральных хеморецепторов — увеличение концентрации Н+ во внеклеточной жидкости мозга. Артериальные (периферические) хеморецепторы. Периферические хеморецепторы находятся в каротидных и аортальных тельцах. Сигналы от артериальных хеморецепторов по синокаротидным и аортальным нервам первоначально поступают к нейронам ядра одиночного пучка продолговатого мозга, а затем переключаются на нейроны дыхательного центра. Ответ периферических хеморецепторов на понижение Рао 2 является очень быстрым, но нелинейным. При Рао 2 в пределах 80— 60 мм рт. ст. (10, 6— 8, 0 к. Па) наблюдается слабое усиление вентиляции, а при Раo 2 ниже 50 мм рт. ст. (6, 7 к. Па) возникает выраженная гипервентиляция. Рaсо 2 и p. Н крови только потенцируют эффект гипоксии на артериальные хеморецепторы и не являются адекватными раздра жителями для этого типа хеморецепторов дыхания.
Хеморефлексы дыхания. Рo 2 и Рсо 2 в артериальной крови человека и животных поддерживается на достаточно стабильном уровне, несмотря на значительные изменения потребления О 2 и выделение СО 2. Гипоксия и понижение р. Н крови (ацидоз) вызывают усиление вентиляции (гипервентиляция), а гипероксия и повышение р. Н крови (алкалоз) — понижение вентиляции (гиповентиляция) или апноэ. Контроль за нормальным содержанием во внутренней среде организма О 2, СО 2 и р. Н осуществляется периферическими и центральными хеморецепторами. Адекватным раздражителем для периферических хеморецепторов является уменьшение Ро 2 артериальной крови, в меньшей степени увеличение Рco 2 и р. Н, а для центральных хеморецепторов — увеличение концентрации Н+ во внеклеточной жидкости мозга. Артериальные (периферические) хеморецепторы. Периферические хеморецепторы находятся в каротидных и аортальных тельцах. Сигналы от артериальных хеморецепторов по синокаротидным и аортальным нервам первоначально поступают к нейронам ядра одиночного пучка продолговатого мозга, а затем переключаются на нейроны дыхательного центра. Ответ периферических хеморецепторов на понижение Рао 2 является очень быстрым, но нелинейным. При Рао 2 в пределах 80— 60 мм рт. ст. (10, 6— 8, 0 к. Па) наблюдается слабое усиление вентиляции, а при Раo 2 ниже 50 мм рт. ст. (6, 7 к. Па) возникает выраженная гипервентиляция. Рaсо 2 и p. Н крови только потенцируют эффект гипоксии на артериальные хеморецепторы и не являются адекватными раздра жителями для этого типа хеморецепторов дыхания.
 Реакция артериальных хеморецепторов и дыхания на гипоксию. Недостаток О 2 в артериальной крови является основным раздражителем периферических хеморецепторов. Импульсная активность в афферентных волокнах синокаротидного нерва прекращается при Рао 2 выше 400 мм рт. ст. (53, 2 к. Па). При нормоксии частота разрядов синокаротидного нерва составляет 10% от их максимальной реакции, которая наблюдается при Раo 2 около 50 мм рт. ст. и ниже. Гипоксическая реакция дыхания практически отсутствует у коренных жителей высокогорья и исчезает примерно через 5 лет у жителей равнин после начала их адаптации к высокогорью (3500 м и выше). Центральные хеморецепторы. Окончательно не уста новлено местоположение центральных хеморецепторов. Исследователи считают, что такие хеморецепторы находятся в ростральных отделах продолговатого мозга вблизи его вентральной поверхности, а также в различных зонах дорсального дыхательного ядра. Наличие центральных хеморецепторов доказывается достаточно просто: после перерезки синокаротидных и аортальных нервов у подопытных животных исчезает чувствительность дыхательного центра к гипоксии, но полностью сохраняется реакция дыхания на гиперкапнию и ацидоз. Перерезка ствола мозга непосредственно выше продолговатого мозга не влияет на характер этой реакции. Адекватным раздражителем для центральных хеморецепторов является изменение концентрации Н* во внеклеточной жидкости мозга. Функцию регулятора пороговых сдвигов р. Н в области цен тральных хеморецепторов выполняют структуры гематоэнцефалического барьера, который отделяет кровь от внеклеточной жидкости мозга. Через этот барьер осуществляется транспорт О 2, СО 2 и Н+ между кровью и внеклеточной жидкостью мозга. Транспорт СО 2 и Н+ из внутренней среды мозга в плазму крови через структуры гематоэнцефалического барьера регулируется с участием фермента карбоангидразы.
Реакция артериальных хеморецепторов и дыхания на гипоксию. Недостаток О 2 в артериальной крови является основным раздражителем периферических хеморецепторов. Импульсная активность в афферентных волокнах синокаротидного нерва прекращается при Рао 2 выше 400 мм рт. ст. (53, 2 к. Па). При нормоксии частота разрядов синокаротидного нерва составляет 10% от их максимальной реакции, которая наблюдается при Раo 2 около 50 мм рт. ст. и ниже. Гипоксическая реакция дыхания практически отсутствует у коренных жителей высокогорья и исчезает примерно через 5 лет у жителей равнин после начала их адаптации к высокогорью (3500 м и выше). Центральные хеморецепторы. Окончательно не уста новлено местоположение центральных хеморецепторов. Исследователи считают, что такие хеморецепторы находятся в ростральных отделах продолговатого мозга вблизи его вентральной поверхности, а также в различных зонах дорсального дыхательного ядра. Наличие центральных хеморецепторов доказывается достаточно просто: после перерезки синокаротидных и аортальных нервов у подопытных животных исчезает чувствительность дыхательного центра к гипоксии, но полностью сохраняется реакция дыхания на гиперкапнию и ацидоз. Перерезка ствола мозга непосредственно выше продолговатого мозга не влияет на характер этой реакции. Адекватным раздражителем для центральных хеморецепторов является изменение концентрации Н* во внеклеточной жидкости мозга. Функцию регулятора пороговых сдвигов р. Н в области цен тральных хеморецепторов выполняют структуры гематоэнцефалического барьера, который отделяет кровь от внеклеточной жидкости мозга. Через этот барьер осуществляется транспорт О 2, СО 2 и Н+ между кровью и внеклеточной жидкостью мозга. Транспорт СО 2 и Н+ из внутренней среды мозга в плазму крови через структуры гематоэнцефалического барьера регулируется с участием фермента карбоангидразы.
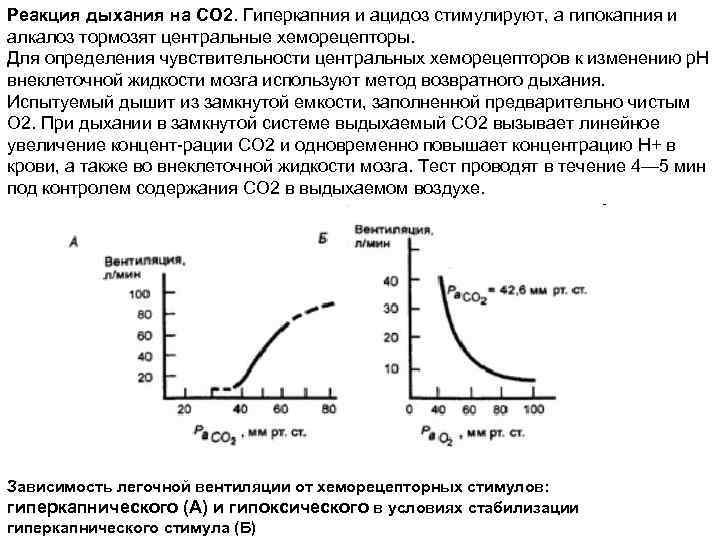 Реакция дыхания на СО 2. Гиперкапния и ацидоз стимулируют, а гипокапния и алкалоз тормозят центральные хеморецепторы. Для определения чувствительности центральных хеморецепторов к изменению р. Н внеклеточной жидкости мозга используют метод возвратного дыхания. Испытуемый дышит из замкнутой емкости, заполненной предварительно чистым О 2. При дыхании в замкнутой системе выдыхаемый СО 2 вызывает линейное увеличение концент рации СО 2 и одновременно повышает концентрацию Н+ в крови, а также во внеклеточной жидкости мозга. Тест проводят в течение 4— 5 мин под контролем содержания СО 2 в выдыхаемом воздухе. Зависимость легочной вентиляции от хеморецепторных стимулов: гиперкапнического (А) и гипоксического в условиях стабилизации гиперкапнического стимула (Б)
Реакция дыхания на СО 2. Гиперкапния и ацидоз стимулируют, а гипокапния и алкалоз тормозят центральные хеморецепторы. Для определения чувствительности центральных хеморецепторов к изменению р. Н внеклеточной жидкости мозга используют метод возвратного дыхания. Испытуемый дышит из замкнутой емкости, заполненной предварительно чистым О 2. При дыхании в замкнутой системе выдыхаемый СО 2 вызывает линейное увеличение концент рации СО 2 и одновременно повышает концентрацию Н+ в крови, а также во внеклеточной жидкости мозга. Тест проводят в течение 4— 5 мин под контролем содержания СО 2 в выдыхаемом воздухе. Зависимость легочной вентиляции от хеморецепторных стимулов: гиперкапнического (А) и гипоксического в условиях стабилизации гиперкапнического стимула (Б)
 Пневмограмма человека при гипокапнии (а) и гиперкапнии (б) а б
Пневмограмма человека при гипокапнии (а) и гиперкапнии (б) а б
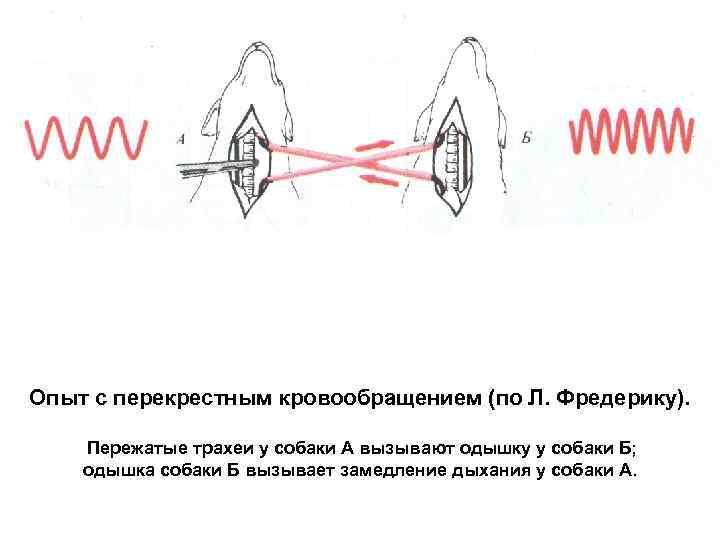 Опыт с перекрестным кровообращением (по Л. Фредерику). Пережатые трахеи у собаки А вызывают одышку у собаки Б; одышка собаки Б вызывает замедление дыхания у собаки А.
Опыт с перекрестным кровообращением (по Л. Фредерику). Пережатые трахеи у собаки А вызывают одышку у собаки Б; одышка собаки Б вызывает замедление дыхания у собаки А.
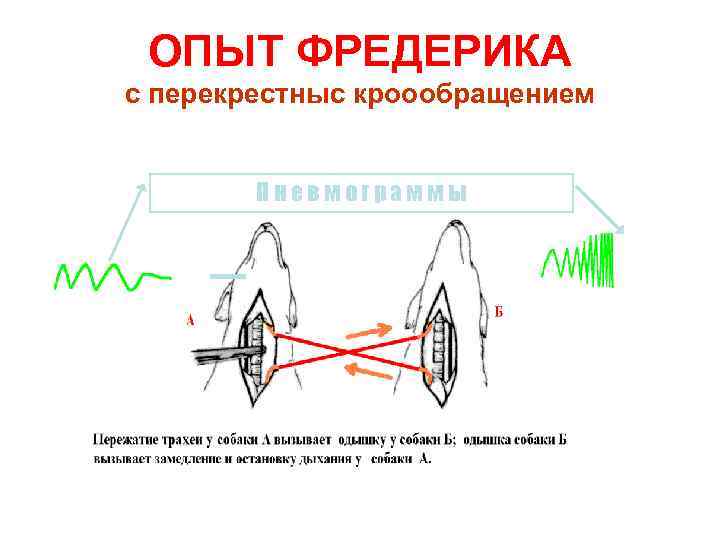 ОПЫТ ФРЕДЕРИКА с перекрестныс кроообращением Пневмограммы
ОПЫТ ФРЕДЕРИКА с перекрестныс кроообращением Пневмограммы
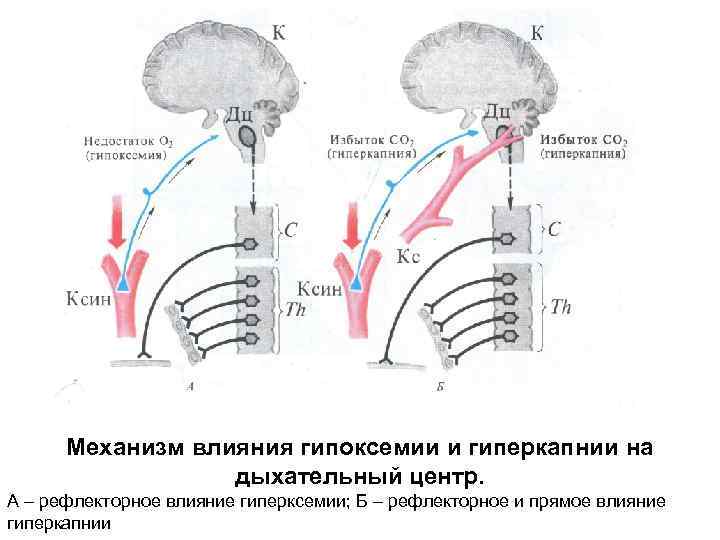 Механизм влияния гипоксемии и гиперкапнии на дыхательный центр. А – рефлекторное влияние гиперксемии; Б – рефлекторное и прямое влияние гиперкапнии
Механизм влияния гипоксемии и гиперкапнии на дыхательный центр. А – рефлекторное влияние гиперксемии; Б – рефлекторное и прямое влияние гиперкапнии
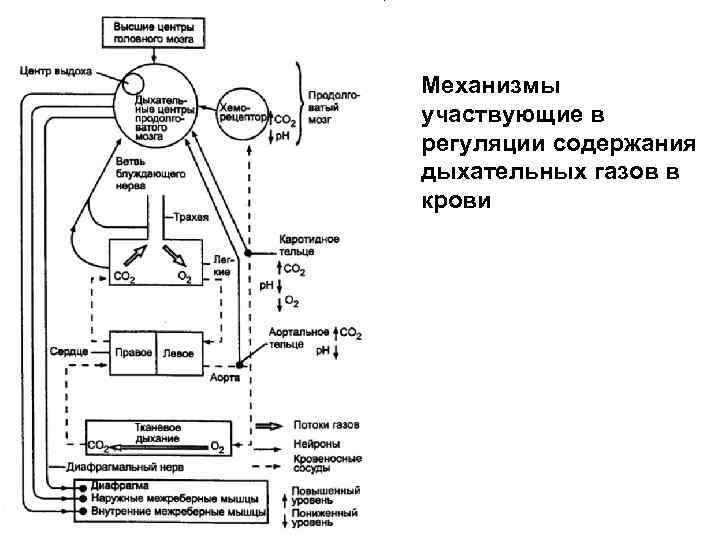 Механизмы участвующие в регуляции содержания дыхательных газов в крови
Механизмы участвующие в регуляции содержания дыхательных газов в крови
 ДЫХАНИЕ ПРИ РАЗЛИЧНЫХ ФУНКЦИОНАЛЬНЫХ СОСТОЯНИЯХ И УСЛОВИЯХ ОБИТАНИЯ ОРГАНИЗМА Функция дыхания отличается большой подвижностью. Она быстро и точно адаптируется к меняющимся энерготратам организма, обусловленным прежде всего двигательной активностью. Индивидуальные особенности дыхания зависят от возраста, функционального состояния, образа жизни, ряда факторов среды.
ДЫХАНИЕ ПРИ РАЗЛИЧНЫХ ФУНКЦИОНАЛЬНЫХ СОСТОЯНИЯХ И УСЛОВИЯХ ОБИТАНИЯ ОРГАНИЗМА Функция дыхания отличается большой подвижностью. Она быстро и точно адаптируется к меняющимся энерготратам организма, обусловленным прежде всего двигательной активностью. Индивидуальные особенности дыхания зависят от возраста, функционального состояния, образа жизни, ряда факторов среды.
 Дыхание в онтогенезе В период внутриутробной жизни артериализация крови плода осуществляется через плаценту, но первые дыхательные движения возникают уже на определенной стадии внутриутробного развития (у плода человека с 2— 3 мес), хотя воздухоносные пути эмбриона еще заполнены жидкостью, а легкие находятся в спавшемся состоянии. Постепенно эти движения становятся все более регулярными, но незадолго до родов прекращаются. После рождения первый вдох (первый крик) происходит в момент пережатия пуповины — очевидно, вследствие резкой стимуляции хеморецепторов благодаря быстрому накоплению в крови CO 2 и убыли О 2. Большое значение при этом имеют тактильные и температурные раздражители, повышающие активность ЦНС, в том числе активность центрального дыхательного механизма. Вначале дыхание новорожденного носит характер судорожных вдохов: грудная клетка и легкие принимают расправленное состояние, в плевральной полости образуется отрицательное давление, из воздухоносных путей удаляется жидкость. Затем устанавливаются ритмичные дыхательные движения, нормализуются газовый состав и кислотно—основное состояние крови.
Дыхание в онтогенезе В период внутриутробной жизни артериализация крови плода осуществляется через плаценту, но первые дыхательные движения возникают уже на определенной стадии внутриутробного развития (у плода человека с 2— 3 мес), хотя воздухоносные пути эмбриона еще заполнены жидкостью, а легкие находятся в спавшемся состоянии. Постепенно эти движения становятся все более регулярными, но незадолго до родов прекращаются. После рождения первый вдох (первый крик) происходит в момент пережатия пуповины — очевидно, вследствие резкой стимуляции хеморецепторов благодаря быстрому накоплению в крови CO 2 и убыли О 2. Большое значение при этом имеют тактильные и температурные раздражители, повышающие активность ЦНС, в том числе активность центрального дыхательного механизма. Вначале дыхание новорожденного носит характер судорожных вдохов: грудная клетка и легкие принимают расправленное состояние, в плевральной полости образуется отрицательное давление, из воздухоносных путей удаляется жидкость. Затем устанавливаются ритмичные дыхательные движения, нормализуются газовый состав и кислотно—основное состояние крови.
 Влияние уровня бодрствования Ядра, входящие в состав центрального дыхательного механизма, располагаются в структурах ретикулярной системы мозга, поэтому активность дыхательного центра тесно связана с так называемым уровнем бодрствования, т. е. с общим функциональным состоянием ЦНС. Отсюда — подверженность дыхания влияниям эмоционального, стрессорного характера. По той же причине во время сна наступает некоторое снижение легочной вентиляции, которое, видимо, обусловлено ослаблением возбудимости центральных хемочувствительных структур. Незрелость этих структур у новорожденных может проявляться в остановке дыхания во сне (апноэ), даже необратимой. Сонное апноэ наблюдается и у пожилых людей, причем оно может сопровождаться спадением (обструкцией) верхних дыхательных путей из—за нарушения регуляции их мускулатуры, что проявляется в храпении. Нередко наблюдается так называемое периодическое дыхание, характерное для всех случаев ослабленной возбудимости бульбарных хеморецепторов и самого дыхательного центра: дыхательные движения время от времени ослабевают вплоть до полной их остановки, затем (в основном в связи с накоплением в крови СО 2 и усилением хеморецепторной стимуляции) усиливаются, после чего (по мере вымывания СО 2 через легкие) вновь затухают. Угнетающее влияние на активность дыхательного центра оказывает наркоз, например введение морфина. Подобным же действием обладают эндогенные опиоиды — энкефалины, эндорфины. По—видимому, это связано с участием нейропептидов в регуляции дыхания. Действительно, такие агенты, как тиреолиберин (тиреотропин—рилизинг— гормон) и субстанция Р, напротив, повышают активность дыхательных нейронов.
Влияние уровня бодрствования Ядра, входящие в состав центрального дыхательного механизма, располагаются в структурах ретикулярной системы мозга, поэтому активность дыхательного центра тесно связана с так называемым уровнем бодрствования, т. е. с общим функциональным состоянием ЦНС. Отсюда — подверженность дыхания влияниям эмоционального, стрессорного характера. По той же причине во время сна наступает некоторое снижение легочной вентиляции, которое, видимо, обусловлено ослаблением возбудимости центральных хемочувствительных структур. Незрелость этих структур у новорожденных может проявляться в остановке дыхания во сне (апноэ), даже необратимой. Сонное апноэ наблюдается и у пожилых людей, причем оно может сопровождаться спадением (обструкцией) верхних дыхательных путей из—за нарушения регуляции их мускулатуры, что проявляется в храпении. Нередко наблюдается так называемое периодическое дыхание, характерное для всех случаев ослабленной возбудимости бульбарных хеморецепторов и самого дыхательного центра: дыхательные движения время от времени ослабевают вплоть до полной их остановки, затем (в основном в связи с накоплением в крови СО 2 и усилением хеморецепторной стимуляции) усиливаются, после чего (по мере вымывания СО 2 через легкие) вновь затухают. Угнетающее влияние на активность дыхательного центра оказывает наркоз, например введение морфина. Подобным же действием обладают эндогенные опиоиды — энкефалины, эндорфины. По—видимому, это связано с участием нейропептидов в регуляции дыхания. Действительно, такие агенты, как тиреолиберин (тиреотропин—рилизинг— гормон) и субстанция Р, напротив, повышают активность дыхательных нейронов.
 Эмоциональные и стрессорные факторы О роли супрапонтинных структур и, в частности, коры мозга в ответах дыхания на влияния, исходящие из внутренней и внешней среды, уже говорилось. К этому следует добавить, что непосредственное участие в реакциях, связанных чаще всего с повышением «уровня бодрствования» , принимают нейрональные структуры ретикулярной формации ствола мозга и гормональная система. Дыхательная активность тормозится при «затаивании» , боли и, напротив, повышается в связи с предстоящей мышечной деятельностью. Дыхательные реакции в ответ на эмоциональные факторы особенно ярко выражены у человека. Они носят разнообразный характер. Для интеллектуально—эмоционального напряжения наиболее характерно тахипноэ — частое но поверхностное дыхание. В стрессорных состояниях подобного рода реакции могут перерастать в гипервентиляцию легких, которая иногда приобретает характер своеобразного «дыхательного невроза» (гипервентиляционный синдром). В свою очередь, гипервентиляция сопровождается гипокапнией, респираторным алкалозом и может повлечь за собой нарушение центрального кровообращения (вплоть до потери сознания) и другие неблагоприятные реакции, осложняющие стрессорное состояние.
Эмоциональные и стрессорные факторы О роли супрапонтинных структур и, в частности, коры мозга в ответах дыхания на влияния, исходящие из внутренней и внешней среды, уже говорилось. К этому следует добавить, что непосредственное участие в реакциях, связанных чаще всего с повышением «уровня бодрствования» , принимают нейрональные структуры ретикулярной формации ствола мозга и гормональная система. Дыхательная активность тормозится при «затаивании» , боли и, напротив, повышается в связи с предстоящей мышечной деятельностью. Дыхательные реакции в ответ на эмоциональные факторы особенно ярко выражены у человека. Они носят разнообразный характер. Для интеллектуально—эмоционального напряжения наиболее характерно тахипноэ — частое но поверхностное дыхание. В стрессорных состояниях подобного рода реакции могут перерастать в гипервентиляцию легких, которая иногда приобретает характер своеобразного «дыхательного невроза» (гипервентиляционный синдром). В свою очередь, гипервентиляция сопровождается гипокапнией, респираторным алкалозом и может повлечь за собой нарушение центрального кровообращения (вплоть до потери сознания) и другие неблагоприятные реакции, осложняющие стрессорное состояние.
 Мышечная деятельность служит наиболее сильным естественным стимулом дыхания. Как только включается мышечная нагрузка, легочная вентиляция возрастает за счет углубления и учащения дыхания — сначала скачкообразно, затем более плавно. Этот быстрый компонент дыхательной реакции на работу объясняется главным образом нейрогенными факторами. Это прежде всего исходящие из сенсомоторной коры команды к работающим мышцам, иррадиирующие, как полагают, и на дыхательный центр. Известно, что уже команда «Приготовиться!» вызывает у спортсмена подъем вентиляции. Кроме того, дыхание стимулируется афферентной импульсацией, поступающей в ЦНС из проприоцепторов работающих мышц: у человека и у животных пассивные, выполняемые экспериментатором движения конечностей либо стимуляция мышц щипанием или вибрацией сопровождаются скачком вентиляции. Предполагают, что в стимуляции дыхания здесь участвует и выброс в кровь катехоламинов, сопутствующий повышению активности симпатической нервной системы. Через 3— 4 мин работы с умеренной нагрузкой наступает устойчивое состояние, при котором уровень легочной вентиляции достигает плато. Этот уровень, как правило, соответствует потреблению кислорода, а следовательно, энерготратам организма при данной нагрузке.
Мышечная деятельность служит наиболее сильным естественным стимулом дыхания. Как только включается мышечная нагрузка, легочная вентиляция возрастает за счет углубления и учащения дыхания — сначала скачкообразно, затем более плавно. Этот быстрый компонент дыхательной реакции на работу объясняется главным образом нейрогенными факторами. Это прежде всего исходящие из сенсомоторной коры команды к работающим мышцам, иррадиирующие, как полагают, и на дыхательный центр. Известно, что уже команда «Приготовиться!» вызывает у спортсмена подъем вентиляции. Кроме того, дыхание стимулируется афферентной импульсацией, поступающей в ЦНС из проприоцепторов работающих мышц: у человека и у животных пассивные, выполняемые экспериментатором движения конечностей либо стимуляция мышц щипанием или вибрацией сопровождаются скачком вентиляции. Предполагают, что в стимуляции дыхания здесь участвует и выброс в кровь катехоламинов, сопутствующий повышению активности симпатической нервной системы. Через 3— 4 мин работы с умеренной нагрузкой наступает устойчивое состояние, при котором уровень легочной вентиляции достигает плато. Этот уровень, как правило, соответствует потреблению кислорода, а следовательно, энерготратам организма при данной нагрузке.
 Механизмы точного сопряжения уровней вентиляции и газообмена во время работы сложны и еще не вполне изучены. Во всяком случае, кроме упомянутых нейрогенных, особенно кортикальных, влияний большое значение имеет обратная связь через хеморецепторы. Так, если вентиляция отстает от уровня газообмена, в крови появляется избыток СО 2 и других кислых продуктов метаболизма работающих мышц и одновременно падает напряжение 02. Усиленная импульсация от хеморецепторов дополнительно стимулирует активность центрального механизма, в результате чего наступает компенсаторный рост вентиляции. Тем самым обеспечивается сохранение более или менее нормального газового состава и кислотно—основного состояния крови во время работы. При тяжелой нагрузке (свыше так называемого анаэробного порога) за счет отставания кислородного снабжения мышц кровь наводняется большим количеством продуктов анаэробного гликолиза (главным образом лактатом), которые стимулируют хеморецепторы, вызывая рост вентиляции, опережающий потребление О 2 и продукцию С 02; наряду с метаболическим ацидозом при этом создается гипокапния — развивается дыхательный алкалоз.
Механизмы точного сопряжения уровней вентиляции и газообмена во время работы сложны и еще не вполне изучены. Во всяком случае, кроме упомянутых нейрогенных, особенно кортикальных, влияний большое значение имеет обратная связь через хеморецепторы. Так, если вентиляция отстает от уровня газообмена, в крови появляется избыток СО 2 и других кислых продуктов метаболизма работающих мышц и одновременно падает напряжение 02. Усиленная импульсация от хеморецепторов дополнительно стимулирует активность центрального механизма, в результате чего наступает компенсаторный рост вентиляции. Тем самым обеспечивается сохранение более или менее нормального газового состава и кислотно—основного состояния крови во время работы. При тяжелой нагрузке (свыше так называемого анаэробного порога) за счет отставания кислородного снабжения мышц кровь наводняется большим количеством продуктов анаэробного гликолиза (главным образом лактатом), которые стимулируют хеморецепторы, вызывая рост вентиляции, опережающий потребление О 2 и продукцию С 02; наряду с метаболическим ацидозом при этом создается гипокапния — развивается дыхательный алкалоз.
 Очень тяжелая работа может потребовать столь интенсивной доставки кислорода, которую не в состоянии обеспечить газотранспортная система организма. Такая работа (например, спринтерский бег) может продолжаться лишь короткое время (несколько секунд) за счет использования анаэробных источников энергии и кислорода, запасенного в миоглобине. Максимальное потребление кислорода (так называемая аэробная производительность) у человека составляет обычно 2— 3 л/мин. При этом максимальный объем вентиляции во время интенсивной работы может достигать 100— 120 л/мин, т. е. в 10— 15 раз превышать уровень вентиляции в покое. Более высокий минутный объем дыхания был бы энергетически невыгоден, так как весь дополнительно поглощаемый в легких кислород уходил бы на обеспечение колоссально усиленной работы дыхательных мышц. После окончания работы легочная вентиляция круто падает благодаря выключению нейрогенных стимулов. Однако ее уровень в течение более или менее продолжительного (в зависимости от тяжести предшествовавшей работы) восстановительного периода остается повышенным. В этот период хеморецепторы стимулируются циркулирующими в крови недоокисленными продуктами обмена. Это молочная и другие органические кислоты. Происходит постепенное погашение образовавшегося кислородного долга, т. е. разности между общим количеством О 2, требуемым для покрытия всех энерготрат (кислородного запроса), и того его количества, которое было фактически потреблено за время работы.
Очень тяжелая работа может потребовать столь интенсивной доставки кислорода, которую не в состоянии обеспечить газотранспортная система организма. Такая работа (например, спринтерский бег) может продолжаться лишь короткое время (несколько секунд) за счет использования анаэробных источников энергии и кислорода, запасенного в миоглобине. Максимальное потребление кислорода (так называемая аэробная производительность) у человека составляет обычно 2— 3 л/мин. При этом максимальный объем вентиляции во время интенсивной работы может достигать 100— 120 л/мин, т. е. в 10— 15 раз превышать уровень вентиляции в покое. Более высокий минутный объем дыхания был бы энергетически невыгоден, так как весь дополнительно поглощаемый в легких кислород уходил бы на обеспечение колоссально усиленной работы дыхательных мышц. После окончания работы легочная вентиляция круто падает благодаря выключению нейрогенных стимулов. Однако ее уровень в течение более или менее продолжительного (в зависимости от тяжести предшествовавшей работы) восстановительного периода остается повышенным. В этот период хеморецепторы стимулируются циркулирующими в крови недоокисленными продуктами обмена. Это молочная и другие органические кислоты. Происходит постепенное погашение образовавшегося кислородного долга, т. е. разности между общим количеством О 2, требуемым для покрытия всех энерготрат (кислородного запроса), и того его количества, которое было фактически потреблено за время работы.
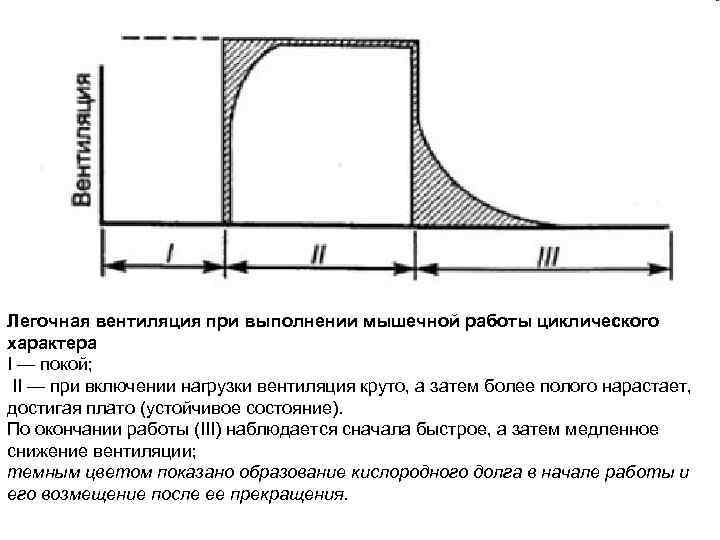 Легочная вентиляция при выполнении мышечной работы циклического характера I — покой; II — при включении нагрузки вентиляция круто, а затем более полого нарастает, достигая плато (устойчивое состояние). По окончании работы (III) наблюдается сначала быстрое, а затем медленное снижение вентиляции; темным цветом показано образование кислородного долга в начале работы и его возмещение после ее прекращения.
Легочная вентиляция при выполнении мышечной работы циклического характера I — покой; II — при включении нагрузки вентиляция круто, а затем более полого нарастает, достигая плато (устойчивое состояние). По окончании работы (III) наблюдается сначала быстрое, а затем медленное снижение вентиляции; темным цветом показано образование кислородного долга в начале работы и его возмещение после ее прекращения.
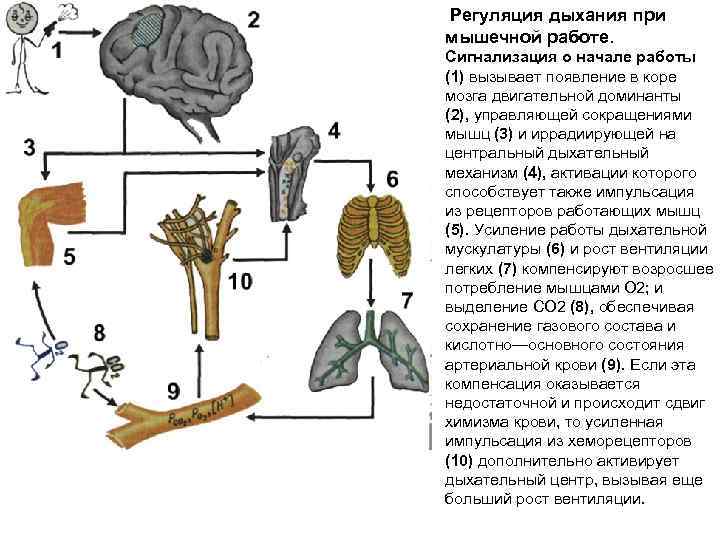 Регуляция дыхания при мышечной работе. Сигнализация о начале работы (1) вызывает появление в коре мозга двигательной доминанты (2), управляющей сокращениями мышц (3) и иррадиирующей на центральный дыхательный механизм (4), активации которого способствует также импульсация из рецепторов работающих мышц (5). Усиление работы дыхательной мускулатуры (6) и рост вентиляции легких (7) компенсируют возросшее потребление мышцами О 2; и выделение СО 2 (8), обеспечивая сохранение газового состава и кислотно—основного состояния артериальной крови (9). Если эта компенсация оказывается недостаточной и происходит сдвиг химизма крови, то усиленная импульсация из хеморецепторов (10) дополнительно активирует дыхательный центр, вызывая еще больший рост вентиляции.
Регуляция дыхания при мышечной работе. Сигнализация о начале работы (1) вызывает появление в коре мозга двигательной доминанты (2), управляющей сокращениями мышц (3) и иррадиирующей на центральный дыхательный механизм (4), активации которого способствует также импульсация из рецепторов работающих мышц (5). Усиление работы дыхательной мускулатуры (6) и рост вентиляции легких (7) компенсируют возросшее потребление мышцами О 2; и выделение СО 2 (8), обеспечивая сохранение газового состава и кислотно—основного состояния артериальной крови (9). Если эта компенсация оказывается недостаточной и происходит сдвиг химизма крови, то усиленная импульсация из хеморецепторов (10) дополнительно активирует дыхательный центр, вызывая еще больший рост вентиляции.
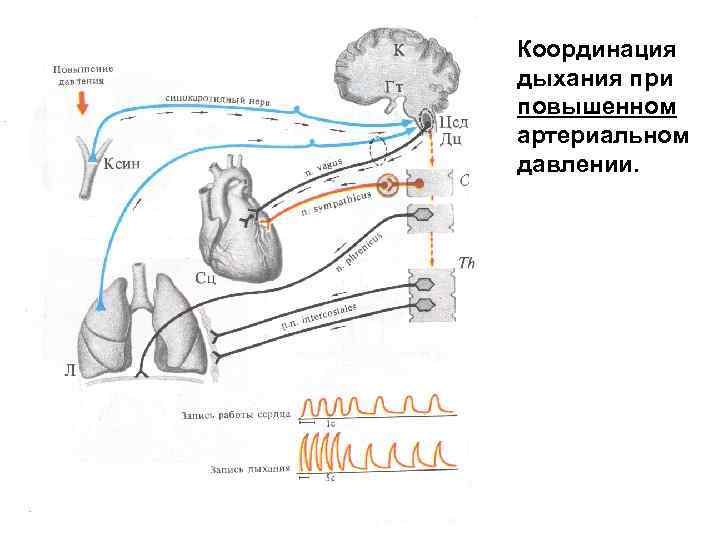 Координация дыхания при повышенном артериальном давлении.
Координация дыхания при повышенном артериальном давлении.
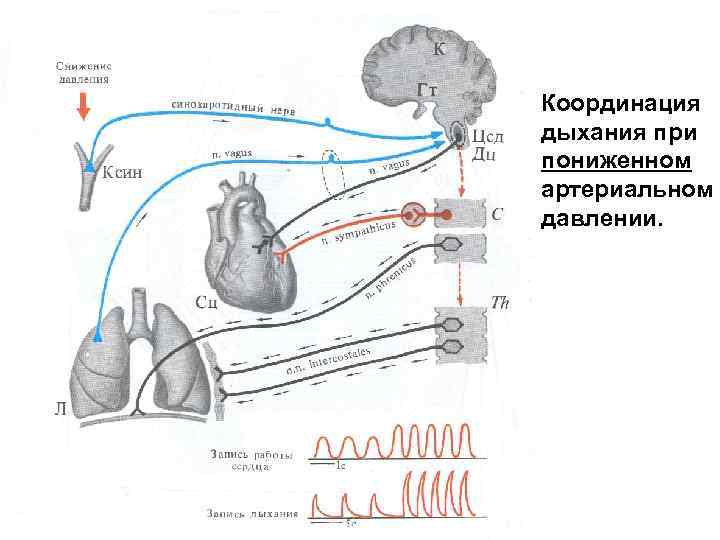 Координация дыхания при пониженном артериальном давлении.
Координация дыхания при пониженном артериальном давлении.
 Измененная газовая среда Высокогорье. Пребывание на больших высотах (его имитируют, помещая объект исследования в камеру, где создают эквивалентное разрежение воздуха) сопряжено со снижением парциального давления кислорода во вдыхаемом воздухе и альвеолярном газе. Так, на высоте 4 км над уровнем моря атмосферное Ро 2 уменьшается до 98 мм рт. ст. , альвеолярное Ро 2 — до 60 мм рт. ст. , т. е. более чем в 1, 5 раза по сравнению с «земным» . При этом у человека могут наступать недостаточность кислородного снабжения организма, особенно мозга, и явления горной (высотной) болезни: одышка и ряд нарушений функций ЦНС (головная боль, бессонница, тошнота). Под влиянием гипоксии спазмируются легочные сосуды, может развиться гипертензия малого круга кровообращения и даже отек легких. Индивидуальная устойчивость человека к высотной гипоксии весьма вариабельна и в известной мере зависит от его тренированности. Однако высоту около 7— 8 км, где атмосферное и альвеолярное Po 2 падают примерно втрое, считают предельно переносимой для человека, если он не дышит газовой смесью, обогащенной кислородом. Важно, что гипоксия вызывает нарушения со стороны психики: расстройство координации, эйфорию, утрату самоконтроля и потерю сознания, которая может наступить совершенно внезапно, приводя в конечном счете человека к гибели. Эти данные относятся главным образом к условиям восхождения человека в горы, так как в обитаемых кабинах современных летательных аппаратов поддерживают парциальное давление О 2, близкое к наземному. Вместе с тем под влиянием гипоксии включаются компенсаторные физиологические механизмы. Первым их звеном является рефлекторное увеличение легочной вентиляции, обусловленное стимуляцией хеморецепторов синокаротидной и отчасти аортальной зон. Одновременно возрастают частота сердечных сокращений и минутный объем крови. В результате утилизация кислорода при сниженном его парциальном давлении в атмосфере осуществляется за счет уменьшения диффузионных градиентов в газотранспортной системе.
Измененная газовая среда Высокогорье. Пребывание на больших высотах (его имитируют, помещая объект исследования в камеру, где создают эквивалентное разрежение воздуха) сопряжено со снижением парциального давления кислорода во вдыхаемом воздухе и альвеолярном газе. Так, на высоте 4 км над уровнем моря атмосферное Ро 2 уменьшается до 98 мм рт. ст. , альвеолярное Ро 2 — до 60 мм рт. ст. , т. е. более чем в 1, 5 раза по сравнению с «земным» . При этом у человека могут наступать недостаточность кислородного снабжения организма, особенно мозга, и явления горной (высотной) болезни: одышка и ряд нарушений функций ЦНС (головная боль, бессонница, тошнота). Под влиянием гипоксии спазмируются легочные сосуды, может развиться гипертензия малого круга кровообращения и даже отек легких. Индивидуальная устойчивость человека к высотной гипоксии весьма вариабельна и в известной мере зависит от его тренированности. Однако высоту около 7— 8 км, где атмосферное и альвеолярное Po 2 падают примерно втрое, считают предельно переносимой для человека, если он не дышит газовой смесью, обогащенной кислородом. Важно, что гипоксия вызывает нарушения со стороны психики: расстройство координации, эйфорию, утрату самоконтроля и потерю сознания, которая может наступить совершенно внезапно, приводя в конечном счете человека к гибели. Эти данные относятся главным образом к условиям восхождения человека в горы, так как в обитаемых кабинах современных летательных аппаратов поддерживают парциальное давление О 2, близкое к наземному. Вместе с тем под влиянием гипоксии включаются компенсаторные физиологические механизмы. Первым их звеном является рефлекторное увеличение легочной вентиляции, обусловленное стимуляцией хеморецепторов синокаротидной и отчасти аортальной зон. Одновременно возрастают частота сердечных сокращений и минутный объем крови. В результате утилизация кислорода при сниженном его парциальном давлении в атмосфере осуществляется за счет уменьшения диффузионных градиентов в газотранспортной системе.
 Эти реакции несколько улучшают кислородный транспорт в организме, однако они имеют и свою «теневую» сторону. Так, рост вентиляции легких (точнее, их гипервентиляция, ибо продукция СО 2 в организме здесь не повышена) сопряжен с избыточным вымыванием СО 2 легкими. Сочетание гипоксии с гипокапнией угнетает возбудимость бульбарных хеморецепторов и дыхательного центра, что может вести к появлению периодического дыхания, особенно во время сна. Кроме того, гипокапния вызывает спазм церебральных сосудов и это еще больше ухудшает снабжение мозга кислородом. Наконец, усиленная вентиляция легких требует дополнительного расхода энергии на работу дыхательных мышц. Поэтому при длительном пребывании в горах по мере адаптации к хронической гипоксии начальные «срочные» реакции дыхания постепенно уступают место более экономичному приспособлению газотранспортной системы организма. Так, у постоянных жителей больших высот (Гималаи, Анды) реакция дыхания на гипоксию оказывается резко ослабленной (гипоксическая глухота) и легочная вентиляция поддерживается почти на том же уровне, что и у живущих на равнине. Зато при длительном проживании в условиях высокогорья возрастает жизненная емкость легких, повышается кислородная емкость крови (за счет увеличения числа эритроцитов и содержания гемоглобина, в том числе фетального, обладающего более высоким сродством к O 2), в мышцах становится больше миоглобина, в митохондриях усиливается активность ферментов, обеспечивающих биологическое окисление и гликолиз.
Эти реакции несколько улучшают кислородный транспорт в организме, однако они имеют и свою «теневую» сторону. Так, рост вентиляции легких (точнее, их гипервентиляция, ибо продукция СО 2 в организме здесь не повышена) сопряжен с избыточным вымыванием СО 2 легкими. Сочетание гипоксии с гипокапнией угнетает возбудимость бульбарных хеморецепторов и дыхательного центра, что может вести к появлению периодического дыхания, особенно во время сна. Кроме того, гипокапния вызывает спазм церебральных сосудов и это еще больше ухудшает снабжение мозга кислородом. Наконец, усиленная вентиляция легких требует дополнительного расхода энергии на работу дыхательных мышц. Поэтому при длительном пребывании в горах по мере адаптации к хронической гипоксии начальные «срочные» реакции дыхания постепенно уступают место более экономичному приспособлению газотранспортной системы организма. Так, у постоянных жителей больших высот (Гималаи, Анды) реакция дыхания на гипоксию оказывается резко ослабленной (гипоксическая глухота) и легочная вентиляция поддерживается почти на том же уровне, что и у живущих на равнине. Зато при длительном проживании в условиях высокогорья возрастает жизненная емкость легких, повышается кислородная емкость крови (за счет увеличения числа эритроцитов и содержания гемоглобина, в том числе фетального, обладающего более высоким сродством к O 2), в мышцах становится больше миоглобина, в митохондриях усиливается активность ферментов, обеспечивающих биологическое окисление и гликолиз.
 Гипоксия и ее виды • • 1. Дыхательная 2. Циркуляторная 3. Анемическая 4. Гистотоксическая
Гипоксия и ее виды • • 1. Дыхательная 2. Циркуляторная 3. Анемическая 4. Гистотоксическая
 ДЫХАТЕЛЬНАЯ ГИПОКСИЯ • Причина – нарушение внешнего дыхания в результате снижения уровня парциального давления О 2 или структуры аэрогематического барьера
ДЫХАТЕЛЬНАЯ ГИПОКСИЯ • Причина – нарушение внешнего дыхания в результате снижения уровня парциального давления О 2 или структуры аэрогематического барьера
 ЦИРКУЛЯТОРНАЯ ГИПОКСИЯ • Причина – нарушение циркуляции крови в результате сердечной недостаточности и (или) прекращения кровоснабжения органов
ЦИРКУЛЯТОРНАЯ ГИПОКСИЯ • Причина – нарушение циркуляции крови в результате сердечной недостаточности и (или) прекращения кровоснабжения органов
 АНЕМИЧЕСКАЯ ГИПОКСИЯ • Причина – снижение кислородной емкости крови в результате кровопотери, внутрисосудистого гемолиза эритроцитов или нарушения кроветворения
АНЕМИЧЕСКАЯ ГИПОКСИЯ • Причина – снижение кислородной емкости крови в результате кровопотери, внутрисосудистого гемолиза эритроцитов или нарушения кроветворения
 ГИСТОТОКСИЧЕСКАЯ ГИПОКСИЯ • Причина – нарушение процессов усвоения кислорода тканями в результате блокады окислительно восстановительных ферментов.
ГИСТОТОКСИЧЕСКАЯ ГИПОКСИЯ • Причина – нарушение процессов усвоения кислорода тканями в результате блокады окислительно восстановительных ферментов.
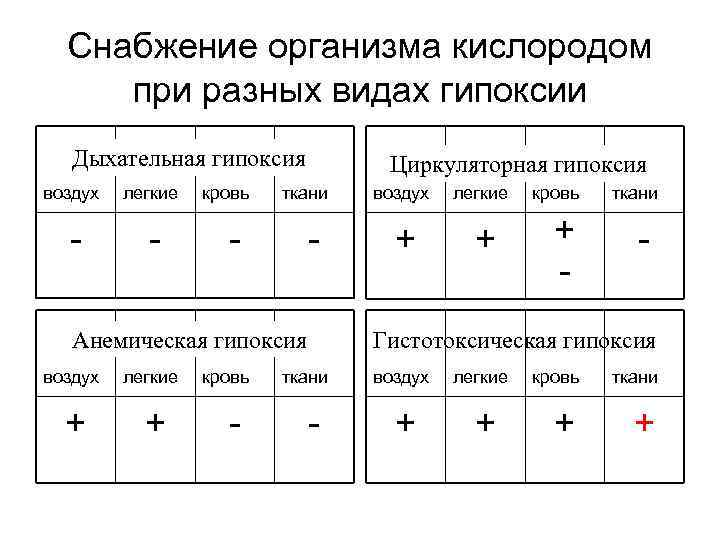 Снабжение организма кислородом при разных видах гипоксии Дыхательная гипоксия воздух легкие кровь Циркуляторная гипоксия ткани Анемическая гипоксия воздух легкие + + кровь + ткани Гистотоксическая гипоксия ткани воздух легкие + + кровь ткани + +
Снабжение организма кислородом при разных видах гипоксии Дыхательная гипоксия воздух легкие кровь Циркуляторная гипоксия ткани Анемическая гипоксия воздух легкие + + кровь + ткани Гистотоксическая гипоксия ткани воздух легкие + + кровь ткани + +
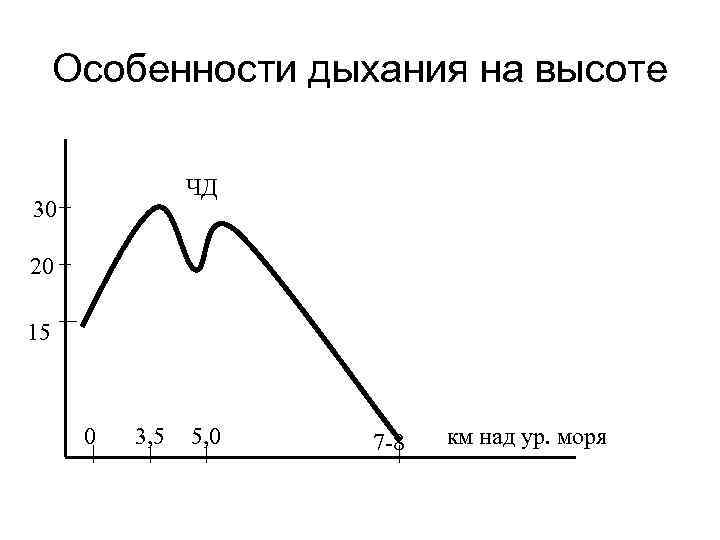 Особенности дыхания на высоте ЧД 30 20 15 0 3, 5 5, 0 7 -8 км над ур. моря
Особенности дыхания на высоте ЧД 30 20 15 0 3, 5 5, 0 7 -8 км над ур. моря
 Особенности дыхания при погружении на глубину • При погружении на каждые 10 м – давление увеличивается на 1 атм. • Азот начинает растворяться в крови • Возникает угроза азотного опьянения на глубине и кессонной болезни при подъеме • Профилактика – медленный подъем • Рекорд погружения с аквалангом – 300 м • (при условии использования специальных газовых смесей)
Особенности дыхания при погружении на глубину • При погружении на каждые 10 м – давление увеличивается на 1 атм. • Азот начинает растворяться в крови • Возникает угроза азотного опьянения на глубине и кессонной болезни при подъеме • Профилактика – медленный подъем • Рекорд погружения с аквалангом – 300 м • (при условии использования специальных газовых смесей)
 Дыхание в измененных условиях. А – последствия кессонной болезни (воздушная эмболия); Б – состояние организма человека при подъёме на высоту (содержание оксигемоглобина в крови).
Дыхание в измененных условиях. А – последствия кессонной болезни (воздушная эмболия); Б – состояние организма человека при подъёме на высоту (содержание оксигемоглобина в крови).
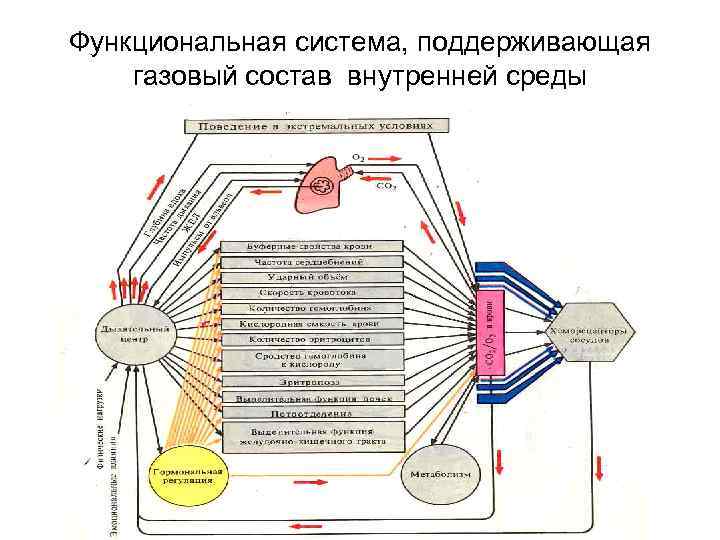 Функциональная система, поддерживающая газовый состав внутренней среды
Функциональная система, поддерживающая газовый состав внутренней среды
 Ныряние. Человек способен произвольно задерживать дыхание не более чем на 1— 2 мин. После предварительной гипервентиляции легких длительность апноэ тренированному человеку удается доводить до 3— 4 мин, редко дольше. Этим и определяется максимальный срок пребывания под водой без специального дыхательного прибора. Однако такое затяжное ныряние после гипервентиляции таит в себе серьезную опасность: быстрое падение оксигенации крови может вызвать внезапную потерю сознания, а в этом состоянии пловец под влиянием императивного стимула, порожденного ростом Рсо 2 крови, вдохнет воду и захлебнется.
Ныряние. Человек способен произвольно задерживать дыхание не более чем на 1— 2 мин. После предварительной гипервентиляции легких длительность апноэ тренированному человеку удается доводить до 3— 4 мин, редко дольше. Этим и определяется максимальный срок пребывания под водой без специального дыхательного прибора. Однако такое затяжное ныряние после гипервентиляции таит в себе серьезную опасность: быстрое падение оксигенации крови может вызвать внезапную потерю сознания, а в этом состоянии пловец под влиянием императивного стимула, порожденного ростом Рсо 2 крови, вдохнет воду и захлебнется.
 Увеличение сопротивления дыханию. При использовании человеком устройств индивидуальной защиты органов дыхания: респираторов, противогазов и др. , отмечено увеличенное резистивное (аэродинамическое) сопротивление, т. е. сопротивление потоку газа в дыхательных путях. Увеличение резистивного сопротивления воспроизводится в экспериментах с дыханием через узкую трубку или перфорированную диафрагму. Первой реакцией на включение сопротивления оказывается снижение глубины дыхания. Однако немедленно сказывается свойство мышц усиливать сокращения при возникновении препятствия (рефлекс преодоления нагрузки), частично опосредованное γ—петлей спинального уровня. В дальнейшем подключаются компенсаторные механизмы супраспинальных структур, в том числе корковых. Изменяется паттерн дыхания: оно становится более редким и глубоким, что способствует снижению энерготрат на работу респираторных мышц в условиях добавочного аэродинамического сопротивления. Если в результате включения этих механизмов вентиляция легких не восстанавливается до нормального уровня, в крови происходит накопление двуокиси углерода. Усиление гиперкапнического стимула, в свою очередь, служит дополнительным фактором, способствующим преодолению увеличенной нагрузки на вентиляторный аппарат.
Увеличение сопротивления дыханию. При использовании человеком устройств индивидуальной защиты органов дыхания: респираторов, противогазов и др. , отмечено увеличенное резистивное (аэродинамическое) сопротивление, т. е. сопротивление потоку газа в дыхательных путях. Увеличение резистивного сопротивления воспроизводится в экспериментах с дыханием через узкую трубку или перфорированную диафрагму. Первой реакцией на включение сопротивления оказывается снижение глубины дыхания. Однако немедленно сказывается свойство мышц усиливать сокращения при возникновении препятствия (рефлекс преодоления нагрузки), частично опосредованное γ—петлей спинального уровня. В дальнейшем подключаются компенсаторные механизмы супраспинальных структур, в том числе корковых. Изменяется паттерн дыхания: оно становится более редким и глубоким, что способствует снижению энерготрат на работу респираторных мышц в условиях добавочного аэродинамического сопротивления. Если в результате включения этих механизмов вентиляция легких не восстанавливается до нормального уровня, в крови происходит накопление двуокиси углерода. Усиление гиперкапнического стимула, в свою очередь, служит дополнительным фактором, способствующим преодолению увеличенной нагрузки на вентиляторный аппарат.
 Повышенное давление газовой среды (гипербария). С этим фактором встречаются в основном водолазы и акванавты при глубоководных погружениях. Давление дыхательной смеси, которая подается в этих условиях человеку, должно обязательно соответствовать гидростатическому давлению на данной глубине, иначе дыхание будет невозможным. При увеличении глубины на каждые 10 м давление возрастает на 1 атм (0, 1 МПа). Следовательно, на глубине 100 м человек вдыхает газовую смесь под давлением, превышающим атмосферное примерно в 10 раз. Пропорционально возрастает и плотность этой смеси, что создает добавочное сопротивление дыханию. Поэтому на глубинах свыше 60— 80 м главный компонент атмосферного воздуха — азот — полностью или частично заменяют гелием, плотность которого в 7 раз меньше, чем у азота. Есть и другая причина такой замены: азот под давлением вызывает у человека наркотический эффект. Вредным для организма является и высокое парциальное давление кислорода — гипероксия. Так, уже при обычном атмосферном давлении дыхание чистым кислородом свыше 12— 15 ч может вызвать раздражение слизистой оболочки воздухоносных путей, нарушение функции сурфактантов, даже воспаление легких, а дыхание кислородом под высоким давлением (более 2— 3 атм) — тяжелые расстройства функции ЦНС (судороги) уже через 1— 2 ч воздействия. Поэтому содержание кислорода в дыхательной смеси по мере увеличения глубины погружения снижают, сохраняя Ро 2, близкое к наземному. Здесь следует заметить, что сказанное о вредных эффектах гипероксии не противоречит строго дозированному применению кислорода под давлением — гипербарической оксигенации — для лечения некоторых состояний, связанных с гипоксией тканей.
Повышенное давление газовой среды (гипербария). С этим фактором встречаются в основном водолазы и акванавты при глубоководных погружениях. Давление дыхательной смеси, которая подается в этих условиях человеку, должно обязательно соответствовать гидростатическому давлению на данной глубине, иначе дыхание будет невозможным. При увеличении глубины на каждые 10 м давление возрастает на 1 атм (0, 1 МПа). Следовательно, на глубине 100 м человек вдыхает газовую смесь под давлением, превышающим атмосферное примерно в 10 раз. Пропорционально возрастает и плотность этой смеси, что создает добавочное сопротивление дыханию. Поэтому на глубинах свыше 60— 80 м главный компонент атмосферного воздуха — азот — полностью или частично заменяют гелием, плотность которого в 7 раз меньше, чем у азота. Есть и другая причина такой замены: азот под давлением вызывает у человека наркотический эффект. Вредным для организма является и высокое парциальное давление кислорода — гипероксия. Так, уже при обычном атмосферном давлении дыхание чистым кислородом свыше 12— 15 ч может вызвать раздражение слизистой оболочки воздухоносных путей, нарушение функции сурфактантов, даже воспаление легких, а дыхание кислородом под высоким давлением (более 2— 3 атм) — тяжелые расстройства функции ЦНС (судороги) уже через 1— 2 ч воздействия. Поэтому содержание кислорода в дыхательной смеси по мере увеличения глубины погружения снижают, сохраняя Ро 2, близкое к наземному. Здесь следует заметить, что сказанное о вредных эффектах гипероксии не противоречит строго дозированному применению кислорода под давлением — гипербарической оксигенации — для лечения некоторых состояний, связанных с гипоксией тканей.
 Серьезная опасность угрожает человеку при подъеме на поверхность после пребывания на глубине. Во время действия высокого давления среды кровь и другие жидкости тела насыщаются растворенным нейтральным (т. е. не участвующем в обмене) газом — азотом или гелием. При быстром падении давления дыхательной среды, декомпрессии, этот газ выделяется в виде мелких пузырьков, которые могут вызвать повреждение тканей и нарушить кровоснабжение органов, в том числе мозга. Чтобы предотвратить декомпрессионные расстройства, подъем водолазов и акванавтов ведут очень медленно, соблюдая специально разработанные режимы. Важное значение здесь имеет и правильный выбор состава дыхательных смесей.
Серьезная опасность угрожает человеку при подъеме на поверхность после пребывания на глубине. Во время действия высокого давления среды кровь и другие жидкости тела насыщаются растворенным нейтральным (т. е. не участвующем в обмене) газом — азотом или гелием. При быстром падении давления дыхательной среды, декомпрессии, этот газ выделяется в виде мелких пузырьков, которые могут вызвать повреждение тканей и нарушить кровоснабжение органов, в том числе мозга. Чтобы предотвратить декомпрессионные расстройства, подъем водолазов и акванавтов ведут очень медленно, соблюдая специально разработанные режимы. Важное значение здесь имеет и правильный выбор состава дыхательных смесей.
 Гипертермия. Дыхательные пути и легкие участвуют в отдаче тепла организмом во внешнюю среду. Эта функция у разных животных выражена неодинаково. Для большинства млекопитающих общая закономерность состоит в увеличении легочной вентиляции с повышением температуры среды. Тем самым увеличивается испарение влаги со слизистой оболочки воздухоносных путей и поверхности альвеол. Следует подчеркнуть, что речь идет о повышении общей, а не альвеолярной вентиляции — последняя должна оставаться на уровне, соответствующем интенсивности газообмена. Это достигается учащением дыхательных циклов при некотором уменьшении дыхательного объема в результате возрастает вентиляция главным образом мертвого пространства но не альвеол. Сказанное не относится к терморегуляции человека, обладающего, как известно, мощным потоотделительным механизмом. Незначительное тахипноэ, которое наблюдается в условиях гипертермии, не имеет существенного значения для отдачи тепла.
Гипертермия. Дыхательные пути и легкие участвуют в отдаче тепла организмом во внешнюю среду. Эта функция у разных животных выражена неодинаково. Для большинства млекопитающих общая закономерность состоит в увеличении легочной вентиляции с повышением температуры среды. Тем самым увеличивается испарение влаги со слизистой оболочки воздухоносных путей и поверхности альвеол. Следует подчеркнуть, что речь идет о повышении общей, а не альвеолярной вентиляции — последняя должна оставаться на уровне, соответствующем интенсивности газообмена. Это достигается учащением дыхательных циклов при некотором уменьшении дыхательного объема в результате возрастает вентиляция главным образом мертвого пространства но не альвеол. Сказанное не относится к терморегуляции человека, обладающего, как известно, мощным потоотделительным механизмом. Незначительное тахипноэ, которое наблюдается в условиях гипертермии, не имеет существенного значения для отдачи тепла.
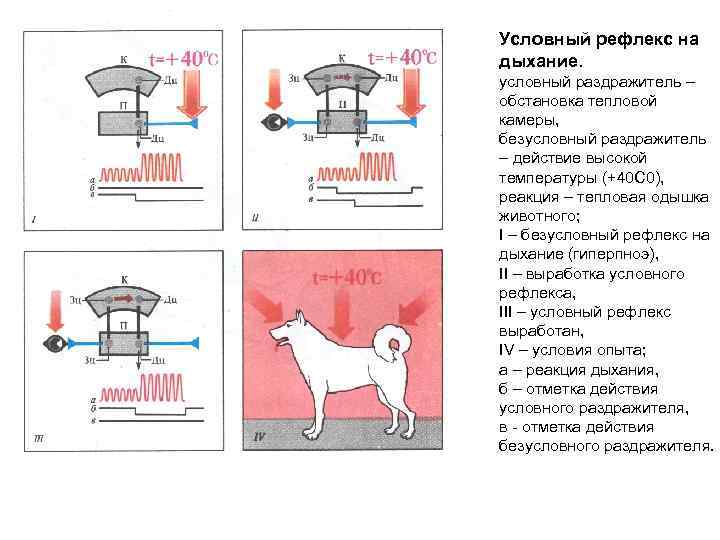 Условный рефлекс на дыхание. условный раздражитель – обстановка тепловой камеры, безусловный раздражитель – действие высокой температуры (+40 С 0), реакция – тепловая одышка животного; I – безусловный рефлекс на дыхание (гиперпноэ), II – выработка условного рефлекса, III – условный рефлекс выработан, IV – условия опыта; а – реакция дыхания, б – отметка действия условного раздражителя, в отметка действия безусловного раздражителя.
Условный рефлекс на дыхание. условный раздражитель – обстановка тепловой камеры, безусловный раздражитель – действие высокой температуры (+40 С 0), реакция – тепловая одышка животного; I – безусловный рефлекс на дыхание (гиперпноэ), II – выработка условного рефлекса, III – условный рефлекс выработан, IV – условия опыта; а – реакция дыхания, б – отметка действия условного раздражителя, в отметка действия безусловного раздражителя.
 Дыхание плода. У плода газообмен происходит в плаценте, куда кровь поступает по пупочным артериям. Толщина диффузионного барьера между кровью матери и плода составляет около 3, 5 мкм. Плацента — менее эффективное газообменное устройство, чем легкие, и напряженность кислорода в крови пупочной вены составляет всего 30 мм рт. ст. Наиболее богатая кислородом кровь поступает в основном к головному мозгу и сердцу, а легкие не участвующие в работе, получают незначительное ее количество. Рождение на свет — это самый сильный стресс в жизни человека. На новорожденного внезапно обрушивается огромное количество внешних раздражителей. Во время родов нарушается плацентарный газообмен, что приводит к гипоксемии и гиперкапнии. Вероятно, в момент рождения резко увеличивается чувствительность хеморецепторов. Все это приводит к первому вдоху. Легкие плода на 40% своей общей емкости наполнены жидкостью, которая постоянно секретируется альвеолярными клетками и обладает низким р. Н. Жидкость эта играет важную роль в последующем расправлении легких, уменьшая поверхностное натяжение и тем самым способствуя образованию сферической поверхности альвеол. В первое время расправление легких у новорожденных происходит неравномерно. Однако сурфактант, образующийся на поздних стадиях внутриутробного развития, способствует стабилизации раскрывшихся альвеол, а жидкость удаляется по лимфатическим сосудам и капиллярам. Задолго до рождения плод совершает очень поверхностные и быстрые дыхательные движения. После рождения вентиляция легких становится равномерной лишь через несколько суток. Первые вдохи ребенка приводят к резкому падению сопротивления легочных сосудов. Это обусловлено несколькими причинами, в том числе внезапным повышением Роз в альвеолах, что приводит к устранению гипоксической вазоконстрикции, и увеличением объема легких, при котором расширяются внеальвеолярные сосуды. Падение сопротивления в малом круге кровообращения увеличивает легочный кровоток.
Дыхание плода. У плода газообмен происходит в плаценте, куда кровь поступает по пупочным артериям. Толщина диффузионного барьера между кровью матери и плода составляет около 3, 5 мкм. Плацента — менее эффективное газообменное устройство, чем легкие, и напряженность кислорода в крови пупочной вены составляет всего 30 мм рт. ст. Наиболее богатая кислородом кровь поступает в основном к головному мозгу и сердцу, а легкие не участвующие в работе, получают незначительное ее количество. Рождение на свет — это самый сильный стресс в жизни человека. На новорожденного внезапно обрушивается огромное количество внешних раздражителей. Во время родов нарушается плацентарный газообмен, что приводит к гипоксемии и гиперкапнии. Вероятно, в момент рождения резко увеличивается чувствительность хеморецепторов. Все это приводит к первому вдоху. Легкие плода на 40% своей общей емкости наполнены жидкостью, которая постоянно секретируется альвеолярными клетками и обладает низким р. Н. Жидкость эта играет важную роль в последующем расправлении легких, уменьшая поверхностное натяжение и тем самым способствуя образованию сферической поверхности альвеол. В первое время расправление легких у новорожденных происходит неравномерно. Однако сурфактант, образующийся на поздних стадиях внутриутробного развития, способствует стабилизации раскрывшихся альвеол, а жидкость удаляется по лимфатическим сосудам и капиллярам. Задолго до рождения плод совершает очень поверхностные и быстрые дыхательные движения. После рождения вентиляция легких становится равномерной лишь через несколько суток. Первые вдохи ребенка приводят к резкому падению сопротивления легочных сосудов. Это обусловлено несколькими причинами, в том числе внезапным повышением Роз в альвеолах, что приводит к устранению гипоксической вазоконстрикции, и увеличением объема легких, при котором расширяются внеальвеолярные сосуды. Падение сопротивления в малом круге кровообращения увеличивает легочный кровоток.
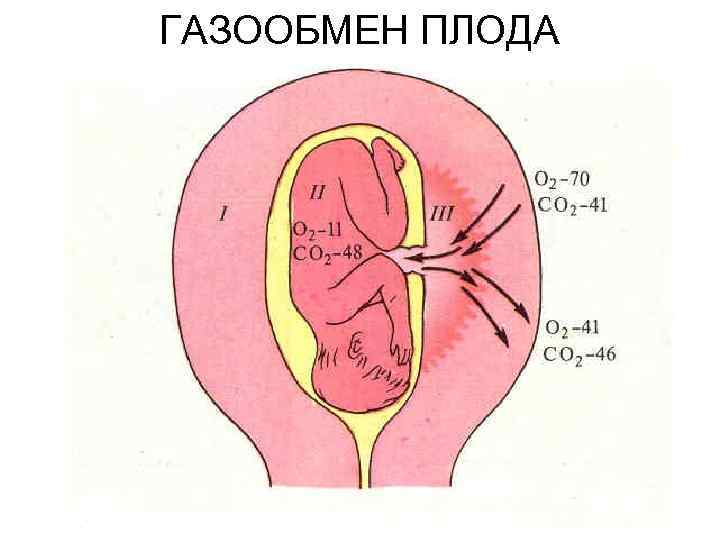 ГАЗООБМЕН ПЛОДА
ГАЗООБМЕН ПЛОДА
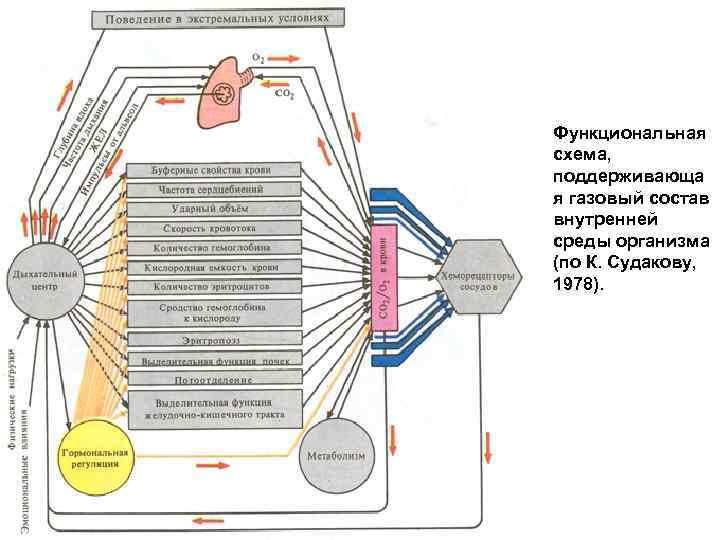 Функциональная схема, поддерживающа я газовый состав внутренней среды организма (по К. Судакову, 1978).
Функциональная схема, поддерживающа я газовый состав внутренней среды организма (по К. Судакову, 1978).
 Недыхательные функции легких • 1. Защитные функции: • -механическая очистка воздуха и путей • - неспецифические гуморальные факторы и иммунные механизмы • 2. Метаболизм БАВ: • - разрушение и деградация кининов, простагландинов, биогенных аминов и т. п. • - выработка или активация БАВ тромбопластина, гепарина, ангиотензина
Недыхательные функции легких • 1. Защитные функции: • -механическая очистка воздуха и путей • - неспецифические гуморальные факторы и иммунные механизмы • 2. Метаболизм БАВ: • - разрушение и деградация кининов, простагландинов, биогенных аминов и т. п. • - выработка или активация БАВ тромбопластина, гепарина, ангиотензина
 Спасибо за внимание
Спасибо за внимание


