MaksimovNM_SPB_16.ppt
- Количество слайдов: 18
 РЕДОКС-РЕГУЛЯЦИЯ ПРОГАМНОЙ ФАЗЫ ОПЛОДОТВОРЕНИЯ Н. М. Максимов МГУ им. М. В. Ломоносова, Биологический факультет, Кафедра физиологии растений Лаборатория физиологии мужского гаметофита под руководством проф. И. П. Ермакова
РЕДОКС-РЕГУЛЯЦИЯ ПРОГАМНОЙ ФАЗЫ ОПЛОДОТВОРЕНИЯ Н. М. Максимов МГУ им. М. В. Ломоносова, Биологический факультет, Кафедра физиологии растений Лаборатория физиологии мужского гаметофита под руководством проф. И. П. Ермакова
 Основные закономерности прорастания и роста пыльцевого зерна 1. Регидратация пыльцевого зерна H 2 O
Основные закономерности прорастания и роста пыльцевого зерна 1. Регидратация пыльцевого зерна H 2 O
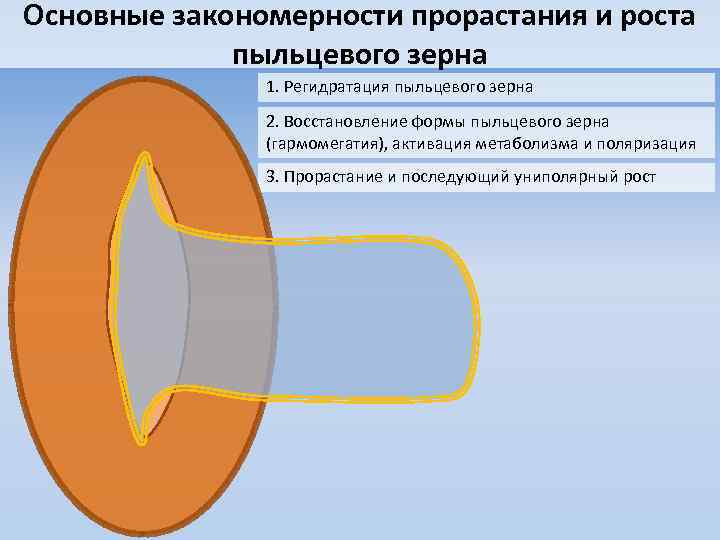 Основные закономерности прорастания и роста пыльцевого зерна 1. Регидратация пыльцевого зерна 2. Восстановление формы пыльцевого зерна (гармомегатия), активация метаболизма и поляризация 3. Прорастание и последующий униполярный рост
Основные закономерности прорастания и роста пыльцевого зерна 1. Регидратация пыльцевого зерна 2. Восстановление формы пыльцевого зерна (гармомегатия), активация метаболизма и поляризация 3. Прорастание и последующий униполярный рост
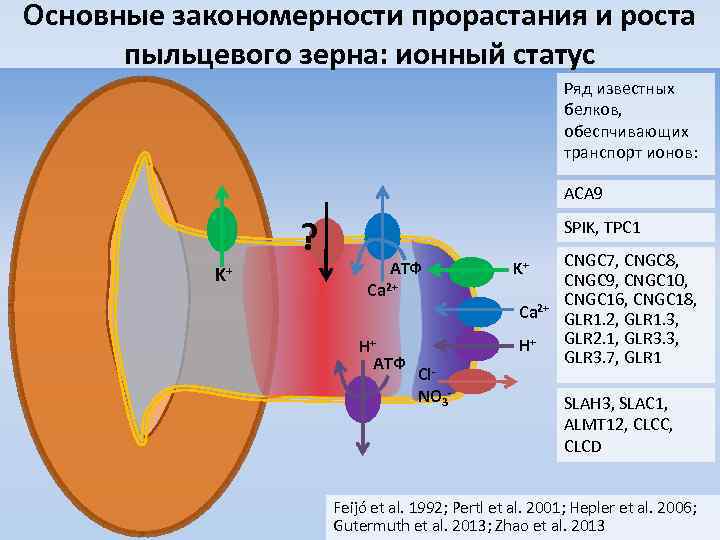 Основные закономерности прорастания и роста пыльцевого зерна: ионный статус Ряд известных белков, обеспчивающих транспорт ионов: ACA 9 ? K+ SPIK, TPC 1 АТФ Ca 2+ H+ АТФ K+ Ca 2+ H+ Cl. NO 3 - CNGC 7, CNGC 8, CNGC 9, CNGC 10, CNGC 16, CNGC 18, GLR 1. 2, GLR 1. 3, GLR 2. 1, GLR 3. 3, GLR 3. 7, GLR 1 SLAH 3, SLAC 1, ALMT 12, CLCC, CLCD Feijó et al. 1992; Pertl et al. 2001; Hepler et al. 2006; Gutermuth et al. 2013; Zhao et al. 2013
Основные закономерности прорастания и роста пыльцевого зерна: ионный статус Ряд известных белков, обеспчивающих транспорт ионов: ACA 9 ? K+ SPIK, TPC 1 АТФ Ca 2+ H+ АТФ K+ Ca 2+ H+ Cl. NO 3 - CNGC 7, CNGC 8, CNGC 9, CNGC 10, CNGC 16, CNGC 18, GLR 1. 2, GLR 1. 3, GLR 2. 1, GLR 3. 3, GLR 3. 7, GLR 1 SLAH 3, SLAC 1, ALMT 12, CLCC, CLCD Feijó et al. 1992; Pertl et al. 2001; Hepler et al. 2006; Gutermuth et al. 2013; Zhao et al. 2013
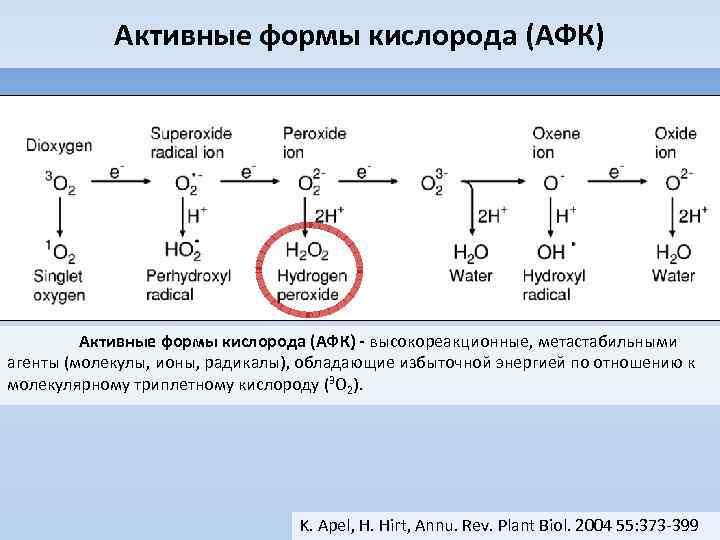 Активные формы кислорода (АФК) - высокореакционные, метастабильными агенты (молекулы, ионы, радикалы), обладающие избыточной энергией по отношению к молекулярному триплетному кислороду (3 O 2). K. Apel, H. Hirt, Annu. Rev. Plant Biol. 2004 55: 373 -399
Активные формы кислорода (АФК) - высокореакционные, метастабильными агенты (молекулы, ионы, радикалы), обладающие избыточной энергией по отношению к молекулярному триплетному кислороду (3 O 2). K. Apel, H. Hirt, Annu. Rev. Plant Biol. 2004 55: 373 -399
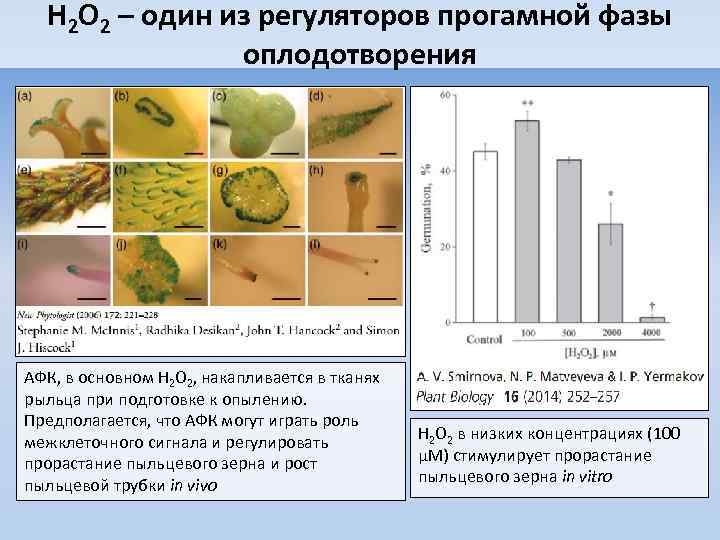 H 2 O 2 – один из регуляторов прогамной фазы оплодотворения АФК, в основном H 2 O 2, накапливается в тканях рыльца при подготовке к опылению. Предполагается, что АФК могут играть роль межклеточного сигнала и регулировать прорастание пыльцевого зерна и рост пыльцевой трубки in vivo H 2 O 2 в низких концентрациях (100 µM) стимулирует прорастание пыльцевого зерна in vitro
H 2 O 2 – один из регуляторов прогамной фазы оплодотворения АФК, в основном H 2 O 2, накапливается в тканях рыльца при подготовке к опылению. Предполагается, что АФК могут играть роль межклеточного сигнала и регулировать прорастание пыльцевого зерна и рост пыльцевой трубки in vivo H 2 O 2 в низких концентрациях (100 µM) стимулирует прорастание пыльцевого зерна in vitro
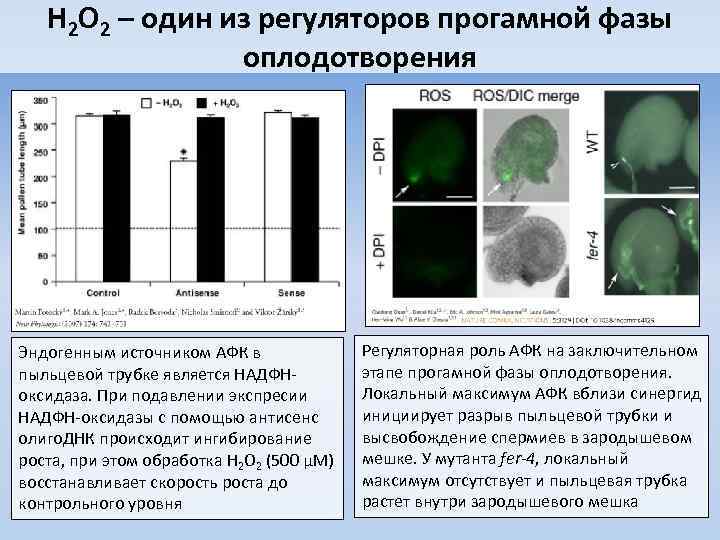 H 2 O 2 – один из регуляторов прогамной фазы оплодотворения Эндогенным источником АФК в пыльцевой трубке является НАДФНоксидаза. При подавлении экспресии НАДФН-оксидазы с помощью антисенс олиго. ДНК происходит ингибирование роста, при этом обработка H 2 O 2 (500 μМ) восстанавливает скорость роста до контрольного уровня Регуляторная роль АФК на заключительном этапе прогамной фазы оплодотворения. Локальный максимум АФК вблизи синергид инициирует разрыв пыльцевой трубки и высвобождение спермиев в зародышевом мешке. У мутанта fer-4, локальный максимум отсутствует и пыльцевая трубка растет внутри зародышевого мешка
H 2 O 2 – один из регуляторов прогамной фазы оплодотворения Эндогенным источником АФК в пыльцевой трубке является НАДФНоксидаза. При подавлении экспресии НАДФН-оксидазы с помощью антисенс олиго. ДНК происходит ингибирование роста, при этом обработка H 2 O 2 (500 μМ) восстанавливает скорость роста до контрольного уровня Регуляторная роль АФК на заключительном этапе прогамной фазы оплодотворения. Локальный максимум АФК вблизи синергид инициирует разрыв пыльцевой трубки и высвобождение спермиев в зародышевом мешке. У мутанта fer-4, локальный максимум отсутствует и пыльцевая трубка растет внутри зародышевого мешка
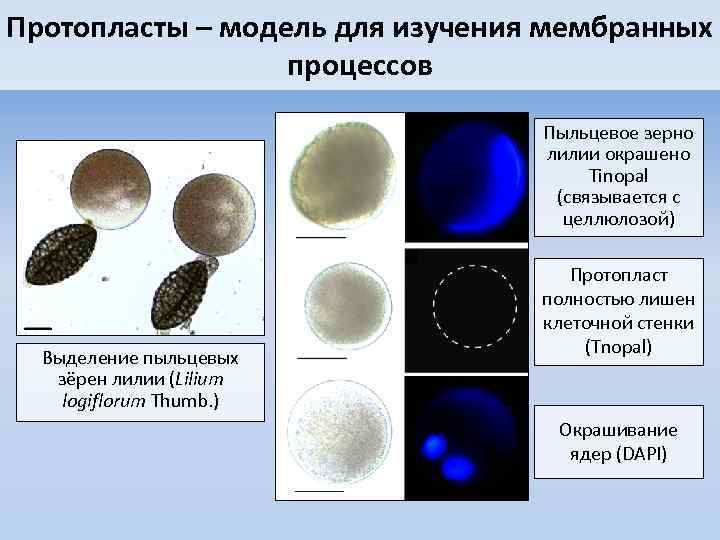 Протопласты – модель для изучения мембранных процессов Пыльцевое зерно лилии окрашено Tinopal (связывается с целлюлозой) Выделение пыльцевых зёрен лилии (Lilium logiflorum Thumb. ) Протопласт полностью лишен клеточной стенки (Tnopal) Окрашивание ядер (DAPI)
Протопласты – модель для изучения мембранных процессов Пыльцевое зерно лилии окрашено Tinopal (связывается с целлюлозой) Выделение пыльцевых зёрен лилии (Lilium logiflorum Thumb. ) Протопласт полностью лишен клеточной стенки (Tnopal) Окрашивание ядер (DAPI)
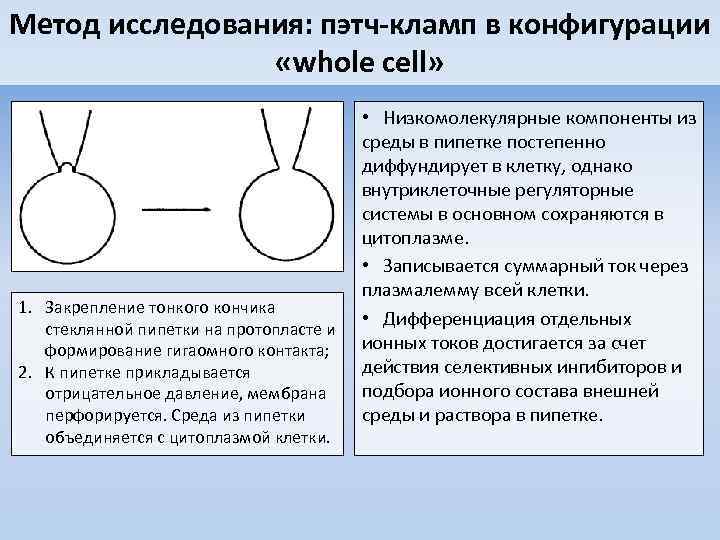 Метод исследования: пэтч-кламп в конфигурации «whole cell» 1. Закрепление тонкого кончика стеклянной пипетки на протопласте и формирование гигаомного контакта; 2. К пипетке прикладывается отрицательное давление, мембрана перфорируется. Среда из пипетки объединяется с цитоплазмой клетки. • Низкомолекулярные компоненты из среды в пипетке постепенно диффундирует в клетку, однако внутриклеточные регуляторные системы в основном сохраняются в цитоплазме. • Записывается суммарный ток через плазмалемму всей клетки. • Дифференциация отдельных ионных токов достигается за счет действия селективных ингибиторов и подбора ионного состава внешней среды и раствора в пипетке.
Метод исследования: пэтч-кламп в конфигурации «whole cell» 1. Закрепление тонкого кончика стеклянной пипетки на протопласте и формирование гигаомного контакта; 2. К пипетке прикладывается отрицательное давление, мембрана перфорируется. Среда из пипетки объединяется с цитоплазмой клетки. • Низкомолекулярные компоненты из среды в пипетке постепенно диффундирует в клетку, однако внутриклеточные регуляторные системы в основном сохраняются в цитоплазме. • Записывается суммарный ток через плазмалемму всей клетки. • Дифференциация отдельных ионных токов достигается за счет действия селективных ингибиторов и подбора ионного состава внешней среды и раствора в пипетке.
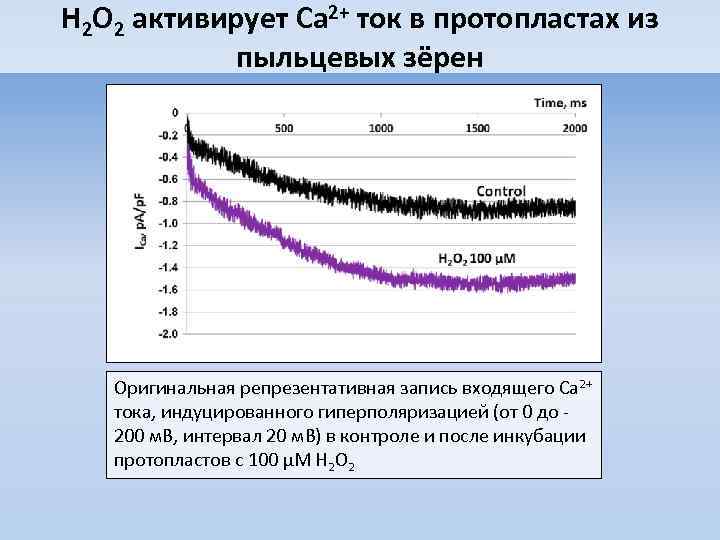 H 2 O 2 активирует Ca 2+ ток в протопластах из пыльцевых зёрен Оригинальная репрезентативная запись входящего Ca 2+ тока, индуцированного гиперполяризацией (от 0 до 200 м. В, интервал 20 м. В) в контроле и после инкубации протопластов с 100 μМ H 2 O 2
H 2 O 2 активирует Ca 2+ ток в протопластах из пыльцевых зёрен Оригинальная репрезентативная запись входящего Ca 2+ тока, индуцированного гиперполяризацией (от 0 до 200 м. В, интервал 20 м. В) в контроле и после инкубации протопластов с 100 μМ H 2 O 2
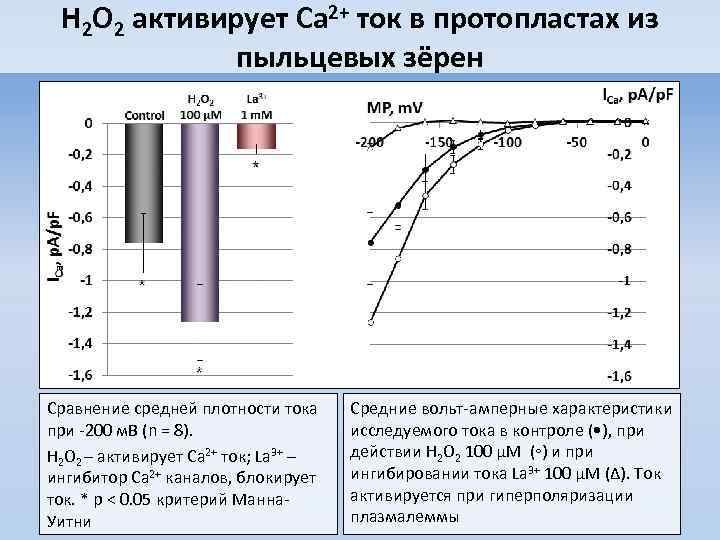 H 2 O 2 активирует Ca 2+ ток в протопластах из пыльцевых зёрен Сравнение средней плотности тока при -200 м. В (n = 8). H 2 O 2 – активирует Ca 2+ ток; La 3+ – ингибитор Ca 2+ каналов, блокирует ток. * p < 0. 05 критерий Манна. Уитни Средние вольт-амперные характеристики исследуемого тока в контроле ( • ), при действии H 2 O 2 100 µM (◦) и при ингибировании тока La 3+ 100 µM (∆). Ток активируется при гиперполяризации плазмалеммы
H 2 O 2 активирует Ca 2+ ток в протопластах из пыльцевых зёрен Сравнение средней плотности тока при -200 м. В (n = 8). H 2 O 2 – активирует Ca 2+ ток; La 3+ – ингибитор Ca 2+ каналов, блокирует ток. * p < 0. 05 критерий Манна. Уитни Средние вольт-амперные характеристики исследуемого тока в контроле ( • ), при действии H 2 O 2 100 µM (◦) и при ингибировании тока La 3+ 100 µM (∆). Ток активируется при гиперполяризации плазмалеммы
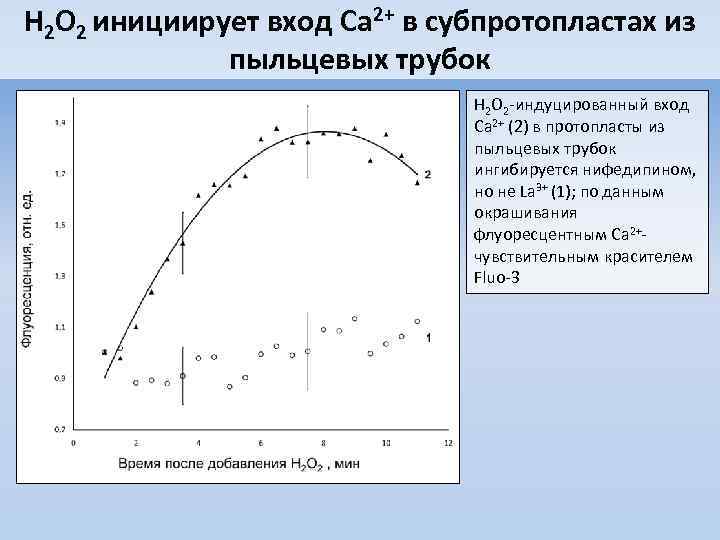 H 2 O 2 инициирует вход Ca 2+ в субпротопластах из пыльцевых трубок H 2 O 2 -индуцированный вход Ca 2+ (2) в протопласты из пыльцевых трубок ингибируется нифедипином, но не La 3+ (1); по данным окрашивания флуоресцентным Ca 2+чувствительным красителем Fluo-3
H 2 O 2 инициирует вход Ca 2+ в субпротопластах из пыльцевых трубок H 2 O 2 -индуцированный вход Ca 2+ (2) в протопласты из пыльцевых трубок ингибируется нифедипином, но не La 3+ (1); по данным окрашивания флуоресцентным Ca 2+чувствительным красителем Fluo-3
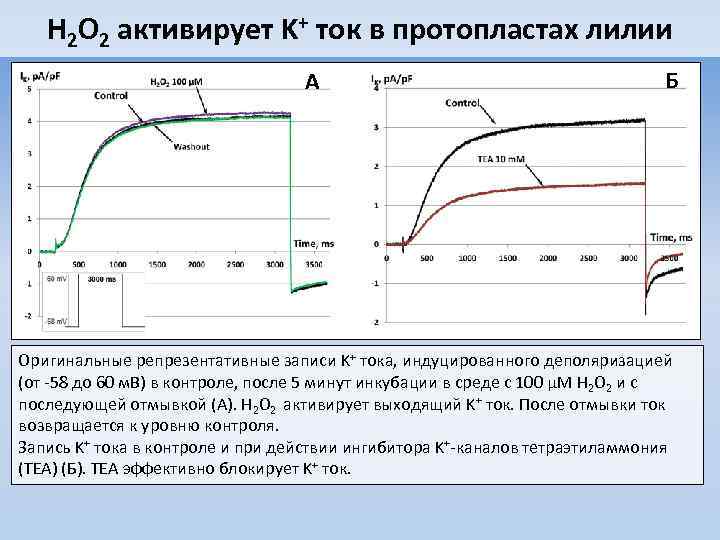 H 2 O 2 активирует K+ ток в протопластах лилии A Б Оригинальные репрезентативные записи K+ тока, индуцированного деполяризацией (от -58 до 60 м. В) в контроле, после 5 минут инкубации в среде с 100 μМ H 2 O 2 и с последующей отмывкой (А). H 2 O 2 активирует выходящий K+ ток. После отмывки ток возвращается к уровню контроля. Запись K+ тока в контроле и при действии ингибитора K+-каналов тетраэтиламмония (TEA) (Б). TEA эффективно блокирует K+ ток.
H 2 O 2 активирует K+ ток в протопластах лилии A Б Оригинальные репрезентативные записи K+ тока, индуцированного деполяризацией (от -58 до 60 м. В) в контроле, после 5 минут инкубации в среде с 100 μМ H 2 O 2 и с последующей отмывкой (А). H 2 O 2 активирует выходящий K+ ток. После отмывки ток возвращается к уровню контроля. Запись K+ тока в контроле и при действии ингибитора K+-каналов тетраэтиламмония (TEA) (Б). TEA эффективно блокирует K+ ток.
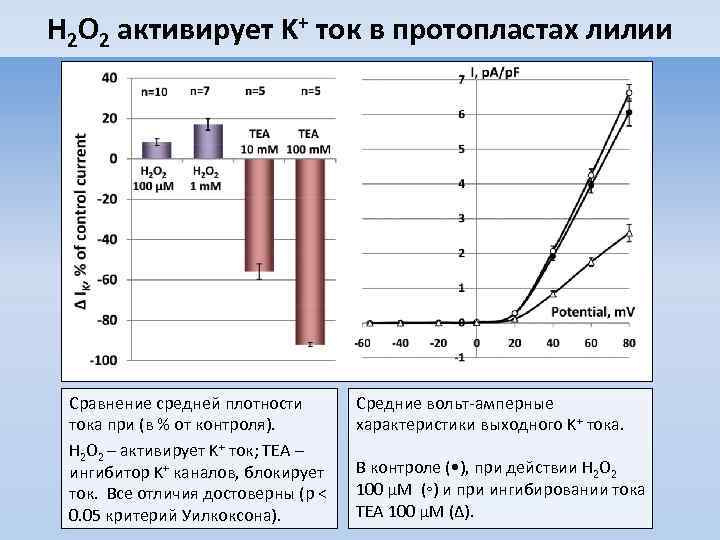 H 2 O 2 активирует K+ ток в протопластах лилии Сравнение средней плотности тока при (в % от контроля). H 2 O 2 – активирует K+ ток; TEA – ингибитор K+ каналов, блокирует ток. Все отличия достоверны (p < 0. 05 критерий Уилкоксона). Средние вольт-амперные характеристики выходного K+ тока. В контроле ( • ), при действии H 2 O 2 100 µM (◦) и при ингибировании тока TEA 100 µM (∆).
H 2 O 2 активирует K+ ток в протопластах лилии Сравнение средней плотности тока при (в % от контроля). H 2 O 2 – активирует K+ ток; TEA – ингибитор K+ каналов, блокирует ток. Все отличия достоверны (p < 0. 05 критерий Уилкоксона). Средние вольт-амперные характеристики выходного K+ тока. В контроле ( • ), при действии H 2 O 2 100 µM (◦) и при ингибировании тока TEA 100 µM (∆).
 H 2 O 2 не оказывает действия на мембранный потенциал протопластов пыльцевого зерна Для измерения потенциала использовали флуоресцентный краситель Di-4 -ANNEPS. t, s Control H 2 O 2 10 μМ H 2 O 2 100 μМ 60 2, 4± 0, 1 2, 3± 0, 1 2, 4± 0, 1 360 2, 6± 0, 1 2, 5± 0, 1 2, 6± 0, 1 Отношение флуоресценции Di-4 -ANNEPS в двух каналах – параметр пропорциональный величине мембранного потенциала после добавления H 2 O 2 (среднее ± стандартная ошибка).
H 2 O 2 не оказывает действия на мембранный потенциал протопластов пыльцевого зерна Для измерения потенциала использовали флуоресцентный краситель Di-4 -ANNEPS. t, s Control H 2 O 2 10 μМ H 2 O 2 100 μМ 60 2, 4± 0, 1 2, 3± 0, 1 2, 4± 0, 1 360 2, 6± 0, 1 2, 5± 0, 1 2, 6± 0, 1 Отношение флуоресценции Di-4 -ANNEPS в двух каналах – параметр пропорциональный величине мембранного потенциала после добавления H 2 O 2 (среднее ± стандартная ошибка).
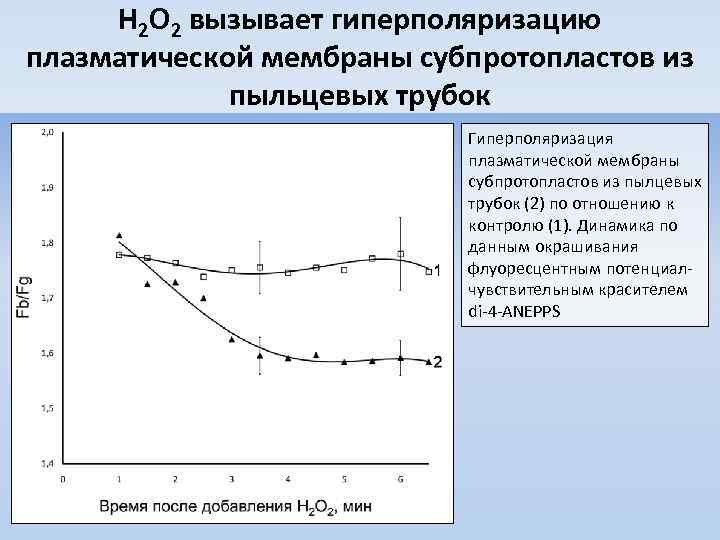 H 2 O 2 вызывает гиперполяризацию плазматической мембраны субпротопластов из пыльцевых трубок Гиперполяризация плазматической мембраны субпротопластов из пылцевых трубок (2) по отношению к контролю (1). Динамика по данным окрашивания флуоресцентным потенциалчувствительным красителем di-4 -ANEPPS
H 2 O 2 вызывает гиперполяризацию плазматической мембраны субпротопластов из пыльцевых трубок Гиперполяризация плазматической мембраны субпротопластов из пылцевых трубок (2) по отношению к контролю (1). Динамика по данным окрашивания флуоресцентным потенциалчувствительным красителем di-4 -ANEPPS
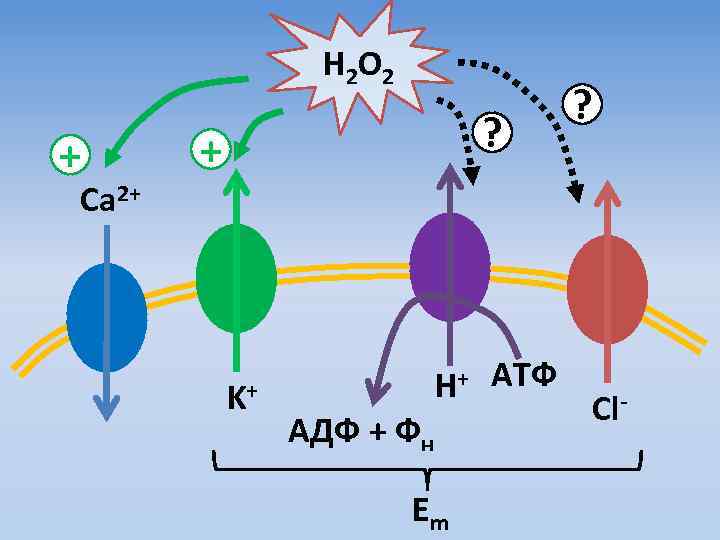 H 2 O 2 + ? Ca 2+ K+ H+ АТФ АДФ + Фн Em Cl-
H 2 O 2 + ? Ca 2+ K+ H+ АТФ АДФ + Фн Em Cl-
 Спасибо за внимание!
Спасибо за внимание!


