рец. Солохин 1.ppt
- Количество слайдов: 50

Рециркуляция - основа интенсификации реакционных процессов Общие положения. 1
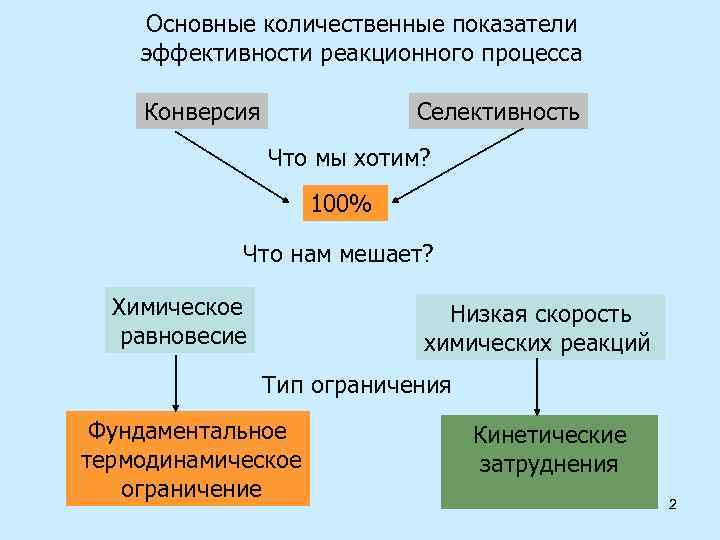
Основные количественные показатели эффективности реакционного процесса Конверсия Селективность Что мы хотим? 100% Что нам мешает? Химическое равновесие Низкая скорость химических реакций Тип ограничения Фундаментальное термодинамическое ограничение Кинетические затруднения 2
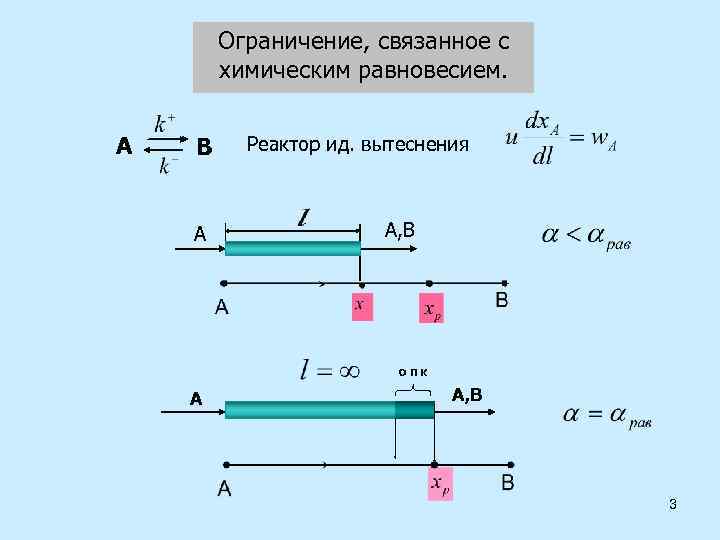
Ограничение, связанное с химическим равновесием. А В А Реактор ид. вытеснения А, В ОПК А А, В 3
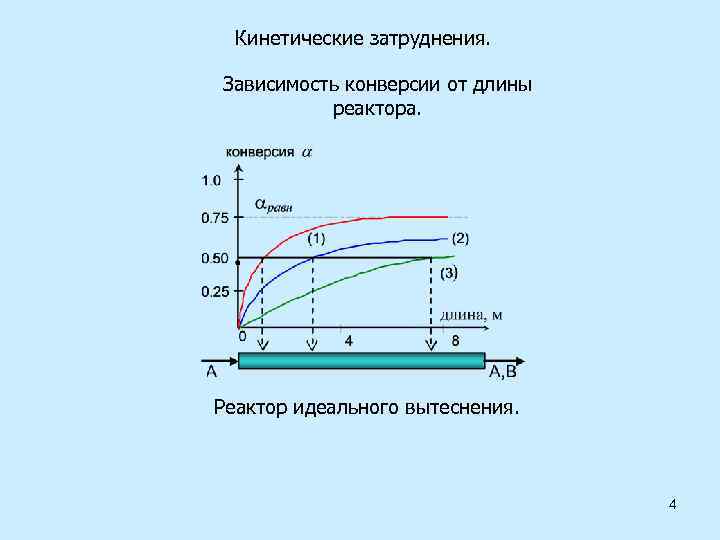
Кинетические затруднения. Зависимость конверсии от длины реактора. Реактор идеального вытеснения. 4

А В+С Производительность реактора по компоненту А Условие полной конверсии Для реактора любого типа 5
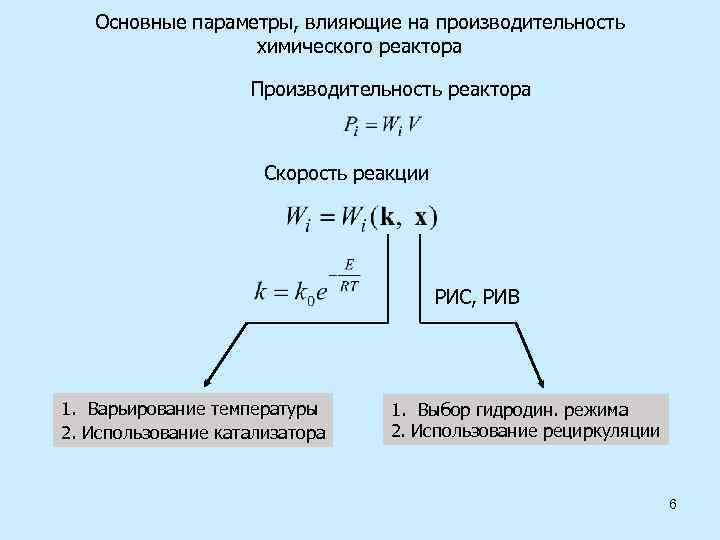
Основные параметры, влияющие на производительность химического реактора Производительность реактора Скорость реакции РИС, РИВ 1. Варьирование температуры 2. Использование катализатора 1. Выбор гидродин. режима 2. Использование рециркуляции 6

А В L А, В А Условие 100% конверсии При любом объеме реактора Увеличение производительности при возможно только за счет увеличения скорости При (концентрация реагента) 7
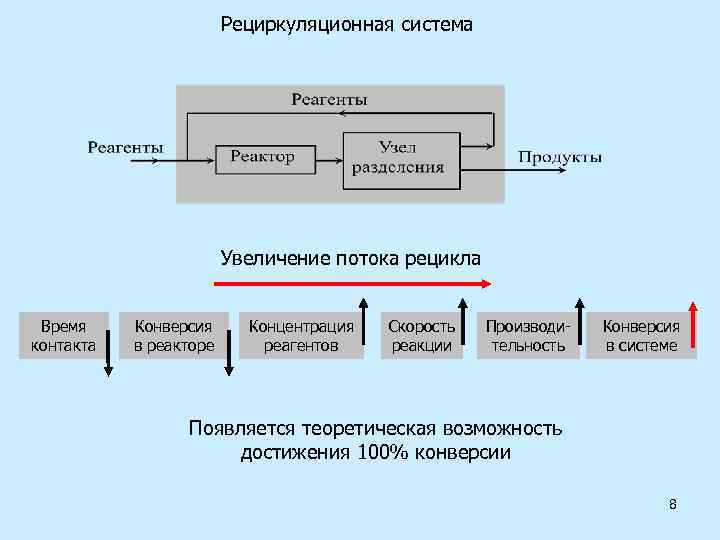
Рециркуляционная система Увеличение потока рецикла Время контакта Конверсия в реакторе Концентрация реагентов Скорость реакции Производительность Конверсия в системе Появляется теоретическая возможность достижения 100% конверсии 8
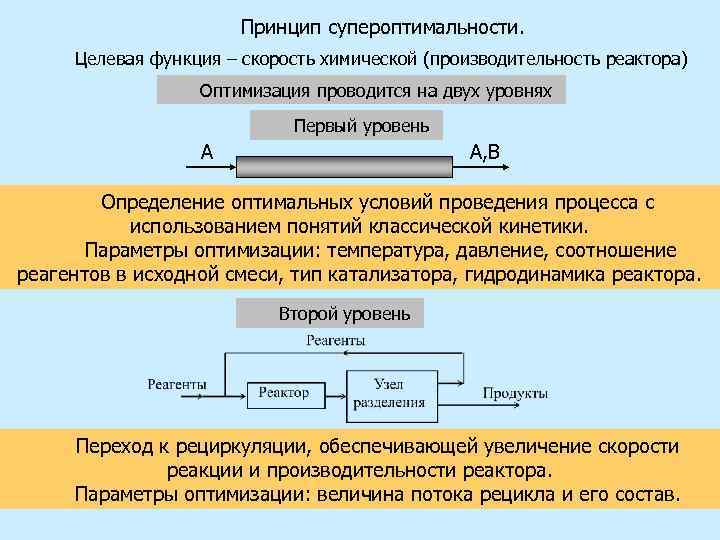
Принцип супероптимальности. Целевая функция – скорость химической (производительность реактора) Оптимизация проводится на двух уровнях Первый уровень А А, В Определение оптимальных условий проведения процесса с использованием понятий классической кинетики. Параметры оптимизации: температура, давление, соотношение реагентов в исходной смеси, тип катализатора, гидродинамика реактора. Второй уровень Переход к рециркуляции, обеспечивающей увеличение скорости реакции и производительности реактора. Параметры оптимизации: величина потока рецикла и его состав. 9

Основные достоинства использования рециркуляции 1. Одновременное достижение в системе высоких значений конверсии и селективности. (теоретически достижение полной конверсии и 100% селективности) 2. Возможность влияния на макрокинетические характеристики процесса за счет варьирования линейной скорости потока. Снижение эффекта внешне диффузионного торможения. Увеличение тепло отвода через теплообменную поверхность. Когда в первую очередь следует использовать рециркуляцию 1). Химическое равновесие существенно смещено в сторону реагентов. 2). Разделение реакционной смеси не вызывает существенных трудностей. 10
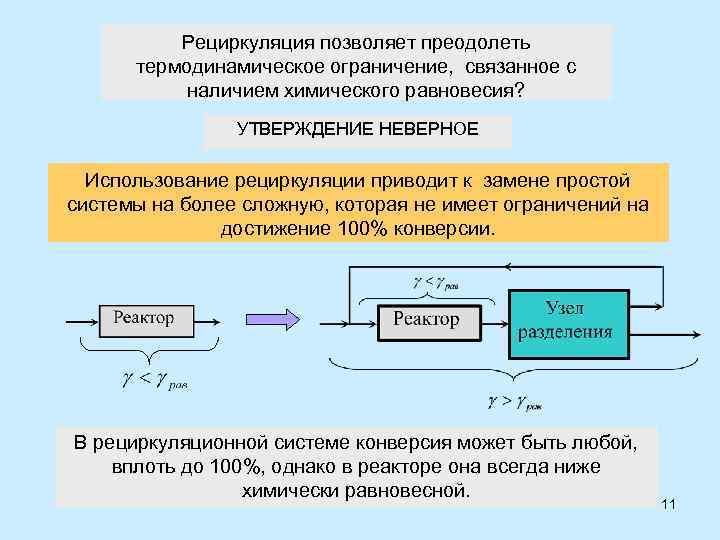
Рециркуляция позволяет преодолеть термодинамическое ограничение, связанное с наличием химического равновесия? УТВЕРЖДЕНИЕ НЕВЕРНОЕ Использование рециркуляции приводит к замене простой системы на более сложную, которая не имеет ограничений на достижение 100% конверсии. В рециркуляционной системе конверсия может быть любой, вплоть до 100%, однако в реакторе она всегда ниже химически равновесной. 11

Основной вывод из теории рециркуляции. Для любой химической реакции за счет рециркуляции может быть достигнуто любое значение конверсии при условии создания рецикла заданного состава и величины. Основная проблема заключается в создании блока разделения, обеспечивающего требуемый поток рецикла. 12
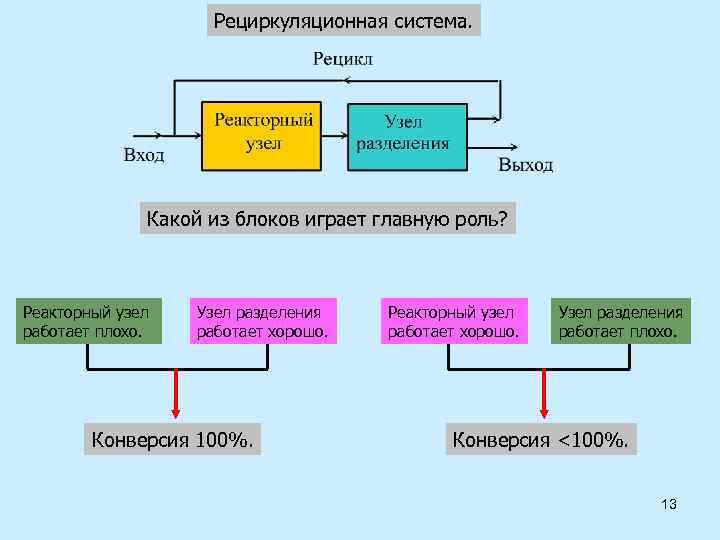
Рециркуляционная система. Какой из блоков играет главную роль? Реакторный узел работает плохо. Узел разделения работает хорошо. Конверсия 100%. Реакторный узел работает хорошо. Узел разделения работает плохо. Конверсия <100%. 13

Основные идеи возможности использования рециркуляции для интенсификации реакционных процессов сформулированы в работах Кисса С. А. и Марковича М. Б. 1930 – 1940 г. Основные положения теории рециркуляции разработаны Нагиевым М. Ф. (1940 – 1975 годы) и получили дальнейшее развитие работах Плановского А. Н. , Бояринова А. И. , и Дуева С. И. Теоретические основы использования рециркуляции, базирующейся на процессе ректификации, представлены в работах Солохина А. В. , Тимофеева В. С, Благова С. А. , Назанского С. Л. 14

Основные положения теории рециркуляции сформулированы для случая использования идеального делителя. Проблемы возникают при рассмотрении конкретного процесса разделения, например, ректификации. 1. Чистота рецикла и его величина. 2. Связь между величинами объема реактора и потока рецикла. 3. Отсутствие общих положений теории рециркуляции при использовании конкретных разделительных процессов. 4. Вопрос о возможности использования режима / для анализа стационарных состояний рециркуляционной системы. 5. Наличие множественности решений математических моделей. 6. Учет взаимного влияние реакционного разделительного процессов друг на друга. и 7. Отсутствие общей математической модели для системы в целом. 15
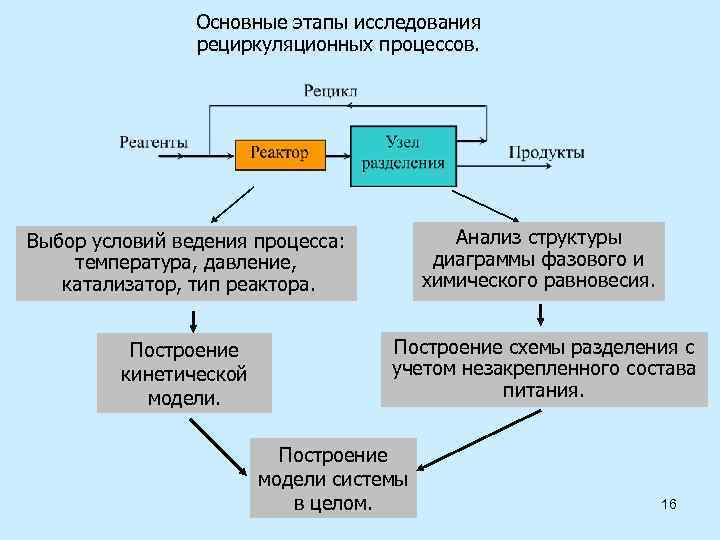
Основные этапы исследования рециркуляционных процессов. Выбор условий ведения процесса: температура, давление, катализатор, тип реактора. Анализ структуры диаграммы фазового и химического равновесия. Построение кинетической модели. Построение схемы разделения с учетом незакрепленного состава питания. Построение модели системы в целом. 16
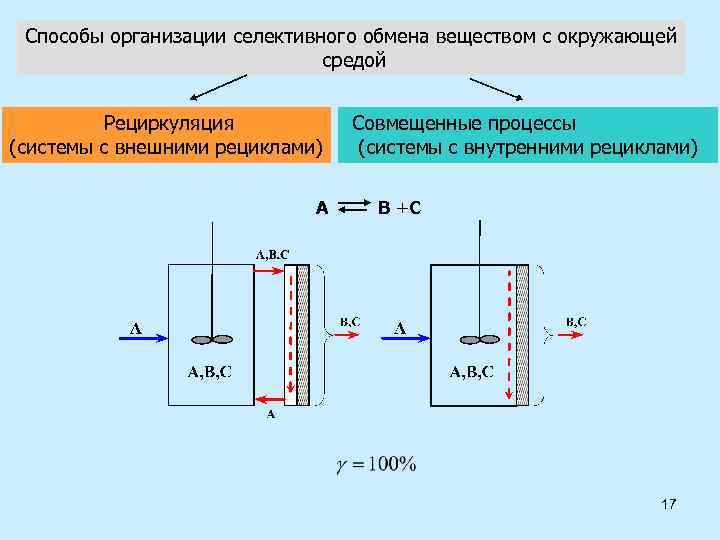
Способы организации селективного обмена веществом с окружающей средой Рециркуляция (системы с внешними рециклами) А Совмещенные процессы (системы с внутренними рециклами) В +С 17
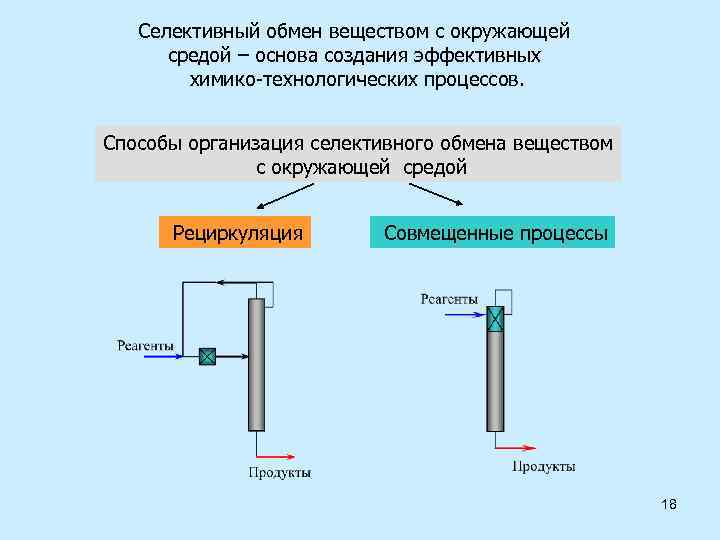
Селективный обмен веществом с окружающей средой – основа создания эффективных химико-технологических процессов. Способы организация селективного обмена веществом с окружающей средой Рециркуляция Совмещенные процессы 18
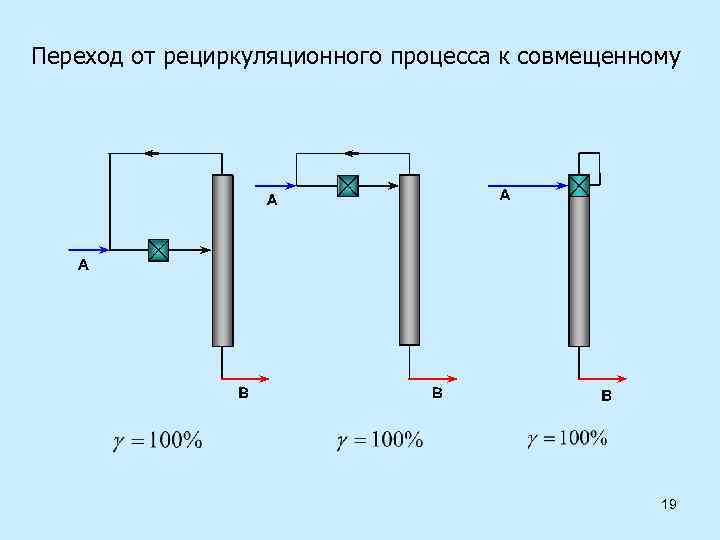
Переход от рециркуляционного процесса к совмещенному 19
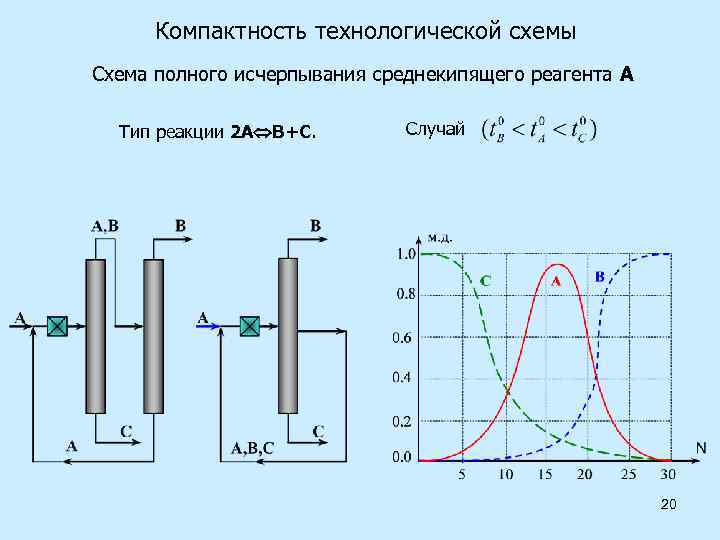
Компактность технологической схемы Схема полного исчерпывания среднекипящего реагента А Тип реакции 2 А В+С. Случай 20
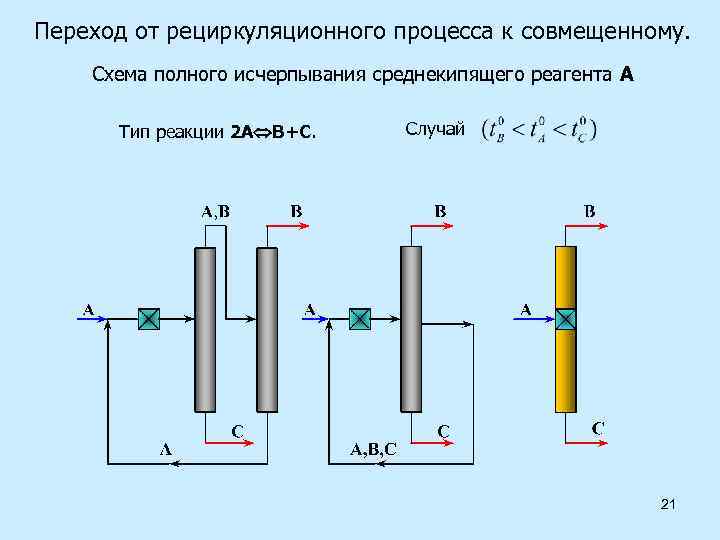
Переход от рециркуляционного процесса к совмещенному. Схема полного исчерпывания среднекипящего реагента А Тип реакции 2 А В+С. Случай 21

Качественные методы анализа химико- технологических систем. Необходимо исключить из рассмотрения по возможности большую часть таких параметров, изменение значений которых приводит лишь к количественным, а не качественным изменениям состояния процесса. Такой подход позволяет существенно упростить математическую модель процесса, сделав ее качественной, а не количественной. Подобное упрощение математической модели возможно при переходе к анализу предельных ХТС, в которых рассматриваются абстрактные, идеализированные аппараты, функционирующие в режимах, максимально эффективных по отношению к протекающим в них процессам. Поскольку при подобных допущениях речь идет об абстрактных аппаратах, то рассматриваемую задачу следует формулировать как проверку принципиальной работоспособности ХТС.

Модель ректификационной колонны Математическая модель простой ректификационной колонны. В поверочном варианте расчета f и рабочее давление P заданы Свободные параметры Зависимые переменные w, d, r

Модель ректификационной колонны Свойства отображения Ψ Модель полного конденсатора Балансовые уравнения Суммарный поток дистиллата , Количество уравнений Общее количество неизвестных. Не хватает равно 3 m уравнений Необходимо дописать материальные и тепловые балансы для каждой тарелки, вместе с уравнениями, описывающими фазовое равновесие в системе.

Модель ректификационной колонны Полная модель ректификационной колонны Модель ректификационной колонны бесконечной высоты в режиме бесконечной флегмы Eдинственным управляющим параметром, определяющим составы куба и дистиллята, является величина отбора дистиллята D или величина отбора кубового потока

Модель ректификационной колонны Полная модель ректификационной колонны Модель ректификационной колонны бесконечной высоты в режиме бесконечной флегмы Eдинственным управляющим параметром, определяющим составы куба и дистиллята, является величина отбора дистиллята D или величина отбора кубового потока
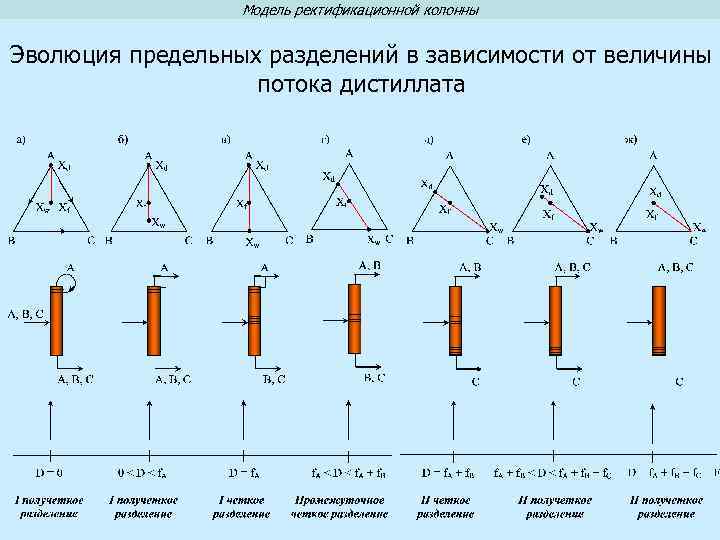
Модель ректификационной колонны Эволюция предельных разделений в зависимости от величины потока дистиллата
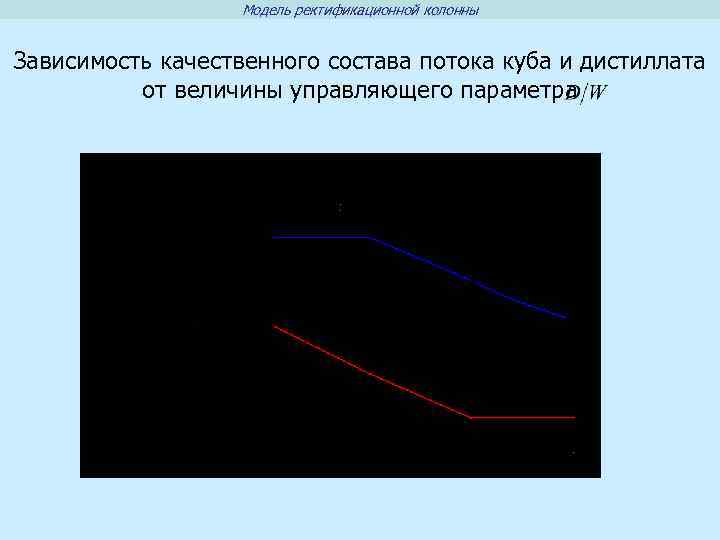
Модель ректификационной колонны Зависимость качественного состава потока куба и дистиллата от величины управляющего параметра .

Модель ректификационной колонны бесконечной высоты, работающей в режиме бесконечной флегмы .

Модель ректификационной колонны Тип разделения A-ABC Система линейных алгебраических уравнений Значения неизвестных Система ограничений (A, B, C)
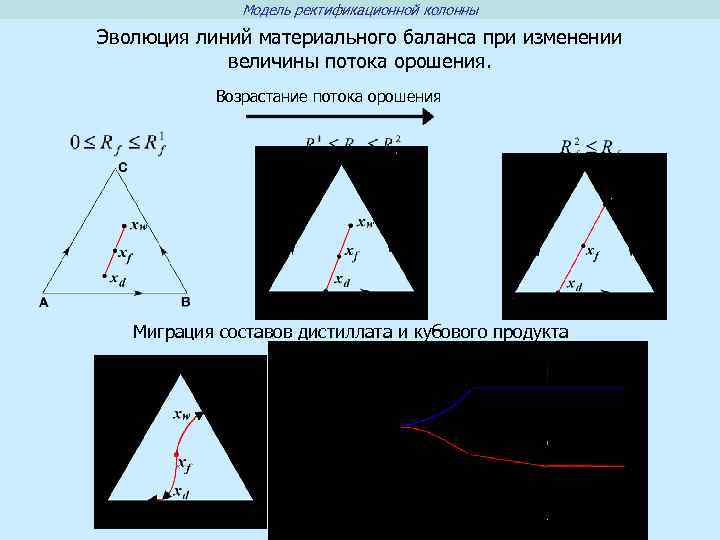
Модель ректификационной колонны Эволюция линий материального баланса при изменении величины потока орошения. Возрастание потока орошения Миграция составов дистиллата и кубового продукта
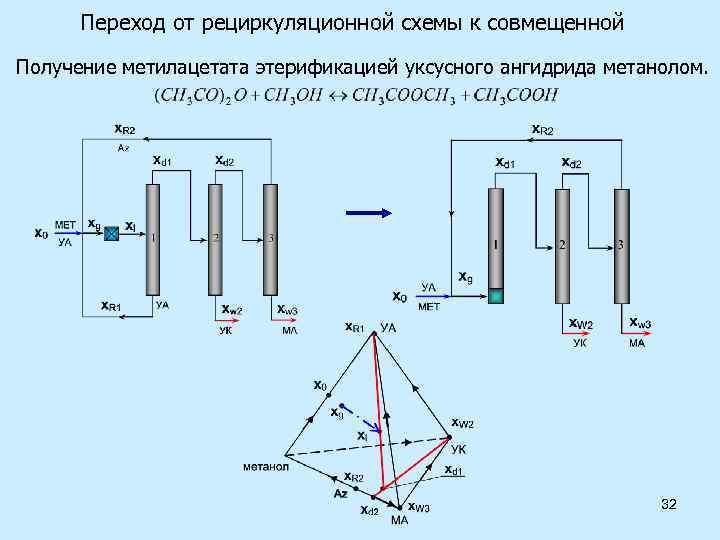
Переход от рециркуляционной схемы к совмещенной Получение метилацетата этерификацией уксусного ангидрида метанолом. 32
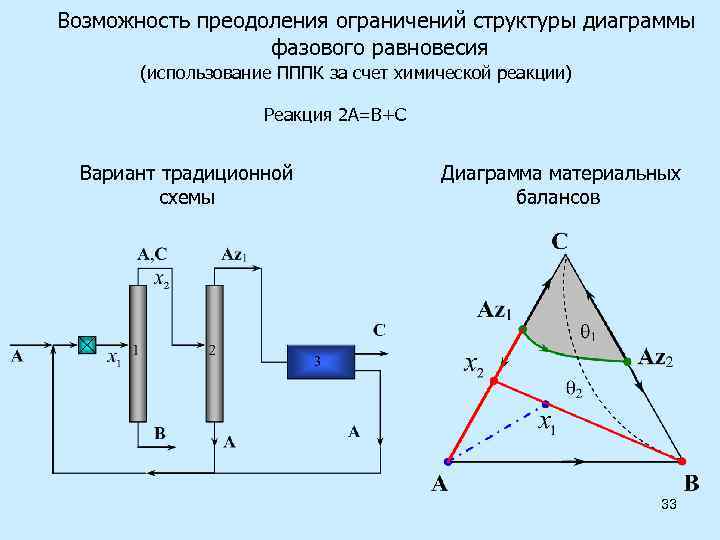
Возможность преодоления ограничений структуры диаграммы фазового равновесия (использование ПППК за счет химической реакции) Реакция 2 А=В+С Вариант традиционной схемы Диаграмма материальных балансов 33
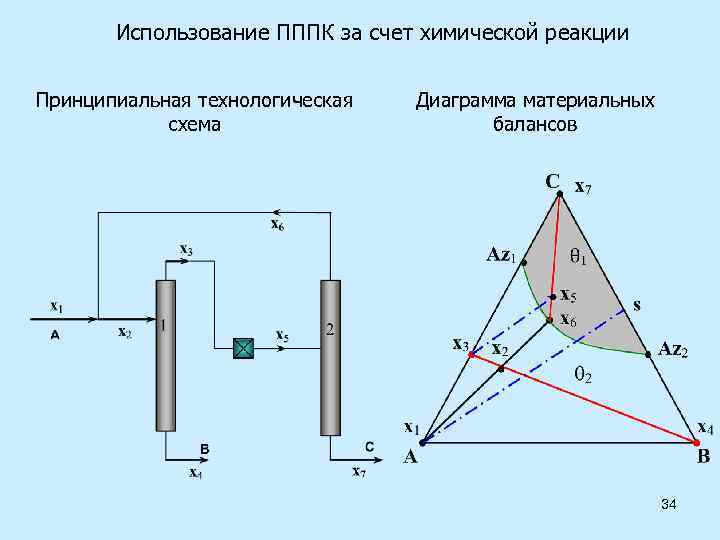
Использование ПППК за счет химической реакции Принципиальная технологическая схема Диаграмма материальных балансов 34

Типы сложных химических реакций Параллельные реакции Последовательные реакции В А А В С Селективность дифференциальная интегральная 35 С

Способы влияния на селективность Влияние на константу скорости реакции 1. Изменение температуры 2. Использование катализатора Влияние на концентрацию в реакционной зоне 1. Выбор гидродинамического режима 2. Использование рециркуляции 36

Влияние рециркуляции на селективность Случай параллельных химических реакций Динамическая система В А С 37
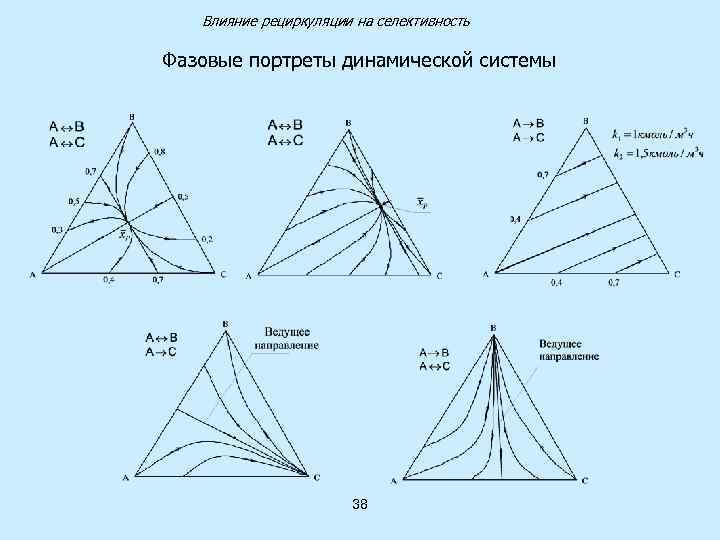
Влияние рециркуляции на селективность Фазовые портреты динамической системы 38
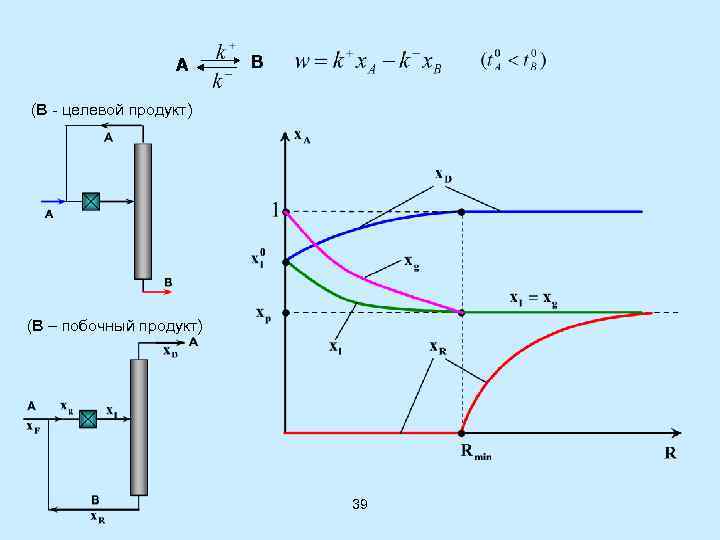
А В (В - целевой продукт) (В – побочный продукт) 39
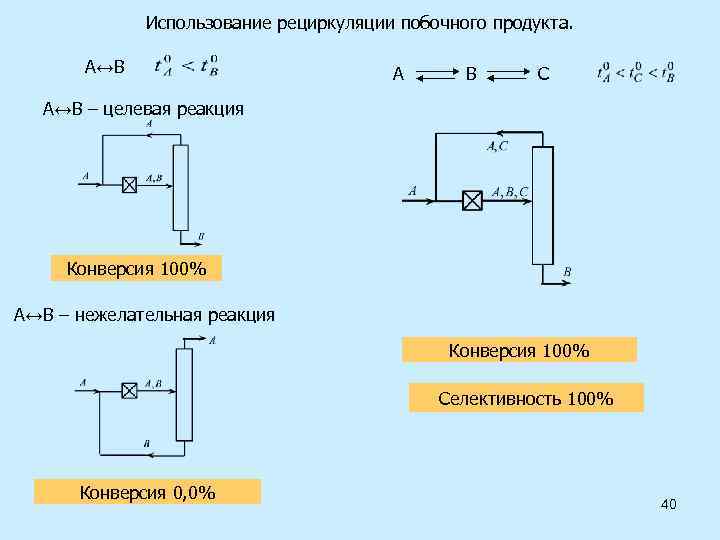
Использование рециркуляции побочного продукта. А↔В А В С А↔В – целевая реакция Конверсия 100% А↔В – нежелательная реакция Конверсия 100% Селективность 100% Конверсия 0, 0% 40
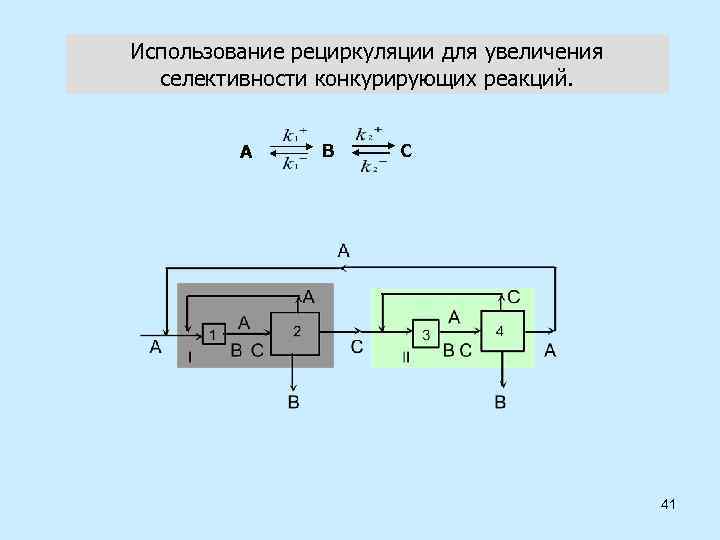
Использование рециркуляции для увеличения селективности конкурирующих реакций. А В С 41
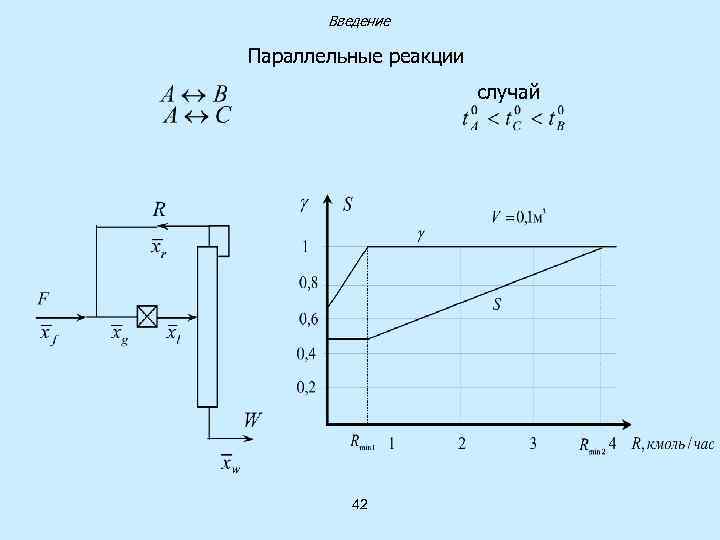
Введение Параллельные реакции случай 42
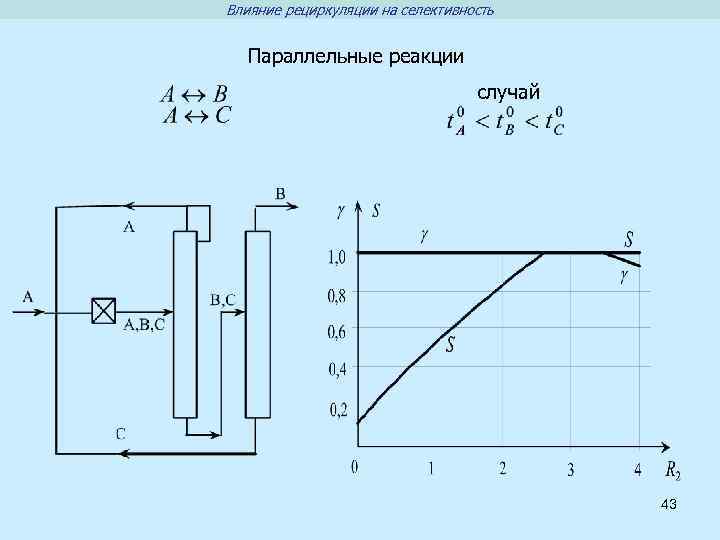
Влияние рециркуляции на селективность Параллельные реакции случай 43
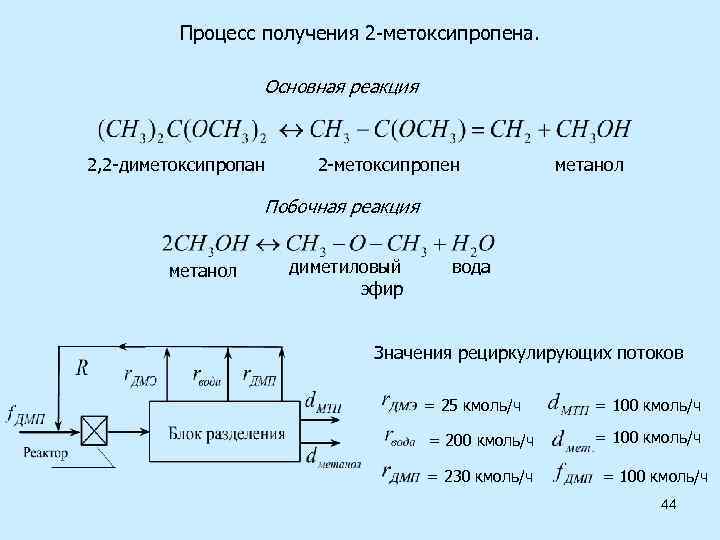
Процесс получения 2 -метоксипропена. Основная реакция 2, 2 -диметоксипропан 2 -метоксипропен метанол Побочная реакция метанол диметиловый эфир вода Значения рециркулирующих потоков = 25 кмоль/ч = 200 кмоль/ч = 230 кмоль/ч = 100 кмоль/ч 44
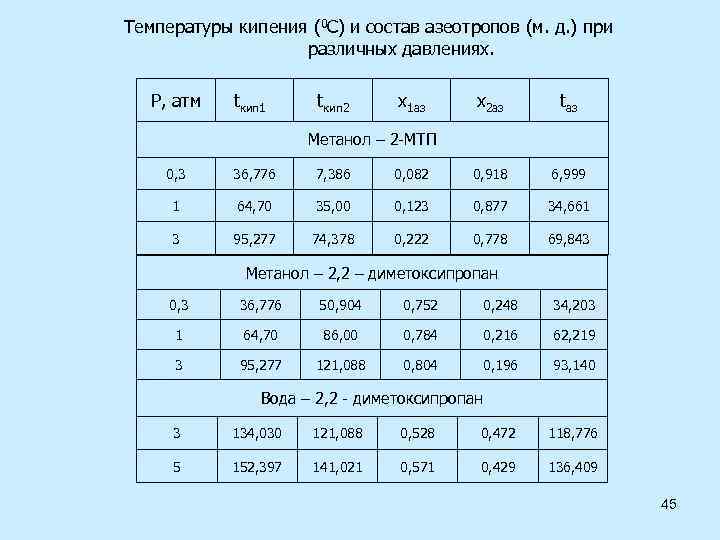
Температуры кипения (0 C) и состав азеотропов (м. д. ) при различных давлениях. P, атм tкип 1 tкип 2 x 1 аз x 2 аз tаз Метанол – 2 -МТП 0, 3 36, 776 7, 386 0, 082 0, 918 6, 999 1 64, 70 35, 00 0, 123 0, 877 34, 661 3 95, 277 74, 378 0, 222 0, 778 69, 843 Метанол – 2, 2 – диметоксипропан 0, 3 36, 776 50, 904 0, 752 0, 248 34, 203 1 64, 70 86, 00 0, 784 0, 216 62, 219 3 95, 277 121, 088 0, 804 0, 196 93, 140 Вода – 2, 2 - диметоксипропан 3 134, 030 121, 088 0, 528 0, 472 118, 776 5 152, 397 141, 021 0, 571 0, 429 136, 409 45
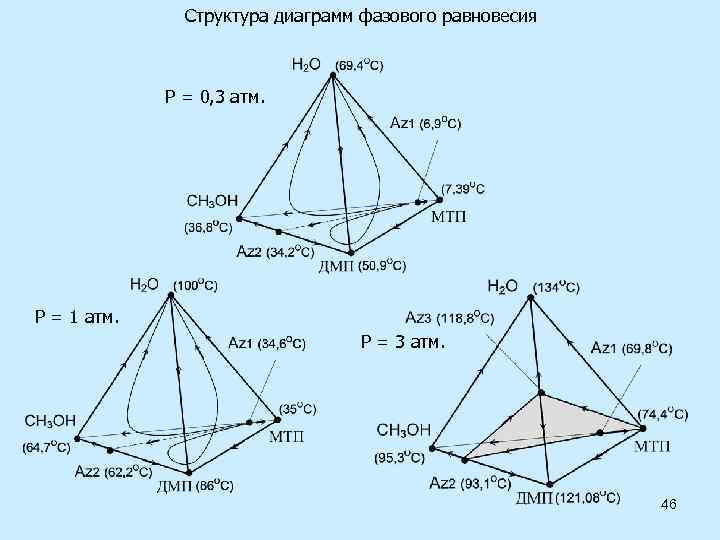
Структура диаграмм фазового равновесия Р = 0, 3 атм. Р = 1 атм. Р = 3 атм. 46
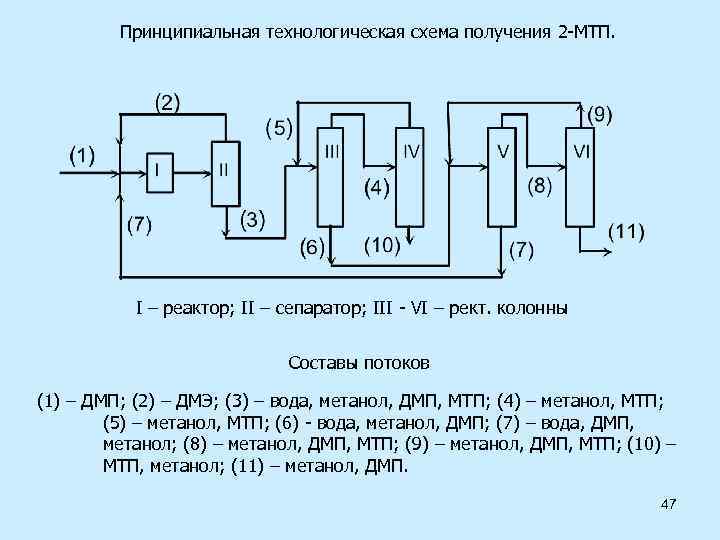
Принципиальная технологическая схема получения 2 -МТП. I – реактор; II – сепаратор; III - VI – рект. колонны Составы потоков (1) – ДМП; (2) – ДМЭ; (3) – вода, метанол, ДМП, МТП; (4) – метанол, МТП; (5) – метанол, МТП; (6) - вода, метанол, ДМП; (7) – вода, ДМП, метанол; (8) – метанол, ДМП, МТП; (9) – метанол, ДМП, МТП; (10) – МТП, метанол; (11) – метанол, ДМП. 47
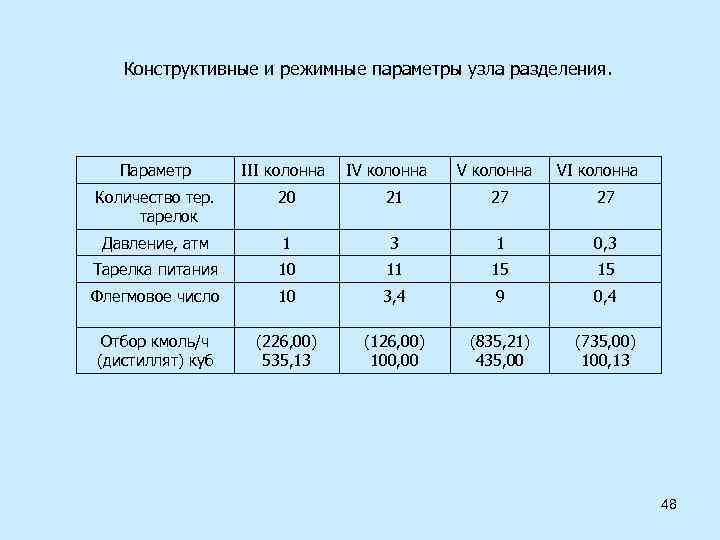
Конструктивные и режимные параметры узла разделения. Параметр III колонна IV колонна VI колонна Количество тер. тарелок 20 21 27 27 Давление, атм 1 3 1 0, 3 Тарелка питания 10 11 15 15 Флегмовое число 10 3, 4 9 0, 4 Отбор кмоль/ч (дистиллят) куб (226, 00) 535, 13 (126, 00) 100, 00 (835, 21) 435, 00 (735, 00) 100, 13 48
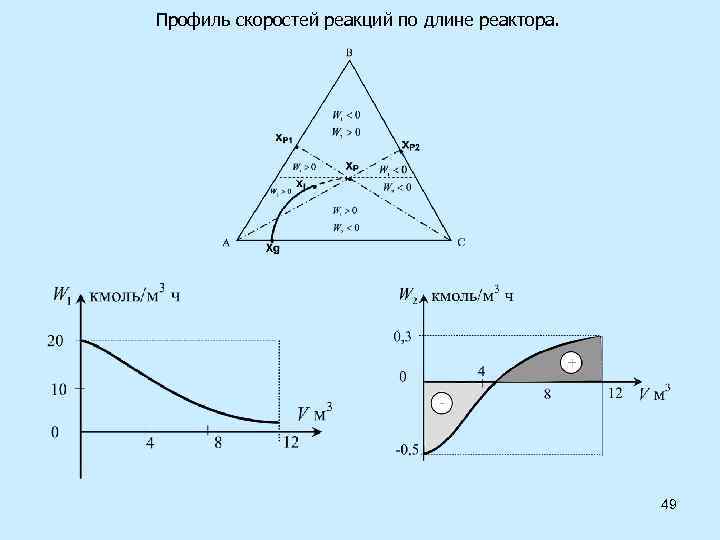
Профиль скоростей реакций по длине реактора. 49

Причины, сдерживающие широкое использование рециркуляции на практике. 1. Классические традиции промышленной химии. 2. Дополнительные капитальные и энергетические затраты на узел разделения. 3. Накопление примесей за счет частичной открытости системы. 4. Недостаточное развитие теории рециркуляции при использовании конкретных разделительных процессов. 5. Сложность пусковых режимов и управления процессом. 50
рец. Солохин 1.ppt