лекции кристаллография и минералогия.pptx
- Количество слайдов: 67

РЕАЛЬНЫЕ КРИСТАЛЛЫ

*Кристаллами обычно называют твердые тела, образующиеся в природных или лабораторных условиях в виде многогранников. Слово «кристаллос» у древних греков обозначало лед. Так же назывался и водяно прозрачный кварц, считавшийся окаменевшим льдом. Впоследствии этот термин был распространен на все тела с природной многогранной формой. В настоящее время к кристаллам относят все твердые образования со строго закономерным внутренним строением, хотя внешне они не обладают геометрически правильной формой. *Поверхность кристаллов ограничена более или менее совершенными плоскостями (гранями), пересекающимися по прямым линиям (ребрам). Точки пересечения ребер образуют вершины.
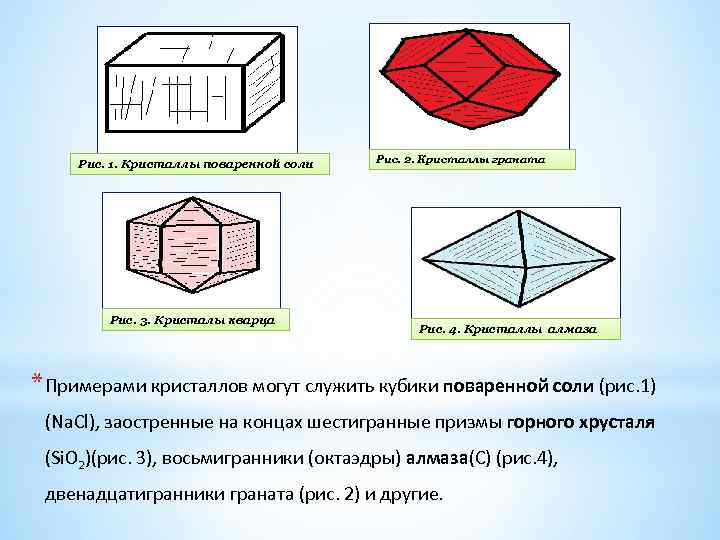
Рис. 1. Кристаллы поваренной соли Рис. 3. Кристалы кварца Рис. 2. Кристаллы граната Рис. 4. Кристаллы алмаза * Примерами кристаллов могут служить кубики поваренной соли (рис. 1) (Na. Cl), заостренные на концах шестигранные призмы горного хрусталя (Si. O 2)(рис. 3), восьмигранники (октаэдры) алмаза(С) (рис. 4), двенадцатигранники граната (рис. 2) и другие.
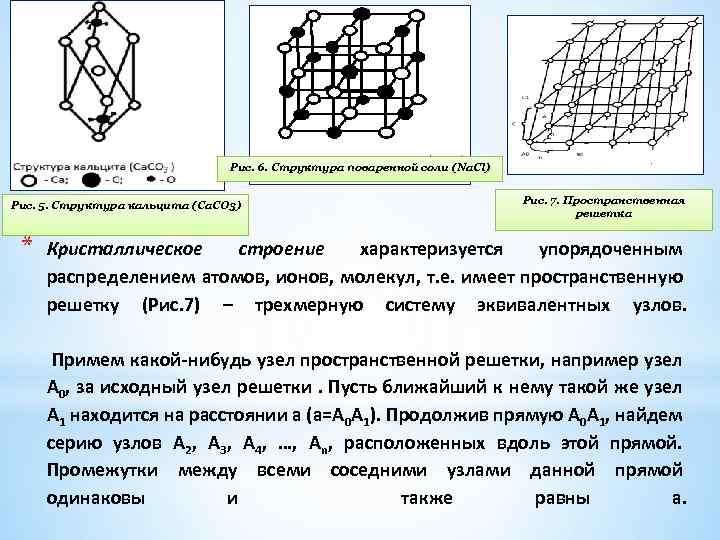
Рис. 6. Структура поваренной соли (Na. Cl) Рис. 5. Структура кальцита (Са. СO 3) * Рис. 7. Пространственная решетка Кристаллическое строение характеризуется упорядоченным распределением атомов, ионов, молекул, т. е. имеет пространственную решетку (Рис. 7) – трехмерную систему эквивалентных узлов. Примем какой-нибудь узел пространственной решетки, например узел А 0, за исходный узел решетки. Пусть ближайший к нему такой же узел А 1 находится на расстоянии а (а=А 0 А 1). Продолжив прямую А 0 А 1, найдем серию узлов А 2, А 3, А 4, …, Аn, расположенных вдоль этой прямой. Промежутки между всеми соседними узлами данной прямой одинаковы и также равны а.
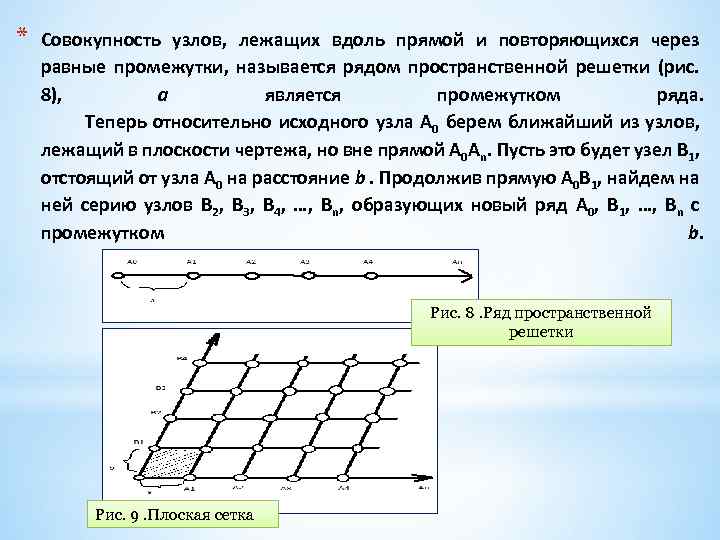
* Совокупность узлов, лежащих вдоль прямой и повторяющихся через равные промежутки, называется рядом пространственной решетки (рис. 8), а является промежутком ряда. Теперь относительно исходного узла А 0 берем ближайший из узлов, лежащий в плоскости чертежа, но вне прямой А 0 Аn. Пусть это будет узел В 1, отстоящий от узла А 0 на расстояние b. Продолжив прямую А 0 В 1, найдем на ней серию узлов В 2, В 3, В 4, …, Вn, образующих новый ряд А 0, В 1, …, Вn с промежутком b. Рис. 8. Ряд пространственной решетки Рис. 9. Плоская сетка

*Проведя через узлы В 1, В 2, …, Вn прямые, параллельные первому ряду А 0, А 1, …, Аn, получим серию рядов во всем ему аналогичных (промежутки построенных рядов по прежнему равны а). Через узлы А 1, А 2, …, Аn проводим параллельно ряду А 0, В 1, …, Вn аналогичные ему ряды (во всех этих рядах расстояния между соседними узлами равны b). *В результате получаем так называемую плоскую сетку (Рис. 9) совокупность узлов, расположенных в одной плоскости и находящихся в вершинах системы равных параллелограммов параллельно ориентированных и смежных по целым сторонам. Такие параллелограммы полностью (без промежутков) покрывают плоскость чертежа [один из них заштрихован]. Плоская сетка Аn. А 0 Вn образуется двумя рядами: А 0, А 1, …, Аn и В 0, В 1, …, Вn.

*При построении плоских сеток, взаимно пересекаясь, образуют совокупность вышеупомянутых параллелепипедов. Полученные параллелепипеды, будучи равными, параллельно ориентированными и смежными по целым граням, без остатка заполняют пространство. Их вершины соответствуют узлам пространственной решетки. Подобное построение приводит к бесконечным фигурам. *В реальных кристаллических структурах на местах узлов пространственной решетки могут находится либо нейтральные атомы, либо заряженные атомы (ионы), либо группы атомов или ионов. Если такая группа в целом нейтральна, ее называют молекулой, если же она заряжена – радикалом. При этом вершины, ребра, грани кристаллов соответствуют узлам, рядам и плоским сеткам пространственной решетки. Заметим, что реальные ребра кристаллов отвечают рядам, густо усаженным материальными частицами, а реальные грани – сеткам, густо покрытым частицами.

*Таким образом, кристаллическая структура кристалла – это способ представления периодичности повторения в пространстве отдельных материальных частиц или их групп (или «пустых» мест между частицами). Узел плоской сетки или пространственной решетки не обязательно отождествлять с атомом, ионом или иной частицей. *Узел решетки может не совпадать с материальной частицей, обязательна лишь идентичность расположения частиц вокруг узла. Для простоты обычно считают, что узлы решетки совпадают с материальными частицами. Пространственная решетка строится на трех основных (трансляциях) параметрах (a, b, c), определяющих элементарную ячейку. В зависимости от величин и взаимной ориентировки трансляций a, b, c, пространственные решетки имеют различную симметрию. Теперь дадим более точное определение кристаллов.

* Кристаллы – это все твердые тела, в которых частицы (атомы, ионы, молекулы) расположены закономерно в виде узлов пространственных решеток. * Твердые тела, в которых частицы располагаются в общем беспорядочно называют аморфными (стекло, пластмасса и др. ). Аморфное вещество не является устойчивым и обнаруживает с течением времени тенденцию к кристаллизации. Кристаллическое состояние твердого тела более устойчиво (при образовании кристаллов теплота выделяется, при их разрушении – растворении – теплота поглощается).
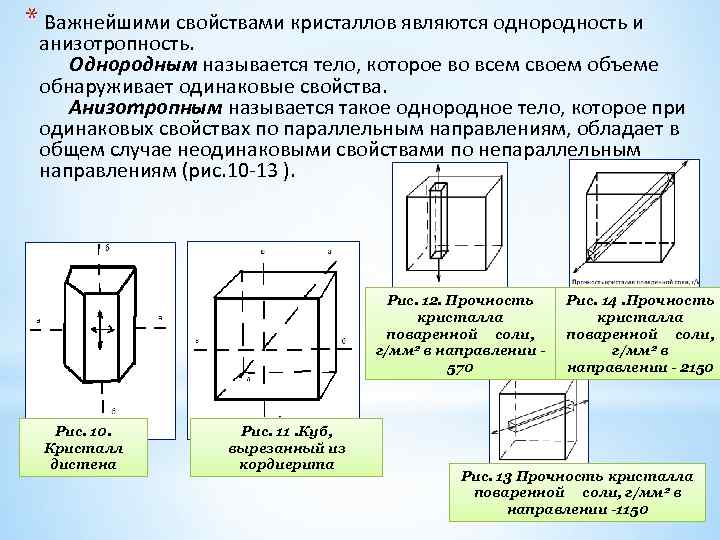
* Важнейшими свойствами кристаллов являются однородность и анизотропность. Однородным называется тело, которое во всем своем объеме обнаруживает одинаковые свойства. Анизотропным называется такое однородное тело, которое при одинаковых свойствах по параллельным направлениям, обладает в общем случае неодинаковыми свойствами по непараллельным направлениям (рис. 10 13 ). Рис. 12. Прочность кристалла поваренной соли, г/мм 2 в направлении 570 Рис. 10. Кристалл дистена Рис. 11. Куб, вырезанный из кордиерита Рис. 14. Прочность кристалла поваренной соли, г/мм 2 в направлении - 2150 Рис. 13 Прочность кристалла поваренной соли, г/мм 2 в направлении -1150

Характерный пример резко выраженной анизотропности представляет слюда. Кристаллические пластины этого минерала легко расщепляются лишь по плоскостям, параллельным его пластинчатости. В поперечных направлениях расщепить слюдяные пластины значительно труднее. Другим ярким примером анизотропности является минерал дистен (Al 2 O[Si. O 4]) отличаю щийся твердостью по неодинаковым направлениям: вдоль удлинения бб кристаллы дистена легко царапаются лезвием ножа, в направлении аа, перпендикулярном удлинению, нож не оставляет никаких следов. *Твердые аморфные образования также могут быть однородными и даже анизотропными (анизотропность, например, может наблюдаться при растягивании или сдавливании стекол), но ни при каких условиях они не могут сами по себе принимать многогранную форму.

Кристалл называется идиоморфным, если он огранен свойственными ему достаточно хорошо развившимися гранями. Кристалл, не имеющий четких граней, называется ксеноморфным, например, кристаллические зерна формы во многих горных породах. Природная многогранная форма наглядно характеризует закономерность структуры кристалла и позволяет судить о симметрии его свойств.

СИММЕТРИЯ КРИСТАЛЛОВ

*Изучение кристаллов начнем с рассмотрения их внешней формы, поскольку морфология, являясь своеобразным ключом к пониманию сложного внутреннего строения кристаллов, их структурных особенностей, часто позволяет объяснить и даже предсказать ряд физических свойств кристаллических веществ, установить условия образования минералов. Огранка кристаллов может быть успешно использована также для направленных поисков и оценки месторождений полезных ископаемых. *Известный русский минералог и геохимик А. Е. Ферсман писал: «Кристалл неизменно несет на себе следы предыдущих моментов своего существования, и по его форме, по скульптуре его граней, мелочам и деталям его поверхности мы можем читать его прошлое»

* Симметрия – это наиболее общая закономерность, присущая строению и свойствам кристаллического вещества. Греческое слово «симметрия» в переводе на русский язык означает «соразмерность» . Представление о симметрии широко распространено в повседневной жизни. *Симметричными, например, называют венчики цветов, крылья бабочек, снежные звездочки. Человечество издавна пользовалось понятием симметрии, применяя его в самых разнообразных областях своей деятельности. Однако математическая разработка учения о симметрии была осуществлена лишь во второй половине прошлого столетия. Симметричная фигура должна состоять из закономерно повторяющихся равных частей.

*В элементарной геометрии равными называются обычно такие фигуры, которые при наложении одна на другую совпадают всеми точками. В кристаллографии равными считаются не только такие совместимо равные, но также и фигуры, относящиеся друг к другу как предмет и его зеркальное отражение (например, зеркальное равенство представляют правая и левая руки). *Переходя к кристаллам, надо помнить, что они являются реальными телами и что равные их части должны быть не только геометрически равными, но и физически одинаковыми. Примером симметричных фигур служат структуры кристаллов, которые можно схематически представить себе состоящими из параллельно ориентированных равных параллелепипедов.

Все сказанное относится к идеально развитым кристаллам. На реальных кристаллах в связи с несовершенными условиями образования тождественные по внутреннему строению симметричные грани могут развиваться неравномерно. Вместе с тем, согласно закону постоянства гранных углов, в кристаллах определенного вещества и величина граней, и форма их могут изменяться, но углы между соответственными гранями остаются постоянными. Поэтому при изучении симметрии реальных кристаллов необходимо основываться на углах между гранями. Таким образом, учение о симметрии базируется на геометрии.
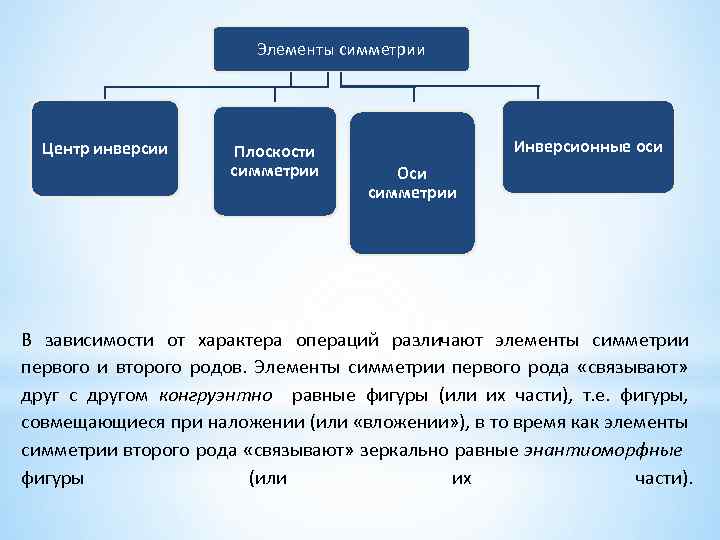
Элементы симметрии Центр инверсии Плоскости симметрии Инверсионные оси Оси симметрии В зависимости от характера операций различают элементы симметрии первого и второго родов. Элементы симметрии первого рода «связывают» друг с другом конгруэнтно равные фигуры (или их части), т. е. фигуры, совмещающиеся при наложении (или «вложении» ), в то время как элементы симметрии второго рода «связывают» зеркально равные энантиоморфные фигуры (или их части).
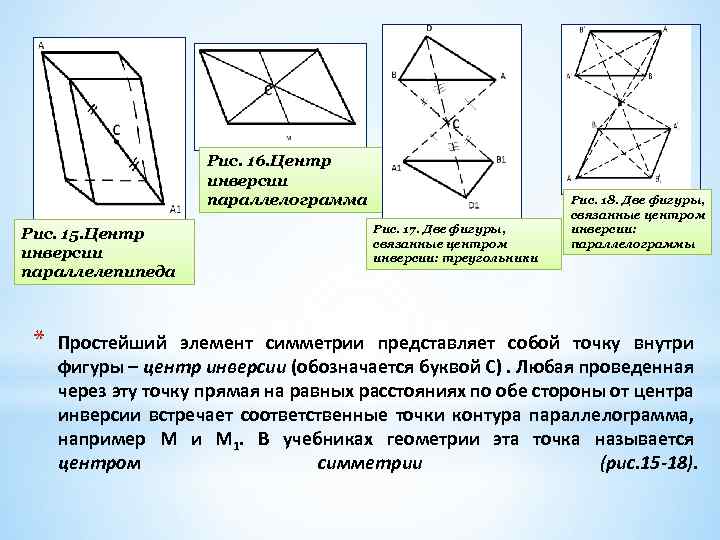
Рис. 16. Центр инверсии параллелограмма Рис. 15. Центр инверсии параллелепипеда * Рис. 17. Две фигуры, связанные центром инверсии: треугольники Рис. 18. Две фигуры, связанные центром инверсии: параллелограммы Простейший элемент симметрии представляет собой точку внутри фигуры – центр инверсии (обозначается буквой С). Любая проведенная через эту точку прямая на равных расстояниях по обе стороны от центра инверсии встречает соответственные точки контура параллелограмма, например М и М 1. В учебниках геометрии эта точка называется центром симметрии (рис. 15 -18).

Плоскости симметрии
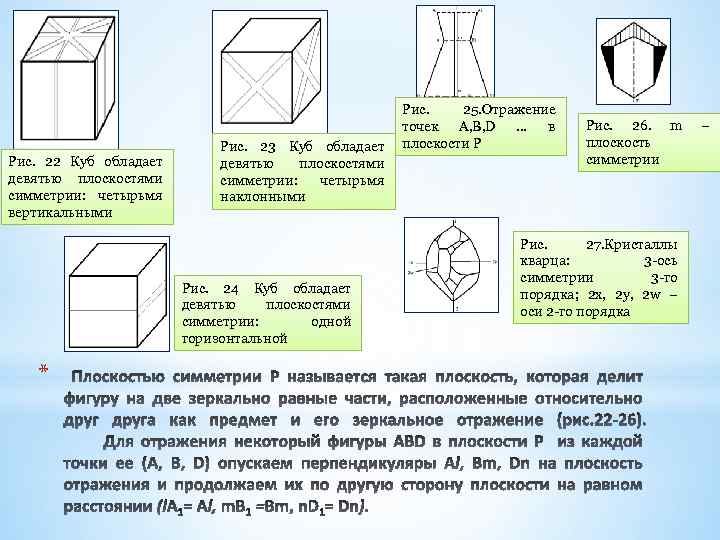
Рис. 22 Куб обладает девятью плоскостями симметрии: четырьмя вертикальными Рис. 23 Куб обладает девятью плоскостями симметрии: четырьмя наклонными Рис. 24 Куб обладает девятью плоскостями симметрии: одной горизонтальной * Рис. 25. Отражение точек А, B, D … в плоскости P Рис. 26. m плоскость симметрии Рис. 27. Кристаллы кварца: 3 -ось симметрии 3 -го порядка; 2 x, 2 y, 2 w – оси 2 -го порядка –


*Таким образом, симметрия означает возможность преобразования объекта, совмещающего с собой. Если F(x 1, x 2, x 3) – функция, описывающая объект, например форму кристалла в трехмерном пространстве или какое либо его свойство, а операция g[x 1, x 2, x 3] осуществляет преобразование координат всех точек объекта, то g является операцией, или преобразованием симметрии, а F симметричным объектом, если выполняются условия: *В кристаллах возможны только оси симметрии 1, 2, 3, 4, 6 -го порядков, а оси 5 -го порядка и выше 6 -го – невозможны. Это ограничение обусловлено тем, что кристаллическое вещество – бесконечная система материальных частиц, симметрично повторяющихся в пространстве. Такие симметричные бесконечные ряды, сетки, решетки, непрерывно заполняющие пространство, не совместимы с осями 5, 7 го и других порядков.
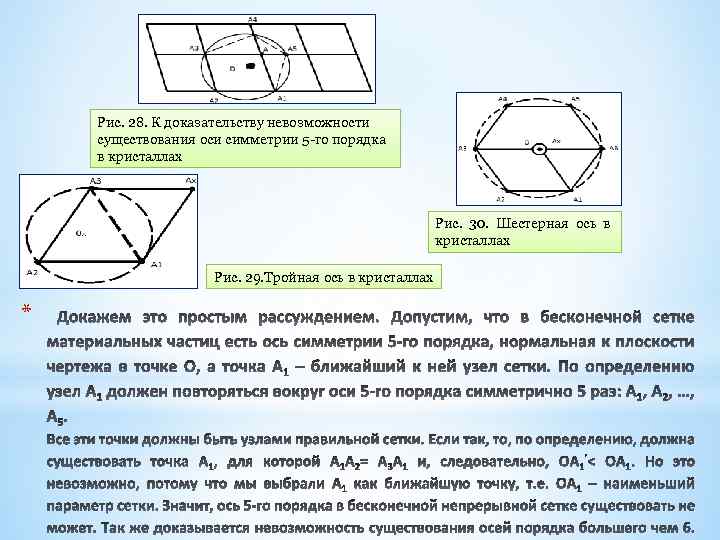
Рис. 28. К доказательству невозможности существования оси симметрии 5 -го порядка в кристаллах Рис. 30. Шестерная ось в кристаллах Рис. 29. Тройная ось в кристаллах *
![Группы симметрии кристаллов Совокупность операций симметрии [g 1…gn] данного кристалла образует группу симметрий G Группы симметрии кристаллов Совокупность операций симметрии [g 1…gn] данного кристалла образует группу симметрий G](https://present5.com/presentation/1/47894357_170449526.pdf-img/47894357_170449526.pdf-25.jpg)
Группы симметрии кристаллов Совокупность операций симметрии [g 1…gn] данного кристалла образует группу симметрий G в смысле математической теории групп. Последовательное проведение двух операций симметрии также является операцией симметрии. Всегда существует операция идентичности g 0, ничего не изменяющая в кристалле, называемая отождествлением, геометрически соответст вующая неподвижности объекта или повороту его на 360° вокруг любой оси. Число операций, образующих группу G, называется порядком группы. Группы симметрии классифицируют: по числу n измерений пространства, в которых они определены; по числу m измерений пространства, в которых объект периодичен (их обозначают Gmn) и по некоторым другим признакам. Для характеристики кристаллов используют различные группы симметрии, из которых важнейшими являются пространственные группы симметрии G 33, описывающие атомную структуру кристаллов, и точечные группы симметрии G 03, описывающие их внешнюю форму. Последние называются также кристаллографическими классами.
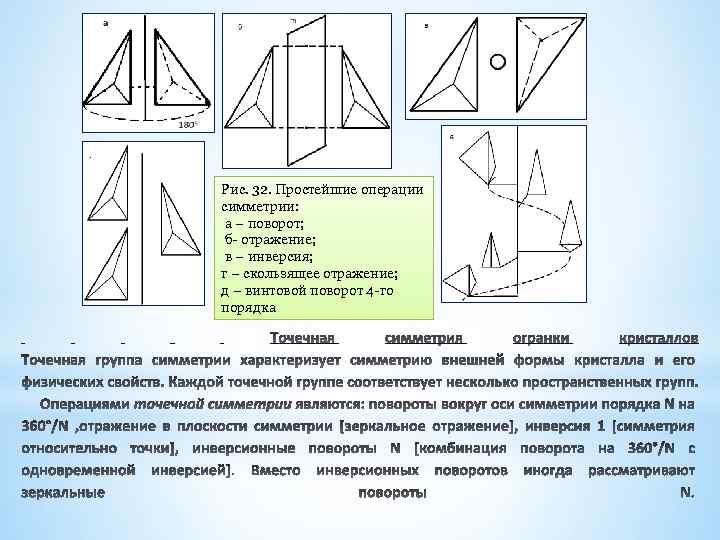
Рис. 32. Простейшие операции симметрии: а – поворот; б- отражение; в – инверсия; г – скользящее отражение; д – винтовой поворот 4 -го порядка

*Стереографическая проекция - это способ перенесения сферической (объемной) проекции на экваториальную плоскость чертежа. Как указывалось ранее, в кристаллах в виду наличия кристаллической решетки возможны только операции и, соответственно, оси симметрии до 6 го порядка (кроме 5 го), которые обозначаются символами: 1, 2, 3, 4, 6, а также инверсионные оси: 1 (она же центр инверсии), 2=m (она же плоскость симметрии), 3, 4, 6. *Взаимодействие простых элементов симметрии (зеркальных плоскостей, поворотных и инверсионных осей симметрии) приводит к 32 их сочетаниям – 32 классам (точечным группам) симметрии, описывающим внешнюю форму кристаллов. Эти группы объединяются по симметрии формы элементарной ячейки (с периодами a, b, c и углами λ, β, γ) в 7 кристаллографических сингоний.

Сингония(греч. ) – сходноугольность. Классы с единой координатной системой объединяются в одно семейство, называемое сингонией – системой. Принадлежность кристалла к той или иной группе определяется гониометрически или рентгенографически. Вывести из точечной группы все соответствующие ей пространственные группы достаточно сложная задача.

*Параллелепипед, построенный на векторах a, b, c, называется параллелепипедом повторяемости, или элементарной ячейкой кристалла. В ней содержится минимальная группировка атомов, «размножение» которой операциями симметрии, в том числе трансляциями, образует кристаллическую решетку. *Элементарная ячейка и размещение в ней атомов устанавливается методами рентгеновского структурного анализа, электронографии и нейтронографии.

ДИФРАКЦИОННАЯ КРИСТАЛЛОГРАФИЯ

*До открытия дифракции рентгеновских лучей и разработки рентгеноструктурного анализа кристаллические вещества характеризовали и отличали одно от другого только по углам между их гранями, которые измеряли с помощью угломерного прибора гониометра. * Однако основные свойства кристаллов определяются как их составом, так и внутренним строением, т. е. закономерностями расположения материальных частиц (атомов, ионов, молекул). *Поэтому особое значение при исследовании кристаллов имеют методы, дающие наиболее полные сведения об их атомной структуре, дифракционные и спектроскопические.

*Дифракция (от лат. diffractus- разломанный) волн – явления, наблюдаемые при прохождении волн мимо края препятствия, связанные с отклонением волн от прямолинейного распространения при взаимодействии с препятствием. Из-за дифракции волны огибают препятствия, проникая в область геометрической тени. Именно дифракцией звуковых волн объясняется: возможность слышать голос человека, находящегося за углом дома; прием радиосигналов в диапазоне длинных и средних радиоволн далеко за пределами прямой видимости излучающей антенны. *Дифракция волн не зависит от их природы, имеет место, если размеры неоднородностей порядка длины волны или больше. Например, дифракция света наблюдается при распространении света вблизи краев непрозрачных тел, сквозь узкие отверстия, щели и т. д. Дифракционная картина (чередование световых максимумов) является результатом интерференции световых волн.

*Дифракция частиц – это рассеяние потока микрочастиц (электронов, нейтронов, атомов, молекул и др. ) кристаллами или молекулами жидкостей и газов с образованием чередующихся максимумов и минимумов в интенсивности рассеяния пучка. *Дифракция частиц аналогична дифракции света и является следствием корпускулярно волнового диализа частиц; наблюдается для частиц, длина волны де Бройля которых порядка расстояния между рассеивающими центрами. Дифракционная картина зависит от внутреннего строения рассеивающего объекта. На дифракции частиц основаны электронография и нейтронография (методы исследования структуры кристалла).

*Дифракционная решетка – это оптический прибор: совокупность большого количества параллельных щелей в непрозрачном экране или отражающих зеркальных полосок (штрихов), равностоящих друг от друга, на которых происходит дифракция света. *Дифракционная решетка разлагает падающий поток света в спектр, что используется в спектральных приборах.

*Дифракция рентгеновских лучей в кристаллах – это рассеяние рентгеновых лучей кристаллическими объектами. *Длина волн рентгеновых лучей: от 140 до 0, 1Å (1Å=10 8 см). *В среднем длина волн рентгеновых лучей была впервые экспериментально подтверждена теория решетчатого строения кристалла, с их помощью стало возможно на конкретных примерах в абсолютных единицах измерять расстояния между атомами и устанавливать структуру (пространственное расположение атомов) исследованного кристаллического объекта. *Применение рентгенографических исследований позволяет диагностировать минералы, определять качественный и количественный состав руд и горных пород, исследовать фазовые превращения в минералах под воздействием высоких и низких температур, высоких давлений, изучать изоморфные примеси, степень дисперсности минералов, совершенство строений и дефектности структур.


При изоморфизме разные, хотя и сходные по химическому составу, вещества кристаллизуются в близких в геометрическом отношении структурах. Помимо геометрического сходства структур, обусловленного близостью объемных размеров структурных единиц, для изоморфных кристаллов необходимо сходство типа химической связи и типа структуры. Различают совершенный, изовалентный, гетеровалентный и усложненный изоморфизм.

*В сериях химически сходных соединений можно проследить закономерное изменение структуры кристаллов, связанное с заменой одного элемента структуры другим, например, у Na. Cl и Cs. Cl. *Подобное изменение структуры параллельно с изменением химического состава носит название морфотропии.

*Мысленно каждому атому или иону приписывают некоторую сферу действия, внутрь которой никакие другие атомы или ионы проникать не могут. *Такая сфера действия носит название атомной или ионной сферы, а ее радиус – атомного или ионного эффективного радиуса. * Эффективный атомный (ионный) радиус (ниже просто радиус) равен минимальному расстоянию, на которое центр сферы данного атома (иона) может приблизится к поверхности сфер соседних атомов (ионов).
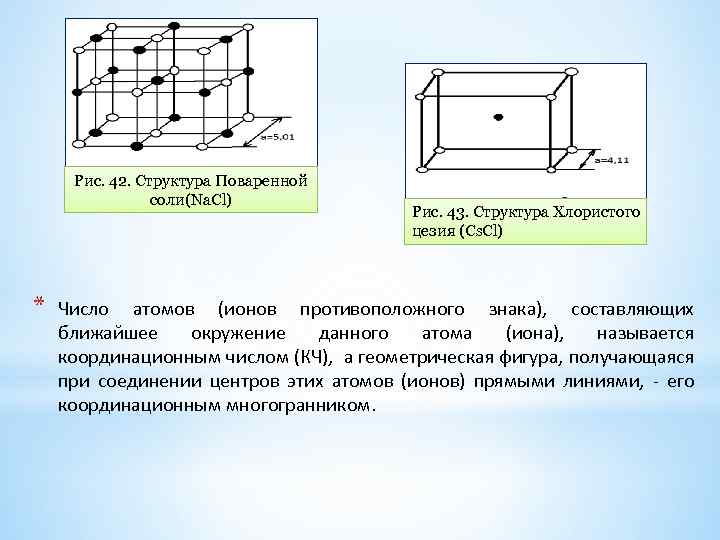
Рис. 42. Структура Поваренной соли(Na. Cl) * Рис. 43. Структура Хлористого цезия (Cs. Cl) Число атомов (ионов противоположного знака), составляющих ближайшее окружение данного атома (иона), называется координационным числом (КЧ), а геометрическая фигура, получающаяся при соединении центров этих атомов (ионов) прямыми линиями, его координационным многогранником.

*Геометрической схемой периодичности является пространственная решетка. Материальные частицы совершают гармонические колебания около своих положений равновесия, причем амплитуды колебаний частиц зависят лишь от внешних условий – от давления и температуры. Количественные соотношения между разнородными атомами точно отвечают стехиометрической формуле вещества.

Дефекты структуры связаны с изменением расстояний частицы до ближайших соседей, отсутствием атома (иона) в каком либо узле решетки, со смещением атома (иона) из узла в междуузлие, с временными местными нарушениями структуры, вызванными световыми, рентгеновскими и γ–лучами, потоком α частиц либо нейтронов, или нарушениями, вызванными условиями образования руды. *

* Выделяют следующие типы дефектов решетки: точечные, линейные, дислокации, поверхностные (двумерные) и объемные (трехмерные). • Точечные дефекты *Точечные дефекты (нуль-мерные) – это нарушения периодичности в изолированных друг от друга точках решетки; во всех трех измерениях они не превышают одного или нескольких междуатомных расстояний. *Точечные дефекты – это вакансии, атомы в междуузлиях, атомы в узлах «чужой» подрешетки, примесные атомы в узлах или междуузлиях(рис. 45 ). Рис. 45. Основные типы точечных дефектов в криссталической решетке: А-атом примеси замещения; В- вакансия; С – атом в междуузлии; D- атом примеси внедрения; E - дивакансия

* К простейшим точечным дефектам кристалла относят вакансии (отсутствие атома или иона в узле кристаллической решетки) и внедренные, или междуузельные, атомы или ионы, располагающиеся на «незаконном» месте между узлами. *Внедренными могут быть как собственные, так и примесные атомы или ионы, отличающиеся от основных атомов по размеру или валентности. Примеси замещения заменяют частицы основного вещества в узлах решетки. Они внедряются в решетку тем легче, чем ближе атомные (ионные) радиусы примесного и основного вещества. *Примеси внедрения занимают междуузлия, и притом тем легче, чем больше объем пространства между атомами. *Точечные дефекты могут двигаться через кристалл, взаимодействовать друг с другом и с другими дефектами. *Встречаясь друг с другом, вакансия и междуузельный атом могут аннигилировать.

• Линейные дефекты *Линейные дефекты - это нарушение правильности структуры вдоль линии. *Поперечные размеры линейного дефекта не превышают одного или нескольких междуатомных расстояний, а длина может достигать размера кристалла. *Линейные дефекты могут быть нестабильными и устойчивыми. * К нестабильным линейным дефектам кристалла относятся цепочки точечных дефектов (вакансий или междоузельных атомов); длительно существовать они не могут. * Устойчивыми, стабильными в кристалле являются дислокации, т. е. линейные искажения типа обрыва или сдвига атомных слоев, нарушающие правильность их чередования в решетке.
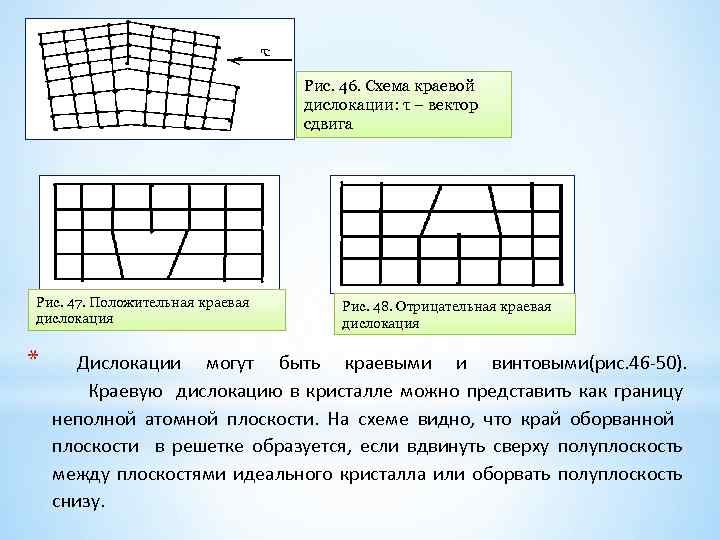
Рис. 46. Схема краевой дислокации: τ – вектор сдвига Рис. 47. Положительная краевая дислокация * Рис. 48. Отрицательная краевая дислокация Дислокации могут быть краевыми и винтовыми(рис. 46 50). Краевую дислокацию в кристалле можно представить как границу неполной атомной плоскости. На схеме видно, что край оборванной плоскости в решетке образуется, если вдвинуть сверху полуплоскость между плоскостями идеального кристалла или оборвать полуплоскость снизу.

Рис. 49. Сдвиг, создавший краевую дислокацию: АВ – линия краевой дислокации; СD - ступенька на поверхности кристалла; τ – вектор сдвига Рис. 50. Сдвиг, создавший винтовую дислокацию: ВС – линия винтовой дислокации; АВ - ступенька на поверхности кристалла; τ – вектор сдвига *

* Поверхностные (двумерные) дефекты простираются в двух измерениях на расстояния, сравнимые с размером кристалла, а в третьем - составляют несколько параметров решетки. *Таковы плоскости двойникования, границы зерен и блоков, стенки доменов, дефекты упаковки, и, наконец, сама поверхность кристалла. * * Двойником называют закономерный сросток двух однородных кристаллов. Домены – это области самопроизвольной намагниченности. Объемные (трехмерные) дефекты - это пустоты, поры, частицы другой фазы, включения. Для установления связи между геометрией кристаллов и их физическими свойствами далее кратко излагается физическая кристаллография.

ФИЗИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ * Все кристаллы в том или ином отношении обладают анизотропностью (разные свойства в зависимости от направления), следовательно характер большинства их физических свойств зависит от направления внутри кристаллического тела. Это так называемые векторные и тензорные физические свойства. * Существуют, однако, и не изменяющиеся в зависимости от направления скалярные физические свойства (масса, плотность, температура и др. ). * Рассмотрим некоторые из векторных и скалярных свойств. * Под твердостью подразумевается степень сопротивления материала внешнему механическому воздействию (по шкале Мооса твердость талька 1, кальцита 3, алмаза 10). * Спайностью называется свойство кристаллов раскалываться при ударе по плоскостям, параллельным действительным или возможным граням. * Магнитные свойства – это способность тела намагничиваться при помещении в магнитное поле H.


*Минералогия зародилась много веков назад как наука о природных ископаемых, веществах и продуктах, полученных из них. * Руда – это такое полезное ископаемое, которое содержит ценный элемент (элементы) в количестве, достаточном для того, чтобы его (их) извлечение было экономически выгодным. * Руда состоит из отдельных минералов. Минералы, которые необходимо извлечь в данном случае, называют ценными, а те, которые при этом не используются, являются минералами пустой породы. * По вещественному составу металлические полезные ископаемые подразделяются на руды черных, цветных, редких, благородных и радиоактивных металлов.

Характеристика основных минералов • Для выбора наиболее эффективного метода обогащения важно знать: в сульфидной или окисленной форме находится минерал, содержание в нем (и в руде) извлекаемого металла, плотность минерала, размер вкрапленности его в другие минералы, магнитные свойства и электропроводность минералов, их цвет, блеск, твердость и т. д. Все эти свойства могут быть использованы для выбора наиболее эффективной техно логической схемы обогащения руды. Минералы, содержащиеся в рудах цветных металлов, можно раз делить на сульфидные и несульфидные. Последние в свою очередь де лятся на окисленные, силикаты, алюмосиликаты, карбонаты, фосфаты и другие.

Типы Сульфиды Характеристика Минералы, представляющие собой соединение металлов и неметаллов с серой Карбонаты Минералы, содержащие углекислоту Основная масса минералов пустой породы, содержащейся в обогащаемых рудах, и значительная часть минералов редких металлов. Самая большая (92%) группа минералов Ca. CO 3 (кальцит) Алюмосиликаты Основные минералы в производстве лития (сподумен, берилл), глинозём, а также большая группа других минералов и минералов пустой породы Сподумен (Li. Al(Si. O 3)2) – до 8% Li. O берилл (3 Be. OAl 2 O 3 - 6 Si. O 2) – до 14% Be. O нефелин (Na 2 O·Al 2 O 3· 2 Si. O 2) Оксиды Значительная часть цветных и редкометалльных минералов Силикаты Примеры Галенит (Pb. S) Полевые шпаты, кварц, хризоколла (Cu. Si. O 3 H 2 O) – до 31% Cu Циркон (Zr. Si. O 4) – до 67% Zr. O 3 Куприт (Сu 2 О)

Минералы медных руд * Основными медьсодержащими минералами являются халькопирит, ковеллин, малахит, сопутствующими пирит, пирротин. * Халькопирит, медный колчедан, (Cu. Fe. S 2) один из важнейших медных минералов, он содержит 34, 6% Cu, 30, 5% Fe, 34, 9% S. В качестве примесей в ничтожных количествах иногда присутствует Ag, Au и др. * Ковеллин (Cu. S) в промышленных рудах присутствует как вторичный сульфидный минерал. Имеет сложную слоистую структуру. Он содержит 66, 5% Cu и 33, 5% S. Бывают примеси Fe, реже Se, Ag и Pb. * Малахит (Cu 2(CO)3(OH)2) является одним из основных промышленных минералов окисленных медных руд и содержит 57, 4% Cu. В очень небольших количествах устанавливается Ca. O, Fe 2 O 3 , Si. O 2 и др. * Пирит, или серный (железный) колчедан, (Fe. S 2) является самым распространенным сульфидным минералом во всех сульфидных рудах и имеет латунно – желтый цвет.

* Кристаллическая структура типа каменной соли (ионная). Содержит 46, 5% Fe, 53, 5% S. Нередко включает в очень небольших количествах примеси: Cu, Ag, и др. Никилистый пирит может содержать до 30, 6% Ni, а кобальтпирит – до 3% Co. Твердость 6, 0 6, 5, удельный вес 4, 9 5, 2. Спайность весьма несовершенная по (100) и (111), иногда по (110). Он хороший полупроводник (электричество проводит слабо). *Пирротин, или магнитный колчедан обычно обозначают Fe. S. Против формулы Fe. S всегда наблюдается «избыточное» содержание серы: вместо 36, 4% оно доходит до 39 40%. Из примесей иногда присутствуют в незначительных количествах Cu, Ni, Co, изредка Mn , Zn, и др. *Пирротин – наиболее легко окисляющийся сульфид. Лишь избыточное количество кислорода способно вызвать частичное окисление других сульфидов.

Минералы свинцовых руд * * Основные свинецсодержащие минералы галенит, церуссит, англезит. Галенит - (свинцовый блеск Pb. S) является основным свинцовым минералом во всех промышленных свинецсодержащих рудах. Он содержит 86, 6% Pb и 13, 4% S. Из примесей чаще всего присутствуют: Ag (до десятых долей процента), Cu, Zn, иногда Se, Bi. As, Sb, Mo и др. * Цвет свинцово серый, блеск металлический, твердость 2 3, хрупок, удельный вес 7, 4 7, 6, полупроводник, обладает слабой электропроводностью. * Церуссит, или белая свинцовая руда, (Pb. CO 3) содержит 77, 5% Pb, 16, 5% CO 2. * Из механических примесей могут присутствовать распыленные остатки Pb. S и Ag 2 S, обуславливающие черный цвет церуссита, изредка Zn. CO 3. * Редко встречающиеся кристаллы имеют белый цвет с сероватым, желтоватым или буроватым оттенком. Блеск алмазный, твердость 3, 0 3, 5, весьма хрупок, удельный вес 6, 4 6, 6.

*Англезит (Pb. SO 4) образуется в основном в зонах окисления свинцово цинковых сульфидных месторождений. Содержит 73, 6% Pb. O, (68, 3% Pb), 26, 4% SO 3. *Примеси обычно отсутствуют. Бесцветен. *Нередко окрашен гидроокислами железа в серый, желтоватый или бурый цвет. *Блеск алмазный, твердость 2, 5 3, 0, хрупок, удельный вес 6, 1 6, 4, спайность несовершенная по (010), (210) и средняя по (001).

* В медно цинковых рудах, так же как и в медных, основными медными минералами являются халькопирит, ковеллин, малахит, которые описаны выше. Кроме того, обязательно присутствует хотя бы один из цинксодержащих минералов (сфалерит, смитсонит и др. ). * Сфалерит, или цинковая обманка, (Zn. S) является основным промышленным минералом и обычно присутствует в гидротермальных залежах всех видов. * Смитсонит, или цинковый шпат, (Zn. CO 3) является типичным минералом зоны окисления месторождений первичных сульфидных руд цинка. Смитсонит содержит 52% Zn, 35, 2% CO 2. * Часто присутствуют в виде изоморфных примесей Fe, Mn, Mg, иногда Co. * Твердость 5, удельный вес 4, 1 4, 5, спайность по (1011) не вполне совершенна. * Обычно он встречается в виде зернистых или землистых масс и натечных агрегатов, крупные кристаллы редки и имеют ромбоэдрический и скаленоэдрический облик. * Смитсонит имеет окраску от белой до желтоватой и бурой.

Минералы никелевых руд • Миллерит, или сернистый никель, (Ni. S) содержит 64, 7 % Ni и 35, 3 % S. Латунно желтого цвета. В виде примесей в нем присут ствуют. Fe, Со, Сu. Миллерит присутствует в гидротермальных рудных жилах совместно с другими сульфидами никеля и кобальта, входящими в состав медно никелевых руд. Никелин, или красный никелевый колчедан, (Ni. As) содержит 43, 9 % Ni и 56, 1 % As, а также примеси Со, Fe и Sb. Цвет никелина бледный медно красный, черта буровато черная, хороший проводник электричества, хрупок.

Минералы золотосодержащих руд * Золото в рудах и россыпях находится главным образом в самородном виде, представляющем твердый раствор золота, в котором также содержатся примеси Ag, Cu, Pb, Bi, Pt, Hg. * Медистое самородное золото может содержать до 20% Cu и до 4% Bi. Содержание серебра может доходить до 43%. *Цвет самородного золота зависит от вида и содержания примеси и изменяется от бледно-желтого до красноватого и даже зеленоватого. *Золото не имеет спайности, мягкое, твердость 2, 5 , 19, 7 15, 5 г/см 3, обладает высокой электропроводностью.

Характеристика руд *Как было сказано выше, руда – это такое полезное ископаемое, которое содержит ценный элемент (элементы) в количестве, достаточном для того, чтобы его (их) извлечение было экономически выгодным. *Так как техника извлечения металлов непрерывно развивается, становится возможной переработка более бедных руд, чем прежде.

Классификация руд * Коренными называются руды, залегающие в месте первоначального образования и расположенные внутри общего массива горных пород. Эти руды после добычи из шахты или открытого рудника перед обогащением требуют предварительного дробления и измельчения. *Ценные минералы и минералы пустой породы в таких рудах находятся в тесной ассоциации между собой. * Россыпями называют вторичные месторождения, образовавшиеся в результате разрушения руд первичных коренных месторождений и вторичного отложения материала из первичных руд. *В россыпях минералы претерпели очень сильные изменения по химическому составу и физическим свойствам.

Медьсодержащие руды * Наибольшее промышленное значение имеют меднопорфировые руды, а также медно-пиритные (медно колчеданные) руды (месторождения СНГ, США, Канады, Мексики). * В зависимости от минерального состава, крупности минералов, характера вкрапленности ценных минералов и минералов пустой породы, формы рудного тела и генезиса, месторождения меди в настоящее время делятся на 6 генетических групп.

Медно-цинковые руды * Запасы медно-цинковых руд сосредоточены в основном в СНГ, Канаде, Финляндии, Норвегии и Японии. * Они представлены двумя типами: вкрапленными, содержащими 20 50% сульфидов, и сплошными, или колчеданными, в которых содержание сульфидных минералов, и в первую очередь пирита, может доходить до 90% и более.

Свинцово-цинковые руды * Руды, содержащие только свинцовые минералы, встречаются крайне редко. В них, как правило, кроме свинца содержится барит (свинцово баритовые руды), цинк (свинцово цинковые руды) и медь (свинцово медно цинковые руды). * Месторождения свинецсодержаших руд делятся на пять типов: скарновые, метасоматические, колчеданные, стратиформные и жильные. *Две трети всех запасов свинца и цинка находится в месторождениях колчеданного и стратиформного типов.

Полиметаллические руды * • Полиметаллические руды являются наиболее труднообогатимыми с техноло гической точки зрения. Они содержат свинец, цинк, медь и серу. Эти элементы представлены в основном сульфидными минералами, которые обладают не только близкими флотационными свойствами, но и взаимно влияют на флотируемость. Большинство полиметаллических руд относится к колчеданным, отличающимся высоким содер жанием пирита и реже пирротина. Руды характе ризуются непостоянством химического и минерального состава даже в пределах одного месторождения. Минералы пустой породы в полиметаллических рудах представлены также довольно широко: наряду с кварцем, кальцитом и доломитом, часто присутствуют барит, флюорит, апатит, мусковит, биотит, полевые шпаты. Эти минералы интенсивно изменены хлоритизацией, серпентинизацией и окварцеванием.

Никельсодержащие руды * Основное количество никеля добывается в месторождениях магматических сульфидных медно никеловых руд (65% обшего количества добываемого из руд никеля). *Основными минералами в рудах этих месторождений являются пирротин, пентландит, халькопирит, магнетит, встречаются пирит, кубанит, никелин, миллерит, минералы группы платина, галенит, сфалерит. *Руды этого типа расположены на Кольском полуострове и в районе Норильска, Канаде, Южной Африке.
лекции кристаллография и минералогия.pptx