l_14_realnye_gazy.pptx
- Количество слайдов: 32
 Реальные газы Уравнение состояния идеального газа – уравнение Менделеева – Клапейрона 1
Реальные газы Уравнение состояния идеального газа – уравнение Менделеева – Клапейрона 1
 Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации. 2
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации. 2
 Уравнение Ван-дер-Ваальса (1873). Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса)обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Силы притяжения суммируются с внешним давлением. 3
Уравнение Ван-дер-Ваальса (1873). Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса)обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Силы притяжения суммируются с внешним давлением. 3
 С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса: или для одного моля 4
С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса: или для одного моля 4
 Силы Ван-дер-Ваальса Я. Д. Ван-дер-Ваальс предположил, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. 5
Силы Ван-дер-Ваальса Я. Д. Ван-дер-Ваальс предположил, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. 5
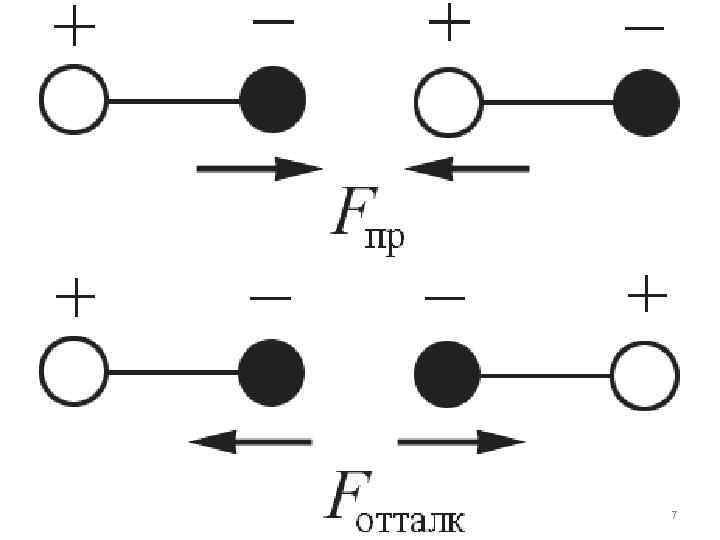
 Межмолекулярные силы взаимодействия имеют электрическую природу и складываются из: сил притяжения (ориентационных, индукционных, дисперсионных) и сил отталкивания. 6
Межмолекулярные силы взаимодействия имеют электрическую природу и складываются из: сил притяжения (ориентационных, индукционных, дисперсионных) и сил отталкивания. 6
 7
7
 Отметим, что все три силы и энергии одинаковым образом убывают с расстоянием: F = Fор + Fинд + Fдисп ~ r – 7 U = Uор + Uинд + Uдисп ~ r – 6 8
Отметим, что все три силы и энергии одинаковым образом убывают с расстоянием: F = Fор + Fинд + Fдисп ~ r – 7 U = Uор + Uинд + Uдисп ~ r – 6 8
 Силы отталкивания действуют между молекулами на очень малых расстояниях, когда происходит взаимодействие электронных оболочек атомов, входящих в состав молекул. Потенциальная энергия сил отталкивания возрастает с уменьшением расстояния по закону Uот(r) ~ r – 12, а, соответственно, сила отталкивания растет как Fот ~ r – 13. 9
Силы отталкивания действуют между молекулами на очень малых расстояниях, когда происходит взаимодействие электронных оболочек атомов, входящих в состав молекул. Потенциальная энергия сил отталкивания возрастает с уменьшением расстояния по закону Uот(r) ~ r – 12, а, соответственно, сила отталкивания растет как Fот ~ r – 13. 9
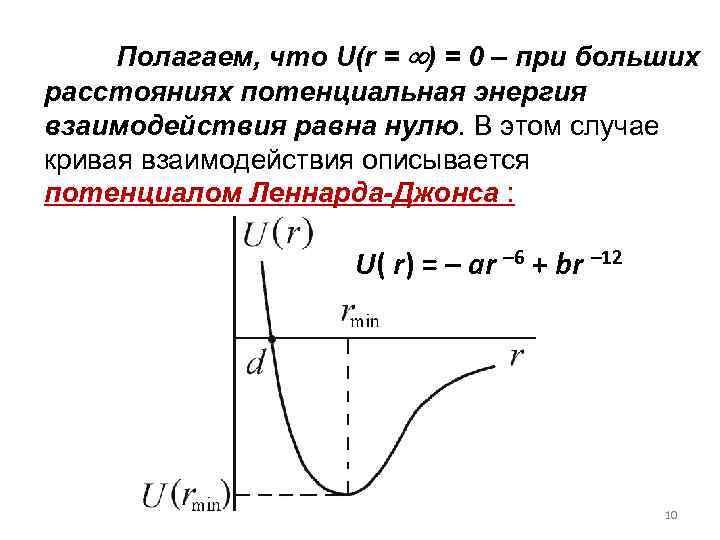 Полагаем, что U(r = ) = 0 – при больших расстояниях потенциальная энергия взаимодействия равна нулю. В этом случае кривая взаимодействия описывается потенциалом Леннарда-Джонса : U( r) = – ar – 6 + br – 12 10
Полагаем, что U(r = ) = 0 – при больших расстояниях потенциальная энергия взаимодействия равна нулю. В этом случае кривая взаимодействия описывается потенциалом Леннарда-Джонса : U( r) = – ar – 6 + br – 12 10
 Вывод уравнения Ван-дер. Ваальса 11
Вывод уравнения Ван-дер. Ваальса 11
 Для = m/ молей газа уравнение состояния газа с учетом конечного размера молекул примет вид: P(V b) = RT. Уравнение является приближенным и выведено в предположении только парных столкновений. 12
Для = m/ молей газа уравнение состояния газа с учетом конечного размера молекул примет вид: P(V b) = RT. Уравнение является приближенным и выведено в предположении только парных столкновений. 12
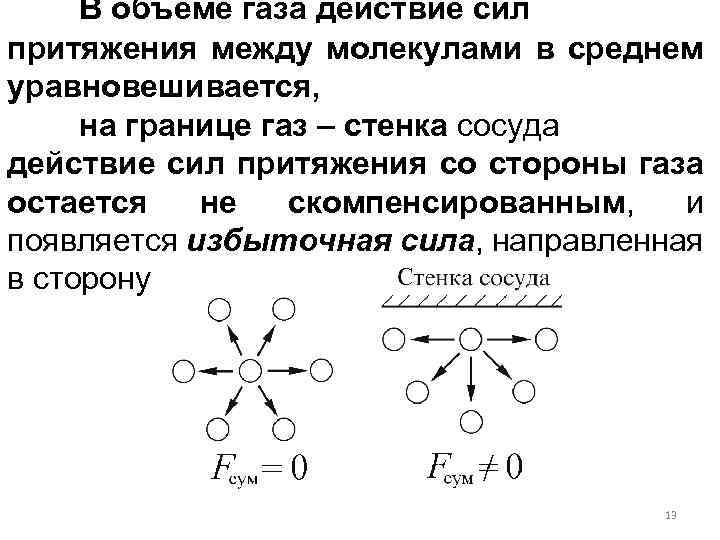 В объеме газа действие сил притяжения между молекулами в среднем уравновешивается, на границе газ – стенка сосуда действие сил притяжения со стороны газа остается не скомпенсированным, и появляется избыточная сила, направленная в сторону газа: 13
В объеме газа действие сил притяжения между молекулами в среднем уравновешивается, на границе газ – стенка сосуда действие сил притяжения со стороны газа остается не скомпенсированным, и появляется избыточная сила, направленная в сторону газа: 13
 Дополнительное внутреннее давление пропорционально числу частиц, приходящихся на единицу площади границы n. S и силе взаимодействия этих частиц с другими частицами газа, находящимися в единице объема n. V. 14
Дополнительное внутреннее давление пропорционально числу частиц, приходящихся на единицу площади границы n. S и силе взаимодействия этих частиц с другими частицами газа, находящимися в единице объема n. V. 14
 Избыточное внутреннее давление Pi если в сосуде находится один моль газа Pi = a/V 2, где а – постоянная величина, своя для каждого сорта газа. В случае -молей имеем Pi = 2 a/V 2. 15
Избыточное внутреннее давление Pi если в сосуде находится один моль газа Pi = a/V 2, где а – постоянная величина, своя для каждого сорта газа. В случае -молей имеем Pi = 2 a/V 2. 15
 Учитывая совместное действие сил притяжения и сил отталкивания и полученные поправки для объема и давления в уравнении Менделеева. Клапейрона, получим уравнение Ван-дер-Ваальса для реального газа 16
Учитывая совместное действие сил притяжения и сил отталкивания и полученные поправки для объема и давления в уравнении Менделеева. Клапейрона, получим уравнение Ван-дер-Ваальса для реального газа 16
 17
17
 Изотермы уравнения Ван-дер. Ваальса Проанализируем изотермы уравнения Ван-дер-Ваальса – зависимости Р от V для реального газа при постоянной температуре. (P + 2 a/V 2)(V b) = RT. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получим: PV – (RT + b. P) V + 3 2 2 V a 3= ab 18 0
Изотермы уравнения Ван-дер. Ваальса Проанализируем изотермы уравнения Ван-дер-Ваальса – зависимости Р от V для реального газа при постоянной температуре. (P + 2 a/V 2)(V b) = RT. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получим: PV – (RT + b. P) V + 3 2 2 V a 3= ab 18 0
 Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня. Изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках. 19
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня. Изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках. 19
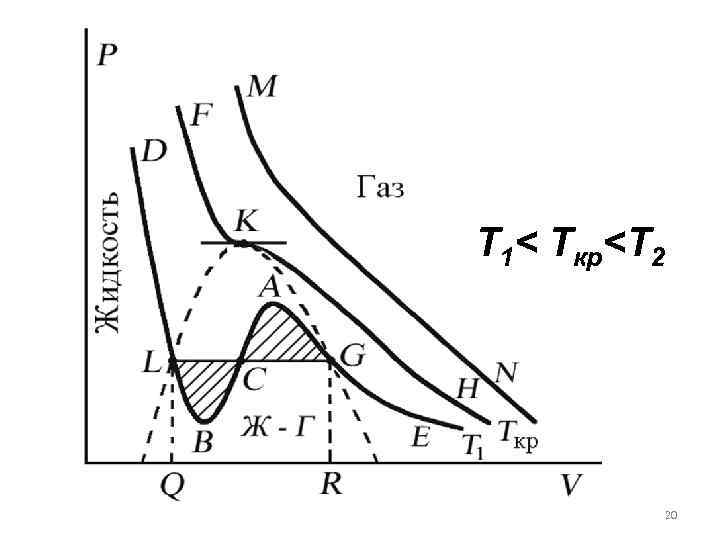 T 1< Tкр
T 1< Tкр
 Изотерма при Ткр разделяет немонотонные T < Tкр и монотонные T > Tкр изотермы. При T > Tкр вещество находится только в одном – газообразном состоянии, как это имело место у идеального газа. 21
Изотерма при Ткр разделяет немонотонные T < Tкр и монотонные T > Tкр изотермы. При T > Tкр вещество находится только в одном – газообразном состоянии, как это имело место у идеального газа. 21
 При температуре газа ниже критической есть возможность перехода вещества из газообразного в жидкое и наоборот. 22
При температуре газа ниже критической есть возможность перехода вещества из газообразного в жидкое и наоборот. 22
 Наличие критической точки на изотерме Ван-дер-Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. 23
Наличие критической точки на изотерме Ван-дер-Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. 23
 Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления. 24
Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления. 24
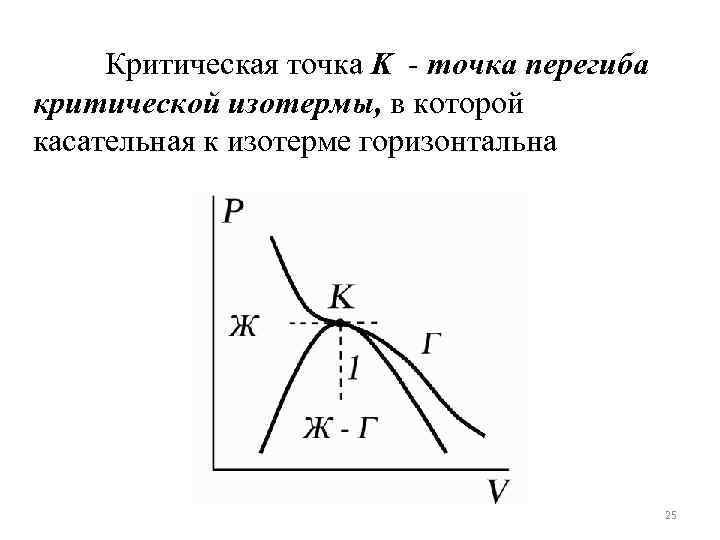 Критическая точка K - точка перегиба критической изотермы, в которой касательная к изотерме горизонтальна 25
Критическая точка K - точка перегиба критической изотермы, в которой касательная к изотерме горизонтальна 25
 Внутренняя энергия газа Вандер-Ваальса Энергия одного моля газа Ван-дер. Ваальса слагается из: • внутренней энергии молекул газа; • кинетической энергии теплового движения центра масс молекул • потенциальной энергии взаимного притяжения молекул 26
Внутренняя энергия газа Вандер-Ваальса Энергия одного моля газа Ван-дер. Ваальса слагается из: • внутренней энергии молекул газа; • кинетической энергии теплового движения центра масс молекул • потенциальной энергии взаимного притяжения молекул 26
 Потенциальная энергия притяжения молекул равна работе, необходимой для разведения молекул на бесконечное расстояние друг от друга. В этом конечном состоянии молекулы не взаимодействуют друг с другом, а потенциальную энергию можно считать равной нулю. 27
Потенциальная энергия притяжения молекул равна работе, необходимой для разведения молекул на бесконечное расстояние друг от друга. В этом конечном состоянии молекулы не взаимодействуют друг с другом, а потенциальную энергию можно считать равной нулю. 27
 Полная энергия одного моля газа Вандер-Ваальса : Если СV не зависит от температуры, то полная энергия одного моля Um = CV Т– a/Vm 28
Полная энергия одного моля газа Вандер-Ваальса : Если СV не зависит от температуры, то полная энергия одного моля Um = CV Т– a/Vm 28
 Основные результаты Уравнение Ван-дер-Ваальса для произвольного количества вещества реального газа учитывает конечный объем молекул b и их взаимодействие между собой 2 a/V 2: где а и b – постоянные Ван-дер-Ваальса V – объем, занимаемый газом; P – давление газа на стенки сосуда. 29
Основные результаты Уравнение Ван-дер-Ваальса для произвольного количества вещества реального газа учитывает конечный объем молекул b и их взаимодействие между собой 2 a/V 2: где а и b – постоянные Ван-дер-Ваальса V – объем, занимаемый газом; P – давление газа на стенки сосуда. 29
 Связь критических параметров – объема, давления и температуры газа – с постоянными а и b Ван-дер-Ваальса определяется соотношениями 30
Связь критических параметров – объема, давления и температуры газа – с постоянными а и b Ван-дер-Ваальса определяется соотношениями 30
 Внутренняя энергия реального газа наряду с кинетической энергией хаотического движения частиц СVT включает и потенциальную энергию их притяжения a/Vm где СV – молярная теплоемкость газа при постоянном объеме. 31
Внутренняя энергия реального газа наряду с кинетической энергией хаотического движения частиц СVT включает и потенциальную энергию их притяжения a/Vm где СV – молярная теплоемкость газа при постоянном объеме. 31
 Контрольные вопросы 1. Перечислите условия отклонения поведения газов от идеального 2. Определите, что означают поправки а и b в уравнении Ван-дер-Ваальса 3. Назовите силы Ван-дер-Ваальса 4. Нарисуйте график потенциала Леннарда-Джонса и поясните его 5. Нарисуйте изотермы Ван-дер. Ваальса 6. Определите, что означает критическая температура 32
Контрольные вопросы 1. Перечислите условия отклонения поведения газов от идеального 2. Определите, что означают поправки а и b в уравнении Ван-дер-Ваальса 3. Назовите силы Ван-дер-Ваальса 4. Нарисуйте график потенциала Леннарда-Джонса и поясните его 5. Нарисуйте изотермы Ван-дер. Ваальса 6. Определите, что означает критическая температура 32


