Реальные газы и жидкости Один.ppt
- Количество слайдов: 13
 Реальные газы и жидкости. Часть первая
Реальные газы и жидкости. Часть первая
 О строении молекул реальных газов • Молекулы газа представляют собой сложные системы движущихся электрических зарядов. • Основная масса и весь положительный заряд сосредоточены в ядрах, имеющих линейные размеры порядка 10 -15 – 10 -14 м. • Вокруг ядер по определенным устойчивым орбитам движутся электроны (отриц-й заряд). Диаметры электронных орбит порядка 10 -10 м.
О строении молекул реальных газов • Молекулы газа представляют собой сложные системы движущихся электрических зарядов. • Основная масса и весь положительный заряд сосредоточены в ядрах, имеющих линейные размеры порядка 10 -15 – 10 -14 м. • Вокруг ядер по определенным устойчивым орбитам движутся электроны (отриц-й заряд). Диаметры электронных орбит порядка 10 -10 м.
 Атомы • Атомы – устойчивые и трудно деформируемые системы. • Эта устойчивость обусловлена тем, что состояния атомов и молекул не могут меняться непрерывно, но способны принимать лишь дискретный ряд значений. • Переход атома из одного возможного состояния в другой связан со сравнительно большим изменением его энергии. • Атомы «тверже» стальных шариков: при столкновении со скоростями 500 м/с стальные шарики разбиваются, тогда как атомы, сталкиваясь с большими скоростями, не меняют структуры.
Атомы • Атомы – устойчивые и трудно деформируемые системы. • Эта устойчивость обусловлена тем, что состояния атомов и молекул не могут меняться непрерывно, но способны принимать лишь дискретный ряд значений. • Переход атома из одного возможного состояния в другой связан со сравнительно большим изменением его энергии. • Атомы «тверже» стальных шариков: при столкновении со скоростями 500 м/с стальные шарики разбиваются, тогда как атомы, сталкиваясь с большими скоростями, не меняют структуры.
 Взаимодействие молекул • Т. к. молекула электрически нейтральна, то ЭП за ее пределами равно нулю уже на расстоянии 2 -3 ее диаметров (т. е. диаметров ее электронной оболочки). • Поэтому на больших расстояниях молекулы не взаимодействуют.
Взаимодействие молекул • Т. к. молекула электрически нейтральна, то ЭП за ее пределами равно нулю уже на расстоянии 2 -3 ее диаметров (т. е. диаметров ее электронной оболочки). • Поэтому на больших расстояниях молекулы не взаимодействуют.
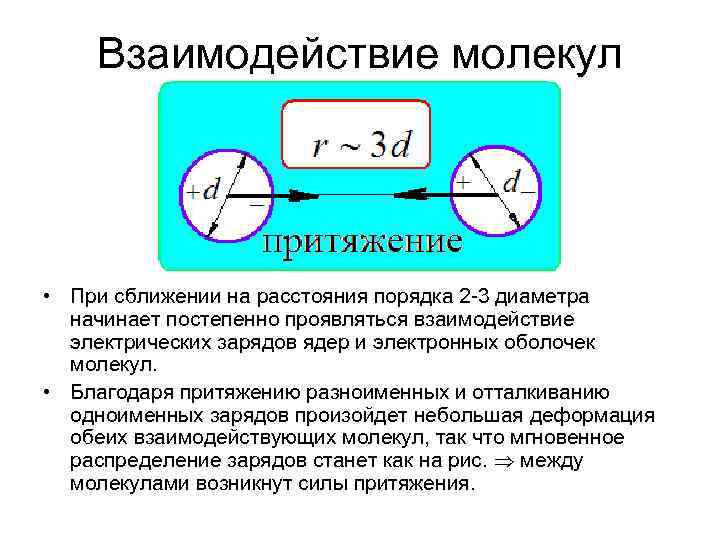 Взаимодействие молекул • При сближении на расстояния порядка 2 -3 диаметра начинает постепенно проявляться взаимодействие электрических зарядов ядер и электронных оболочек молекул. • Благодаря притяжению разноименных и отталкиванию одноименных зарядов произойдет небольшая деформация обеих взаимодействующих молекул, так что мгновенное распределение зарядов станет как на рис. между молекулами возникнут силы притяжения.
Взаимодействие молекул • При сближении на расстояния порядка 2 -3 диаметра начинает постепенно проявляться взаимодействие электрических зарядов ядер и электронных оболочек молекул. • Благодаря притяжению разноименных и отталкиванию одноименных зарядов произойдет небольшая деформация обеих взаимодействующих молекул, так что мгновенное распределение зарядов станет как на рис. между молекулами возникнут силы притяжения.
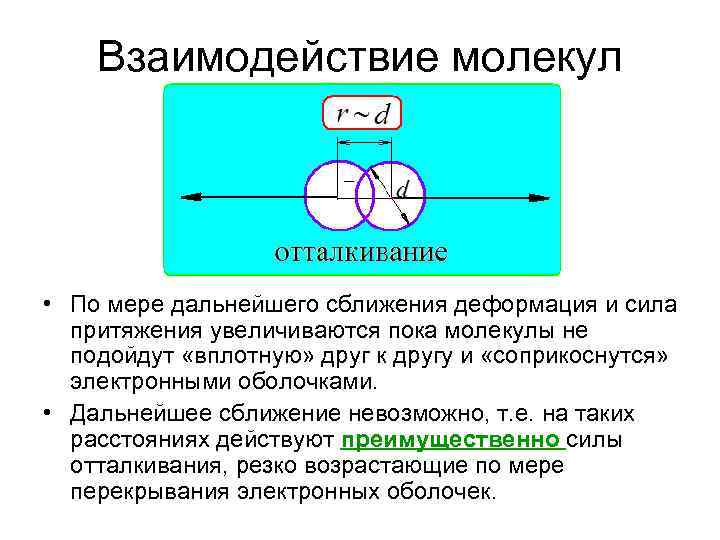 Взаимодействие молекул • По мере дальнейшего сближения деформация и сила притяжения увеличиваются пока молекулы не подойдут «вплотную» друг к другу и «соприкоснутся» электронными оболочками. • Дальнейшее сближение невозможно, т. е. на таких расстояниях действуют преимущественно силы отталкивания, резко возрастающие по мере перекрывания электронных оболочек.
Взаимодействие молекул • По мере дальнейшего сближения деформация и сила притяжения увеличиваются пока молекулы не подойдут «вплотную» друг к другу и «соприкоснутся» электронными оболочками. • Дальнейшее сближение невозможно, т. е. на таких расстояниях действуют преимущественно силы отталкивания, резко возрастающие по мере перекрывания электронных оболочек.
 Главное: • Величина сил взаимодействия зависит не только от расстояний, но и от строения молекул, их ориентации. • Но качественный характер одинаков для всех: притяжение на больших расстояниях и отталкивание на малых.
Главное: • Величина сил взаимодействия зависит не только от расстояний, но и от строения молекул, их ориентации. • Но качественный характер одинаков для всех: притяжение на больших расстояниях и отталкивание на малых.
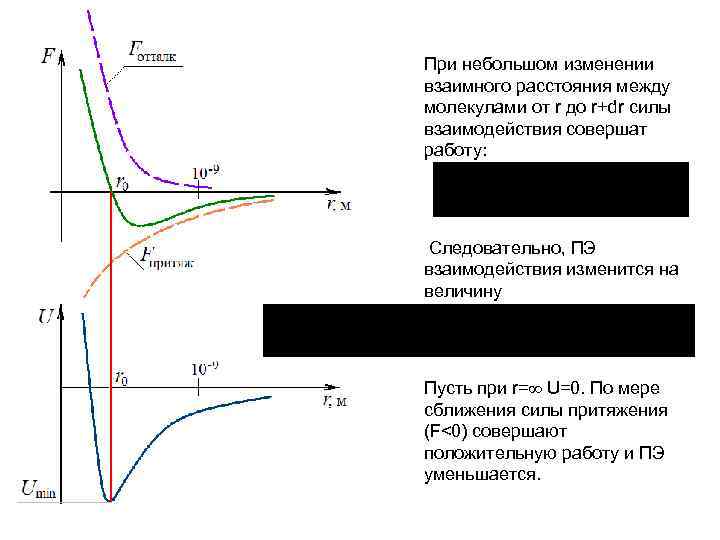 При небольшом изменении взаимного расстояния между молекулами от r до r+dr силы взаимодействия совершат работу: Следовательно, ПЭ взаимодействия изменится на величину Пусть при r= U=0. По мере сближения силы притяжения (F<0) совершают положительную работу и ПЭ уменьшается.
При небольшом изменении взаимного расстояния между молекулами от r до r+dr силы взаимодействия совершат работу: Следовательно, ПЭ взаимодействия изменится на величину Пусть при r= U=0. По мере сближения силы притяжения (F<0) совершают положительную работу и ПЭ уменьшается.
 Положение равновесия • Причем U(r 0)=Umin. • При дальнейшем сближении возникнут силы отталкивания (F>0) и и ПЭ будет круто возрастать. • Т. о. кривая ПЭ имеет вид “потенциальной ямы” с наибольшей глубиной в положении равновесия: r=r 0, F=0, U=Umin<0.
Положение равновесия • Причем U(r 0)=Umin. • При дальнейшем сближении возникнут силы отталкивания (F>0) и и ПЭ будет круто возрастать. • Т. о. кривая ПЭ имеет вид “потенциальной ямы” с наибольшей глубиной в положении равновесия: r=r 0, F=0, U=Umin<0.
 Вывод: Устойчивое положение взаимодействующих молекул соответствует: 1. наименьшему значению ПЭ взаимодействия молекул. Это – общее положение: система устойчива, если она обладает минимальным запасом энергии; 2. равенству нулю сил взаимодействия молекул.
Вывод: Устойчивое положение взаимодействующих молекул соответствует: 1. наименьшему значению ПЭ взаимодействия молекул. Это – общее положение: система устойчива, если она обладает минимальным запасом энергии; 2. равенству нулю сил взаимодействия молекул.
 • Глубина потенциальной ямы определяет величину работы, которую нужно совершить против сил притяжения для того, чтобы молекулы, оказавшиеся в положении равновесия, оторвать друг от друга и развести на бесконечное расстояние.
• Глубина потенциальной ямы определяет величину работы, которую нужно совершить против сил притяжения для того, чтобы молекулы, оказавшиеся в положении равновесия, оторвать друг от друга и развести на бесконечное расстояние.
 Агрегатные состояния вещества Т. к. средняя КЭ хаотического движения молекул имеет порядок k. T, то структура любой совокупности молекул и агрегатное состояние вещества будут существенно зависеть от соотношения величин и k. T. 1. - молекулы притянутся и расположатся в определенном порядке – твердое агрегатное состояние; 2. - интенсивное тепл-е движение препятствует соединению молекул – газ; 3. - тепл. дв-е меняет положение молекул в пространстве, не изменяя расстояния между молекулами, - жидкость.
Агрегатные состояния вещества Т. к. средняя КЭ хаотического движения молекул имеет порядок k. T, то структура любой совокупности молекул и агрегатное состояние вещества будут существенно зависеть от соотношения величин и k. T. 1. - молекулы притянутся и расположатся в определенном порядке – твердое агрегатное состояние; 2. - интенсивное тепл-е движение препятствует соединению молекул – газ; 3. - тепл. дв-е меняет положение молекул в пространстве, не изменяя расстояния между молекулами, - жидкость.
 • Температура перехода из одного состояния в другое зависит от величины • Для азота и кислорода это 3 10 -21 Дж. • При достаточно большом объеме молекулы могут значительно удаляться друг от друга поэтому над твердым телом и жидкостью всегда присутствует небольшое количество этого вещества в гаообразном состоянии.
• Температура перехода из одного состояния в другое зависит от величины • Для азота и кислорода это 3 10 -21 Дж. • При достаточно большом объеме молекулы могут значительно удаляться друг от друга поэтому над твердым телом и жидкостью всегда присутствует небольшое количество этого вещества в гаообразном состоянии.


