Moya_Lektsia_2_1.pptx
- Количество слайдов: 31

Реакционная способность спиртов, фенолов, тиолов и аминов Лекция № 2
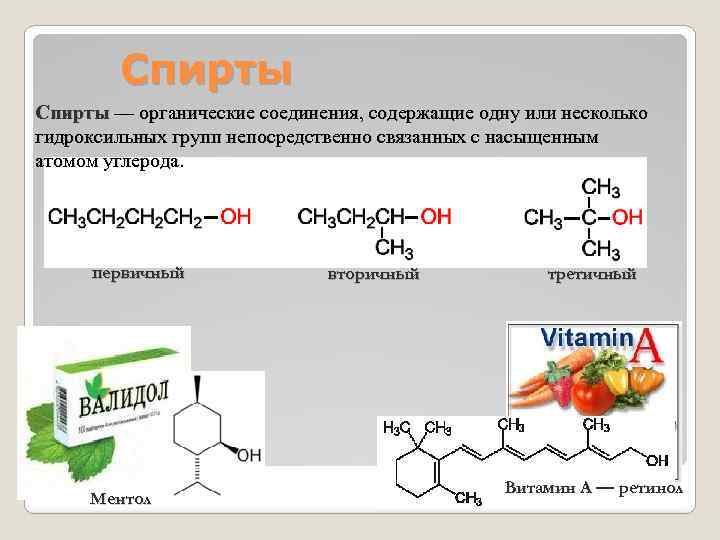
Спирты — органические соединения, содержащие одну или несколько гидроксильных групп непосредственно связанных с насыщенным атомом углерода. первичный Ментол вторичный третичный Витамин А — ретинол

Фенолы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. фенол тимол Сильнодействующие антисептики широкого спектра
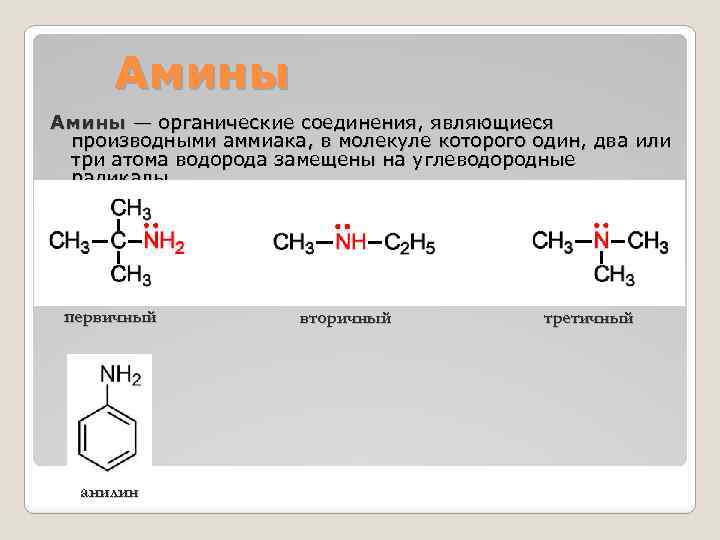
Амины — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. первичный анилин вторичный третичный

Тиолы — органические вещества, серосодержащие аналоги спиртов. аллилмеркаптан тиофенол

Реакционные центры Кислотный центр -I Электрофильный центр СН-кислотный центр Основный и нуклеофильный центр

Кислоты и основания Брёнстеда Кислота — это соединение, способное отдавать основанию катионы водорода Н+ (донор протонов). Основание — это соединение, способное принимать у кислоты катионы водорода Н+ (акцептор протонов). Одно и то же вещество в зависимости от взаимодействия может быть и кислотой, и основанием. Йоханнес-Николаус Брёнстед
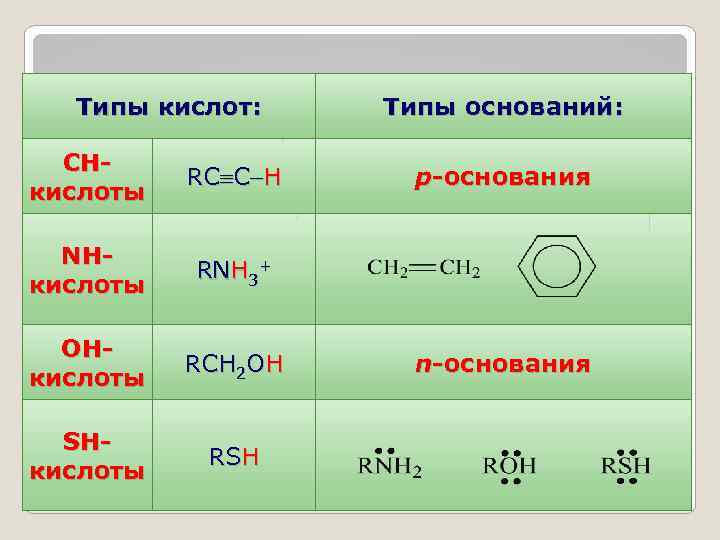
Типы кислот: СНкислоты RC C H NHкислоты RNH 3+ ОНкислоты RCH 2 OH SHкислоты RSH Типы оснований: р-основания n-основания

Факторы влияющие на кислотность и основность 1 2 3 • Природа центрального атома • Сопряжение • Природа заместителей
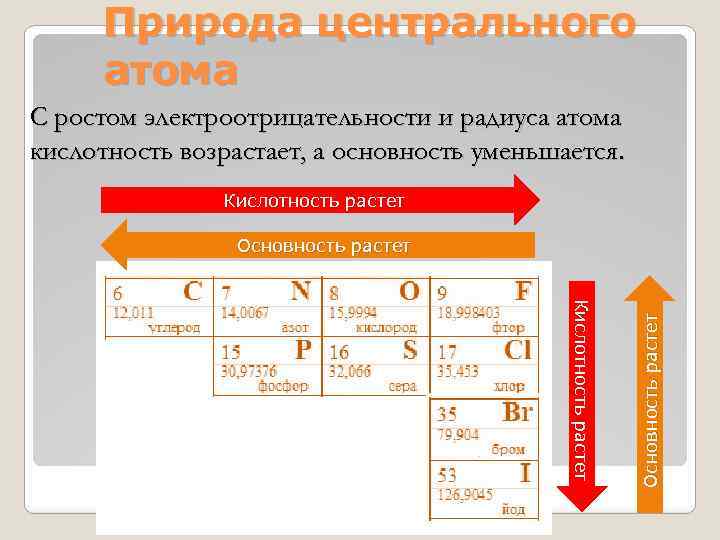
Природа центрального атома С ростом электроотрицательности и радиуса атома кислотность возрастает, а основность уменьшается. Кислотность растет Основность растет
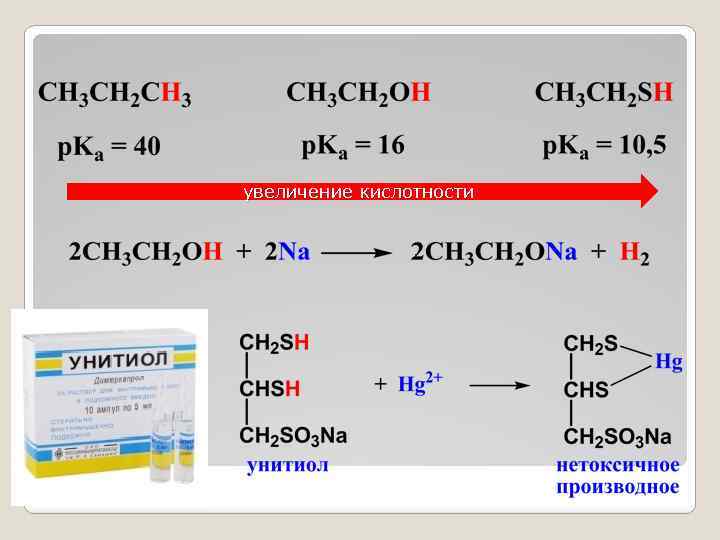
увеличение кислотности

увеличение основности
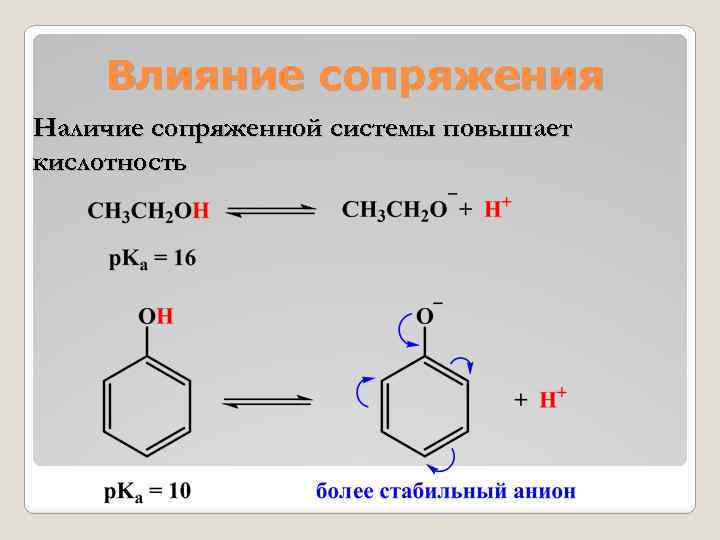
Влияние сопряжения Наличие сопряженной системы повышает кислотность

Наличие сопряженной системы снижает основность
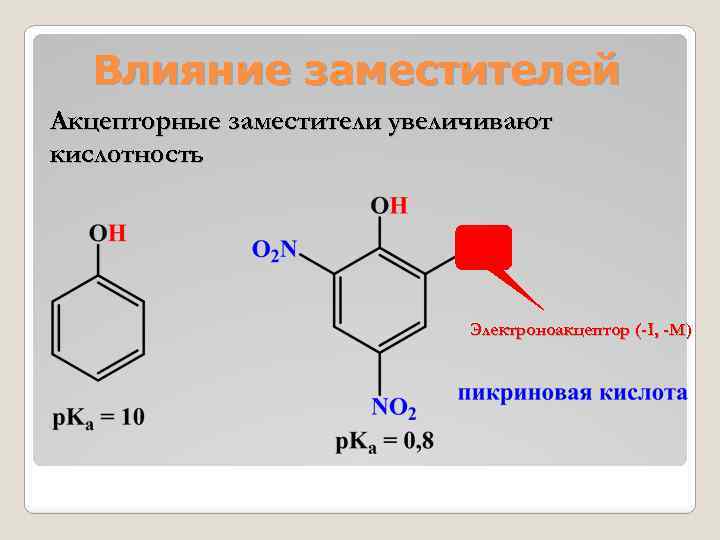
Влияние заместителей Акцепторные заместители увеличивают кислотность Электроноакцептор (-I, -M)

Донорные заместители увеличивают основность Донорный заместитель ( +I)

Электрофильный центр может подвергаться атаке нуклеофилом (Nu ). В результате осуществляется реакция нуклеофильного замещения. СН-кислотный центр может взаимодействовать с основаниями (В ). В результате осуществляется реакция элиминирования.

Термины «нуклеофил» и «основание» применяют для описания одних и тех же частиц (анионов или нейтральных молекул содержащих элемент с неподеленной электронной парой), но участвующих в разных процессах. Нуклеофильность – способность отдать электронную пару атому углерода. Основность – способность предоставить электронную пару протону.

В пределах одного периода нуклеофильность изменяется параллельно с основностью
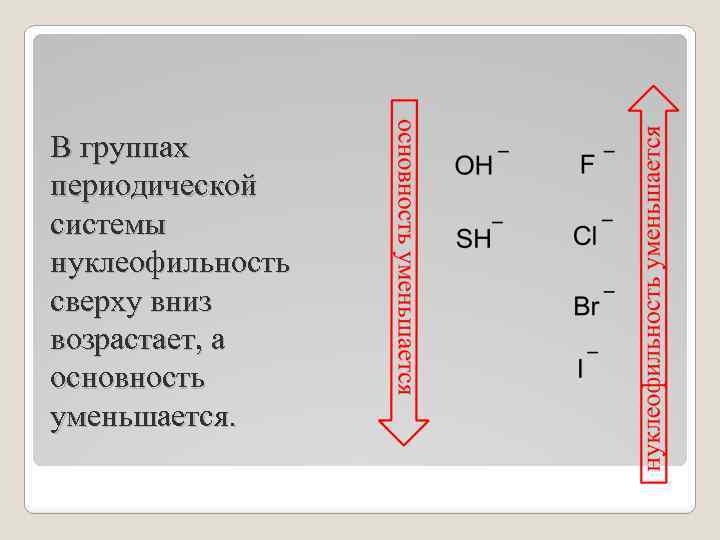
В группах периодической системы нуклеофильность сверху вниз возрастает, а основность уменьшается.

Нуклеофильное замещение и элиминирование – конкурирующие процессы. На преимущественное протекание того или иного процесса будет влиять: • основность и нуклеофильность реагента, • структура субстрата, • условия проведения реакции (температура, растворитель).
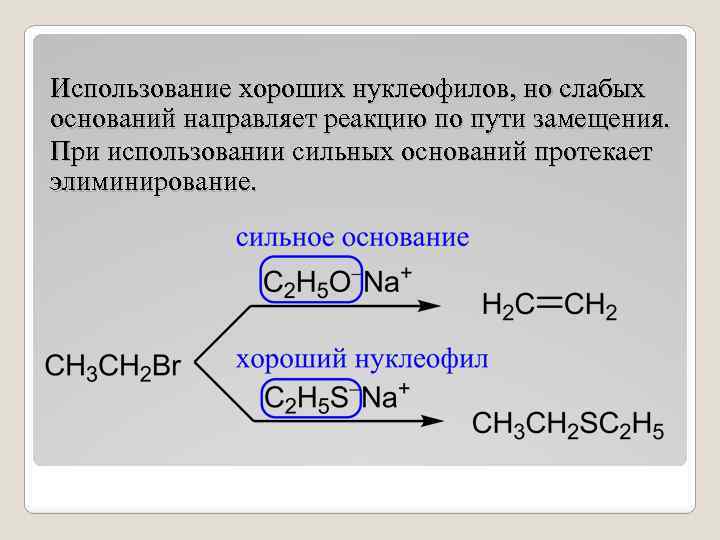
Использование хороших нуклеофилов, но слабых оснований направляет реакцию по пути замещения. При использовании сильных оснований протекает элиминирование.
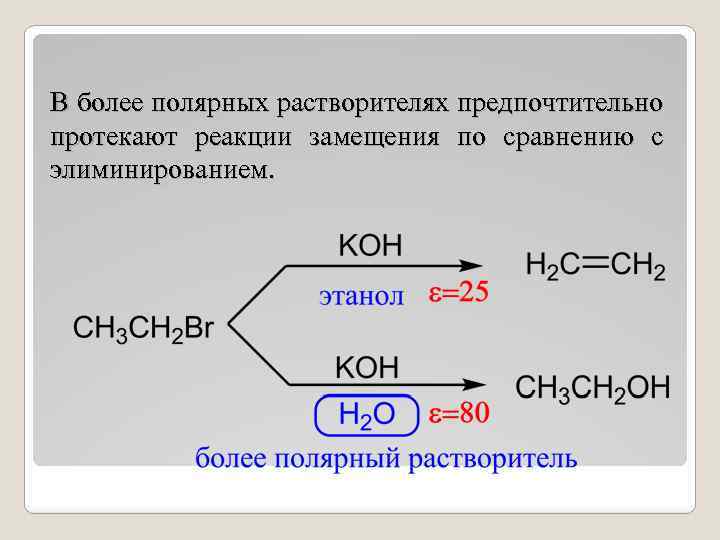
В более полярных растворителях предпочтительно протекают реакции замещения по сравнению с элиминированием.
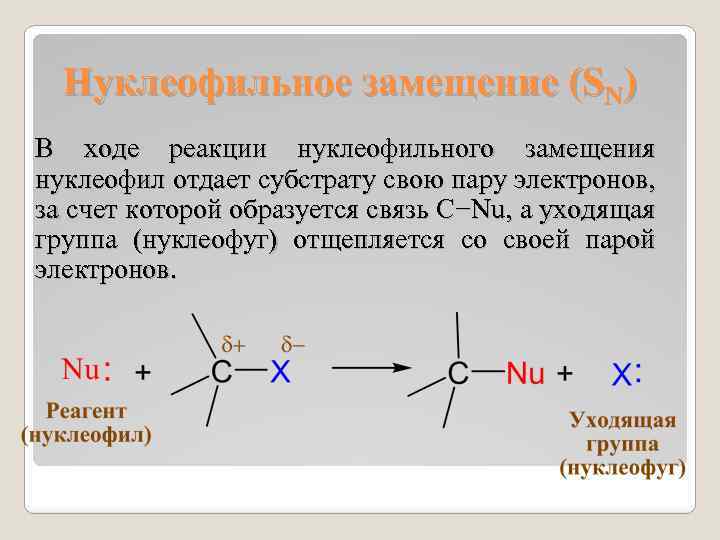
Нуклеофильное замещение (SN) В ходе реакции нуклеофильного замещения нуклеофил отдает субстрату свою пару электронов, за счет которой образуется связь С−Nu, а уходящая группа (нуклеофуг) отщепляется со своей парой электронов.

Для осуществления нуклеофильного замещения необходимо, чтобы уходящая группа (нуклеофуг) была более стабильной, чем вступающий в реакцию нуклеофил.
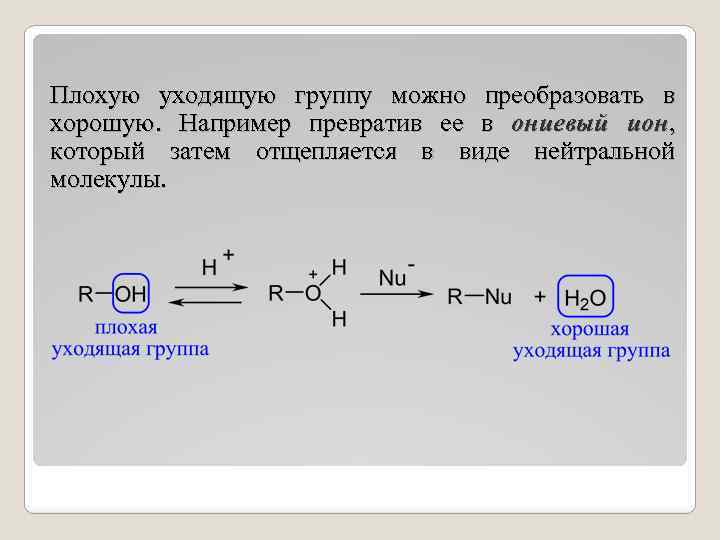
Плохую уходящую группу можно преобразовать в хорошую. Например превратив ее в ониевый ион, который затем отщепляется в виде нейтральной молекулы.
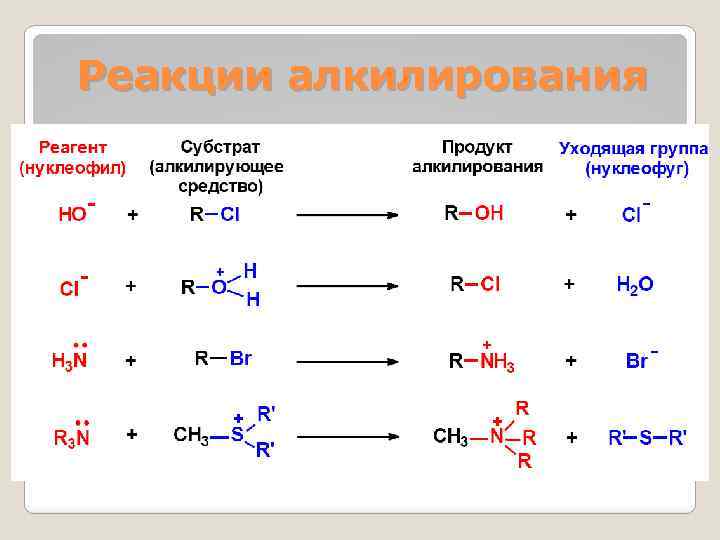
Реакции алкилирования

Элиминирование (Е) Процессы элиминирования (отщепления) подчиняются правилу Зайцева: атом водорода отщепляется от наименее гидрогенизированного углеродного атома.

Окисление спиртов • Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот. • Вторичные — до соответствующих кетонов. • Третичные спирты устойчивы к окислению.
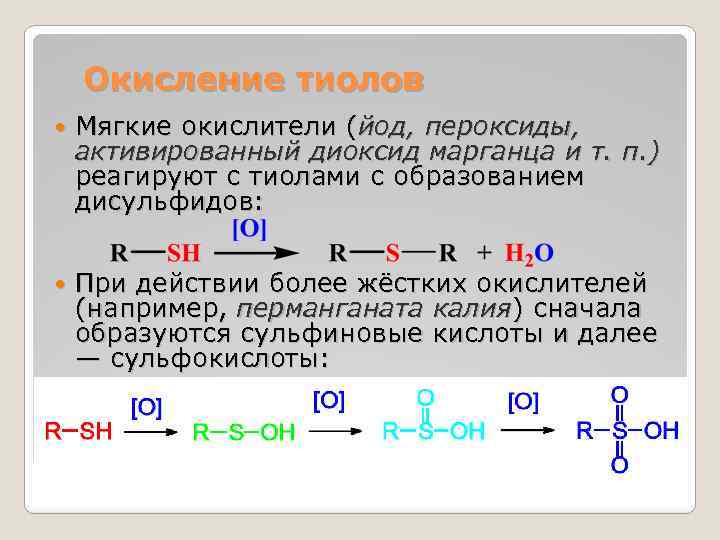
Окисление тиолов Мягкие окислители (йод, пероксиды, активированный диоксид марганца и т. п. ) реагируют с тиолами с образованием дисульфидов: При действии более жёстких окислителей (например, перманганата калия) сначала образуются сульфиновые кислоты и далее — сульфокислоты:
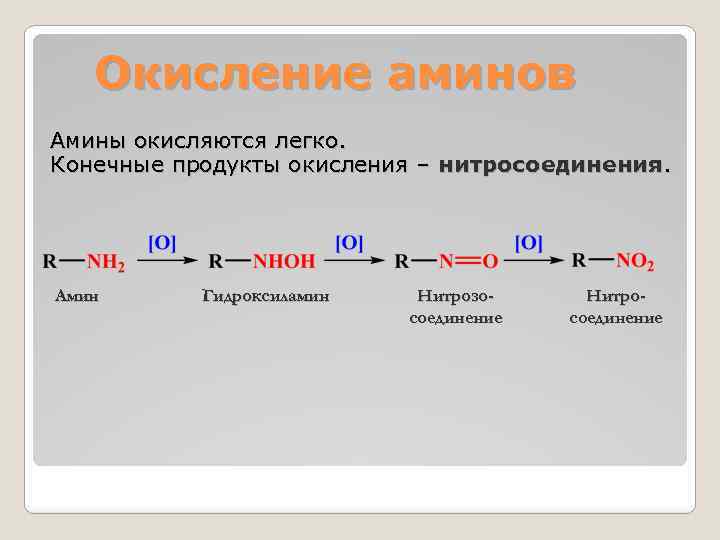
Окисление аминов Амины окисляются легко. Конечные продукты окисления – нитросоединения. Амин Гидроксиламин Нитрозосоединение Нитросоединение
Moya_Lektsia_2_1.pptx