Lektsia_BAV_2_2.ppt
- Количество слайдов: 28

Реакционная способность карбоновых кислот
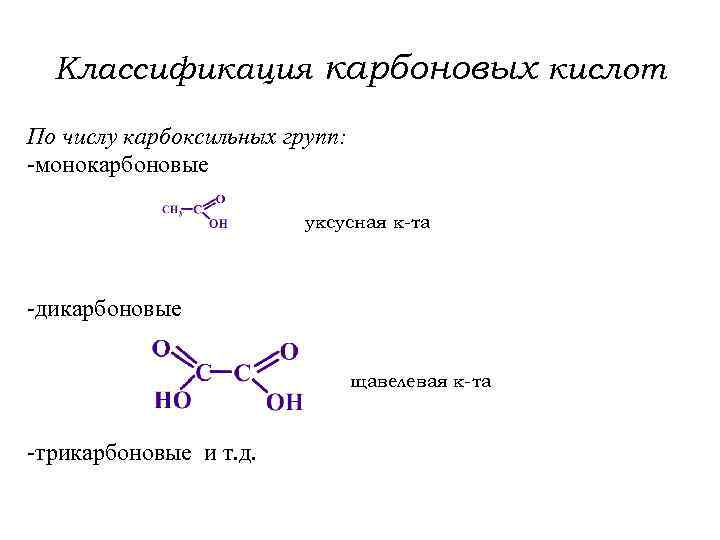
Классификация карбоновых кислот По числу карбоксильных групп: -монокарбоновые уксусная к-та -дикарбоновые щавелевая к-та -трикарбоновые и т. д.

Классификация карбоновых кислот по строению углеводородного радикала: -алифатические -алициклические уксусная к-та -ароматические циклогексановая к-та -гетероциклические никотиновая к-та бензойная к-та
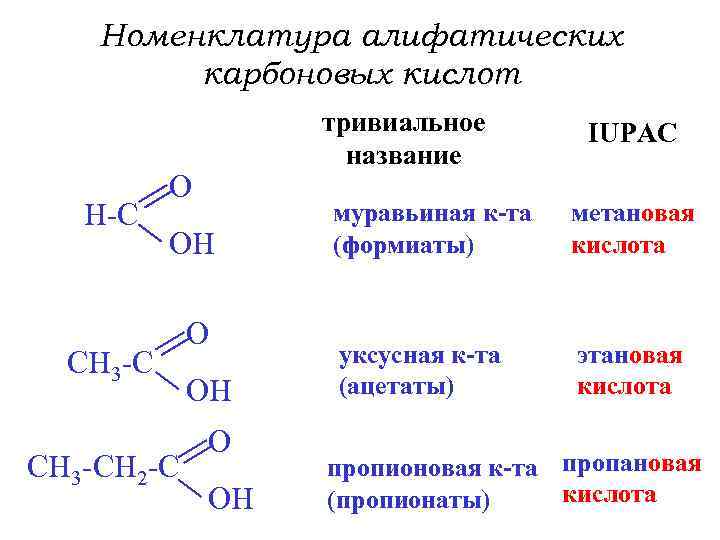
Номенклатура алифатических карбоновых кислот H-C тривиальное название O OH CH 3 -CH 2 -C O OH IUPAC муравьиная к-та (формиаты) метановая кислота уксусная к-та (ацетаты) этановая кислота пропионовая к-та пропановая кислота (пропионаты)

Номенклатура алифатических карбоновых кислот CH 3 -(CH 2)2 -C CH 3 -(CH 2)3 -C тривиальное название O OH O IUPAC масляная к-та (бутираты) бутановая кислота валериановая к-та OH (валераты) изовалериановая к-та (изовалериаты) пентановая кислота 3 -метилбутановая кислота
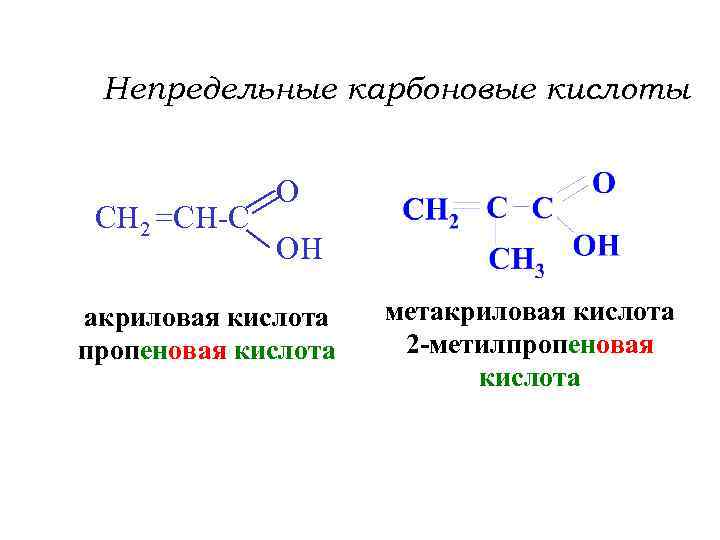
Непредельные карбоновые кислоты CH 2 =CH-C O OH акриловая кислота пропеновая кислота метакриловая кислота 2 -метилпропеновая кислота
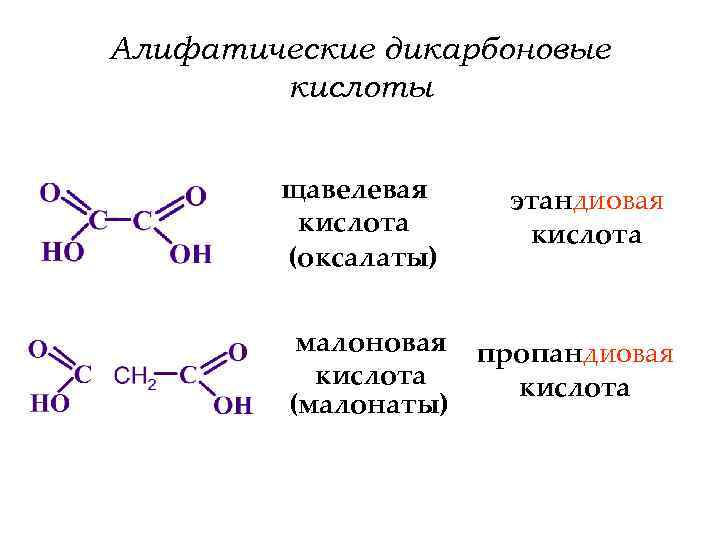
Алифатические дикарбоновые кислоты щавелевая кислота (оксалаты) малоновая кислота (малонаты) этандиовая кислота пропандиовая кислота

Алифатические дикарбоновые кислоты янтарная кислота (сукцинаты) глутаровая кислота (глутараты) бутандиовая кислота пентандиовая кислота

Непредельные дикарбоновые кислоты СООН Н Н С С = = С С СООН Н СООН малеиновая кислота цис-бутендиовая НООС Н фумаровая кислота транс-бутендиовая

Реакционные центры в молекулах карбоновых кислот δ- H δ' + R C H δ+ C O: . . O основный центр H OH-кислотный центр CH-кислотный электрофильный центр

Кислотные свойства CH 3 -CH 2 -C O OH + Na. OH пропионовая кислота C бензойная кислота O OH + Na. HCO 3 CH 3 -CH 2 -C O ONa пропионат натрия + H 2 O C бензоат натрия + CO 2 + H 2 O O ONa

Кислотные свойства карбоновых кислот Электроноакцепторные заместители в радикале карбоновых кислот повышают их кислотные свойства, электронодонорные – понижают. В гомологическом ряду предельных алифатических карбоновых кислотность понижается.

Реакции нуклеофильного замещения О + E+ Nu. R–С ОН + OE R– С – Nu OH -E R– С – Nu присоединение OH E+ замещение R–С О Nu + E+ OH-

Функциональные производные карбоновых кислот Cl хлорангидриды R–С О NH 2 амиды R–С O R–С О О ангидриды О R–С NH–NH 2 гидразиды R–С О OR 1 сложные эфиры нитрилы

Реакции нуклеофильного замещения SN Реакция образования сложных эфиров (этерификации) О + СН 3 ОН СН 3–С ОН уксусная кислота метанол Н+ to СН 3–С О + Н 2 О ОСН 3 метилацетат

Получение хлорангидридов to О О + SOCl 2 CH 3–С + SO 2 + HCl Cl ОН тионилхлорид ацетилхлорид уксусная кислота СН 3–С С О ОН + РCl 5 бензойная кислота С to О Cl + РOCl 3 + HCl бензоилхлорид

Получение ангидридов О OН + О СН 3– С ОН Р 2 О 5 , to СН 3–С О O + Н 2 О О СН 3–С уксусный ангидрид
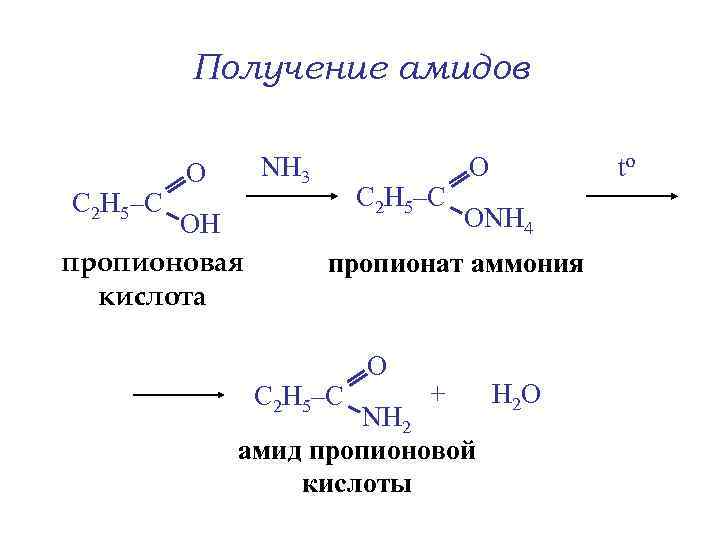
Получение амидов С 2 Н 5–С NH 3 О ОН пропионовая кислота С 2 Н 5–С О to ОNH 4 пропионат аммония С 2 Н 5–С О + NH 2 амид пропионовой кислоты Н 2 О

Реакции карбоновых кислот по радикалу Насыщенные алифатические карбоновые кислоты СН 3–СН 2–СООН + Cl 2 Ркр, t пропионовая кислота СН 3–СН–СООН + НCl Cl α-хлорпропионовая кислота

Реакции карбоновых кислот по радикалу Ненасыщенные карбоновые кислоты Реакция галоганирования СН 2=СН–СООН + Br 2 H 2 O пропеновая кислота СН 2–СН–СООН Br Br 2, 3 -дибромпропановая кислота

Реакции карбоновых кислот по радикалу Ненасыщенные карбоновые кислоты Реакции гидрогалогенирования кислоты протекают против Марковникова δ+ δ- СН 2=СН–С О ОН + – + НBr пропеновая кислота акриловой правила СН 2–СООН Br 3 -бромпропановая кислота

Реакции карбоновых кислот по радикалу Ароматические карбоновые кислоты Реакции электрофильного бензольному кольцу СООН замещения по СООН + Br 2 бензойная кислота Fe. Br 3 to + НBr Br м-бромбензойная кислота

Дикарбоновые кислоты
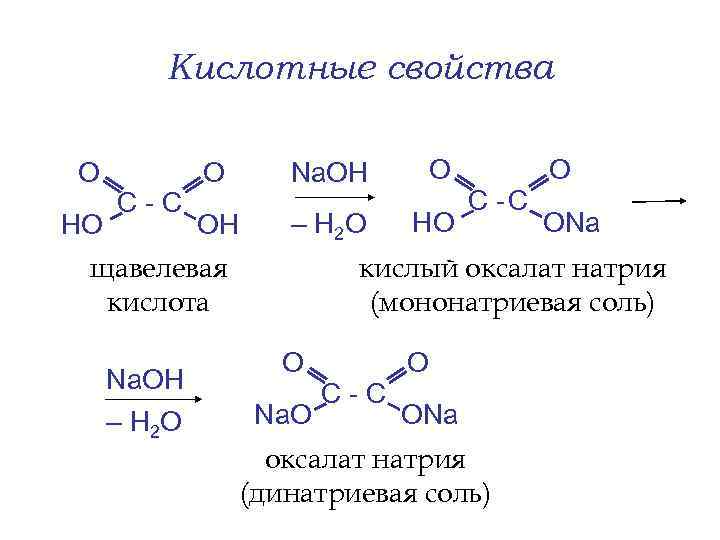
Кислотные свойства О HO С-С О Na. OH О ОН – Н 2 O HO щавелевая кислота Na. OH – Н 2 O С -С О ОNa кислый оксалат натрия (мононатриевая соль) О Na. O С-С О ОNa оксалат натрия (динатриевая соль)

Качественная реакция О HO С-С О Сa. Сl 2 О ОН – Сa. Cl 2 O щавелевая кислота С -С О О Ca оксалат кальция осадок белого цвета
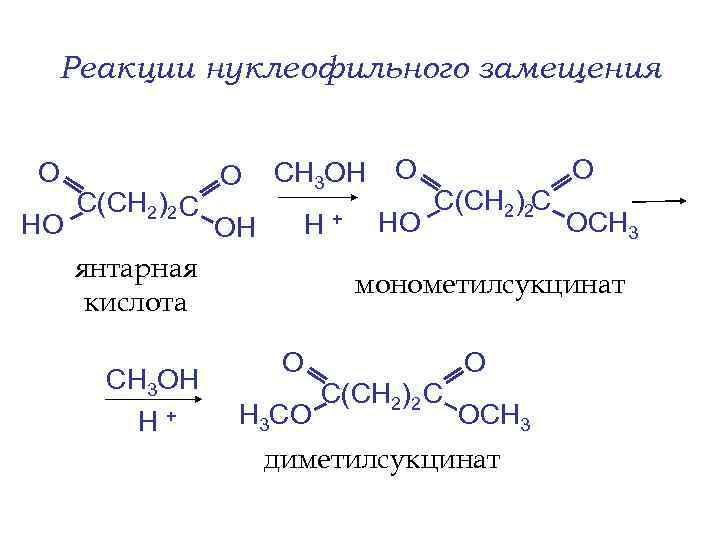
Реакции нуклеофильного замещения О HO С(СН 2)2 С О СН 3 OH О ОН Н+ HO янтарная кислота СН 3 OH Н+ С(СН 2)2 С О ОСН 3 монометилсукцинат О Н 3 СO С(СН 2)2 С О ОСН 3 диметилсукцинат
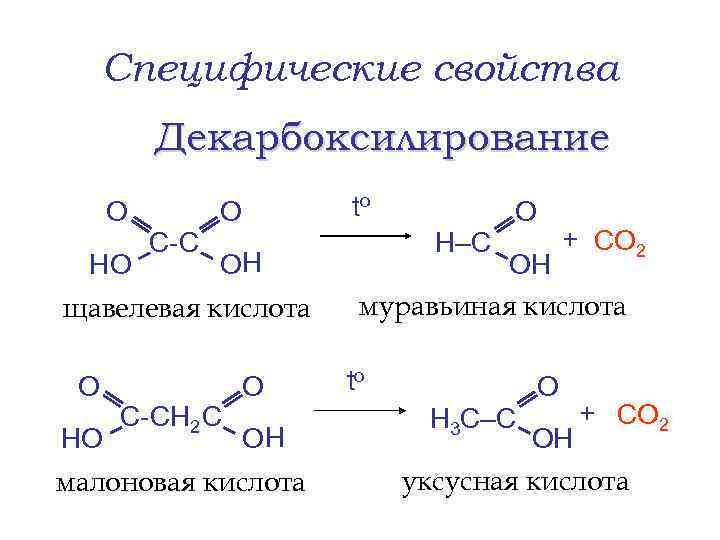
Специфические свойства Декарбоксилирование О HO С- С О to ОН ОН муравьиная кислота щавелевая кислота О HO С-СН 2 С О ОН малоновая кислота Н–С О to + СО 2 О Н 3 С–С + СО 2 ОН уксусная кислота

Специфические свойства Образование циклических ангидридов HO С Н 2 С С янтарная кислота О to Н 2 С–С ОН Н 2 С–С O + Н 2 О О янтарный ангидрид
Lektsia_BAV_2_2.ppt