Реакционная способность альдегидов и кетонов Реакции нуклеофильного присоединения




























farm_aldegidy_i_ketony.ppt
- Размер: 2 Mегабайта
- Количество слайдов: 106
Описание презентации Реакционная способность альдегидов и кетонов Реакции нуклеофильного присоединения по слайдам
 Реакционная способность альдегидов и кетонов Реакции нуклеофильного присоединения
Реакционная способность альдегидов и кетонов Реакции нуклеофильного присоединения
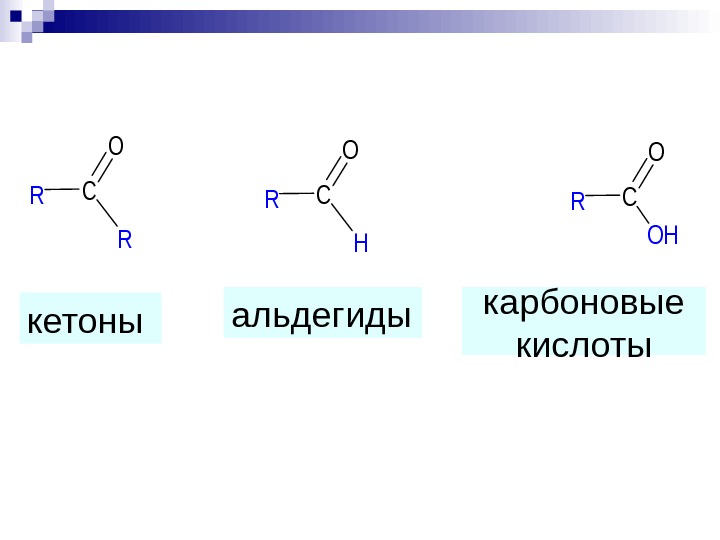
 альдегиды кетоны. C H O RC OH O R C R O R карбоновые кислоты
альдегиды кетоны. C H O RC OH O R C R O R карбоновые кислоты
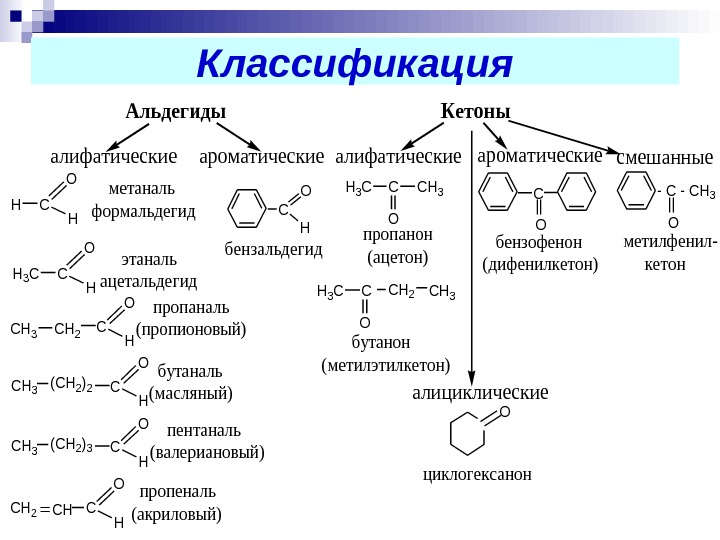
 Классификация альдегидов и кетонов: — алифатические (насыщенные и ненасыщенные) — ароматические — кетоны могут быть смешанными (жирно-ароматические)
Классификация альдегидов и кетонов: — алифатические (насыщенные и ненасыщенные) — ароматические — кетоны могут быть смешанными (жирно-ароматические)
 Классификация. Альдегиды. Кетоны алифатическиеароматические C O H HC O H метаналь формальдегид H 3 CC O H этаналь ацетальдегид пропаналь (пропионовый)CH 3 CH 2 C O H (CH 2)2 CH 3 бутаналь (масляный)C O H (CH 2)3 CH 3 пентаналь (валериановый)C O H CH 2=CH пропеналь (акриловый) бензальдегид алифатическиеароматические H 3 CCCH 3 O пропанон (ацетон) H 3 CC O CH 3 CH 2 бутанон (метилэтилкетон) C || O бензофенон (дифенилкетон) смешанные — CH 3|| O метилфенил- кетон алициклические O циклогексанон
Классификация. Альдегиды. Кетоны алифатическиеароматические C O H HC O H метаналь формальдегид H 3 CC O H этаналь ацетальдегид пропаналь (пропионовый)CH 3 CH 2 C O H (CH 2)2 CH 3 бутаналь (масляный)C O H (CH 2)3 CH 3 пентаналь (валериановый)C O H CH 2=CH пропеналь (акриловый) бензальдегид алифатическиеароматические H 3 CCCH 3 O пропанон (ацетон) H 3 CC O CH 3 CH 2 бутанон (метилэтилкетон) C || O бензофенон (дифенилкетон) смешанные — CH 3|| O метилфенил- кетон алициклические O циклогексанон
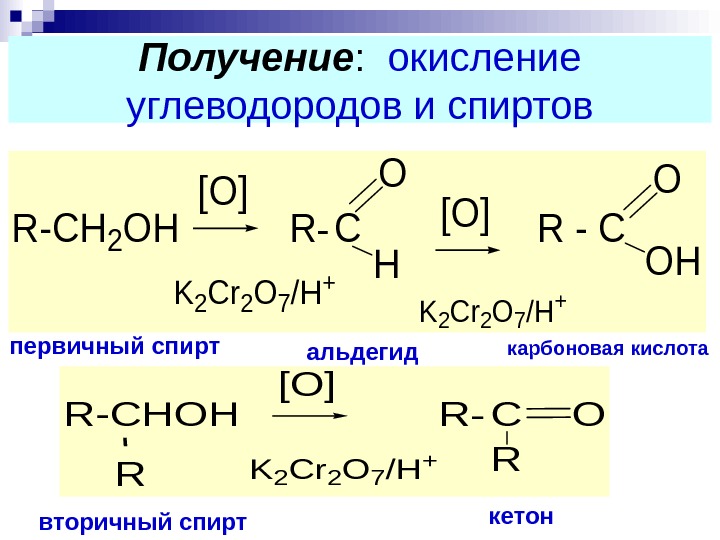
 Получение : окисление углеводородов и спиртов. R-CH 2 OH R- C R — C O H [O] K 2 Cr 2 O 7/H + O OH [O] K 2 Cr 2 O 7/H + R-CHOH R- CO R [O] K 2 Cr 2 O 7/H + R вторичный спирт альдегидпервичный спирт кетон карбоновая кислота
Получение : окисление углеводородов и спиртов. R-CH 2 OH R- C R — C O H [O] K 2 Cr 2 O 7/H + O OH [O] K 2 Cr 2 O 7/H + R-CHOH R- CO R [O] K 2 Cr 2 O 7/H + R вторичный спирт альдегидпервичный спирт кетон карбоновая кислота
 Получение : восстановление карбоновых кислот до альдегидов. RCOOH RCOCl RCHO + HCl SOCl 2 H 2, Pd карбоновая кислота альдегид ацилхлорид
Получение : восстановление карбоновых кислот до альдегидов. RCOOH RCOCl RCHO + HCl SOCl 2 H 2, Pd карбоновая кислота альдегид ацилхлорид
 Физические свойства Низшие алифатические альдегиды и кетоны — подвижные жидкости (формальдегид — газ ) Первые представители (формальдегид, ацетальдегид, ацетон) хорошо растворимы в воде. По мере удлинения углеродной цепи растворимость в воде снижается. Ароматические карбонильные соединения плохо растворимы в воде
Физические свойства Низшие алифатические альдегиды и кетоны — подвижные жидкости (формальдегид — газ ) Первые представители (формальдегид, ацетальдегид, ацетон) хорошо растворимы в воде. По мере удлинения углеродной цепи растворимость в воде снижается. Ароматические карбонильные соединения плохо растворимы в воде
 Физические свойства Альдегиды и кетоны имеют более низкие температуры кипения , чем спирты и карбоновые кислоты с тем же числом атомов углерода. Это объясняется тем, что альдегиды и кетоны не образуют ассоциатов
Физические свойства Альдегиды и кетоны имеют более низкие температуры кипения , чем спирты и карбоновые кислоты с тем же числом атомов углерода. Это объясняется тем, что альдегиды и кетоны не образуют ассоциатов
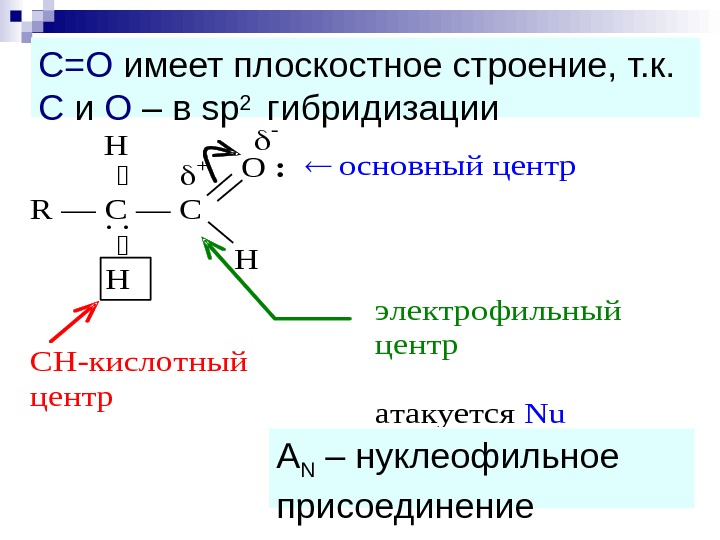
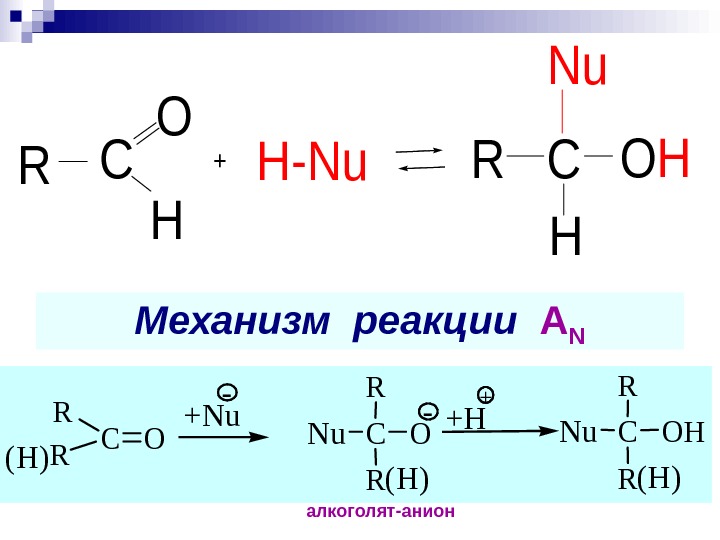
 R — С — C О : H Н Н + — . . основный центр CН-кислотный центр электрофильный центр атакуется Nu A N – нуклеофильное присоединение. С=О имеет плоскостное строение, т. к. С и О – в sp 2 гибридизации
R — С — C О : H Н Н + — . . основный центр CН-кислотный центр электрофильный центр атакуется Nu A N – нуклеофильное присоединение. С=О имеет плоскостное строение, т. к. С и О – в sp 2 гибридизации
 Механизм реакции А NC O H +H-Nu. RRC H Nu OH CO R R COH R R +Nu- — Nu + Nu (H) +H (H) алкоголят-анион CO R R COH R R +Nu- — Nu + Nu (H) (H) +H (H)
Механизм реакции А NC O H +H-Nu. RRC H Nu OH CO R R COH R R +Nu- — Nu + Nu (H) +H (H) алкоголят-анион CO R R COH R R +Nu- — Nu + Nu (H) (H) +H (H)
 Скорость протекания реакций A N зависит: от величины эффективного положительного заряда на атоме углерода карбонильной группы пространственной доступности электрофильного центра
Скорость протекания реакций A N зависит: от величины эффективного положительного заряда на атоме углерода карбонильной группы пространственной доступности электрофильного центра
 У кетонов A N реакции идут медленнее: два радикала с + I -эффектом снижают электрофильность карбонильного атома С при наличии объемных заместителей (например, третбутильных) создаются пространственные затруднения для атаки нуклеофила и реакция невозможна циклические кетоны (циклопентанон) более реакционноспособны , чем ациклические аналоги (пентанон-3): пространственная доступность
У кетонов A N реакции идут медленнее: два радикала с + I -эффектом снижают электрофильность карбонильного атома С при наличии объемных заместителей (например, третбутильных) создаются пространственные затруднения для атаки нуклеофила и реакция невозможна циклические кетоны (циклопентанон) более реакционноспособны , чем ациклические аналоги (пентанон-3): пространственная доступность
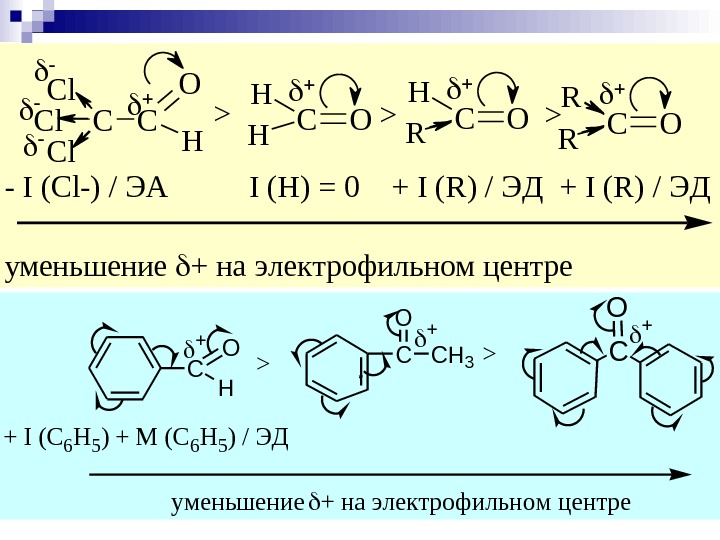
 CC O H Cl Cl Cl CO H H >>CO H R >CO R R — I ( C l — ) / Э А I ( Н ) = 0 + I ( R ) / Э Д у м е н ь ш е н и е + н а э л е к т р о ф и л ь н о м ц е н т р е > > C O H CCH 3 O C O + I (С 6 Н 5) + М (С 6 Н 5) / ЭД уменьшение + на электрофильном центре
CC O H Cl Cl Cl CO H H >>CO H R >CO R R — I ( C l — ) / Э А I ( Н ) = 0 + I ( R ) / Э Д у м е н ь ш е н и е + н а э л е к т р о ф и л ь н о м ц е н т р е > > C O H CCH 3 O C O + I (С 6 Н 5) + М (С 6 Н 5) / ЭД уменьшение + на электрофильном центре
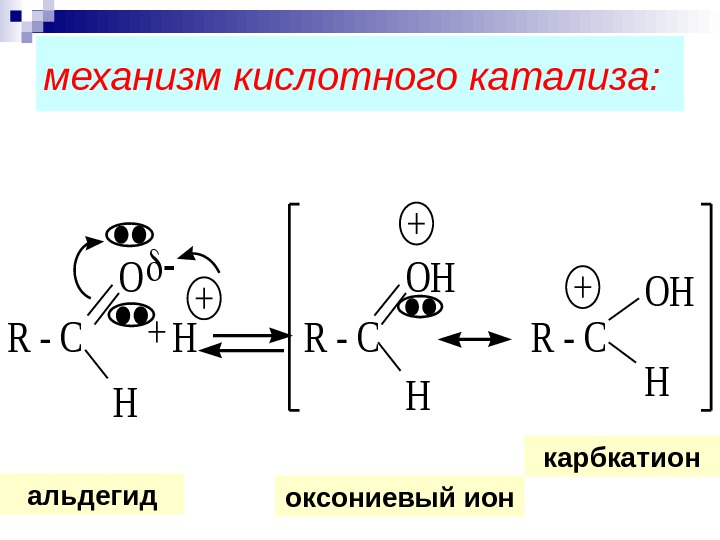
 Повысить реакционную способность в А N реакциях можно: введением в радикал сильных электроноакцепторов , например, атомов галогена в 2, 2, 2 -трихлорэтанале; использованием кислотного катализа
Повысить реакционную способность в А N реакциях можно: введением в радикал сильных электроноакцепторов , например, атомов галогена в 2, 2, 2 -трихлорэтанале; использованием кислотного катализа
 механизм кислотного катализа: R — C H R — C O H OH H альдегид карбкатион оксониевый ион
механизм кислотного катализа: R — C H R — C O H OH H альдегид карбкатион оксониевый ион
 Реакции с кислородсодержащими нуклеофилами
Реакции с кислородсодержащими нуклеофилами
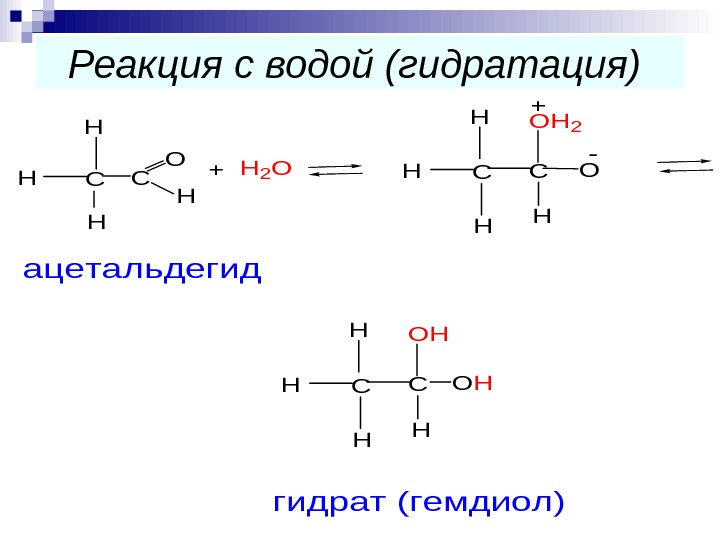
 Реакция с водой (гидратация) CC Н Н Н O H CCOHH H H HOH +H 2 OCCOH HH HOH 2 + — ацетальдегид гидрат (гемдиол)
Реакция с водой (гидратация) CC Н Н Н O H CCOHH H H HOH +H 2 OCCOH HH HOH 2 + — ацетальдегид гидрат (гемдиол)
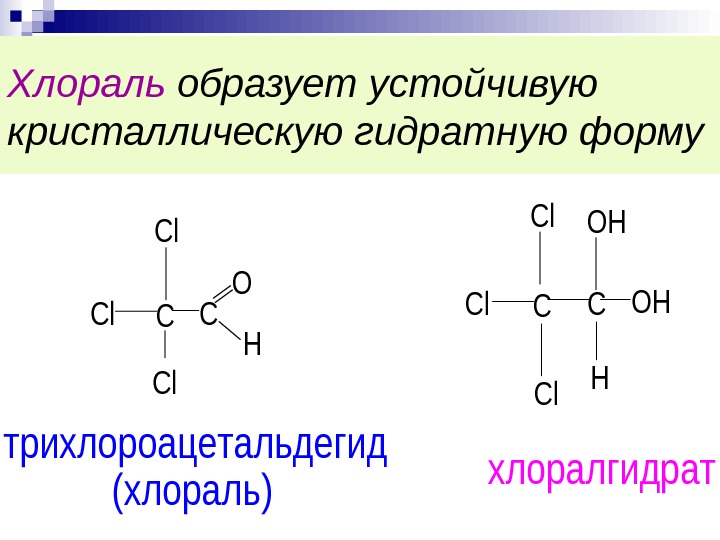
 Хлораль образует устойчивую кристаллическую гидратную форму CC Cl Cl Cl O H CCOHCl Cl H Cl. OH трихлороацетальдегид (хлораль) хлоралгидрат
Хлораль образует устойчивую кристаллическую гидратную форму CC Cl Cl Cl O H CCOHCl Cl H Cl. OH трихлороацетальдегид (хлораль) хлоралгидрат
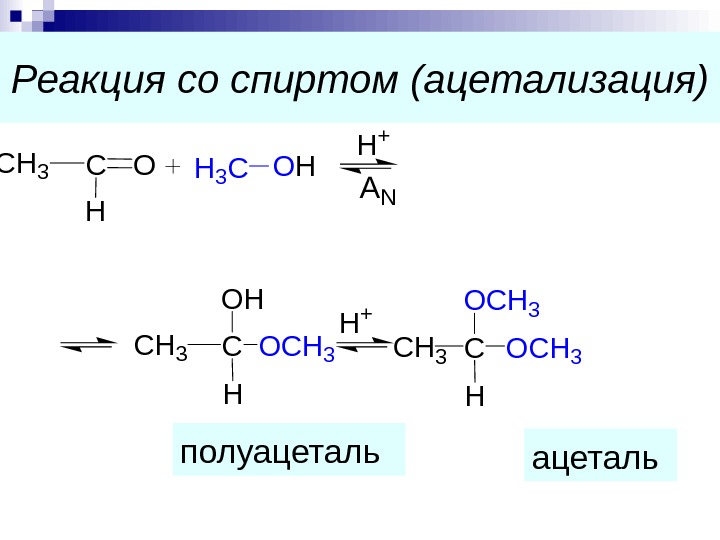
 Реакция со спиртом (ацетализация) полуацеталь. C H OCH 3 H 3 COH H + AN C H OH CH 3 OCH 3 H + C H OCH 3 OCH
Реакция со спиртом (ацетализация) полуацеталь. C H OCH 3 H 3 COH H + AN C H OH CH 3 OCH 3 H + C H OCH 3 OCH
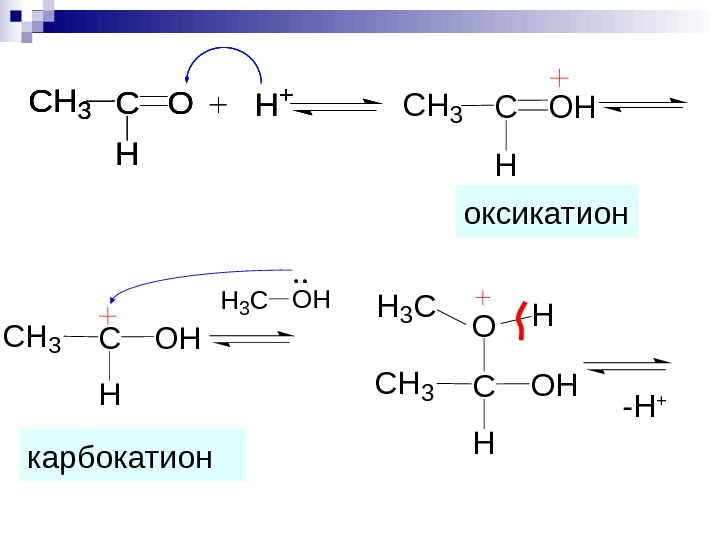
 C H OHCH 3 C H OCH 3 H + C H OHCH 3 оксикатион карбокатион H 3 COH — H + C H OHCH 3 H 3 C O H C H OCH 3 H +
C H OHCH 3 C H OCH 3 H + C H OHCH 3 оксикатион карбокатион H 3 COH — H + C H OHCH 3 H 3 C O H C H OCH 3 H +
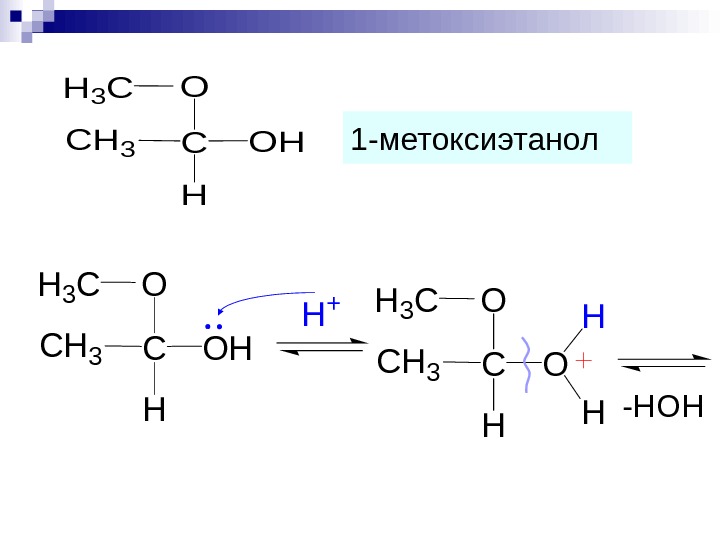
 C H OHCH 3 H 3 CO 1 — метоксиэтанол C H OCH 3 H 3 CO H H C H OHCH 3 H 3 C H + O -HOH
C H OHCH 3 H 3 CO 1 — метоксиэтанол C H OCH 3 H 3 CO H H C H OHCH 3 H 3 C H + O -HOH
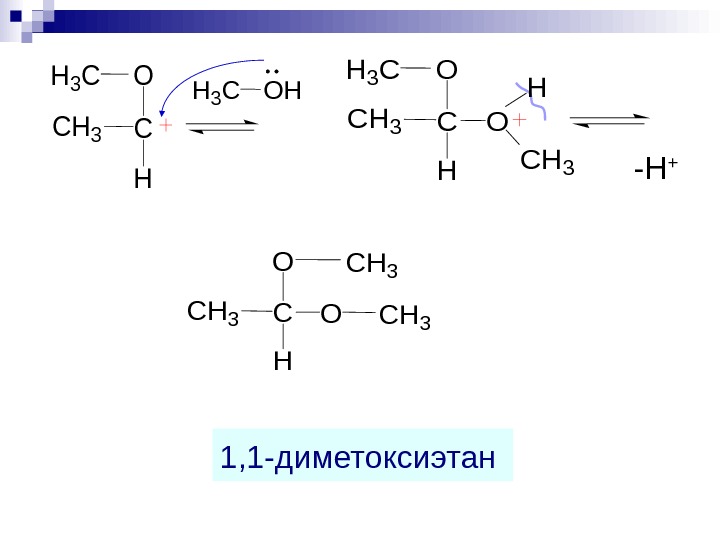
 1 , 1 — диметоксиэтан -H + C H CH 3 H 3 COH C H CH 3 H 3 CO O H CH 3 C H CH 3 O OCH
1 , 1 — диметоксиэтан -H + C H CH 3 H 3 COH C H CH 3 H 3 CO O H CH 3 C H CH 3 O OCH
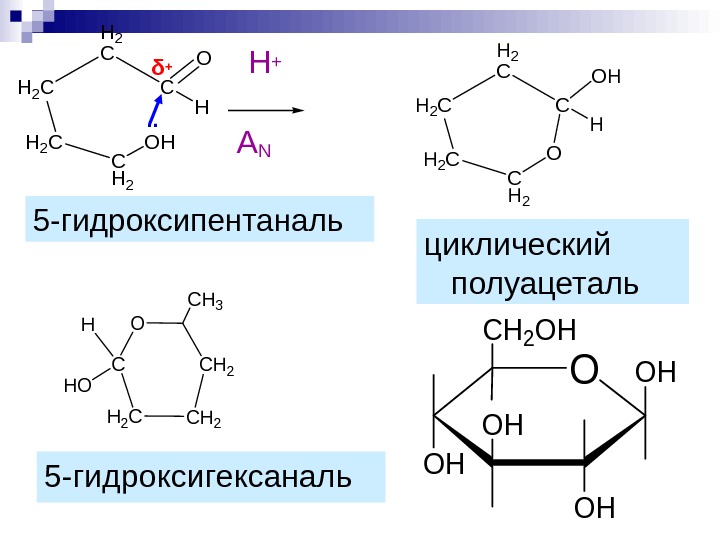
 5 -гидроксипентаналь. C H 2 C H 2 C C O H OH Н +. . δ + C H 2 C H 2 C C OH H O циклический полуацеталь C H 2 H 2 CC H O C H 3 5 -гидроксигексаналь O OH OH CH 2 OH A N
5 -гидроксипентаналь. C H 2 C H 2 C C O H OH Н +. . δ + C H 2 C H 2 C C OH H O циклический полуацеталь C H 2 H 2 CC H O C H 3 5 -гидроксигексаналь O OH OH CH 2 OH A N
 Реакции с серосодержащими нуклеофилами
Реакции с серосодержащими нуклеофилами
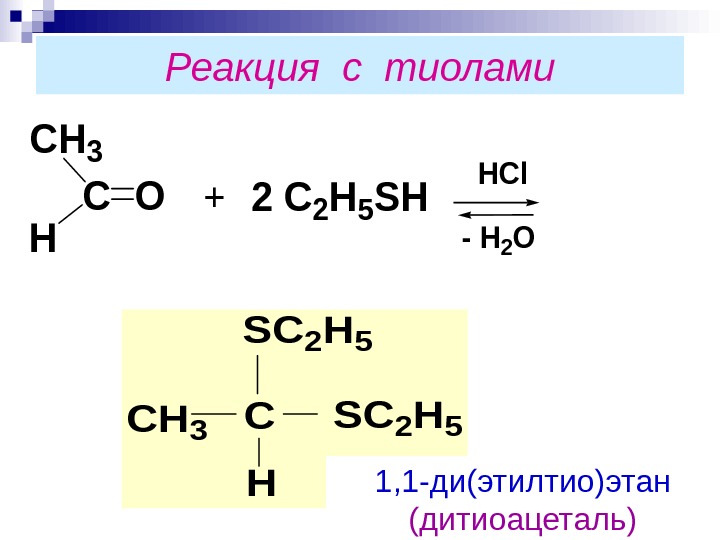
 Реакция с тиолами. CO CH 3 H +2 C 2 H 5 SH HCl — H 2 O CH 3 C H SC 2 H 5 1, 1 -ди(этилтио)этан (дитиоацеталь)
Реакция с тиолами. CO CH 3 H +2 C 2 H 5 SH HCl — H 2 O CH 3 C H SC 2 H 5 1, 1 -ди(этилтио)этан (дитиоацеталь)
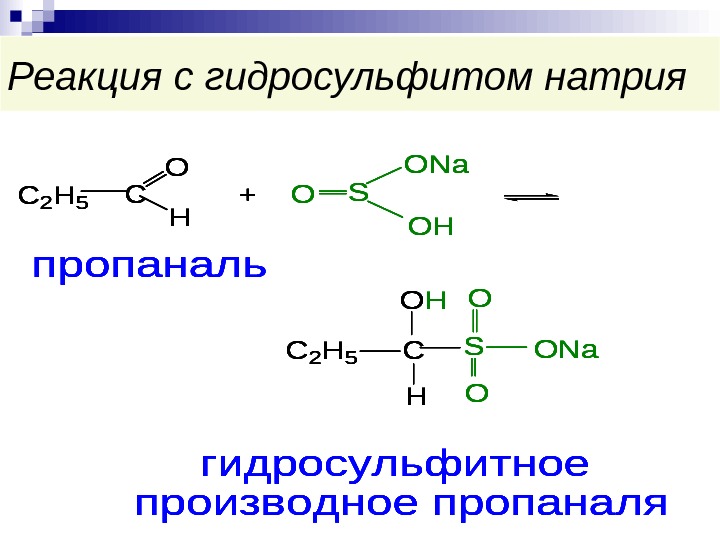
 Реакция с гидросульфитом натрия. C 2 H 5 C O H +S ONa OH C 2 H 5 C OH H S O O ONa пропаналь гидросульфитное производное пропаналя ОC 2 H 5 C O H +S ONa OH C 2 H 5 C OH H S O O ONa пропаналь гидросульфитное производное пропаналя О
Реакция с гидросульфитом натрия. C 2 H 5 C O H +S ONa OH C 2 H 5 C OH H S O O ONa пропаналь гидросульфитное производное пропаналя ОC 2 H 5 C O H +S ONa OH C 2 H 5 C OH H S O O ONa пропаналь гидросульфитное производное пропаналя О
 Реакции с азотсодержащими нуклеофилами
Реакции с азотсодержащими нуклеофилами
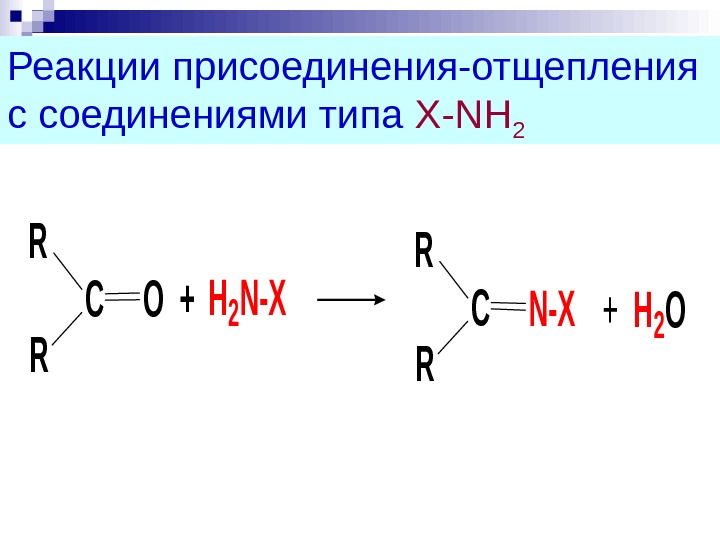
 Реакции присоединения-отщепления с соединениями типа X-NH 2 R R СО+H 2 N-X R R СN-X+ H 2 O
Реакции присоединения-отщепления с соединениями типа X-NH 2 R R СО+H 2 N-X R R СN-X+ H 2 O
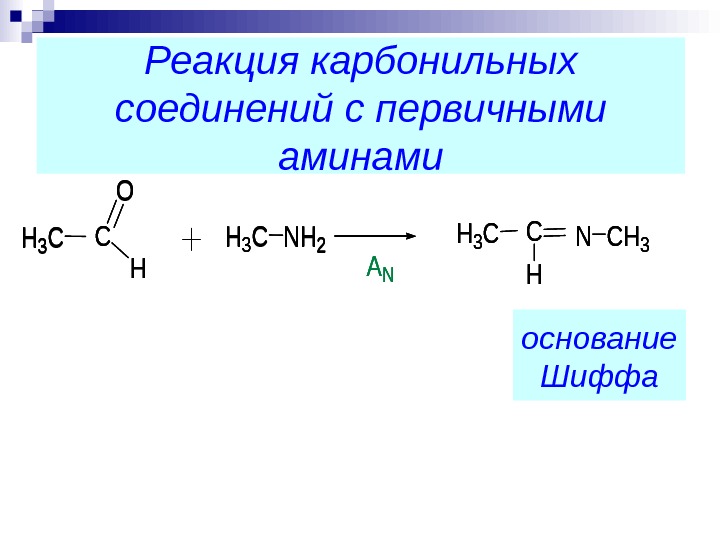
 Реакция карбонильных соединений с первичными аминами. H 3 CNH 2 H 3 CC O HAN CH 3 NH 3 CC H основание Шиффа H 3 CNH 2 H 3 CC O HAN CH 3 NH 3 CC H
Реакция карбонильных соединений с первичными аминами. H 3 CNH 2 H 3 CC O HAN CH 3 NH 3 CC H основание Шиффа H 3 CNH 2 H 3 CC O HAN CH 3 NH 3 CC H
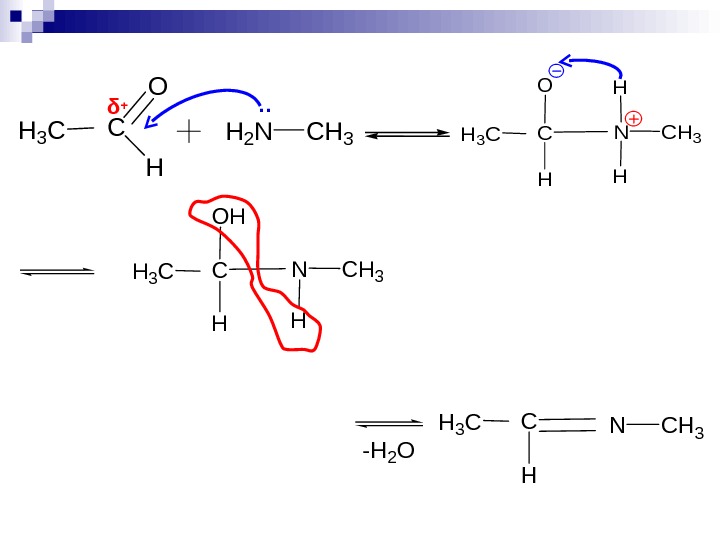
 CH 3 H 2 NH 3 CC O H δ +. . CH 3 NH 3 CC H OH H CH 3 NH 3 CC H -H 2 O
CH 3 H 2 NH 3 CC O H δ +. . CH 3 NH 3 CC H OH H CH 3 NH 3 CC H -H 2 O
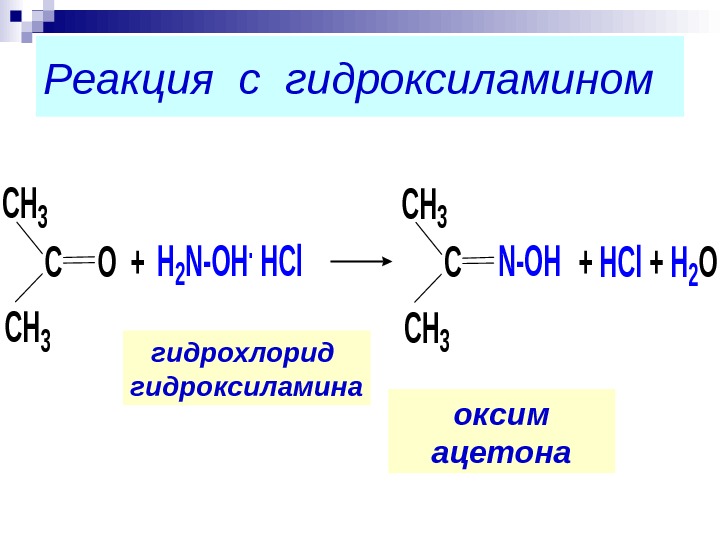
 Реакция с гидроксиламином оксим ацетона. CH 3 СО+H 2 N-OH. HCl+ HCl + H 2 O CH 3 СN-OHгидрохлорид гидроксиламина
Реакция с гидроксиламином оксим ацетона. CH 3 СО+H 2 N-OH. HCl+ HCl + H 2 O CH 3 СN-OHгидрохлорид гидроксиламина
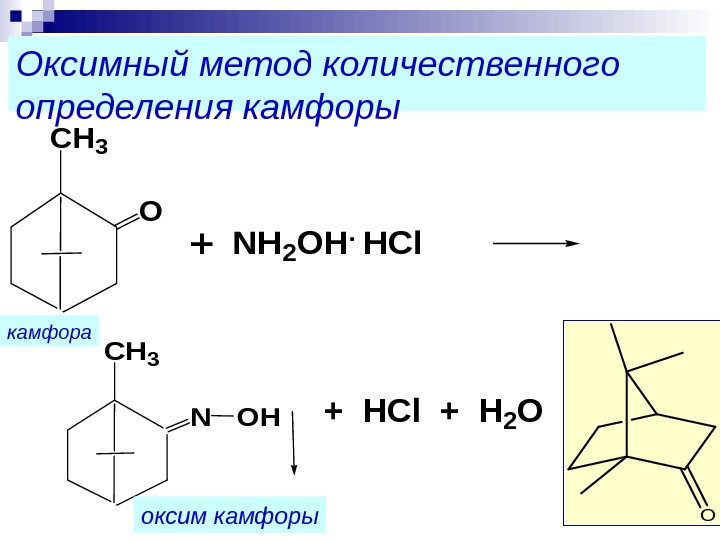
 Оксимный метод количественного определения камфоры. O CH 3 O + NH 2 OH. HCl CH 3 N OH+ HCl + H 2 O оксим камфорыкамфора
Оксимный метод количественного определения камфоры. O CH 3 O + NH 2 OH. HCl CH 3 N OH+ HCl + H 2 O оксим камфорыкамфора
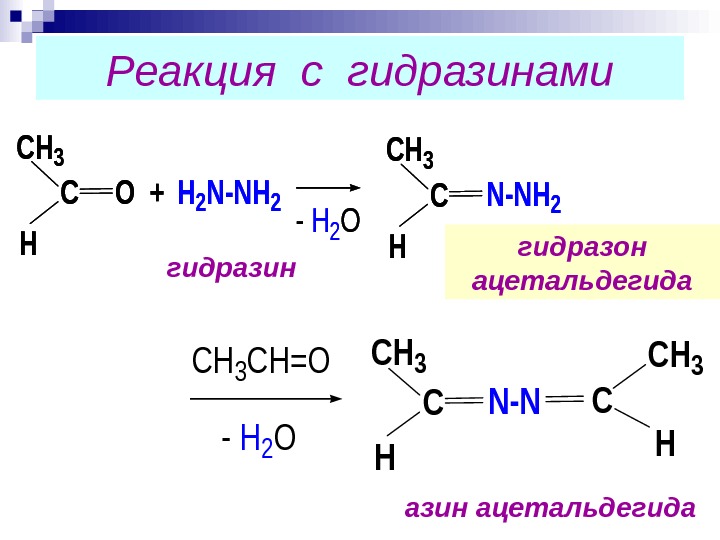
 Реакция с гидразинами. CH 3 H СО+H 2 N-NH 2 — H 2 O CH 3 H СN-NH 2 — H 2 O CH 3 CH=OCH 3 H СN-NC CH 3 H азин ацетальдегида гидразон ацетальдегидагидразин CH 3 H СО+H 2 N-NH 2 — H 2 O CH 3 H СN-NH
Реакция с гидразинами. CH 3 H СО+H 2 N-NH 2 — H 2 O CH 3 H СN-NH 2 — H 2 O CH 3 CH=OCH 3 H СN-NC CH 3 H азин ацетальдегида гидразон ацетальдегидагидразин CH 3 H СО+H 2 N-NH 2 — H 2 O CH 3 H СN-NH
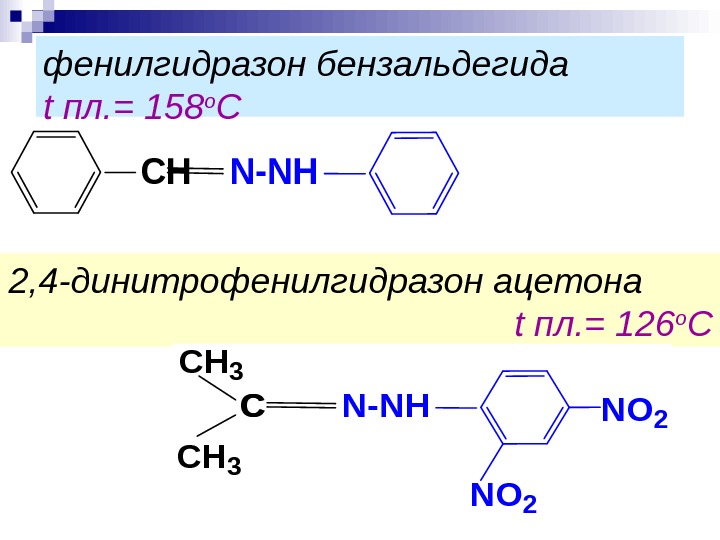
 фенилгидразон бензальдегида t пл. = 158 о ССHN-NH 2, 4 -динитрофенилгидразон ацетона t пл. = 126 о С CH 3 СN-NH CH 3 СNO
фенилгидразон бензальдегида t пл. = 158 о ССHN-NH 2, 4 -динитрофенилгидразон ацетона t пл. = 126 о С CH 3 СN-NH CH 3 СNO
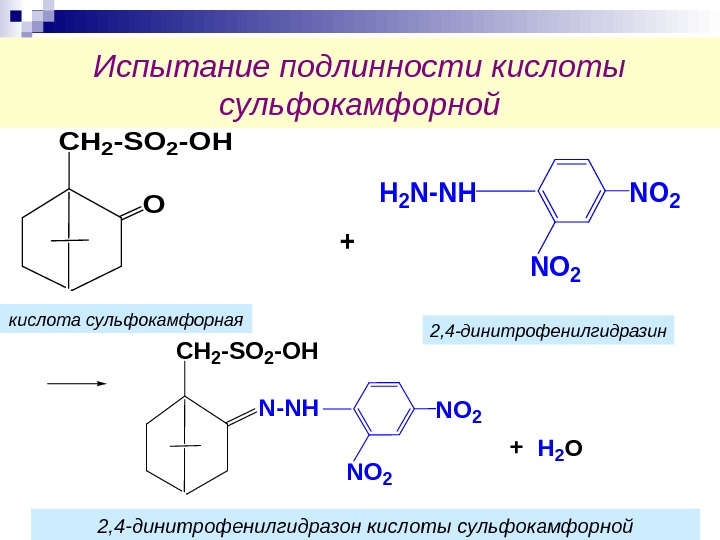
 Испытание подлинности кислоты сульфокамфорной. CH 2 -SO 2 -OH O H 2 N-NHNO 2 + CH 2 -SO 2 -OH N-NHNO 2 +H 2 Oкислота сульфокамфорная 2, 4 -динитрофенилгидразин 2, 4 -динитрофенилгидразон кислоты сульфокамфорной
Испытание подлинности кислоты сульфокамфорной. CH 2 -SO 2 -OH O H 2 N-NHNO 2 + CH 2 -SO 2 -OH N-NHNO 2 +H 2 Oкислота сульфокамфорная 2, 4 -динитрофенилгидразин 2, 4 -динитрофенилгидразон кислоты сульфокамфорной
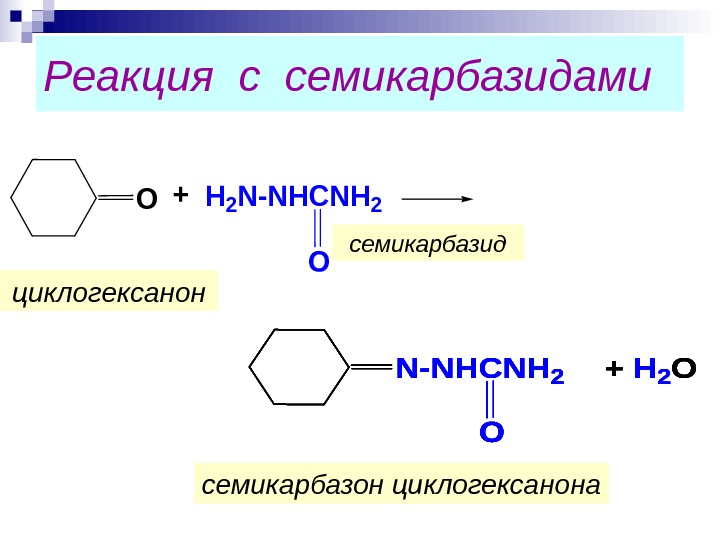
 Реакция с семикарбазидами. О+H 2 N-NHCNH 2+ H 2 O семикарбазид семикарбазон циклогексанонациклогексанон. N-NHCNH 2+ H 2 ON-NHCNH 2+ H 2 O
Реакция с семикарбазидами. О+H 2 N-NHCNH 2+ H 2 O семикарбазид семикарбазон циклогексанонациклогексанон. N-NHCNH 2+ H 2 ON-NHCNH 2+ H 2 O
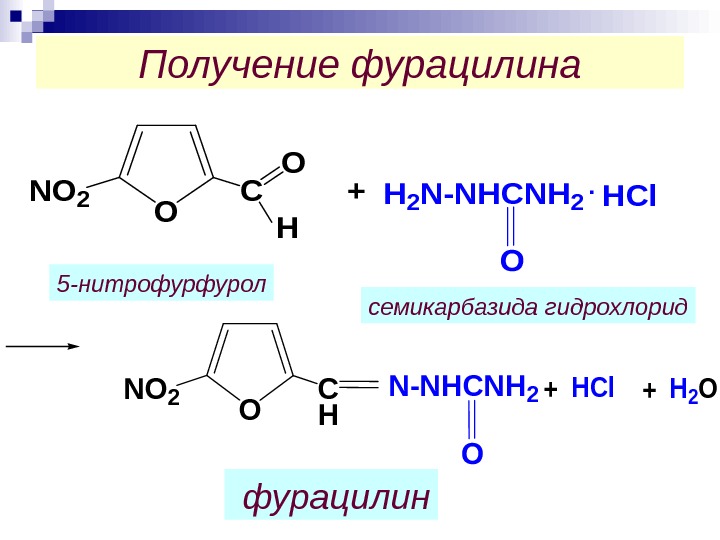
 Получение фурацилина. O NO 2 C O +H 2 N-NHCNH 2. HCl H O NO 2 C H N-NHCNH 2+HCl+H 2 O фурацилин 5 -нитрофурфурол семикарбазида гидрохлорид
Получение фурацилина. O NO 2 C O +H 2 N-NHCNH 2. HCl H O NO 2 C H N-NHCNH 2+HCl+H 2 O фурацилин 5 -нитрофурфурол семикарбазида гидрохлорид
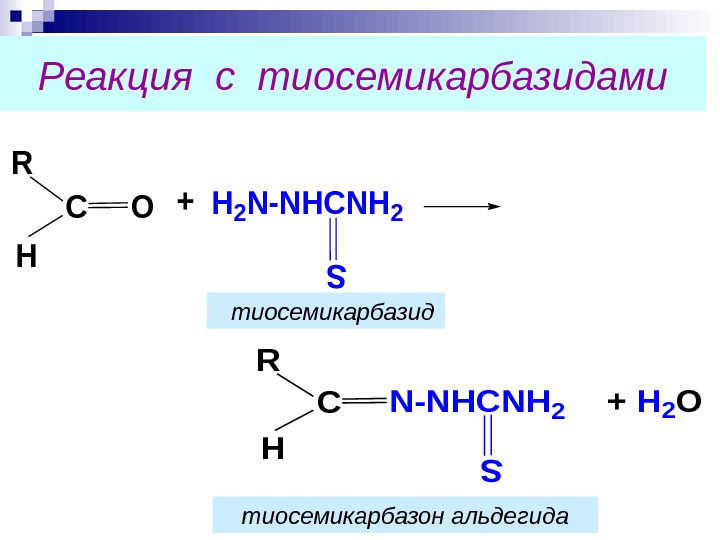
 Реакция с тиосемикарбазидами+H 2 N-NHCNH 2 R H СО N-NHCNH 2+ H 2 O R H С тиосемикарбазид тиосемикарбазон альдегида
Реакция с тиосемикарбазидами+H 2 N-NHCNH 2 R H СО N-NHCNH 2+ H 2 O R H С тиосемикарбазид тиосемикарбазон альдегида
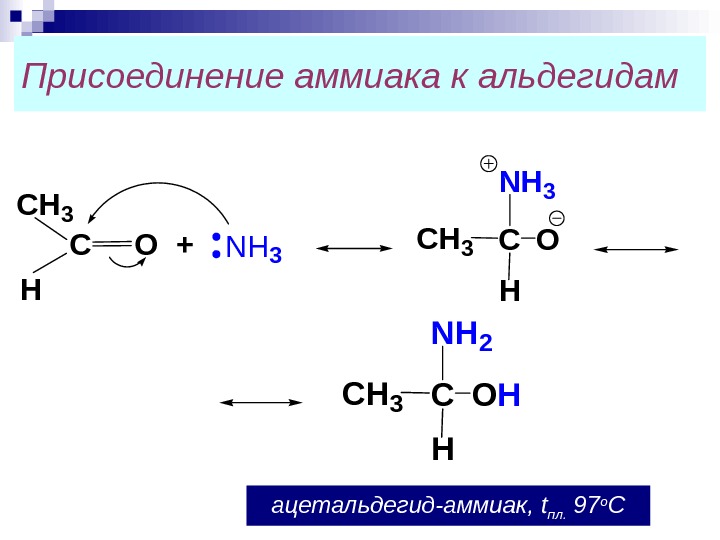
 Присоединение аммиака к альдегидам C H 3 H С О + N H 3 С H 3 C ON H 3 H СH 3 COH NH 2 H ацетальдегид-аммиак, t пл. 97 о С
Присоединение аммиака к альдегидам C H 3 H С О + N H 3 С H 3 C ON H 3 H СH 3 COH NH 2 H ацетальдегид-аммиак, t пл. 97 о С
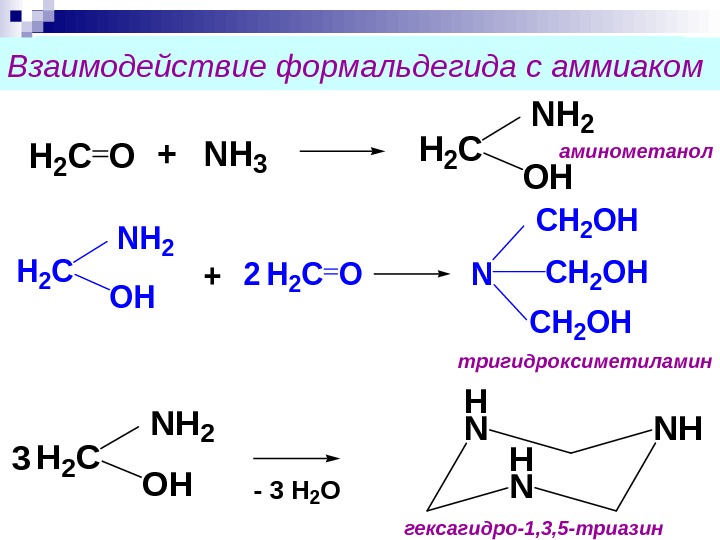
 Взаимодействие с аммиаком. H 2 CO+NH 3 Н 2 С OH NH 2 3 — 3 H 2 O H N NH Н 2 С OH NH 2 H 2 CO+2 N CH 2 OHВзаимодействие формальдегида с аммиаком гексагидро-1, 3, 5 -триазин тригидроксиметиламинометанол
Взаимодействие с аммиаком. H 2 CO+NH 3 Н 2 С OH NH 2 3 — 3 H 2 O H N NH Н 2 С OH NH 2 H 2 CO+2 N CH 2 OHВзаимодействие формальдегида с аммиаком гексагидро-1, 3, 5 -триазин тригидроксиметиламинометанол
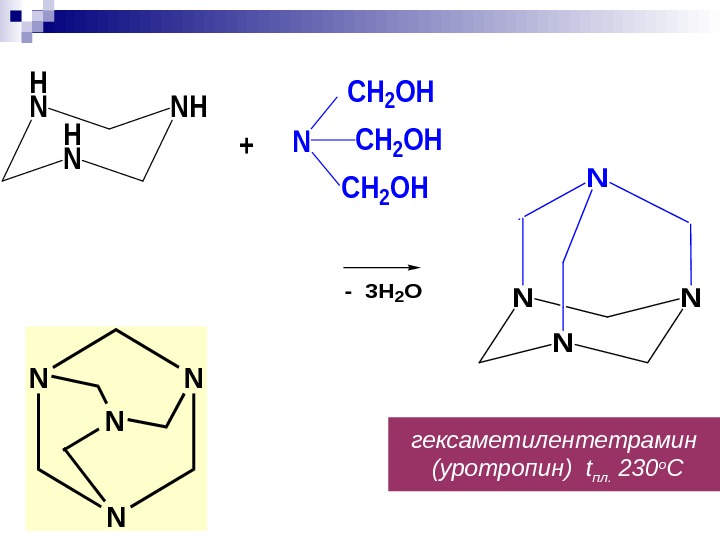
 гексаметилентетрамин (уротропин) t пл. 230 о СH N NH N CH 2 OH + N N — 3 H 2 O N N
гексаметилентетрамин (уротропин) t пл. 230 о СH N NH N CH 2 OH + N N — 3 H 2 O N N
 Реакции с углеродсодержащими нуклеофилами
Реакции с углеродсодержащими нуклеофилами
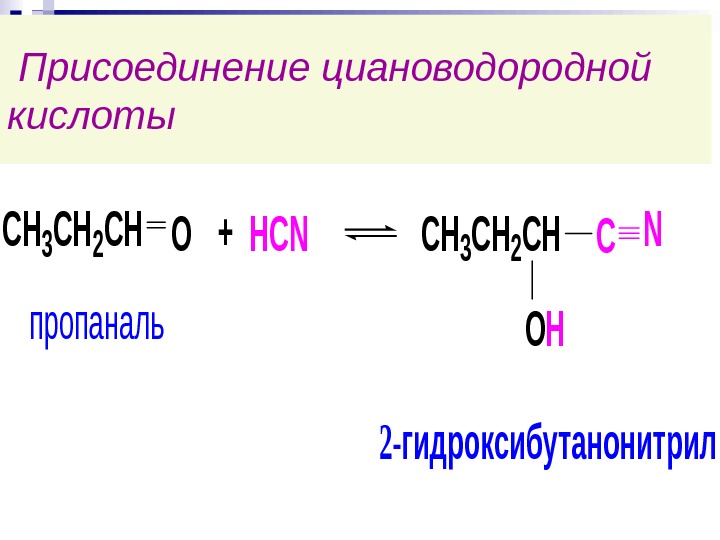
 Присоединение циановодородной кислоты. CH 3 CH 2 CHO+HCNCH 3 CH 2 CHCN OHпропаналь 2 -гидроксибутанонитрил
Присоединение циановодородной кислоты. CH 3 CH 2 CHO+HCNCH 3 CH 2 CHCN OHпропаналь 2 -гидроксибутанонитрил
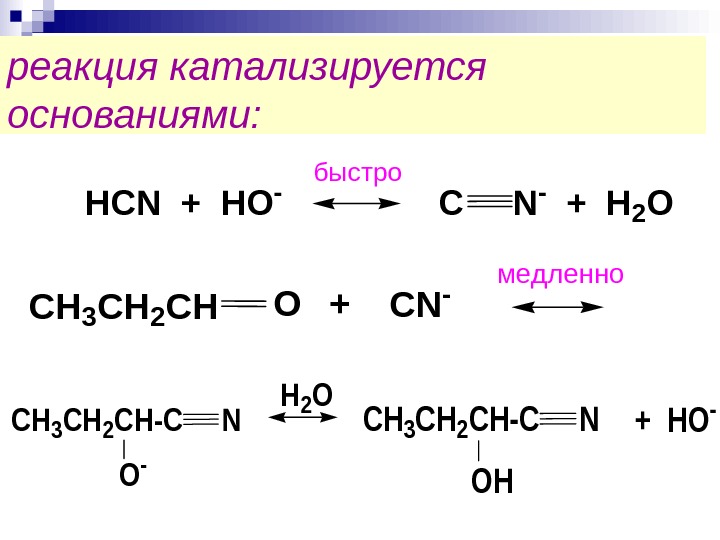
 реакция катализируется основаниями: HCN + HO — C N — + H 2 O быстро +CH 3 CH 2 CHOCN — медленно H 2 O CH 3 CH 2 CH-C N O — CH 3 CH 2 CH-C N OH + HO —
реакция катализируется основаниями: HCN + HO — C N — + H 2 O быстро +CH 3 CH 2 CHOCN — медленно H 2 O CH 3 CH 2 CH-C N O — CH 3 CH 2 CH-C N OH + HO —
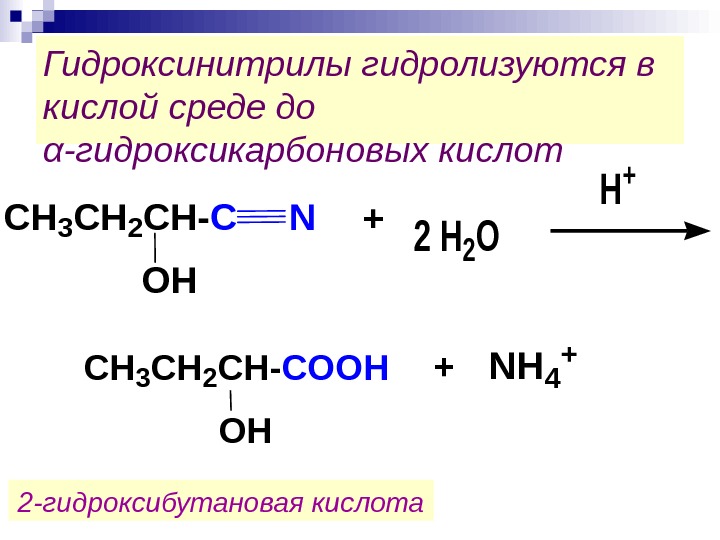
 Гидроксинитрилы гидролизуются в кислой среде до α -гидроксикарбоновых кислот2 H 2 O H + C H 3 C H 2 C H — С O O H + NH 4 + 2 -гидроксибутановая кислота CH 3 CH 2 CH-C N OH +
Гидроксинитрилы гидролизуются в кислой среде до α -гидроксикарбоновых кислот2 H 2 O H + C H 3 C H 2 C H — С O O H + NH 4 + 2 -гидроксибутановая кислота CH 3 CH 2 CH-C N OH +
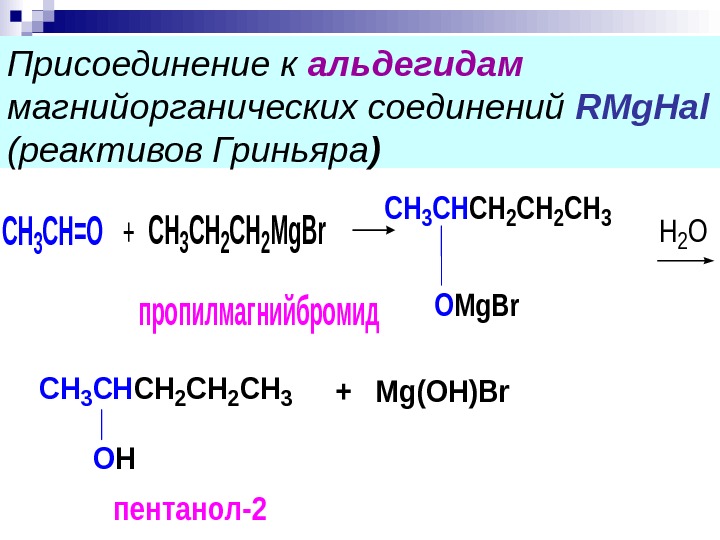
 Присоединение к альдегидам магнийорганических соединений RMg. Hal ( реактивов Гриньяра )CH 3 CH 2 Mg. Br пропилмагнийбромид СН 3 СН=О+ CH 3 CHCH 2 CH 3 OMg. Br H 2 O CH 3 CНCH 2 CH 3 OH +Mg(OH)Br пентанол-
Присоединение к альдегидам магнийорганических соединений RMg. Hal ( реактивов Гриньяра )CH 3 CH 2 Mg. Br пропилмагнийбромид СН 3 СН=О+ CH 3 CHCH 2 CH 3 OMg. Br H 2 O CH 3 CНCH 2 CH 3 OH +Mg(OH)Br пентанол-
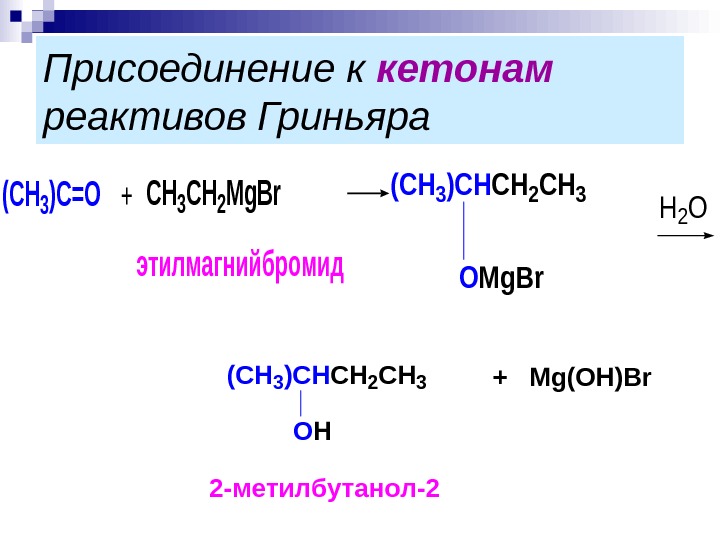
 Присоединение к кетонам реактивов Гриньяра. CH 3 CH 2 Mg. Br этилмагнийбромид (СН 3)С=О+ (CH 3)CHCH 2 CH 3 OMg. Br H 2 O (CH 3)CНCH 2 CH 3 OH +Mg(OH)Br 2 -метилбутанол-
Присоединение к кетонам реактивов Гриньяра. CH 3 CH 2 Mg. Br этилмагнийбромид (СН 3)С=О+ (CH 3)CHCH 2 CH 3 OMg. Br H 2 O (CH 3)CНCH 2 CH 3 OH +Mg(OH)Br 2 -метилбутанол-
 Магний- и литийорганические соединения проявляют сильные основные и нуклеофильные свойства. Они легко присоединяются к полярным кратным связям С=О , С= S , C=N. Алкильные и арильные радикалы связываются с положительным концом диполя: С+CC XM CXM М – Li или Mg. Hal
Магний- и литийорганические соединения проявляют сильные основные и нуклеофильные свойства. Они легко присоединяются к полярным кратным связям С=О , С= S , C=N. Алкильные и арильные радикалы связываются с положительным концом диполя: С+CC XM CXM М – Li или Mg. Hal
![in vitro - с участием Li[Al. H 4 ] in vivo - с in vitro - с участием Li[Al. H 4 ] in vivo - с](/docs//farm_aldegidy_i_ketony_images/farm_aldegidy_i_ketony_48.jpg) in vitro — с участием Li[Al. H 4 ] in vivo — с участием кофермента НАДНВосстановление карбонильных соединений нуклеофил – гидрид-анион — Н —
in vitro — с участием Li[Al. H 4 ] in vivo — с участием кофермента НАДНВосстановление карбонильных соединений нуклеофил – гидрид-анион — Н —
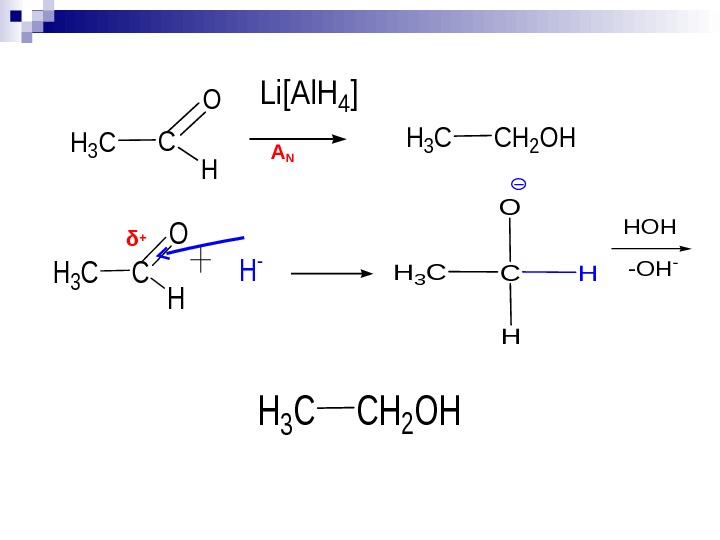
![H 3 CC O H Li[Al. H 4] H 3 CCH 2 OH H H 3 CC O H Li[Al. H 4] H 3 CCH 2 OH H](/docs//farm_aldegidy_i_ketony_images/farm_aldegidy_i_ketony_49.jpg) H 3 CC O H Li[Al. H 4] H 3 CCH 2 OH H 3 CC O H H — δ + A N H 3 CC O H H HOH -OH- H 3 CCH 2 OH
H 3 CC O H Li[Al. H 4] H 3 CCH 2 OH H 3 CC O H H — δ + A N H 3 CC O H H HOH -OH- H 3 CCH 2 OH
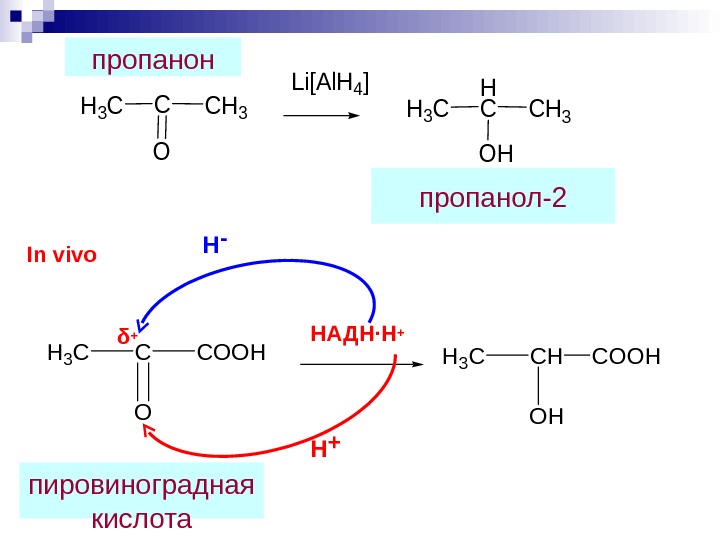
![H 3 CC O CH 3 Li[Al. H 4] H 3 C H CCH H 3 CC O CH 3 Li[Al. H 4] H 3 C H CCH](/docs//farm_aldegidy_i_ketony_images/farm_aldegidy_i_ketony_50.jpg) H 3 CC O CH 3 Li[Al. H 4] H 3 C H CCH 3 OH H 3 CCHCOOH OH H 3 CCCOOH O НАДН∙Н +Н — Н +In vivo пировиноградная кислота δ + пропанол-2 пропанон
H 3 CC O CH 3 Li[Al. H 4] H 3 C H CCH 3 OH H 3 CCHCOOH OH H 3 CCCOOH O НАДН∙Н +Н — Н +In vivo пировиноградная кислота δ + пропанол-2 пропанон
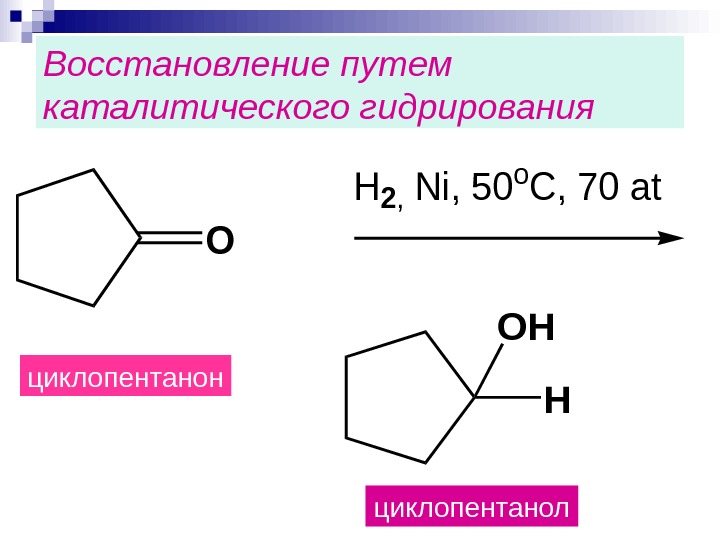
 Восстановление путем каталитического гидрирования. O H 2, Ni, 50 o C, 70 at H OH циклопентанолциклопентанон
Восстановление путем каталитического гидрирования. O H 2, Ni, 50 o C, 70 at H OH циклопентанолциклопентанон
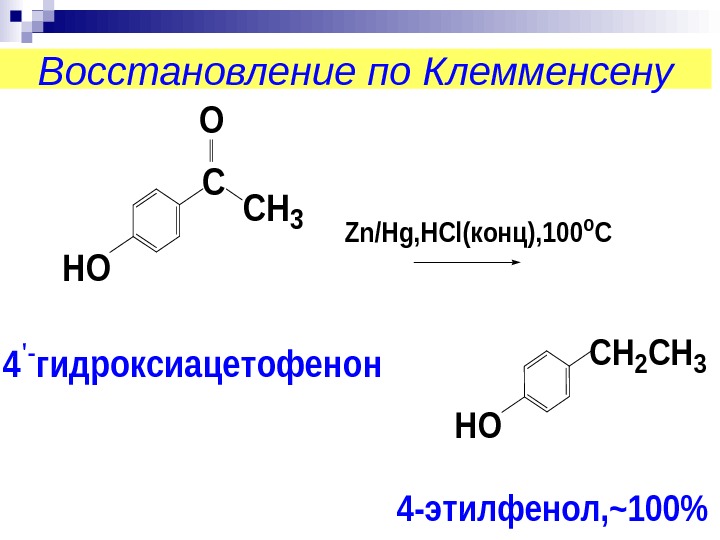
 Восстановление по Клемменсену. C O CH 3 HO Zn/Hg, HCl(конц), 100 o C 4 ‘- гидроксиацетофенон CH 2 CH 3 HO 4 -этилфенол, ~100%
Восстановление по Клемменсену. C O CH 3 HO Zn/Hg, HCl(конц), 100 o C 4 ‘- гидроксиацетофенон CH 2 CH 3 HO 4 -этилфенол, ~100%
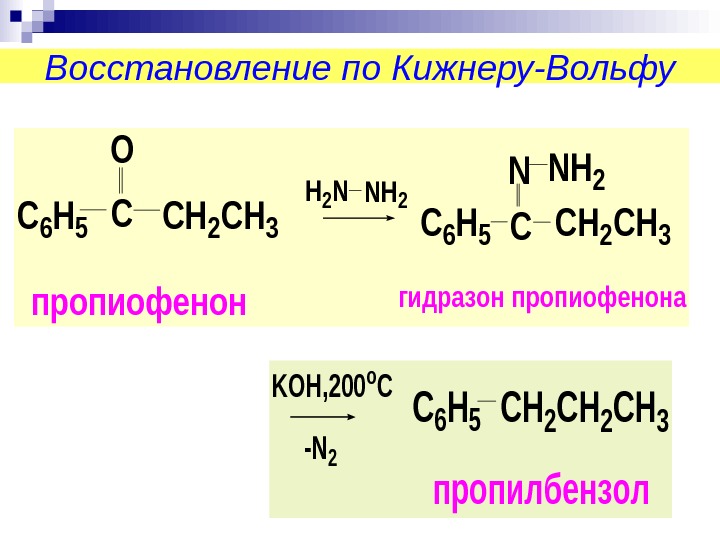
 Восстановление по Кижнеру-Вольфу. C 6 H 5 C O CH 2 CH 3 H 2 NNH 2 C 6 H 5 C NNH 2 CH 2 CH 3 пропиофенонгидразон пропиофенона KOH, 200 o C -N 2 C 6 H 5 CH 2 CH 3 пропилбензол
Восстановление по Кижнеру-Вольфу. C 6 H 5 C O CH 2 CH 3 H 2 NNH 2 C 6 H 5 C NNH 2 CH 2 CH 3 пропиофенонгидразон пропиофенона KOH, 200 o C -N 2 C 6 H 5 CH 2 CH 3 пропилбензол
 Реакции с участием α-СН кислотного центра альдегидов и кетонов. Кето-енольная таутомерия Окисление альдегидов и кетонов
Реакции с участием α-СН кислотного центра альдегидов и кетонов. Кето-енольная таутомерия Окисление альдегидов и кетонов
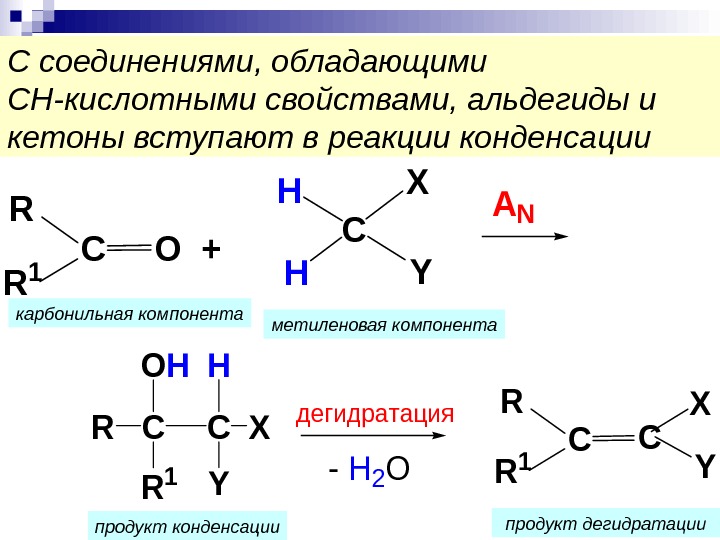
 С соединениями, обладающими СН-кислотными свойствами, альдегиды и кетоны вступают в реакции конденсации. R R 1 СО+ C XH HY AN C R 1 RС OHH Y X — H 2 O дегидратация С R R 1 С X Y карбонильная компонента метиленовая компонента продукт конденсации продукт дегидратации
С соединениями, обладающими СН-кислотными свойствами, альдегиды и кетоны вступают в реакции конденсации. R R 1 СО+ C XH HY AN C R 1 RС OHH Y X — H 2 O дегидратация С R R 1 С X Y карбонильная компонента метиленовая компонента продукт конденсации продукт дегидратации
 Переход карбонильного соединения, имеющего СН-кислотный центр , в енол и обратный переход енола в карбонильное соединение происходит за счет миграции протона. Такое явление называется таутомерией
Переход карбонильного соединения, имеющего СН-кислотный центр , в енол и обратный переход енола в карбонильное соединение происходит за счет миграции протона. Такое явление называется таутомерией
 Таутомерия динамическая изомерия, при которой изомеры могут переходить друг в друга, находясь в растворе в состоянии подвижного равновесия Таутомерия, связанная с переносом протона называется прото-тропной
Таутомерия динамическая изомерия, при которой изомеры могут переходить друг в друга, находясь в растворе в состоянии подвижного равновесия Таутомерия, связанная с переносом протона называется прото-тропной
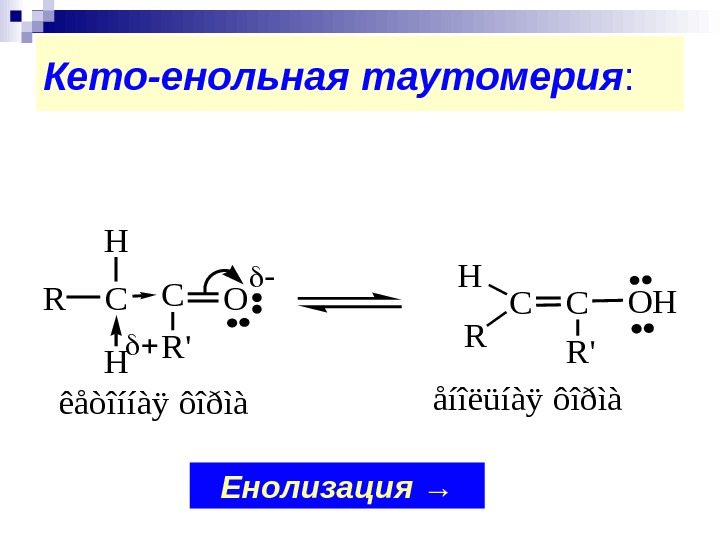
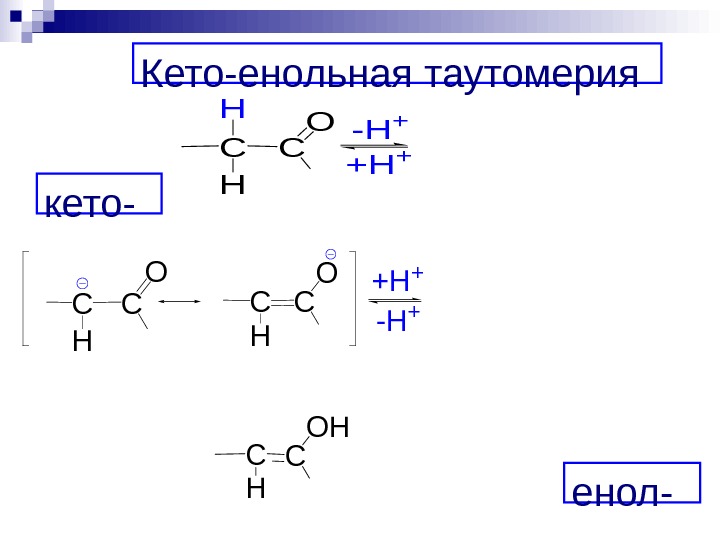
 Кето-енольная таутомерия : COC R’ R H H COHC R’ R H êåòîííàÿ ôîðìàåíîëüíàÿ ôîðìà Енолизация →
Кето-енольная таутомерия : COC R’ R H H COHC R’ R H êåòîííàÿ ôîðìàåíîëüíàÿ ôîðìà Енолизация →
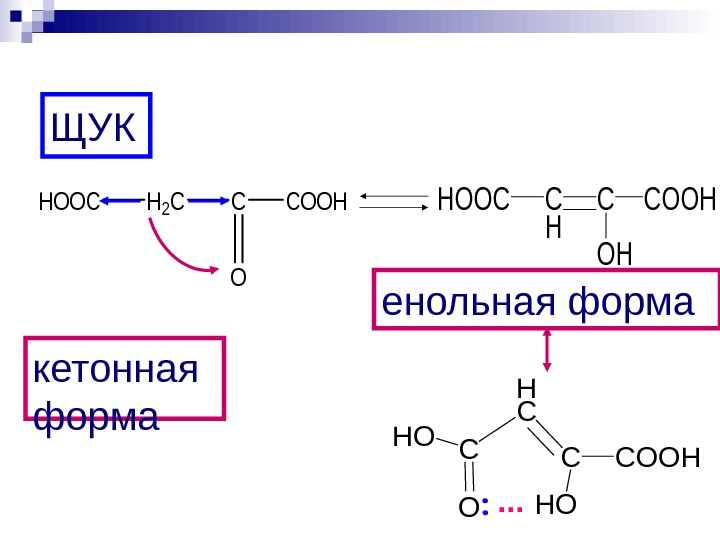
 H 2 CC O COOHHOOCC H C OH COOHHOOC ЩУК кетонная форма енольная форма H C C HO COOHC HO O. . .
H 2 CC O COOHHOOCC H C OH COOHHOOC ЩУК кетонная форма енольная форма H C C HO COOHC HO O. . .
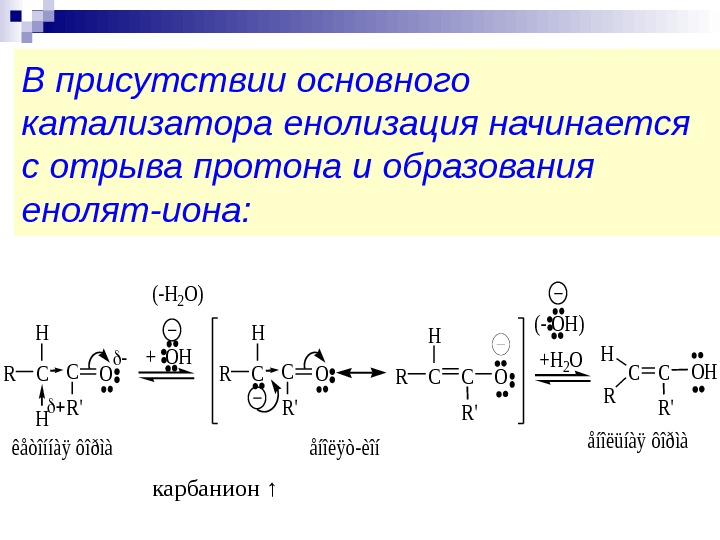
 В присутствии основного катализатора енолизация начинается с отрыва протона и образования енолят-иона: COC R’ R H H COHC R’ R H êåòîííàÿ ôîðìàåíîëüíàÿ ôîðìà + OH COC R’ R H åíîëÿò-èîí +H 2 O (- OH) (-H 2 O) карбанион ↑
В присутствии основного катализатора енолизация начинается с отрыва протона и образования енолят-иона: COC R’ R H H COHC R’ R H êåòîííàÿ ôîðìàåíîëüíàÿ ôîðìà + OH COC R’ R H åíîëÿò-èîí +H 2 O (- OH) (-H 2 O) карбанион ↑
 Кето-енольная таутомерия енол-кето-CC H H O-H + +H + CC H OH C C H O — H ++ H +
Кето-енольная таутомерия енол-кето-CC H H O-H + +H + CC H OH C C H O — H ++ H +
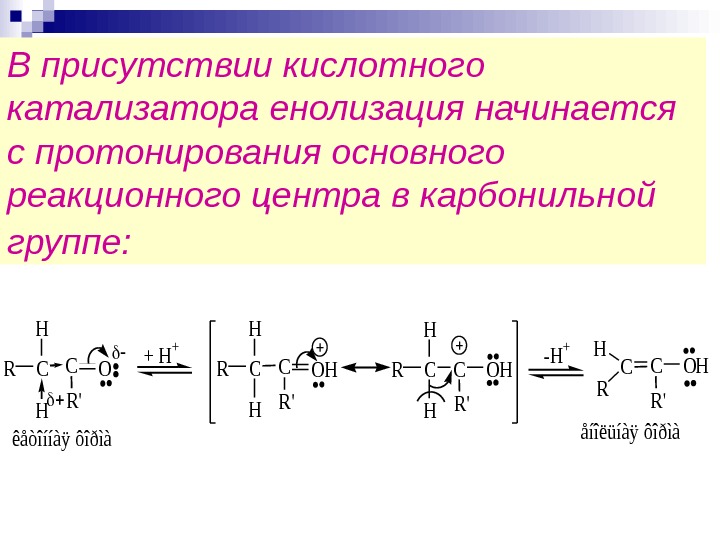
 В присутствии кислотного катализатора енолизация начинается с протонирования основного реакционного центра в карбонильной группе: COC R’ R H H COHC R’ R H êåòîííàÿ ôîðìàåíîëüíàÿ ôîðìà + H + COHC R’ R H -H + H COHC R’ R H H
В присутствии кислотного катализатора енолизация начинается с протонирования основного реакционного центра в карбонильной группе: COC R’ R H H COHC R’ R H êåòîííàÿ ôîðìàåíîëüíàÿ ôîðìà + H + COHC R’ R H -H + H COHC R’ R H H
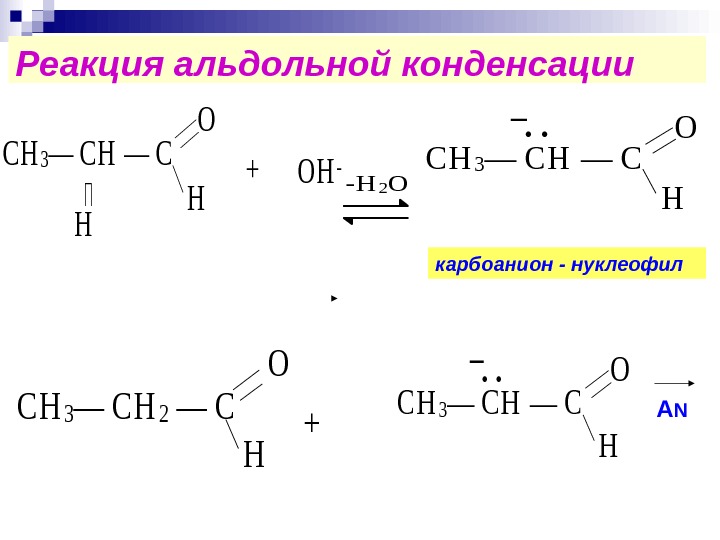
 Реакция альдольной конденсации. С Н 3— С Н — C O H H ОН-+ -Н 2 О С Н 3— С Н — C O H. . _ С Н 3— С Н 2 — C O H + С Н 3— С Н — C O H. . _ карбоанион — нуклеофил А N
Реакция альдольной конденсации. С Н 3— С Н — C O H H ОН-+ -Н 2 О С Н 3— С Н — C O H. . _ С Н 3— С Н 2 — C O H + С Н 3— С Н — C O H. . _ карбоанион — нуклеофил А N
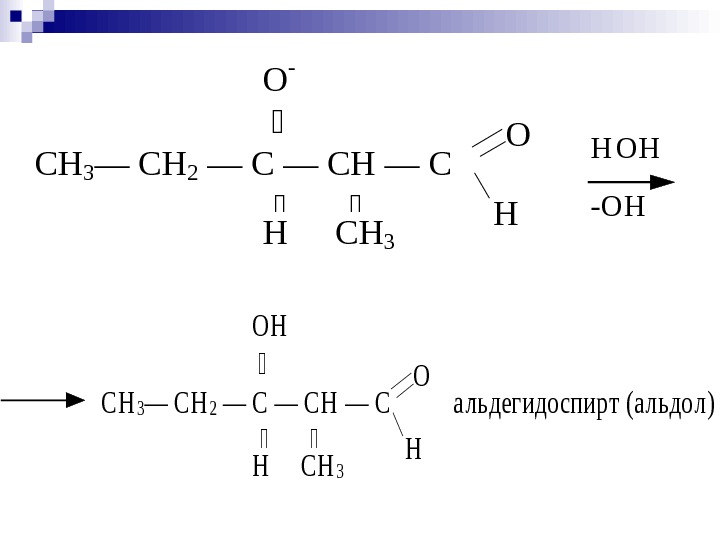
 С Н 3— С Н 2 — C — С Н — C O ОН H H С Н 3 а льдегидо спир т (а льдо л) СН 3— СН 2 — C — СН — C O H О — H СН 3 Н ОН -ОН
С Н 3— С Н 2 — C — С Н — C O ОН H H С Н 3 а льдегидо спир т (а льдо л) СН 3— СН 2 — C — СН — C O H О — H СН 3 Н ОН -ОН
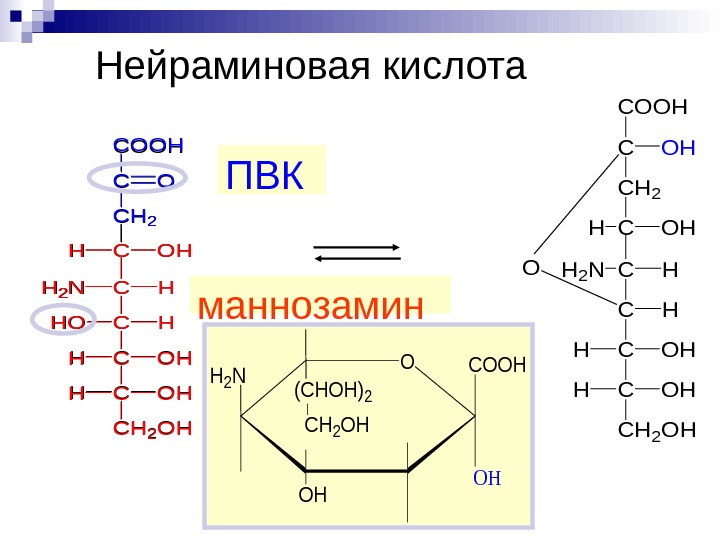
 Нейраминовая кислота. CH 2 NH C C HOH HOH CH 2 OH COOH CO CH 2 CHOH ПВК маннозамин CH 2 NH C C O H C HOH CH 2 OH COH CH 2 CHOH OCOOH OH OH (CHOH)2 CH 2 OH H 2 N
Нейраминовая кислота. CH 2 NH C C HOH HOH CH 2 OH COOH CO CH 2 CHOH ПВК маннозамин CH 2 NH C C O H C HOH CH 2 OH COH CH 2 CHOH OCOOH OH OH (CHOH)2 CH 2 OH H 2 N
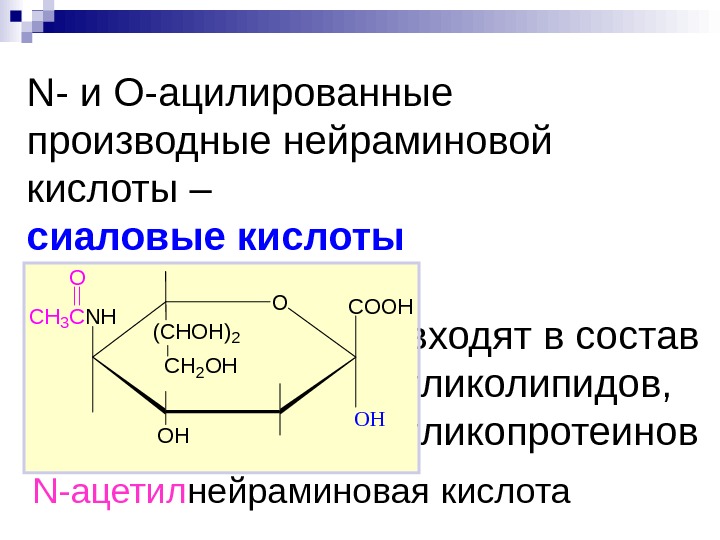
 N- и O -ацилированные производные нейраминовой кислоты – сиаловые кислоты входят в состав гликолипидов, гликопротеинов. OCOOH OH OH (CHOH)2 CH 2 OH CH 3 CNH O N- ацетил нейраминовая кислота
N- и O -ацилированные производные нейраминовой кислоты – сиаловые кислоты входят в состав гликолипидов, гликопротеинов. OCOOH OH OH (CHOH)2 CH 2 OH CH 3 CNH O N- ацетил нейраминовая кислота
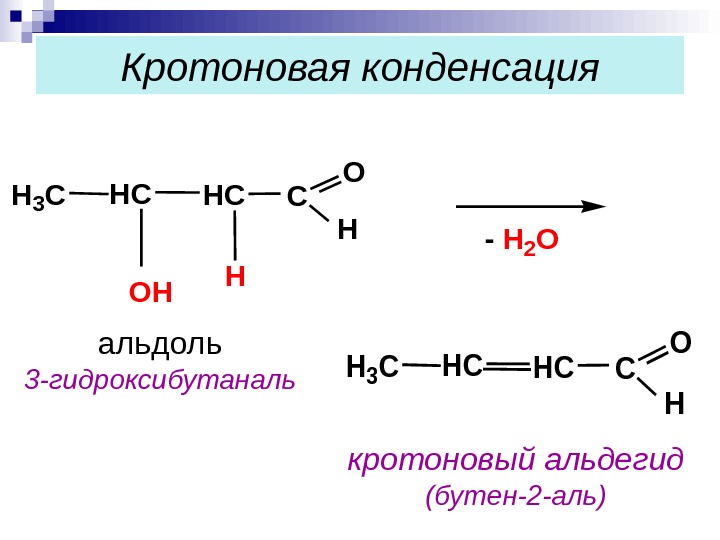
 Кротоновая конденсация. H 3 CHC OH HC H C O H — H 2 O H 3 CHCHCC O H кротоновый альдегид (бутен-2 -аль)альдоль 3 -гидроксибутаналь
Кротоновая конденсация. H 3 CHC OH HC H C O H — H 2 O H 3 CHCHCC O H кротоновый альдегид (бутен-2 -аль)альдоль 3 -гидроксибутаналь
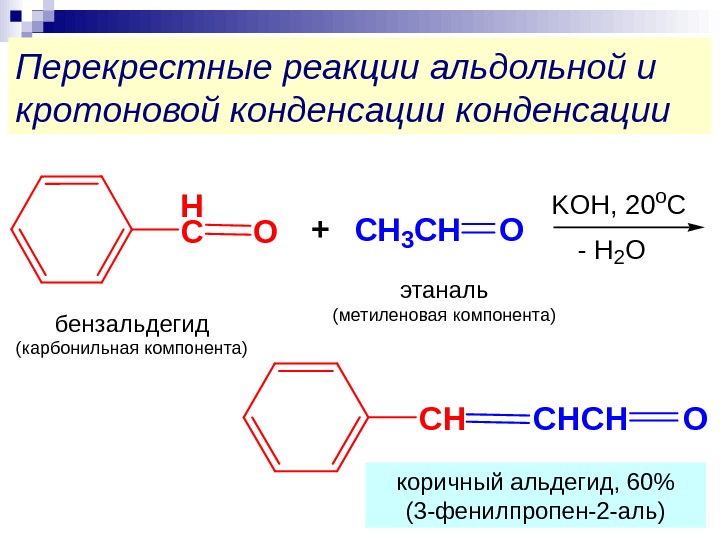
 Перекрестные реакции альдольной и кротоновой конденсации. H СO+CH 3 CHO СHCHCHO этаналь (метиленовая компонента) бензальдегид (карбонильная компонента) коричный альдегид, 60% (3 -фенилпропен-2 -аль) KOH, 20 o C — H 2 O
Перекрестные реакции альдольной и кротоновой конденсации. H СO+CH 3 CHO СHCHCHO этаналь (метиленовая компонента) бензальдегид (карбонильная компонента) коричный альдегид, 60% (3 -фенилпропен-2 -аль) KOH, 20 o C — H 2 O
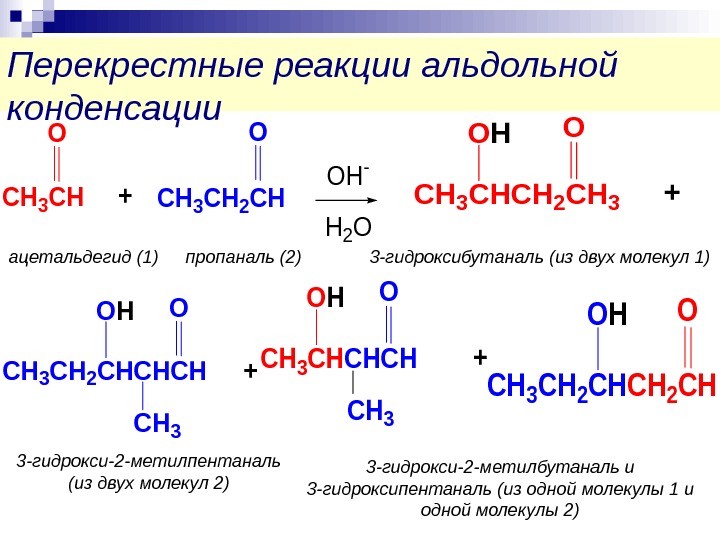
 Перекрестные реакции альдольной конденсации+CH 3 CH O CH 3 CH 2 CH O OH — H 2 O +CH 3 CHCHCH O CH 3 OH CH 3 CH 2 CH OOH +CH 3 CHCH 2 CH 3 OOH CH 3 CH 2 CHCHCH O CH 3 OH + 3 -гидрокси-2 -метилбутаналь и 3 -гидроксипентаналь (из одной молекулы 1 и одной молекулы 2)3 -гидрокси-2 -метилпентаналь (из двух молекул 2) 3 -гидроксибутаналь (из двух молекул 1)пропаналь (2)ацетальдегид (1)
Перекрестные реакции альдольной конденсации+CH 3 CH O CH 3 CH 2 CH O OH — H 2 O +CH 3 CHCHCH O CH 3 OH CH 3 CH 2 CH OOH +CH 3 CHCH 2 CH 3 OOH CH 3 CH 2 CHCHCH O CH 3 OH + 3 -гидрокси-2 -метилбутаналь и 3 -гидроксипентаналь (из одной молекулы 1 и одной молекулы 2)3 -гидрокси-2 -метилпентаналь (из двух молекул 2) 3 -гидроксибутаналь (из двух молекул 1)пропаналь (2)ацетальдегид (1)
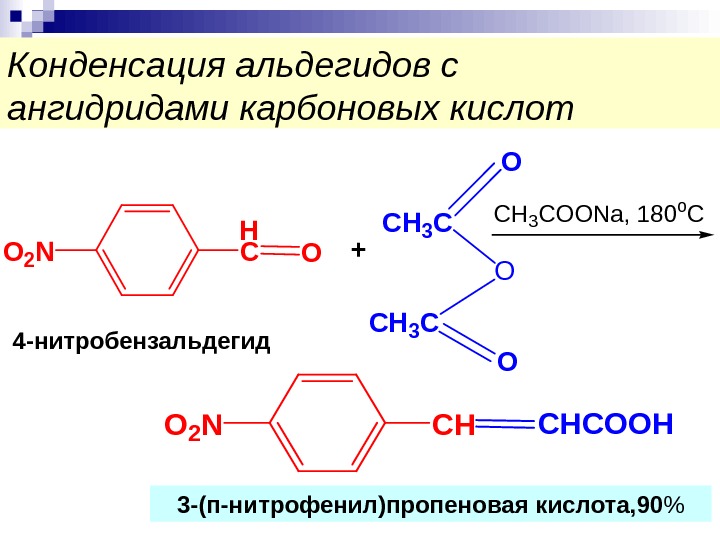
 Конденсация альдегидов с ангидридами карбоновых кислот. H СO+ CH 3 C O O 2 N CH 3 C O O CH 3 COONa, 180 o. C СHCHCOOHO 2 N 3 -(п-нитрофенил)пропеновая кислота, 90 %4 -нитробензальдегид
Конденсация альдегидов с ангидридами карбоновых кислот. H СO+ CH 3 C O O 2 N CH 3 C O O CH 3 COONa, 180 o. C СHCHCOOHO 2 N 3 -(п-нитрофенил)пропеновая кислота, 90 %4 -нитробензальдегид
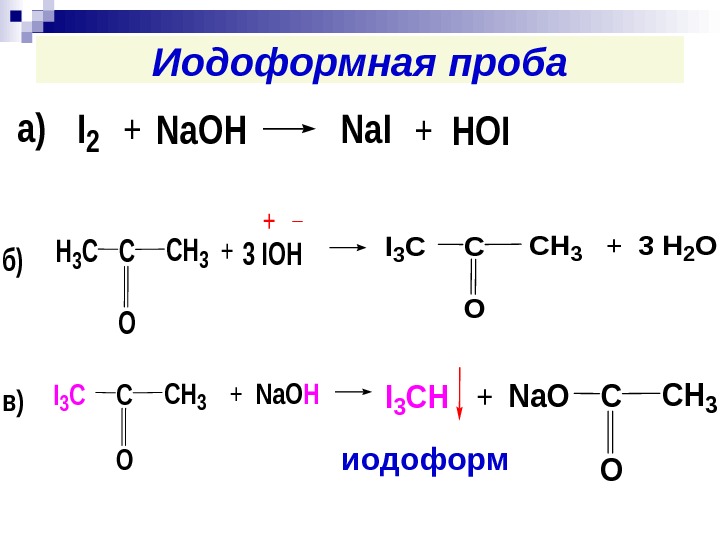
 Иодоформная пробаа)I 2+Na. OHNa. I+HOI б)Н 3 СССН 3 О +3 IOH + _ +I 3 СССН 3 О 3 Н 2 О +I 3 СССН 3 О Na. ОHв)ССН 3 О +I 3 СHNa. O иодоформ
Иодоформная пробаа)I 2+Na. OHNa. I+HOI б)Н 3 СССН 3 О +3 IOH + _ +I 3 СССН 3 О 3 Н 2 О +I 3 СССН 3 О Na. ОHв)ССН 3 О +I 3 СHNa. O иодоформ
 Йодоформная проба позволяет также идентифицировать этанол и вторичные спирты , имеющие в своем составе фрагмент СН 33 -СН(ОН)-, т. к. в условиях реакции эти спирты окисляются в соответствующие карбонильные соединения.
Йодоформная проба позволяет также идентифицировать этанол и вторичные спирты , имеющие в своем составе фрагмент СН 33 -СН(ОН)-, т. к. в условиях реакции эти спирты окисляются в соответствующие карбонильные соединения.
 Окисление карбонильных соединений альдегиды окисляются легко, до карбоновых кислот кетоны — трудно, с разрывом С-С связей
Окисление карбонильных соединений альдегиды окисляются легко, до карбоновых кислот кетоны — трудно, с разрывом С-С связей
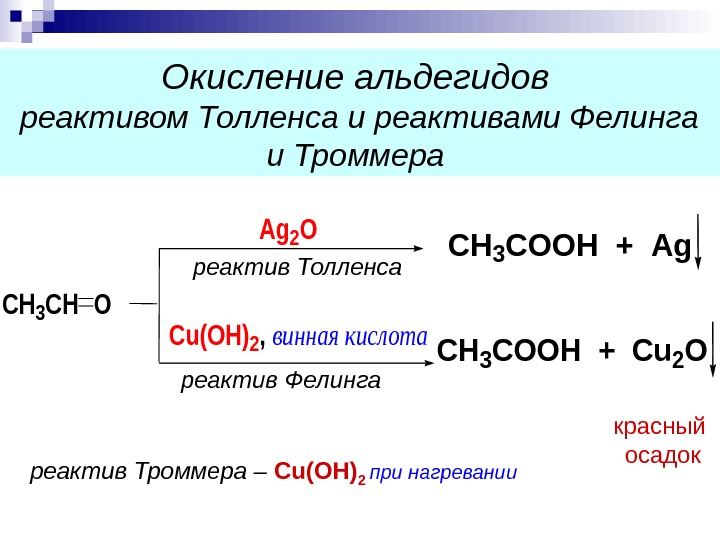
 CH 3 CHO Ag 2 O Cu(OH)2, винная кислота СH 3 COOH + Ag СH 3 COOH + Cu 2 O Окисление альдегидов реактивом Толленса и реактивами Фелинга и Троммера красный осадок реактив Троммера – С u(OH) 2 при нагреванииреактив Толленса реактив Фелинга
CH 3 CHO Ag 2 O Cu(OH)2, винная кислота СH 3 COOH + Ag СH 3 COOH + Cu 2 O Окисление альдегидов реактивом Толленса и реактивами Фелинга и Троммера красный осадок реактив Троммера – С u(OH) 2 при нагреванииреактив Толленса реактив Фелинга
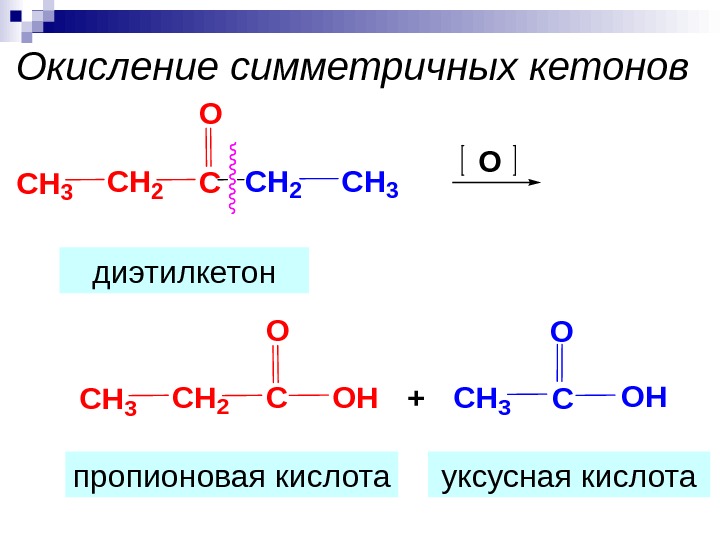
 Окисление симметричных кетонов СH 3 CH 2 CCH 3 O O СH 3 CH 2 C O OH+CH 3 COH O диэтилкетон пропионовая кислота уксусная кислота
Окисление симметричных кетонов СH 3 CH 2 CCH 3 O O СH 3 CH 2 C O OH+CH 3 COH O диэтилкетон пропионовая кислота уксусная кислота
 Окисление несимметричных кетонов. СH 2 CCH 3 O O CH 3 СH 3 CH 2 C O OH+CH 3 COH O пропионовая кислота уксусная кислотаметилпропилкетон
Окисление несимметричных кетонов. СH 2 CCH 3 O O CH 3 СH 3 CH 2 C O OH+CH 3 COH O пропионовая кислота уксусная кислотаметилпропилкетон
 Роль СН-кислотного центра Альдегиды, имеющие СН-кислотный центр при α -углеродном атоме, вступают в р-цию альдольной конденсации, а не имеющие его – в реакцию дисмутации или оксидо-редукции (формальдегид, бензальдегид и альдегиды типа -R — С(СН 3)2 — С О Н ).
Роль СН-кислотного центра Альдегиды, имеющие СН-кислотный центр при α -углеродном атоме, вступают в р-цию альдольной конденсации, а не имеющие его – в реакцию дисмутации или оксидо-редукции (формальдегид, бензальдегид и альдегиды типа -R — С(СН 3)2 — С О Н ).
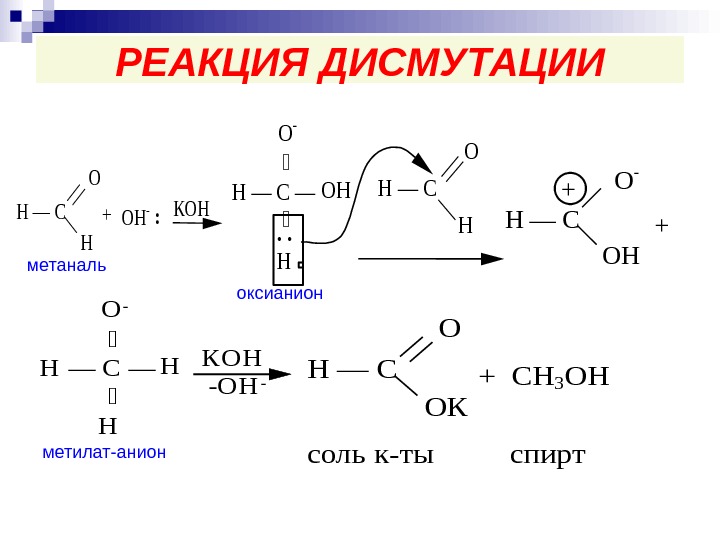
 РЕАКЦИЯ ДИСМУТАЦИИН — C О Н +ОН- : КОН Н — С — ОН. . Н О — Н — С O Н Н — C О — ОН ++ Н — С — Н Н О- К О Н -OH-Н — C О ОК +CН 3 ОН соль к-тыспирт оксианион метилат-анионметаналь
РЕАКЦИЯ ДИСМУТАЦИИН — C О Н +ОН- : КОН Н — С — ОН. . Н О — Н — С O Н Н — C О — ОН ++ Н — С — Н Н О- К О Н -OH-Н — C О ОК +CН 3 ОН соль к-тыспирт оксианион метилат-анионметаналь
 Формалин – 40% р-р формальдегида -используется для консервирования анатомических препаратов -как дезинфицирующее средство -вызывает денатурацию белков за счет взаимодействия с NH 2 -группами
Формалин – 40% р-р формальдегида -используется для консервирования анатомических препаратов -как дезинфицирующее средство -вызывает денатурацию белков за счет взаимодействия с NH 2 -группами
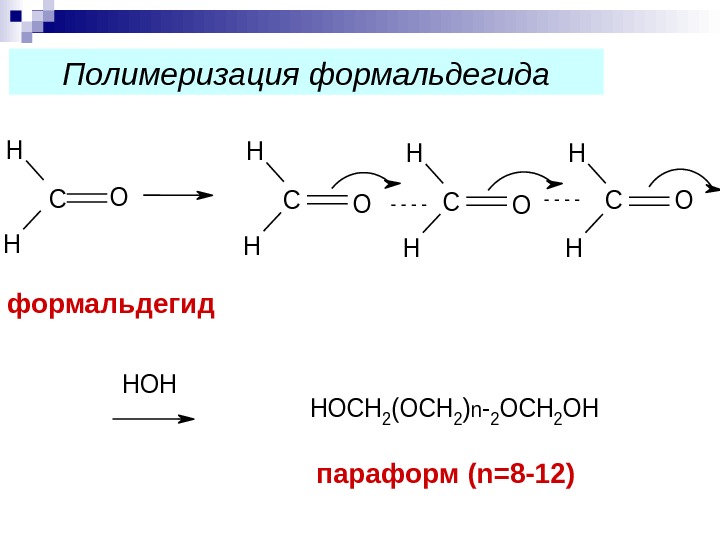
 C H H O HOH C H H OC H H O HOCH 2(OCH 2)n-2 OCH 2 OH параформ ( n= 8 — 12)формальдегид Полимеризация формальдегида
C H H O HOH C H H OC H H O HOCH 2(OCH 2)n-2 OCH 2 OH параформ ( n= 8 — 12)формальдегид Полимеризация формальдегида
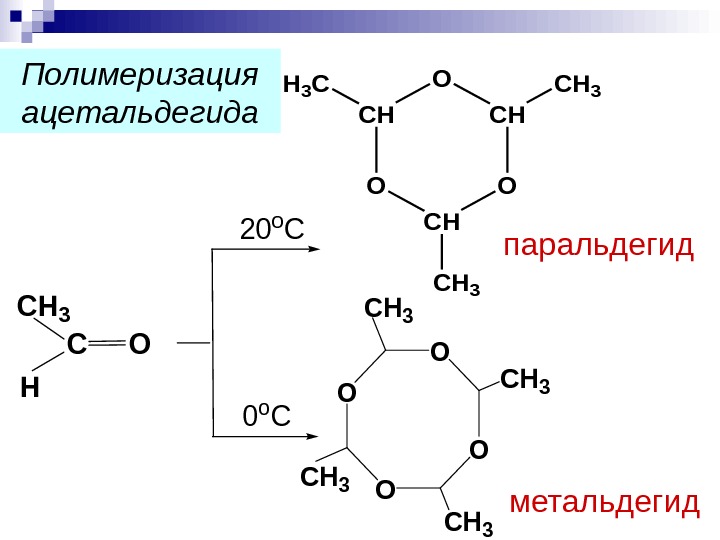
 паральдегид. CH 3 H СО 20 о С CH OCH 3 H 3 C О О СН 3 метальдегид. Полимеризация ацетальдегида
паральдегид. CH 3 H СО 20 о С CH OCH 3 H 3 C О О СН 3 метальдегид. Полимеризация ацетальдегида
 Реакции α , β -ненасыщенных карбонильных соединений
Реакции α , β -ненасыщенных карбонильных соединений
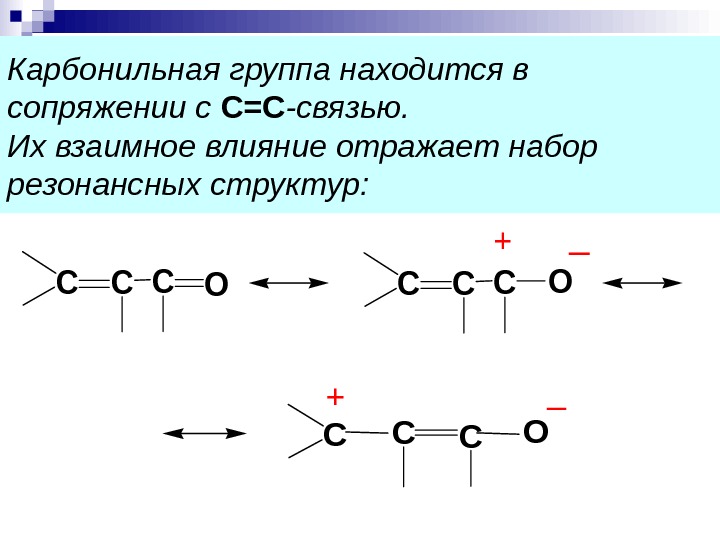
 Карбонильная группа находится в сопряжении с С=С -связью. Их взаимное влияние отражает набор резонансных структур: CCCO +_
Карбонильная группа находится в сопряжении с С=С -связью. Их взаимное влияние отражает набор резонансных структур: CCCO +_
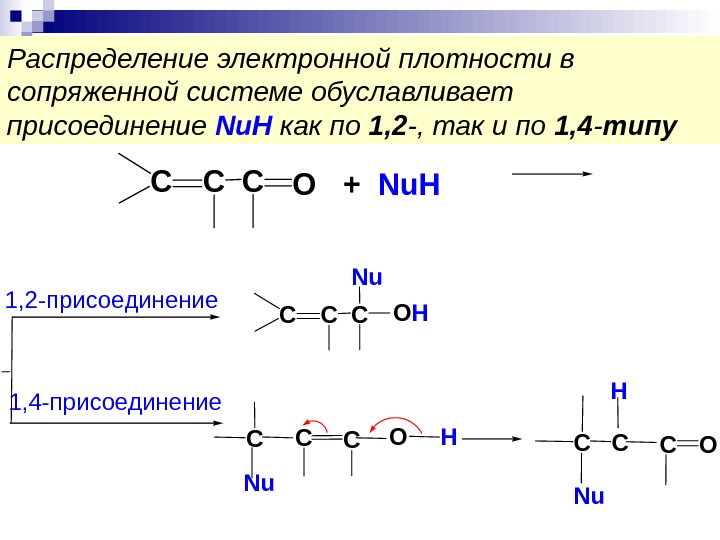
 Распределение электронной плотности в сопряженной системе обуславливает присоединение Nu. H как по 1, 2 -, так и по 1, 4 — типу. CCCO+ Nu. H CCCOН Nu CCCO H Nu Н CCOC Nu 1, 2 -присоединение 1, 4 -присоединение
Распределение электронной плотности в сопряженной системе обуславливает присоединение Nu. H как по 1, 2 -, так и по 1, 4 — типу. CCCO+ Nu. H CCCOН Nu CCCO H Nu Н CCOC Nu 1, 2 -присоединение 1, 4 -присоединение
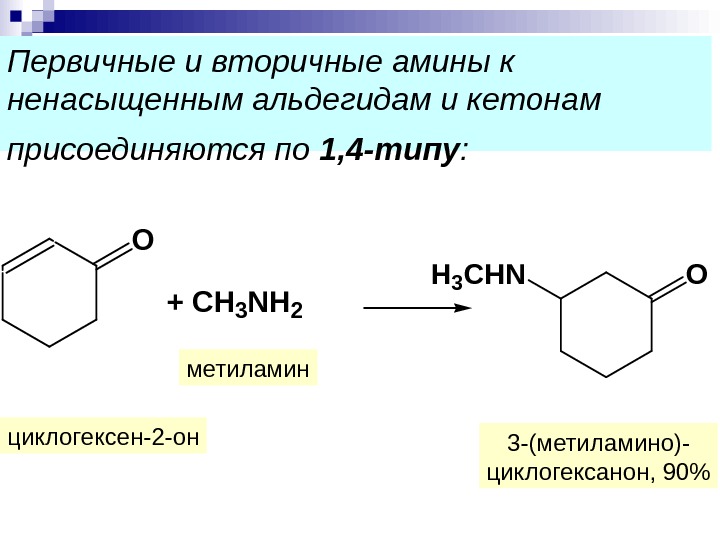
 Первичные и вторичные амины к ненасыщенным альдегидам и кетонам присоединяются по 1, 4 -типу : 3 -(метиламино)- циклогексанон, 90%метиламин циклогексен-2 -он. O + СH 3 NH 2 OH 3 C H N
Первичные и вторичные амины к ненасыщенным альдегидам и кетонам присоединяются по 1, 4 -типу : 3 -(метиламино)- циклогексанон, 90%метиламин циклогексен-2 -он. O + СH 3 NH 2 OH 3 C H N
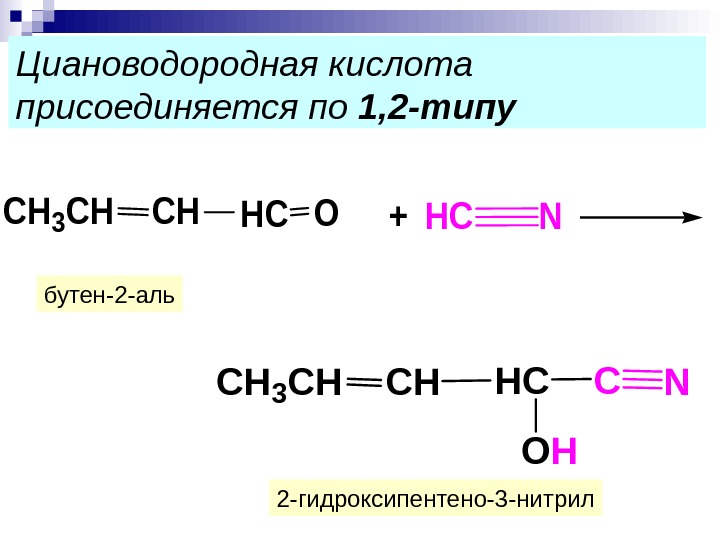
 Циановодородная кислота присоединяется по 1, 2 -типу. CH 3 CH CHO+HC NHC CH 3 CH CHCHC OH N 2 -гидроксипентено-3 -нитрилбутен-2 -аль
Циановодородная кислота присоединяется по 1, 2 -типу. CH 3 CH CHO+HC NHC CH 3 CH CHCHC OH N 2 -гидроксипентено-3 -нитрилбутен-2 -аль
 Определение подлинности глицерина: акролеин ( acre — острое , oleum — масло) имеет неприятный раздражающий запах (обуславливает запах подгоревшего жира) С Н 2 С Н С О Н акролеин (пропеналь)глицерин. СН 2 СН ОН ОН ОН СН 2 СН О — 2 Н 2 О Н KHSO 4, t o.
Определение подлинности глицерина: акролеин ( acre — острое , oleum — масло) имеет неприятный раздражающий запах (обуславливает запах подгоревшего жира) С Н 2 С Н С О Н акролеин (пропеналь)глицерин. СН 2 СН ОН ОН ОН СН 2 СН О — 2 Н 2 О Н KHSO 4, t o.
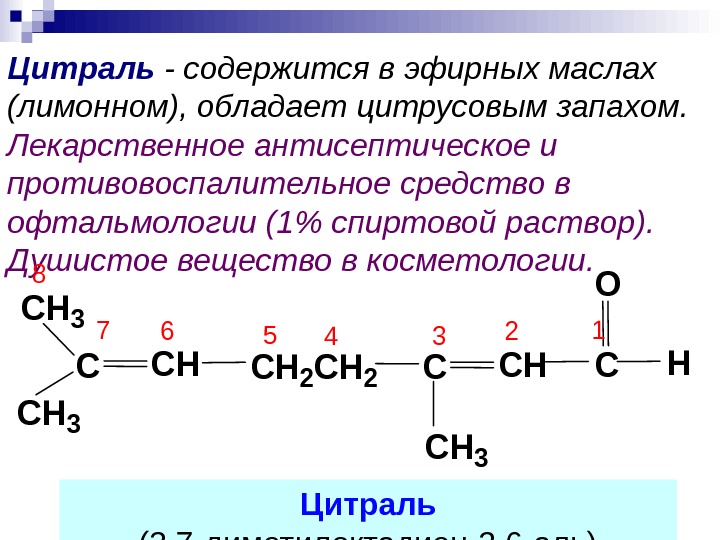
 Цитраль — содержится в эфирных маслах (лимонном), обладает цитрусовым запахом. Лекарственное антисептическое и противовоспалительное средство в офтальмологии (1% спиртовой раствор). Душистое вещество в косметологии. СCH 2 CHC CH 3 O СH 3 CHC CH 3 H 1234567 8 Цитраль (3, 7 -диметилоктадиен-2, 6 -аль)
Цитраль — содержится в эфирных маслах (лимонном), обладает цитрусовым запахом. Лекарственное антисептическое и противовоспалительное средство в офтальмологии (1% спиртовой раствор). Душистое вещество в косметологии. СCH 2 CHC CH 3 O СH 3 CHC CH 3 H 1234567 8 Цитраль (3, 7 -диметилоктадиен-2, 6 -аль)
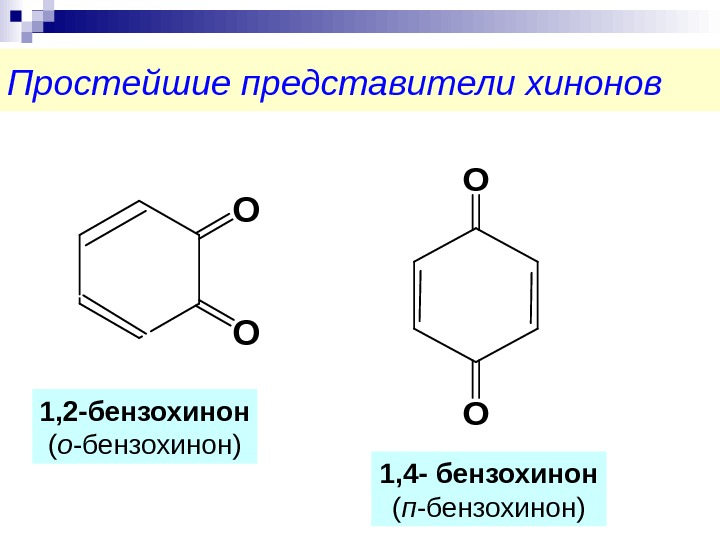
 Простейшие представители хинонов. O O 1, 4 — бензохинон ( п -бензохинон)1, 2 -бензохинон ( о -бензохинон)
Простейшие представители хинонов. O O 1, 4 — бензохинон ( п -бензохинон)1, 2 -бензохинон ( о -бензохинон)
 Физические свойства Хиноны представляют собой кристаллические вещества с высокими температурами плавления. За счет наличия в молекулах протяженных сопряженных систем хиноны имеют окраску : желтую, оранжевую, красную
Физические свойства Хиноны представляют собой кристаллические вещества с высокими температурами плавления. За счет наличия в молекулах протяженных сопряженных систем хиноны имеют окраску : желтую, оранжевую, красную
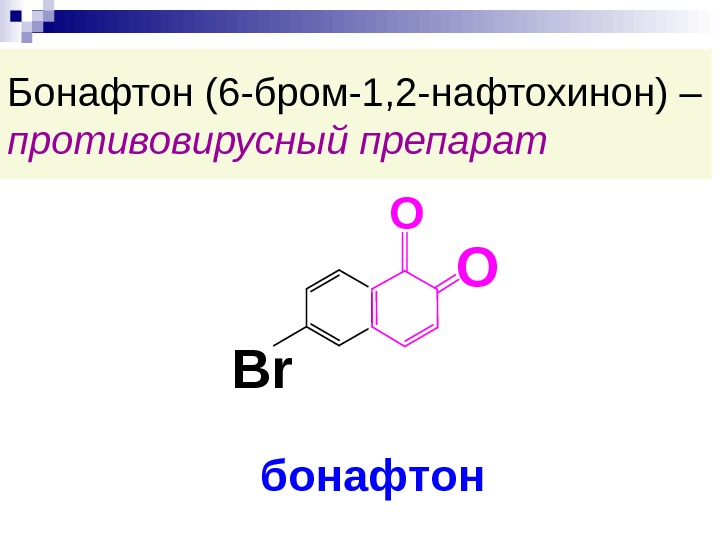
 Бонафтон (6 -бром-1, 2 -нафтохинон) – противовирусный препарат. O Br O бонафтон
Бонафтон (6 -бром-1, 2 -нафтохинон) – противовирусный препарат. O Br O бонафтон
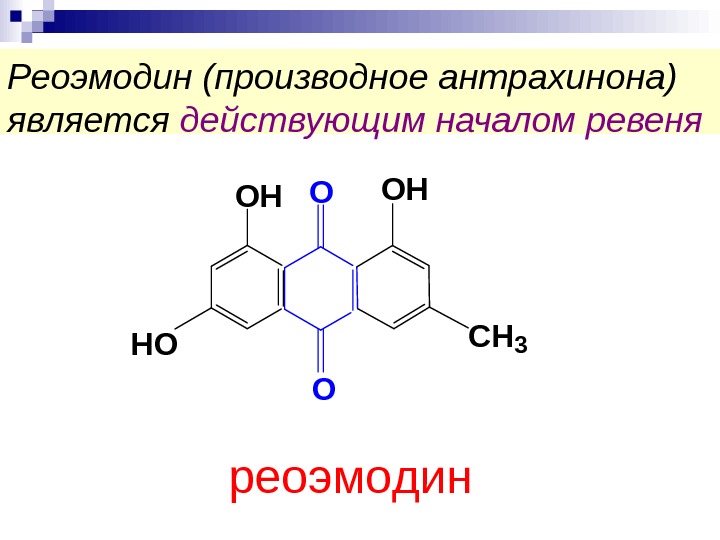
 Реоэмодин (производное антрахинона) является действующим началом ревеня. OOH HO OH CH 3 O р е о э м о д и н
Реоэмодин (производное антрахинона) является действующим началом ревеня. OOH HO OH CH 3 O р е о э м о д и н
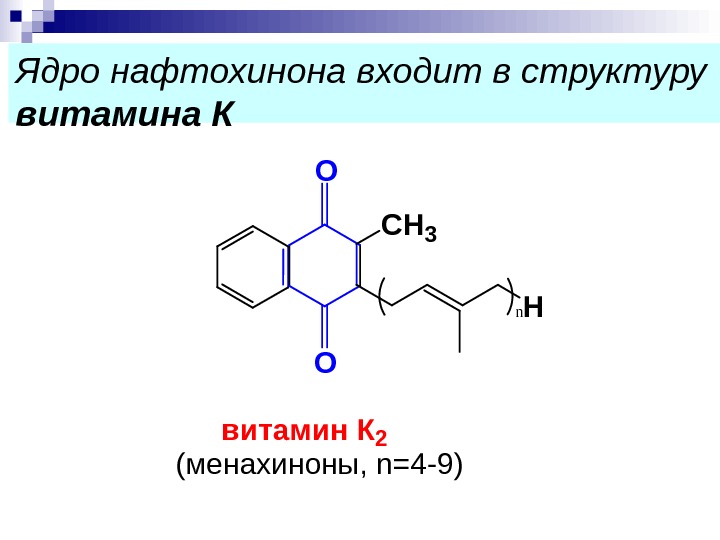
 Ядро нафтохинона входит в структуру витамина К О O C H 3 Hn в и т а м и н К 2 ( м е н а х и н о н ы , n = 4 — 9 )
Ядро нафтохинона входит в структуру витамина К О O C H 3 Hn в и т а м и н К 2 ( м е н а х и н о н ы , n = 4 — 9 )
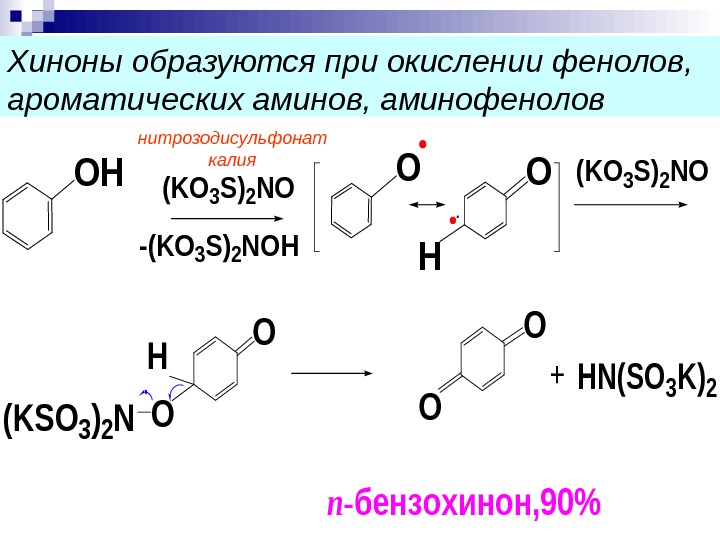
 Хиноны образуются при окислении фенолов, ароматических аминов, аминофенолов. OH (KO 3 S)2 NO -(KO 3 S)2 NOH OO H (KO 3 S)2 NO O H (KSO 3)2 NO O O n-бензохинон, 90% +HN(SO 3 K)2 нитрозодисульфонат калия
Хиноны образуются при окислении фенолов, ароматических аминов, аминофенолов. OH (KO 3 S)2 NO -(KO 3 S)2 NOH OO H (KO 3 S)2 NO O H (KSO 3)2 NO O O n-бензохинон, 90% +HN(SO 3 K)2 нитрозодисульфонат калия
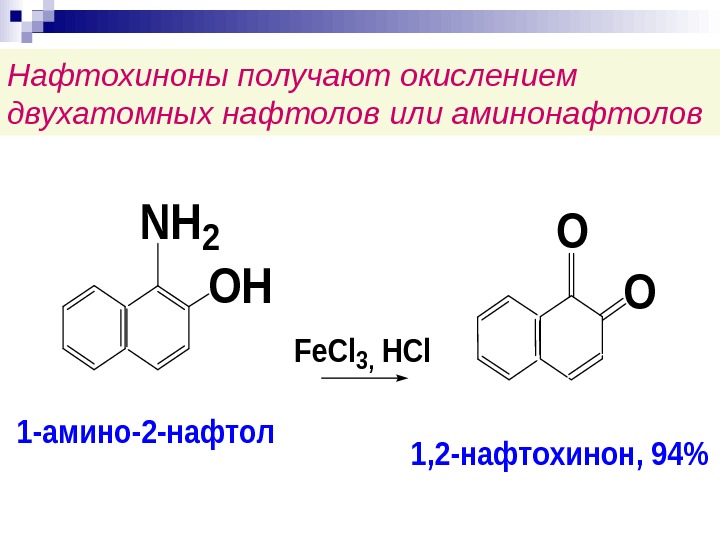
 Нафтохиноны получают окислением двухатомных нафтолов или аминонафтолов. OH NH 2 Fe. Cl 3, HCl O O 1 -амино-2 -нафтол 1, 2 -нафтохинон, 94%
Нафтохиноны получают окислением двухатомных нафтолов или аминонафтолов. OH NH 2 Fe. Cl 3, HCl O O 1 -амино-2 -нафтол 1, 2 -нафтохинон, 94%
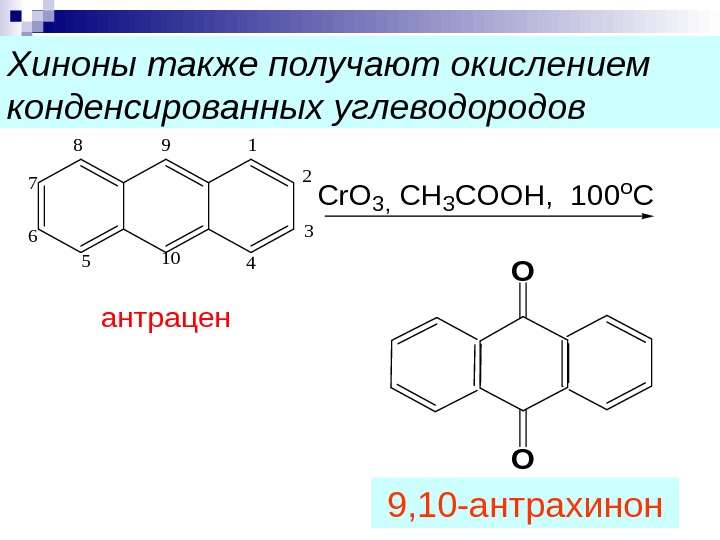
 Хиноны также получают окислением конденсированных углеводородов 1 2 3 4105 6 7 89 антрацен Cr. O 3, CH 3 COOH, 100 o C O O 9, 10 -антрахинон
Хиноны также получают окислением конденсированных углеводородов 1 2 3 4105 6 7 89 антрацен Cr. O 3, CH 3 COOH, 100 o C O O 9, 10 -антрахинон
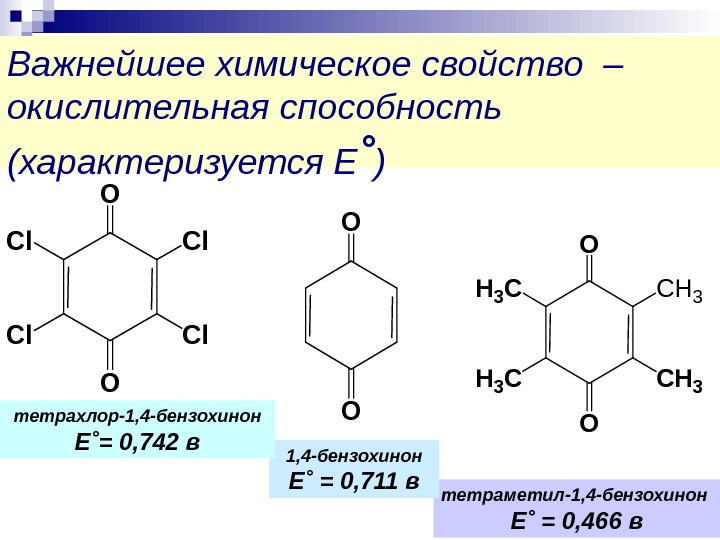
 Важнейшее химическое свойство – окислительная способность (характеризуется Е ˚ )O O H 3 C CH 3 O O Cl Cl тетраметил-1, 4 -бензохинон Е ˚ = 0, 466 в 1, 4 -бензохинон Е ˚ = 0, 711 втетрахлор-1, 4 -бензохинон Е ˚ = 0, 742 в
Важнейшее химическое свойство – окислительная способность (характеризуется Е ˚ )O O H 3 C CH 3 O O Cl Cl тетраметил-1, 4 -бензохинон Е ˚ = 0, 466 в 1, 4 -бензохинон Е ˚ = 0, 711 втетрахлор-1, 4 -бензохинон Е ˚ = 0, 742 в
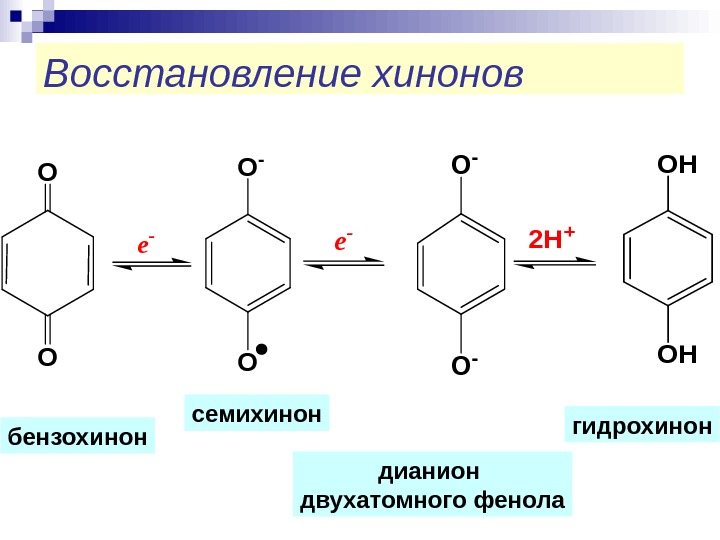
 Восстановление хинонов. O O O — O e — O — e — OH OH 2 H + семихинон гидрохинон бензохинон дианион двухатомного фенола
Восстановление хинонов. O O O — O e — O — e — OH OH 2 H + семихинон гидрохинон бензохинон дианион двухатомного фенола
 Хингидрон (промежуточный продукт) – комплекс с переносом заряда, стабилизированный водородными связями O OH H хингидрон
Хингидрон (промежуточный продукт) – комплекс с переносом заряда, стабилизированный водородными связями O OH H хингидрон
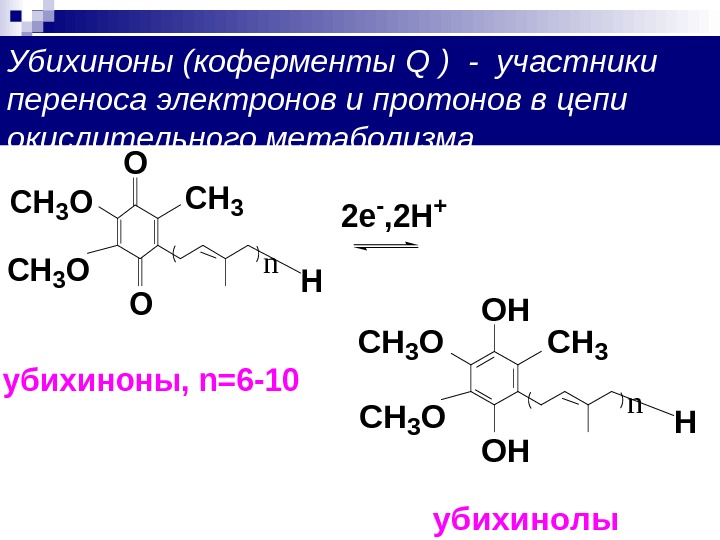
 Убихиноны (коферменты Q ) — участники переноса электронов и протонов в цепи окислительного метаболизма. H n O O CH 3 O CH 3 2 e — , 2 H + убихиноны, n=6 -10 H n CH 3 O CH 3 OH OH убихинолы
Убихиноны (коферменты Q ) — участники переноса электронов и протонов в цепи окислительного метаболизма. H n O O CH 3 O CH 3 2 e — , 2 H + убихиноны, n=6 -10 H n CH 3 O CH 3 OH OH убихинолы
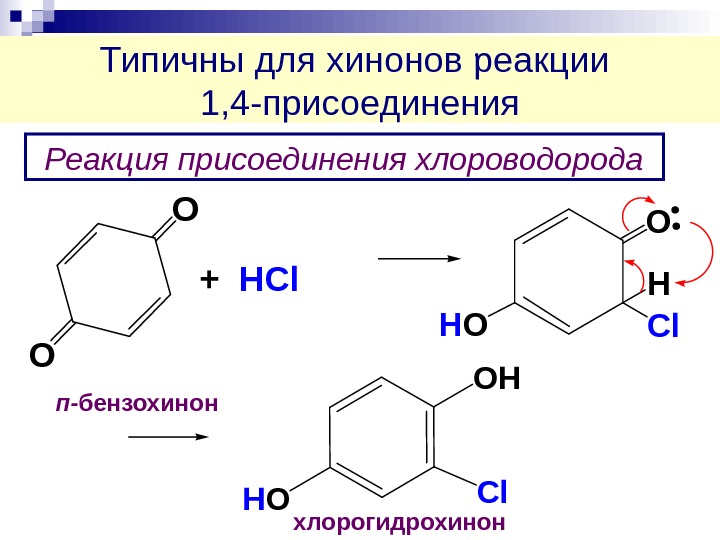
 Типичны для хинонов реакции 1, 4 -присоединения O O + H C l. O Cl H HOРеакция присоединения хлороводорода OH HOCl хлорогидрохинонп- бензохинон
Типичны для хинонов реакции 1, 4 -присоединения O O + H C l. O Cl H HOРеакция присоединения хлороводорода OH HOCl хлорогидрохинонп- бензохинон
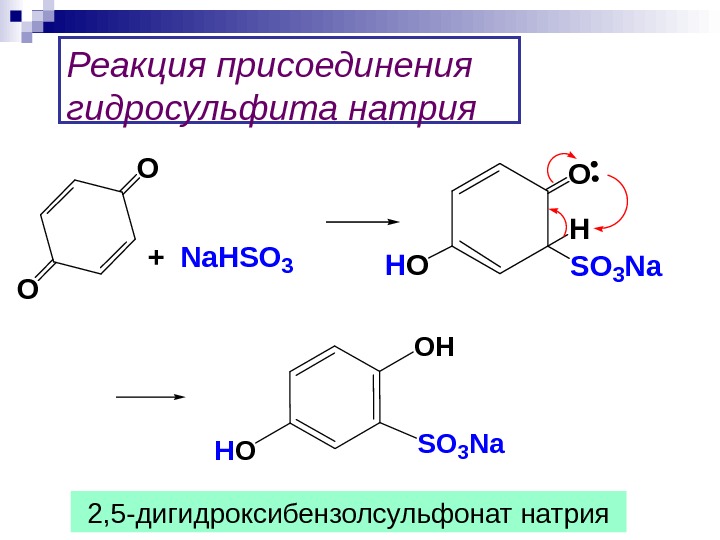
 Реакция присоединения гидросульфита натрия. O O + Na. HSO 3 O SO 3 Na H HO OH HOSO 3 Na 2, 5 -дигидроксибензолсульфонат натрия
Реакция присоединения гидросульфита натрия. O O + Na. HSO 3 O SO 3 Na H HO OH HOSO 3 Na 2, 5 -дигидроксибензолсульфонат натрия
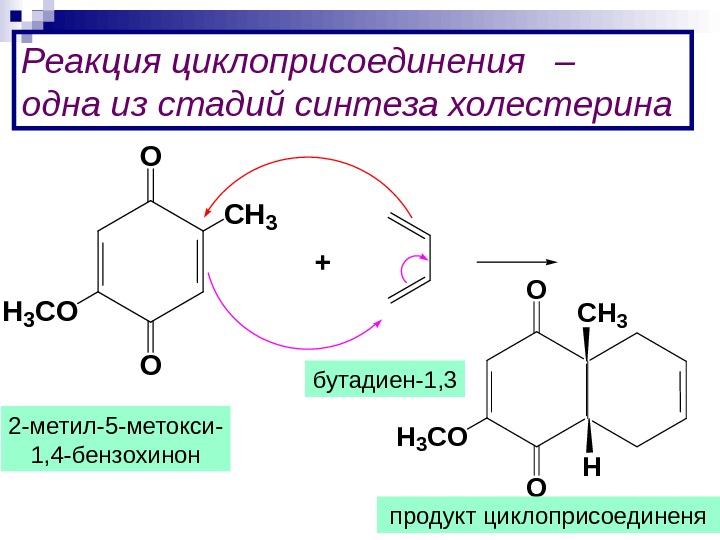
 Реакция циклоприсоединения – одна из стадий синтеза холестерина O O C H 3 C O + O O C H 3 C O H продукт циклоприсоединенябутадиен-1, 3 2 -метил-5 -метокси- 1, 4 -бензохинон
Реакция циклоприсоединения – одна из стадий синтеза холестерина O O C H 3 C O + O O C H 3 C O H продукт циклоприсоединенябутадиен-1, 3 2 -метил-5 -метокси- 1, 4 -бензохинон
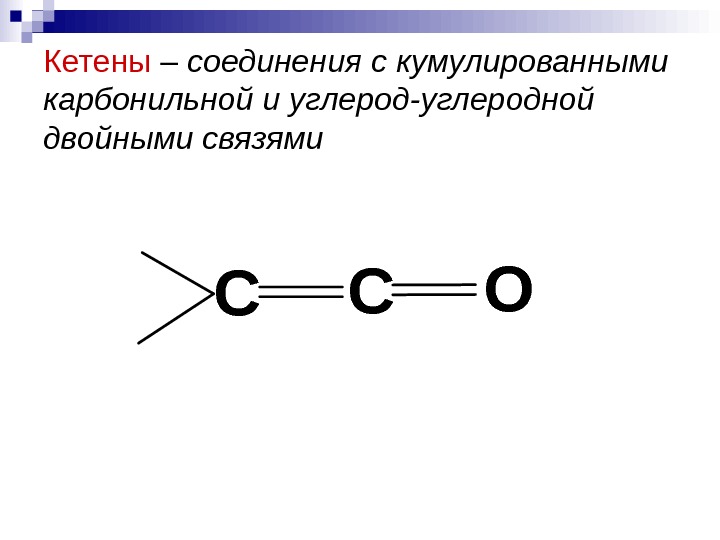
 Кетены – соединения с кумулированными карбонильной и углерод-углеродной двойными связями. ССО
Кетены – соединения с кумулированными карбонильной и углерод-углеродной двойными связями. ССО
 Кетен – ацилирующий агент для соединений типа ROH и RNH 2 ССО Н Н
Кетен – ацилирующий агент для соединений типа ROH и RNH 2 ССО Н Н

